BE试验流程
BE试验一般程序
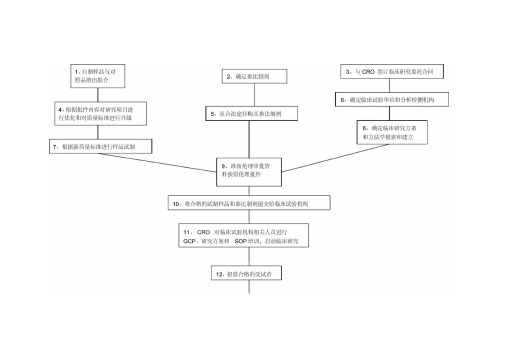
所做工作流程及所需信息资料:1、与原研参比制剂进行多种介质溶出曲线比较:0.1M HCI (pH1.2 )、pH4.5醋酸-醋酸钠缓冲液、pH6.8磷酸盐缓冲液、H20中,f2因子法测得受试样品和参比样品在15分钟的平均溶出量均不低于85%。
2、根据原研已在境内上市,所以确定已进口的原研样品作为参比制剂。
3、与CRO签订委托合同,该合同应包括双方的权利义务,明确分为自制样品本身所造成的不等效和非药物导致的不等效,自制样品本身所致不等效:药物溶解性、药物吸收性、晶型、化学稳定性、处方工艺等;非药物本身所致不等效(试验设计):试验设计样本量、测定方法学问题、生物样本采集点选择、统计分析方法错误;CRO费用分为预BE和正式试验,采用分期付款方式;是否在合同中加强CRO对临床机构的监督检查4、基于批件内容,对涉及质量标准变更所需增加的研究内容,应尽快完成,以便得到最终确定的质量标准以进行BE样品试制;对不涉及质量标准变更的研究内容可以变进行研究变做BE,在完成BE最终将申报资料报到国家局之前完成。
同时相关BE样品试制所采购的原辅料质量标准和检验均应升级到申报所对应的中国药典标准。
5、合法途径采购参比制剂,选定代理商所提供的资质:经营资质,供货合同或协议,发票,检验报告,销售清单。
发票最好开给以药厂名义申报的药厂,检验报告最好能要到原研的检验报告(GSP的销售商肯定有,就看他们愿不愿意提供),如果拿不到经销商的检验报告,应由申报的药厂进行参比制剂的检验工作,并出具检验报告。
6、确定临床机构,根据项目特点和既往同类项目操作经验选择临床激光和分析检测机构。
原则是专业、经验丰富,并且要考虑CRO与临床机构的关系是否紧密;如果CRO有分析测试部门,考察其专业性和规范性,如果CRO没有分析检测部分,应确定其合作的分析测试单位的专业性、规范性和经验。
7、BE试验样品试制,在GMP车间生产受试样品应来自一个不少于生产规模1/10的批次或100000单位,两者中选择更多,除非另外说明理由;使用的生产批次应该确实保证产品和过程在工业规模可行。
be项目流程

be项目流程
BE项目流程指的是生物等效性试验,一般流程如下:
1. 自制样品与对照品溶出拟合。
2. 根据批件内容对研究项目进行优化和对质量标准进行升级。
3. 根据新质量标准进行样品试制。
4. 从合法途径购买参比制剂。
5. 与CRO签订临床研究委托合同。
6. 确定临床试验单位和分析检测机构。
7. 确定参比制剂。
8. 确定临床研究方案和方法学摸索和建立。
9. 准备伦理审批资料获得伦理批件。
10. 将合格的试制样品和参比制剂递交给临床试验机构。
11. CRO对临床试验机构相关人员进行GCP、研究方案和SOP培训,启动临床研究。
12. 招募合格的受试者。
13. 依照临床试验方案、GCP、SOP等进行给药采血及数据收集。
14. 血样运输至分析检测机构(冷链运输CRO负责)。
15. 根据之前建立的方法学,对血样进行检测。
生物等效性试验是一项复杂的工作,需要严格按照相关法规和标准进行。
在进行BE项目时,建议咨询专业的机构或专家,以确保试验的合法性、科学性和有效性。
最新be试验一般程序学习资料
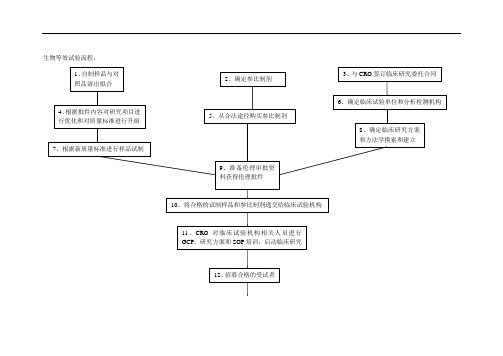
生物等效试验流程:所做工作流程及所需信息资料:1、与原研参比制剂进行多种介质溶出曲线比较:0.1M HCl(pH1.2)、pH4.5醋酸-醋酸钠缓冲液、pH6.8磷酸盐缓冲液、H2O中,f2因子法测得受试样品和参比样品在15分钟的平均溶出量均不低于85%。
2、根据原研已在境内上市,所以确定已进口的原研样品作为参比制剂。
3、与CRO签订委托合同,该合同应包括双方的权利义务,明确分为自制样品本身所造成的不等效和非药物导致的不等效,自制样品本身所致不等效:药物溶解性、药物吸收性、晶型、化学稳定性、处方工艺等;非药物本身所致不等效(试验设计):试验设计样本量、测定方法学问题、生物样本采集点选择、统计分析方法错误;CRO费用分为预BE 和正式试验,采用分期付款方式;是否在合同中加强CRO对临床机构的监督检查4、基于批件内容,对涉及质量标准变更所需增加的研究内容,应尽快完成,以便得到最终确定的质量标准以进行BE样品试制;对不涉及质量标准变更的研究内容可以变进行研究变做BE,在完成BE最终将申报资料报到国家局之前完成。
同时相关BE样品试制所采购的原辅料质量标准和检验均应升级到申报所对应的中国药典标准。
5、合法途径采购参比制剂,选定代理商所提供的资质:经营资质,供货合同或协议,发票,检验报告,销售清单。
发票最好开给以药厂名义申报的药厂,检验报告最好能要到原研的检验报告(GSP的销售商肯定有,就看他们愿不愿意提供),如果拿不到经销商的检验报告,应由申报的药厂进行参比制剂的检验工作,并出具检验报告。
6、确定临床机构,根据项目特点和既往同类项目操作经验选择临床激光和分析检测机构。
原则是专业、经验丰富,并且要考虑CRO与临床机构的关系是否紧密;如果CRO有分析测试部门,考察其专业性和规范性,如果CRO没有分析检测部分,应确定其合作的分析测试单位的专业性、规范性和经验。
7、BE试验样品试制,在GMP车间生产受试样品应来自一个不少于生产规模1/10的批次或100000单位,两者中选择更多,除非另外说明理由;使用的生产批次应该确实保证产品和过程在工业规模可行。
仿制药质量和疗效一致性评价参比制剂与BE备案-zheng

总局关于落实《国务院办公厅关于开展仿制药质量和疗效一致性评价的意见》有关事项的 公告(食品药品监管总局公告2016年第106号)
总局药品审评中心正在拟定一致性评价临床技术指南
参比制剂遴选
备案程序
药品生产企业
行业协会 原研企业 国际公认的同种 药物生产企业
备案 推荐
申报
提交
电子版资料 纸质版资料
用户注册
打开网址后进入用户登录页面;
如果用户未注册账号,须首先在申请人之窗进行用户注册,操作如下图;
点击注册
用户登录 化学药BE试验备案信息平台简介
用户登录
企业用户须使用药审中心的申请人之窗账户进行登录。企业用户登录方式有两种:
账号密码登录和UKEY证书登录。
方式一:账号密码登录(管理人员同样使用此方式登录)
圳信立泰药业股份有限公司的替格瑞洛片,亚宝药业集团股
份有限公司的苯甲酸阿格列汀片,上海安必生制药技术有限
公司的孟鲁司特钠咀嚼片)。
现平台为非结构化的,预计从今年7月起全采用结构化的
平台。
化学药BE试验备案信息平台简介 非结构化备案流程
企业使用申请人之窗账户进行登录
新建备案
终止备案
撤销备案
用户注册 化学药BE试验备案信息平台简介
备案范围
2.属于下列情形的化学药,如需开展BE试验,可按照《药品注册管理办法》的有关规定申报受理 和审评审批。
4)不以境内注册申请或仿制药质量和疗效一致性评价为目的进行BE试验药品; 5)注册申请人认为BE试验可能潜在安全性风险需要进行技术评价的药品。
BE试验备案和程序
备案资料
注册申请人信息 产品基本信息 处方工艺 质量研究和质量标准 参比制剂基本信息 稳定性研究 原料药 试验方案设计 伦理委员会批准证明文件等
BE试验一般程序审批稿

B E试验一般程序YKK standardization office【 YKK5AB- YKK08- YKK2C- YKK18】生物等效试验流程:所做工作流程及所需信息资料:1、与原研参比制剂进行多种介质溶出曲线比较: HCl()、醋酸-醋酸钠缓冲液、磷酸盐缓冲液、H2O中,f2因子法测得受试样品和参比样品在15分钟的平均溶出量均不低于85%。
2、根据原研已在境内上市,所以确定已进口的原研样品作为参比制剂。
3、与CRO签订委托合同,该合同应包括双方的权利义务,明确分为自制样品本身所造成的不等效和非药物导致的不等效,自制样品本身所致不等效:药物溶解性、药物吸收性、晶型、化学稳定性、处方工艺等;非药物本身所致不等效(试验设计):试验设计样本量、测定方法学问题、生物样本采集点选择、统计分析方法错误;CRO费用分为预BE和正式试验,采用分期付款方式;是否在合同中加强CRO对临床机构的监督检查4、基于批件内容,对涉及质量标准变更所需增加的研究内容,应尽快完成,以便得到最终确定的质量标准以进行BE样品试制;对不涉及质量标准变更的研究内容可以变进行研究变做BE,在完成BE最终将申报资料报到国家局之前完成。
同时相关BE样品试制所采购的原辅料质量标准和检验均应升级到申报所对应的中国药典标准。
5、合法途径采购参比制剂,选定代理商所提供的资质:经营资质,供货合同或协议,发票,检验报告,销售清单。
发票最好开给以药厂名义申报的药厂,检验报告最好能要到原研的检验报告(GSP的销售商肯定有,就看他们愿不愿意提供),如果拿不到经销商的检验报告,应由申报的药厂进行参比制剂的检验工作,并出具检验报告。
6、确定临床机构,根据项目特点和既往同类项目操作经验选择临床激光和分析检测机构。
原则是专业、经验丰富,并且要考虑CRO与临床机构的关系是否紧密;如果CRO有分析测试部门,考察其专业性和规范性,如果CRO 没有分析检测部分,应确定其合作的分析测试单位的专业性、规范性和经验。
BE试验一般程序
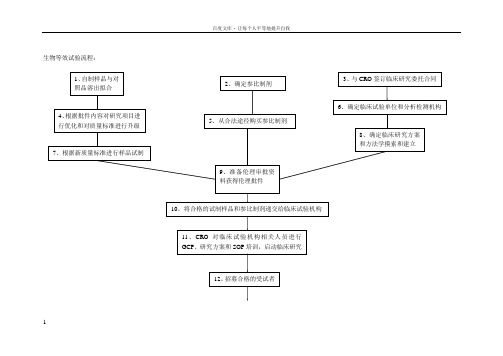
生物等效试验流程:12所做工作流程及所需信息资料:1、与原研参比制剂进行多种介质溶出曲线比较:0.1M HCl(pH1.2)、pH4.5醋酸-醋酸钠缓冲液、pH6.8磷酸盐缓冲液、H2O中,f2因子法测得受试样品和参比样品在15分钟的平均溶出量均不低于85%。
2、根据原研已在境内上市,所以确定已进口的原研样品作为参比制剂。
3、与CRO签订委托合同,该合同应包括双方的权利义务,明确分为自制样品本身所造成的不等效和非药物导致的不等效,自制样品本身所致不等效:药物溶解性、药物吸收性、晶型、化学稳定性、处方工艺等;非药物本身所致不等效(试验设计):试验设计样本量、测定方法学问题、生物样本采集点选择、统计分析方法错误;CRO费用分为预BE 和正式试验,采用分期付款方式;是否在合同中加强CRO对临床机构的监督检查4、基于批件内容,对涉及质量标准变更所需增加的研究内容,应尽快完成,以便得到最终确定的质量标准以进行BE样品试制;对不涉及质量标准变更的研究内容可以变进行研究变做BE,在完成BE最终将申报资料报到国家局之前完成。
同时相关BE样品试制所采购的原辅料质量标准和检验均应升级到申报所对应的中国药典标准。
5、合法途径采购参比制剂,选定代理商所提供的资质:经营资质,供货合同或协议,发票,检验报告,销售清单。
发票最好开给以药厂名义申报的药厂,检验报告最好能要到原研的检验报告(GSP的销售商肯定有,就看他们愿不愿意提供),如果拿不到经销商的检验报告,应由申报的药厂进行参比制剂的检验工作,并出具检验报告。
6、确定临床机构,根据项目特点和既往同类项目操作经验选择临床激光和分析检测机构。
原则是专业、经验丰富,并且要考虑CRO与临床机构的关系是否紧密;如果CRO有分析测试部门,考察其专业性和规范性,如果CRO没有分析检测部分,应确定其合作的分析测试单位的专业性、规范性和经验。
7、BE试验样品试制,在GMP车间生产受试样品应来自一个不少于生产规模1/10的批次或100000单位,两者中选择更多,除非另外说明理由;使用的生产批次应该确实保证产品和过程在工业规模可行。
BE试验一般程序
B E试验一般程序公司内部编号:(GOOD-TMMT-MMUT-UUPTY-UUYY-DTTI-9018)生物等效试验流程:所做工作流程及所需信息资料:1、与原研参比制剂进行多种介质溶出曲线比较:0.1M HCl(pH1.2)、pH4.5醋酸-醋酸钠缓冲液、pH6.8磷酸盐缓冲液、H2O中,因子法测得受试样品和参比样品在15分钟的平均溶出量均不低于f285%。
2、根据原研已在境内上市,所以确定已进口的原研样品作为参比制剂。
3、与CRO签订委托合同,该合同应包括双方的权利义务,明确分为自制样品本身所造成的不等效和非药物导致的不等效,自制样品本身所致不等效:药物溶解性、药物吸收性、晶型、化学稳定性、处方工艺等;非药物本身所致不等效(试验设计):试验设计样本量、测定方法学问题、生物样本采集点选择、统计分析方法错误;CRO费用分为预BE 和正式试验,采用分期付款方式;是否在合同中加强CRO对临床机构的监督检查4、基于批件内容,对涉及质量标准变更所需增加的研究内容,应尽快完成,以便得到最终确定的质量标准以进行BE样品试制;对不涉及质量标准变更的研究内容可以变进行研究变做BE,在完成BE最终将申报资料报到国家局之前完成。
同时相关BE样品试制所采购的原辅料质量标准和检验均应升级到申报所对应的中国药典标准。
5、合法途径采购参比制剂,选定代理商所提供的资质:经营资质,供货合同或协议,发票,检验报告,销售清单。
发票最好开给以药厂名义申报的药厂,检验报告最好能要到原研的检验报告(GSP的销售商肯定有,就看他们愿不愿意提供),如果拿不到经销商的检验报告,应由申报的药厂进行参比制剂的检验工作,并出具检验报告。
6、确定临床机构,根据项目特点和既往同类项目操作经验选择临床激光和分析检测机构。
原则是专业、经验丰富,并且要考虑CRO与临床机构的关系是否紧密;如果CRO有分析测试部门,考察其专业性和规范性,如果CRO没有分析检测部分,应确定其合作的分析测试单位的专业性、规范性和经验。
药物临床试验简介
目录
一 药物临床试验简介
二 BE概念 三 仿制药一致性评价背景 四 BE试验特点
精医求实 博爱创新
重庆市红十字会医院(江北区人民医院)
Chongqing Red Cross Hospital(People’s Hospital of Jiangbei District)
一、药物临床试验简介
1. 概念
研究目的
受试者
研究环境 受益
健康or患者,几例?
封闭or临床科室 药物疗效?经济补偿?监控措施?
研究人员
试验周期 标准化管理
多,集中
双周期or清洗期,访视期 饮食,活动
精医求实 博爱创新
重庆市红十字会医院(江北区人民医院)
Chongqing Red Cross Hospital(People’s Hospital of Jiangbei District)
精医求实 博爱创新
重庆市红十字会医院(江北区人民医院)
Chongqing Red Cross Hospital(People’s Hospital of Jiangbei District)
二、BE概念
•两制剂、单次给药、平行试验设计
-适用于长半衰期药物 -优点:周期短 -缺点:例数多、个体内比较差异大
重庆市红十字会医院(江北区人民医院)
Chongqing Red Cross Hospital(People’s Hospital of Jiangbei District)
药物临床试验简介—BE试验
药剂科 王彩云 2017.11.23
精医求实 博爱创新
重庆市红十字会医院(江北区人民医院)
Chongqing Red Cross Hospital(People’s Hospital of Jiangbei District)
BE试验一般程序
所做工作流程及所需信息资料:1、与原研参比制剂进行多种介质溶出曲线比较: HCl()、醋酸-醋酸钠缓冲液、磷酸盐缓冲液、H2O中,f2因子法测得受试样品和参比样品在15分钟的平均溶出量均不低于85%。
2、根据原研已在境内上市,所以确定已进口的原研样品作为参比制剂。
3、与CRO签订委托合同,该合同应包括双方的权利义务,明确分为自制样品本身所造成的不等效和非药物导致的不等效,自制样品本身所致不等效:药物溶解性、药物吸收性、晶型、化学稳定性、处方工艺等;非药物本身所致不等效(试验设计):试验设计样本量、测定方法学问题、生物样本采集点选择、统计分析方法错误;CRO费用分为预BE和正式试验,采用分期付款方式;是否在合同中加强CRO对临床机构的监督检查4、基于批件内容,对涉及质量标准变更所需增加的研究内容,应尽快完成,以便得到最终确定的质量标准以进行BE样品试制;对不涉及质量标准变更的研究内容可以变进行研究变做BE,在完成BE最终将申报资料报到国家局之前完成。
同时相关BE样品试制所采购的原辅料质量标准和检验均应升级到申报所对应的中国药典标准。
5、合法途径采购参比制剂,选定代理商所提供的资质:经营资质,供货合同或协议,发票,检验报告,销售清单。
发票最好开给以药厂名义申报的药厂,检验报告最好能要到原研的检验报告(GSP的销售商肯定有,就看他们愿不愿意提供),如果拿不到经销商的检验报告,应由申报的药厂进行参比制剂的检验工作,并出具检验报告。
6、确定临床机构,根据项目特点和既往同类项目操作经验选择临床激光和分析检测机构。
原则是专业、经验丰富,并且要考虑CRO与临床机构的关系是否紧密;如果CRO有分析测试部门,考察其专业性和规范性,如果CRO没有分析检测部分,应确定其合作的分析测试单位的专业性、规范性和经验。
7、BE试验样品试制,在GMP车间生产受试样品应来自一个不少于生产规模1/10的批次或100000单位,两者中选择更多,除非另外说明理由;使用的生产批次应该确实保证产品和过程在工业规模可行。
仿制药be试验的流程和注意事项
仿制药be试验的流程和注意事项下载提示:该文档是本店铺精心编制而成的,希望大家下载后,能够帮助大家解决实际问题。
文档下载后可定制修改,请根据实际需要进行调整和使用,谢谢!本店铺为大家提供各种类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by this editor. I hope that after you download it, it can help you solve practical problems. The document can be customized and modified after downloading, please adjust and use it according to actual needs, thank you! In addition, this shop provides you with various types of practical materials, such as educational essays, diary appreciation, sentence excerpts, ancient poems, classic articles, topic composition, work summary, word parsing, copy excerpts, other materials and so on, want to know different data formats and writing methods, please pay attention!仿制药BE试验的流程和注意事项仿制药的生产和上市审批需要通过一系列严格的临床试验来证明其与原始药品的生物等效性(BE)。
