面心立方堆积及六方堆积
六方最密堆积的计算

六方最密堆积的计算
六方最密堆积空间利用率和密度的计算,需要弄清堆积方式、晶胞切割方法、晶胞体积、晶胞中的原子数、原子的体积。
堆积方式为ABAB ------ (六方最密堆积)
一定要区别于ABCABC--- (面心最密堆积)
面心立方密堆积密置层按三层一组相互错开,第四层正对着第一层的方式堆积而成。
配位数为12,晶胞所含原子数为4,金属原子空间利用率为74%。
÷ Ca t SL Pt l Pd J Cu, Ag等约50多种金属为面心立方密堆积
而学生感到困难的是六方最密堆积的晶胞体积,因为它的晶胞是平行六面体,其余的金属晶体晶胞是正六面体!
六方最密堆积计算的关键晶胞体积
文档
至此,你再求晶体空间利用率和晶体密度,障碍是不是消失了?。
晶体结构和性质

2.另一种堆积方式是第三层球的突出部分 落在第二层的八面体空隙上。这样,第三 层与第一、第二层都不同而形成 ABCABC…的结构。这种堆积方式可以从
中划出一个立方面心单位来,所以称为面
心立方最密堆积(A1)。
六方最密堆积(A3)图
六方最密堆积(A3)分解图
面 心 立 方 最 密 堆 积 ( 一 ) 图
c
αβ b γ
c a b a
c b a
立方 Cubic a=b=c, ===90°
四方 Tetragonal a=bc, ===90°
正交 Rhombic abc, ===90°
c b a b
三方 Rhombohedral a=b=c, ==90° a=bc, ==90° =120°
两层堆积情况分析 1.在第一层上堆积第二层时,要形成最密堆积, 必须把球放在第二层的空隙上。这样,仅有半数 的三角形空隙放进了球,而另一半空隙上方是第 二层的空隙。 2.第一层上放了球的一半三角形空隙,被4个球 包围,形成四面体空隙;另一半其上方是第二层 球的空隙,被6个球包围,形成八面体空隙。
三层球堆积情况分析 第二层堆积时形成了两种空隙:四面体空隙和 八面体空隙。那么,在堆积第三层时就会产 生两种方式: 1.第三层等径圆球的突出部分落在正四面体空 隙上,其排列方式与第一层相同,但与第二 层错开,形成ABAB…堆积。这种堆积方式可 以从中划出一个六方单位来,所以称为六方 最密堆积(A3)。
c a
c b a
c b a
六方 Hexagonal a=bc, ==90°, =120°
单斜 Monoclinic abc ==90°, 90°
三斜 Triclinic abc ===90°
六、晶体结构的表达及应用
金属晶体讲解

重点:各类堆积中原子半径(r )与晶胞棱长(a )的关系
1.简单立方堆积
两个顶点的原子紧邻,因此a=2r
晶胞的体积=a 3,每个晶胞中平均只含有一个原子,因此原子总体积=43πr 3=16
πa 3 空间利用率=原子总体积÷晶胞体积=16
π=52.3% 2.体心立方堆积
体对角线的三个原子紧邻,因此4r= 3 a ,即a=43
3 r 晶胞的体积=a 3,每个晶胞中平均含有2个原子,因此原子总体积=2×43
πr 3=38πa 3 空间利用率=原子总体积÷晶胞体积=38π=68%
3.面心立方最密堆积
面对角线的三个原子紧邻,因此4r= 2 a ,即a=2 2 r
晶胞的体积=a 3,每个晶胞中平均含有4个原子,因此原子总体积=4×43
πr 3=26πa 3 空间利用率=原子总体积÷晶胞体积=26π=74%
六方最密堆积的晶胞如果按照课件上的六棱柱比较容易理解,课本上采用的平行六面体晶胞相当于取了六棱柱的三分之一,也就是两个相邻的正三棱柱组合起来。
体心的原子并不是位于平行六面体的正中心,而是位于其中一个三棱柱的正中心。
各类堆积形式的典型金属(高考可能不给具体的晶胞直接考查结构)
简单立方堆积:钋(就一个,比较好记)
体心立方堆积:碱金属加上用量最大的金属铁
面心立方最密堆积:金、银、铜(记成奖牌的三种材质就行了)
六方最密堆积:镁、锌、钛(重点记住这个就行了)
石墨的结构和性质参考课本和课件,也要熟练掌握。
金属晶体金属键堆积方式
修高
3
) 第 三 章
二 化 学 ( 选
第三节
金属晶体
Ti
金属样品 Ti
1、金属共同的物理性质
容易导电、导热、有延展性、有金属光泽等。
金属为什么具有这些共同性质呢? 2、金属的结构
㈠、金属键
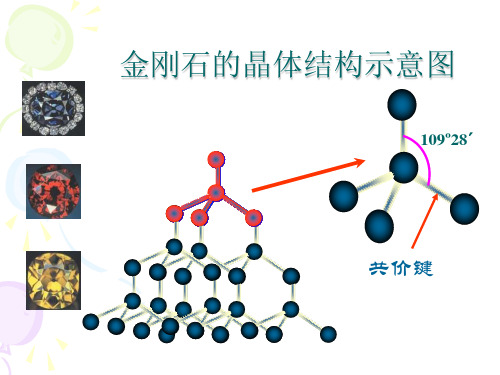
(1)定义: 金属离子和自由电子之间的相互作用。 (2)成键微粒: 金属阳离子和自由电子 (3)键的存在: 金属单质和合金中 (4)方向性: 无方向性 (5)键的本质: 电子气理论
【总结】非金属单质是原子晶体还是分子晶体的 判断方法
(1)依据组成晶体的粒子和粒子间的作用判断: 原子晶体的粒子是原子,质点间的作用是共价键; 分子晶体的粒子是分子,质点间的作用是范德华力。
(2)记忆常见的、典型的原子晶体。 (3)依据晶体的熔点判断:原子晶体熔、沸点高, 常在1000℃以上;分子晶体熔、沸点低,常在数百 度以下至很低的温度。 (4)依据导电性判断:分子晶体为非导体,但部 分分子晶体溶于水后能导电;原子晶体多数为非导 体,但晶体硅、晶体锗是半导体。 (5)依据硬度和机械性能判断:原子晶体硬度大, 分子晶体硬度小且较脆。
③ 六方堆积 ——六方晶胞
④面心立方堆积 ——面心立方晶胞
配位数 = 12 空间利用率 = 74.05% 配位数 = 12 空间利用率 = 74.05%
知识拓展-石墨
一种结晶形碳,有天然出产的矿物。铁 黑色至深钢灰色。质软具滑腻感,可沾污手 指成灰黑色。有金属光泽。六方晶系,成叶 片状、鳞片状和致密块状。密度2.25g/cm3, 化学性质不活泼。具有耐腐蚀性,在空气或 氧气中强热可以燃烧生成二氧化碳。石墨可 用作润滑剂,并用于制造坩锅、电极、铅笔 芯等。
4.金属晶体熔点变化规律
金属晶体的三种密堆积方式

金属晶体的三种密堆积方式金属晶体的三种密堆积方式中,原子排列的密堆积方式是指原子在三维空间中紧密排列,以使得晶体的空间利用率达到最大。
密堆积方式可以有效影响金属的密度、强度、硬度等物理性质,因此在材料科学和固体物理中具有重要意义。
通常,金属晶体的密堆积方式主要分为以下三种:面心立方堆积(FCC)、六方最密堆积(HCP)和体心立方堆积(BCC)。
一、面心立方堆积(FCC)面心立方堆积(Face-Centered Cubic, FCC)是一种常见的密堆积方式,其中每个立方体的面上都有一个原子,且每个顶点上也有一个原子。
FCC结构可以看作是由许多面心立方单元重复堆积而成,其代表性金属包括铜(Cu)、铝(Al)、银(Ag)和金(Au)等。
1. 结构特点:在FCC结构中,每个原子都有12个最近邻原子,即配位数为12。
该结构单胞中包含4个原子(8个顶点上的原子分别与相邻单元共享,6个面的原子与邻近单元共享),堆积因子达到0.74,即约74%的空间被原子占据,属于最密堆积结构。
2. 性质:FCC结构由于其紧密的堆积方式,具有较高的塑性和延展性。
因此,FCC金属在室温下一般较易发生滑移,从而产生延展变形。
例如,铜和铝具有良好的延展性,易于加工成型。
3. 堆积方式:在面心立方堆积中,原子在平面上形成紧密的六边形排列,层间顺序为ABCABC 的排列模式。
这意味着每三层后结构重复,形成周期性排列。
4. 应用:FCC结构的金属由于其良好的延展性和抗冲击性,常用于制造电线、金属薄膜和结构材料等。
二、六方最密堆积(HCP)六方最密堆积(Hexagonal Close-Packed, HCP)是一种与面心立方相似的密堆积方式,但其晶体结构为六方柱体,且具有不同的堆积顺序。
HCP结构的代表性金属包括镁(Mg)、钛(Ti)、锌(Zn)和钴(Co)等。
1. 结构特点:在HCP结构中,原子的配位数同样为12,说明其紧密度与FCC相似。
晶体密堆积原理

密堆积:由无方向性的金属键、离子键和范德华 力等结合的晶体中,原子、离子或分子等微观 粒子总是趋向于相互配位数高,能充分利用空 间的堆积密度最大的那些结构。
密堆积方式因充分利用了空间,而使体系的势能 尽可能降低,而结构稳定。
常见的密堆积类型
常见密堆积型式
面心立方最密堆积(A1)
六方最密堆积(A3)
3
r 3a 4
r 3a 8
5.堆积方式与晶胞关系
A1—面心立方晶胞 A2—体心立方晶胞 A4—面心立方晶胞 A3—六方晶胞
六方晶胞中a=bc, ==90º, =120º
晶体类型
根据形成晶体的化合物的种类不同可以 将晶体分为:离子晶体、分子晶体、原 子晶体和金属晶体。
1. 离子晶体
离子键无方向性和饱和性,在离子晶体中 正、负离子尽可能地与异号离子接触,采 用最密堆积。 离子晶体可以看作大离子进行等径球密堆 积,小离子填充在相应空隙中形成的。 离子晶体多种多样,但主要可归结为6种 基本结构型式。
2
3
2a3 8 2r3
V球
2
4
3
r3
(晶胞中有2个球)
V球 V晶胞 100% 74.05%
A1型堆积方式的空间利用率计算
解:V晶胞
a3
32 2
r3
晶胞中含4个球 :
V球
4
4 3
r 3
空间利用率 V球 V晶胞 74.05%
2.体心立方密堆积(A2)
A2不是最密堆积。每个球有八个最近的配体 (处于边长为a的立方体的8个顶点)和6个稍远 的配体,分别处于和这个立方体晶胞相邻的六 个立方体中心。故其配体数可看成是14,空间 利用率为68.02%. 每个球与其8个相近的配体距离 d 3 a
金属晶体堆积方式

第三章第三节 金属晶体
金属晶体的原子堆积方式
学习目标
熟知金属晶体的原子堆积模型的分类 及结构特点
金属原子在二维空间的放置方式
金属晶体中的原子可看成直径相等的球体,金属原子 排列在平面上有两种放置方式。
非密置层
密置层
金属原子在三维空间的放置方式
金属晶体可看成金属原子在三维空间中堆积而成。金 属原子堆积有如下4种基本模式。 1.简单立方堆积 2.体心立方堆积 3.六方最密堆积 4.面心立方最密堆积
归纳总结
1.堆积原理
组成晶体的金属原子在没有其他因素影响时,在空间的排列大都服从
紧密堆积原理。这是因为在金属晶体中,金属键没有方向性和饱和性,
因此都趋向于使金属原子吸引更多的其他原子分布于周围,并以密堆
积方式降低体系的能量,使晶体变得比较稳定。
2.常见的堆积模型
堆积模型
简单 立方
采纳这种堆积 的典型代表
置层记作A,第二层记作B,B层的球对准A层中的三角形
空隙位置,第三层记作C,C层的球对准B层的空隙,同时
应对准A层中的三角形空隙(即C层球不对准A层球)。这种 排列方式三层为一周期,记为ABC„由于在这种排列中可
以划出面心立方晶胞,故称这种堆积方式为面心立方最密
堆积。 Cu 、 Ag 、 Au 等均采用此类堆积方式。
两层中各 3 个球相接触,故每个球与周围 12 个球相
接触,所以其配位数是 12 。原子的空间利用率最大。 Mg、Zn、Ti都是采用这种堆积方式。
面心立方堆积(ABCABC…)
B
C
A
A C B A C B A
面心立方堆积(ABCABC…)
A C B A C B A
金属晶体堆积模型复习及计算

请计算:空间利用率?
以体心立方晶胞为例,计算晶胞中原子的 空间占有率。
小结:(2)钾型 (体心立方堆积)
配位数:8
(3)面心立方:在立方体顶点的微粒为8 个晶胞共有,在面心的为2个晶胞共有。
微粒数为: 8×1/8 + 6×1/2 = 4
请计算:空间利用率?
B
此种立方紧密堆积的前视图A
7 1 9
6
5
8 2
3 4
10
11
12
这种堆积晶胞空间利用率高(74%),属于 最密置层堆集,配位数为 ,许多金属(如 Mg、Zn、Ti等)采取这种堆积方式。
回顾镁型的晶胞
1200
平行六面体
找铜型的晶胞
C B A
回顾:配位数 每个小球周围距离最近的小球数
=19.36g/cm3 1nm=10-9m=10-7cm
复习1pm=10-12m
练2:
现有甲、乙、丙、丁四种晶胞,可推知甲
晶晶体体体的中化的与学化的式学粒 为式子—为E—个F——D或—数—C——F比2——E—为;或——丁—C—1—晶—2:D1——体——;的—;丙化乙晶学 式为—X—Y——2Z——。
BA
甲
DC
乙
F
E
丙
Z X
Y
丁
练3: 甲
乙
丙
上图甲、乙、丙分别为体心堆积、面心立方堆积、 六方堆积的结构单元,则甲、乙、丙三种结构单
元中,金属原子个数比为——1—:—2:—3————。
乙晶胞中所含金属原子数为8×1/8+6×1/2=4 晶胞中所含金属原子数为12×1/6+2×1/2+3=6
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
将视线逐步移向体对角线, 沿此线观察:
你看到的正是ABCABC……堆积!
六方最密堆积:ABAB……
六方晶胞
六方最密堆积形成后, 从中可以划 分出六方晶胞.
每个晶胞含2个原子(即81/8+1), 组成一个结构基元. 可抽象成六方简单格子:
c
晶胞
体心立方
面心立方
六方
ABCABC…
垂直于密置层观察(俯视图) 平行于密置层观察(侧视图)
面心立方晶胞
ABCABC……堆积怎么会形成面心立方晶胞? 请来个逆向思维:
取一个面心立方晶胞:Байду номын сангаас
体对角线垂直方向就是密置层, 将它们设成3种色彩:
从逆向思维你已明白, 立方面心晶胞确实满足 ABCABC……堆积。
那么, 再把思路正过来: ABCABC……堆积形成面 心立方晶胞也容易理解吧?
面心立方堆积 及六方堆积
(1)ABCABC……, 即 每三层重复一次, 这种结构 从中可以取出面心立方晶胞;
(2)ABABAB……, 即每 两层重复一次, 从中可取出六 方晶胞。
这两种最密堆积是金属单质晶体的典型结构.
面心立方堆积 : ABCABC…
红、绿、蓝球是同一种原子,使用三种色球只是为了看清三层的关系 。
