晶胞计算习题
晶胞计算习题

1.回答下列问题(1)金属铜晶胞为面心立方最密堆积, 边长为acm。
又知铜的密度为ρ g·cm-3, 阿伏加德罗常数为_______。
(2)下图是CaF2晶体的晶胞示意图, 回答下列问题:①Ca2+的配位数是______, F-的配位数是_______。
②该晶胞中含有的Ca2+数目是____, F-数目是_____, ③CaF2晶体的密度为ag·cm-3, 则晶胞的体积是_______(只要求列出算式)。
2.某些金属晶体(Cu、Ag、Au)的原子按面心立方的形式紧密堆积, 即在晶体结构中可以划出一块正立方体的结构单元, 金属原子处于正立方体的八个顶点和六个侧面上, 试计算这类金属晶体中原子的空间利用率。
(2)(3)3、单晶硅的晶体结构与金刚石一种晶体结构相似, 都属立方晶系晶胞, 如图:(1)将键联的原子看成是紧靠着的球体, 试计算晶体硅的空间利用率(计算结果保留三位有效数字, 下同)。
(2)已知Si—Si键的键长为234 pm, 试计算单晶硅的密度是多少g/cm3。
4、金晶体的最小重复单元(也称晶胞)是面心立方体, 如图所示, 即在立方体的8个顶点各有一个金原子, 各个面的中心有一个金原子, 每个金原子被相邻的晶胞所共有。
金原子的直径为d, 用NA表示阿伏加德罗常数, M表示金的摩尔质量。
请回答下列问题:(1)金属晶体每个晶胞中含有________个金原子。
(2)欲计算一个晶胞的体积, 除假定金原子是刚性小球外, 还应假定_______________。
(3)一个晶胞的体积是____________。
(4)金晶体的密度是____________。
5.1986年, 在瑞士苏黎世工作的两位科学家发现一种性能良好的金属氧化物超导体, 使超导工作取得突破性进展, 为此两位科学家获得了1987年的诺贝尔物理学奖, 实验测定表明, 其晶胞结构如图所示。
(4)(5)(6)(1)根据所示晶胞结构, 推算晶体中Y、Cu、Ba和O的原子个数比, 确定其化学式。
高中化学晶胞的相关计算专项训练知识点及练习题及答案

高中化学晶胞的相关计算专项训练知识点及练习题及答案一、晶胞的相关计算1.铁(Fe)、铜(Cu)、银(Ag)是常见的金属元素,它们的单质及其化合物在生活中有广泛应用。
(1)Ag 与 Cu 在同一族,则 Ag 在周期表中________ (填“s”、“p”、“d”或“ds”)区;[Ag(NH3)2]+中Ag+空的 5s 轨道和 5p 轨道以sp 杂化成键,则该配离子的空间构型是________。
(2)基态 Cu+的简化电子排布式为________。
(3)表中是 Fe 和 Cu 的部分电离能数据:请解释 I2(Cu)大于 I2(Fe)的主要原因:________。
元素Fe Cu第一电离能 I1/kJ·mol-1759746第二电离能 I2/kJ·mol-115611958(4)亚铁氰化钾是食盐中常用的抗结剂,其化学式为 K4[Fe(CN)6]。
①CN-的电子式是________;1mol 该配离子中含σ 键数目为________。
②该配合物中存在的作用力类型有________ (填字母)。
A.金属键 B.离子键 C.共价键 D.配位键 E.氢键 F.范德华力(5)氧化亚铁晶体的晶胞结构如图所示。
已知:氧化亚铁晶体的密度为ρg•cm﹣3,N A代表阿伏加德罗常数的值。
在该晶胞中,与 Fe2+紧邻且等距离的 Fe2+数目为________,Fe2+与O2﹣最短核间距为________pm。
2.国庆70周年阅兵式展示了我国研制的各种导弹。
导弹之所以有神奇的命中率,与材料息息相关,镓(Ga)、锗(Ge)、硅(Si)、硒(Se)的单质及某些化合物(如砷化镓、磷化镓等)都是常用的半导体材料。
回答下列问题:(1)硒常用作光敏材料,基态硒原子的核外电子排布式为[Ar]__。
(2)根据元素周期律,原子半径Ga__As,第一电离能Ga__As。
(填“大于”或“小于”)(3)水晶的主要成分是二氧化硅,在水晶中硅原子的配位数是__。
《结晶学基础》第十章习题答案9501第一步:计算出金刚石的晶胞参数a...

《结晶学基础》第十章习题答案9501第一步: 计算出金刚石的晶胞参数a 。
d =3A/a N ZM a = (30231051.3)1002.6/()00.128(-⨯⨯⨯)1/3pm = 356.8 pm 第二步: 根据C 原子的坐标参数, 计算键长。
其中,相邻两个C 原子的坐标: (0,0,0); (1/4,1/4,1/4);它们之间的距离即键长是晶 胞对角线长的1/4,晶胞对角线长为3ad c —c = 43a = 48.3563⨯pm = 154 pm9502(B)950334.01%9504(1)硅晶体晶胞中有8个Si 原子, d =23310023.606.288⨯⨯⨯a , a = 543pm (2) r Si —Si =(1/4)3a = 235 pm 9505 a = 31178⨯pm = 540 pm9506 (1)60sin 21642A c a N )(+=866.01037.752.41002.618424223⨯⨯⨯⨯⨯⨯-g ·cm -3=0.917 g ·cm -3(2) O —H …O 氢键存在于各邻近的O …O 之间, 氢键键长为0.375×737 pm=276 pm 。
9506 (1)60sin 21642A c a N )(+=866.01037.752.41002.618424223⨯⨯⨯⨯⨯⨯-g ·cm -3=0.917 g ·cm -3(2) O —H …O 氢键存在于各邻近的O …O 之间, 氢键键长为0.375×737 pm=276 pm 。
9508含有2个B------B 三中心二电子桥键。
9509参看周公度编著,《结构化学基础》,北京大学出版社,1989, p.444 。
4个B------B 三中心二电子硼氢桥键 1个 五中心六电子硼键。
9510(1) 参看周公度编著, 《结构化学基础》,北京大学出版社,1989, p.444 。
【化学奥赛】晶体结构习题new!
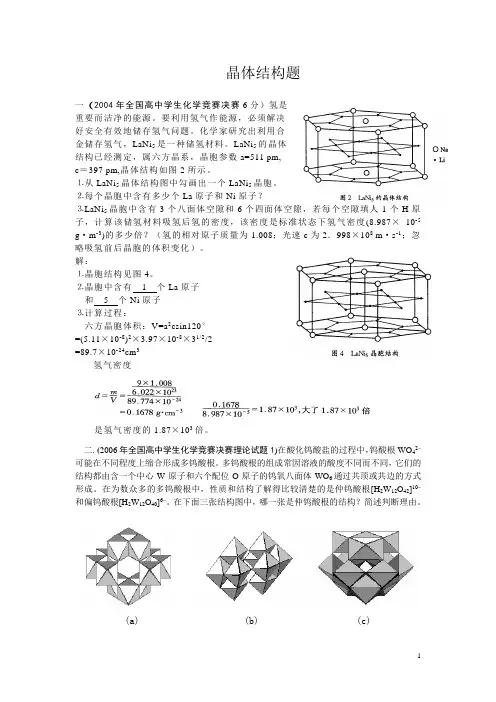
晶体结构题一(2004年全国高中学生化学竞赛决赛6分)氢是重要而洁净的能源。
要利用氢气作能源,必须解决好安全有效地储存氢气问题。
化学家研究出利用合金储存氢气,LaNi5是一种储氢材料。
LaNi5的晶体结构已经测定,属六方晶系,晶胞参数a=511 pm,c=397 pm,晶体结构如图2所示。
⒈从LaNi5晶体结构图中勾画出一个LaNi5晶胞。
⒉每个晶胞中含有多少个La原子和Ni原子?⒊LaNi5晶胞中含有3个八面体空隙和6个四面体空隙,若每个空隙填人1个H原子,计算该储氢材料吸氢后氢的密度,该密度是标准状态下氢气密度(8.987×10-5 g·m-3)的多少倍?(氢的相对原子质量为1.008;光速c为2.998×108 m·s-1;忽略吸氢前后晶胞的体积变化)。
解:⒈晶胞结构见图4。
⒉晶胞中含有1个La原子和5个Ni原子⒊计算过程:六方晶胞体积:V=a2csin120°=(5.11×10-8)2×3.97×10-8×31/2/2=89.7×10-24cm3氢气密度是氢气密度的1.87×103倍。
二. (2006年全国高中学生化学竞赛决赛理论试题1)在酸化钨酸盐的过程中,钨酸根WO42-可能在不同程度上缩合形成多钨酸根。
多钨酸根的组成常因溶液的酸度不同而不同,它们的结构都由含一个中心W原子和六个配位O原子的钨氧八面体WO6通过共顶或共边的方式形成。
在为数众多的多钨酸根中,性质和结构了解得比较清楚的是仲钨酸根[H2W12O42]10-和偏钨酸根[H2W12O40]6-。
在下面三张结构图中,哪一张是仲钨酸根的结构?简述判断理由。
(a) (b) (c)解:提示:考察八面体的投影图,可以得到更清楚地认识。
三.(2006年全国高中学生化学竞赛决赛理论试题4)轻质碳酸镁是广泛应用于橡胶、塑料、食品和医药工业的化工产品,它的生产以白云石(主要成分是碳酸镁钙)为原料。
第二章 习题
3 在立方晶系中画出以[001]为晶带轴的所有晶面
4.试计算面心立方晶体的(100),(110),(111)等晶面 的面间距和面致密度,并指出面间距最大的晶面。
5. 在立方晶系的一个晶胞中画出同时位于(101),(011) 和(112)晶面上的 [111] 晶向
6. 通过计算判断 (110) 、(132)、(311)晶面是否属于同 一晶带轴?
7求(211)和(110)晶面的晶带轴,并列出5个属于该晶带 轴的晶面的Байду номын сангаас勒指数。
概念辨析: 晶体结构与空间点阵 间隙固溶体与间隙化合物 晶向指数晶面指数
1. 标出面心立方晶胞中(111)面上各点坐标,并判断 [110] 是否位于(111)面上,然后计算 [110]方向的线密度。
2. 标出具有下列弥勒指数的晶面和晶向: 立方晶向:(421), [123] ,(130), [211] , [311] 六方晶系:(2111) (1101) [2111] [1213]
晶体学习题(附录部分)

附录 习题1-1 CaF 2晶体的晶胞中有4个Ca 2+其指数(坐标分数)为:0 0 0,1/20 1/2, 0 1/2 1/2,1/2 0 1/2。
还有8个F —,其指数为1/4 1/4 1/4,3/41/4 1/4,1/4 3/4 1/4, 1/4 1/4 3/4,3/4 3/4 3/4,1/4 3/4 3/4,3/4 1/4 3/4, 3/4 3/4 1/4,试为它应属何种点阵类型?为什么?它的结构基元是什么?1-2 为什么在复杂点阵中只有底心、体心和面心三种,并画出这三种点阵的阵胞。
1-3 分别写出晶胞中0 0 0 指向1/4 1/4 1/2, 1/2 1/2 0 指向 0 0 1/2 两个晶向的指数,并在晶胞中画出这两个晶向。
1-4 写出过 (1)1/2 0 0 ,0 1/4 0,0 0 1/2(2)1 1/2 1, 1/2 1 1,1 1 –1点的两个晶面指数,且在晶胞中画出这两个晶面。
1-5 在简单阵胞中分别画出题1-4 中两个晶面族中离原点最近的两个面网。
2-1 试证明垂直二次旋转轴具有对称面的图形必具有对称中心。
2-2 Si 属m d h F O 24731-空间群,α-SiO 2属23143P D - 空间群,试写出它们分别属什么晶系、晶类、晶族、点阵类型及微观、宏观对称元素所在晶面(或晶向、点)的指数。
(h P O 244732-, D4h-4/m 2/m 2/m, Td-43m) 2-3 写出七大晶系晶胞参数的特点。
2-4 在布拉菲点阵中为何没有底心立方、底心六角、体心六角和面心六角?它们分别属于何种布拉菲点阵?2-5写出立方晶系中{111}晶形中全部等同晶面指数。
2-6写出六方晶系中{110}晶形中全部等同晶面指数。
2-7写出立方晶系中<123>的全部等同晶向指数。
2-8写出六方晶系中<110>的全部等同晶向指数。
3-1 写出七大晶系倒格子晶胞参数的特点。
晶胞计算习题问题详解
1、【答案】(1)mol-1(2)①8 4 ②48③【解析】(1)铜晶胞为面心立方最密堆积,1个晶胞能分摊到4个Cu原子;1个晶胞的体积为a3cm3;一个晶胞的质量为a3ρ g;由=a3ρ g,得N A=mol-1。
(2) ①每个Ca2+周围吸引8个F-,每个F-周围吸收4个Ca2+,所以Ca2+的配位数为8,F-的配位数为4。
②F-位于晶胞部,所以每个晶胞中含有F-8个。
含有Ca2+为×8+×6=4个。
③ρ===a g·cm-3,V=。
2、【解析】试题分析:本考查学生对知识综合利用能力,要求对晶胞知识能够融会贯通。
依题意画出侧面图,设正立方体边长为a,则体积为a3。
,AC=4r,故原子半径,根据均摊法得,每个正立方体包括金属原子8×1/8+6×1/2=4(个),球体体积共4×空间利用率为:.考点:均摊法计算点评:本题考查相对综合,是学生能力提升的较好选择。
3、(1)34.0% (2)2.36 g/cm3【解析】(1)该晶胞中Si原子个数=4+8×1/8+6×1/2=8,设Si原子半径为xcm,该晶胞中硅原子总体积=,根据硬球接触模型可知,体对角线四分之一处的原子与顶点上的原子紧贴,设晶胞边长为a,所以,解得a=,晶胞体积=()3,因此空间利用率=×100%=34.0%。
(2)根据以上分析可知边长=,所以密度==2.36g/cm3。
4、【答案】(1)4(2)金属原子间相接触,即相切(3)2d3(4)【解析】利用均摊法解题,8个顶点上每个金原子有属于该晶胞,6个面上每个金原子有属于该晶胞,故每个晶胞中金原子个数=8×+6×=4。
假设金原子间相接触,则有正方形的对角线为2d。
正方形边长为d。
所以V晶=(d)3=2d3,V m=N A=d3N A,所以ρ==。
5、【答案】(1)YBa2Cu3O7(2)价n(Cu2+)∶n(Cu3+)=2∶1【解析】(1)由题图所示晶胞可知:一个晶胞中有1个Y3+,2个Ba2+。
第一章晶格结构习题
第一章晶体结构习题1、晶体结构的堆积比率 在sc, bcc 和fcc 结构中,fcc 是原子排列最密积的,sc 是最稀疏的,它们的配位数分别是fcc-12;bcc-8;sc-6;而金刚石结构比简单立方结构还要稀疏,配位数是4。
如果把同样的硬球放置在这些结构原子所在的位置上,球的体积取得尽可能大,以使最近邻的球正好接触,但彼此并不重迭。
我们把一个晶胞中被硬球占据的体积和晶胞体积之比定义为结构的堆积比率(又叫最大空间利用率)。
试证明以上四种结构的堆积比率是fcc :74.062=π bcc :68.083=π sc :52.061=π 金刚石:34.0163=π 2、点阵常数的计算 已知氯化钠是立方晶体,其分子量为58.46,在室温下的密度是2.167×103 kg·m -3,试计算氯化钠结构的点阵常数。
3、立方晶系的晶面和晶向 证明立方晶系中方向[hkl ]垂直于平面(hkl )。
4、六角密堆积结构 (a) 证明理想的六角密堆积结构(hcp)的轴比c /a 是 (8/3)1/2=1.633。
(b) 钠在23K 附近从bcc 结构转变为hcp 结构(马氏体相变),假如在此相变过程中保持密度不变,求hcp 相的点阵常数a 。
已知bcc 相的点阵常数是4.23Å,且hcp 相的c /a 比值与理想值相同。
5、面间距 考虑晶体中一组互相平行的点阵平面 (hkl ),(a) 证明倒易点阵矢量G (hkl )=h b 1+k b 2+l b 3垂直于这组平面(hkl );(b) 证明两个相邻的点阵平面间的距离d (hkl )为:)(2)(hkl G hkl d π= (c) 证明对初基矢量a 1、a 2、a 3互相正交的晶体点阵,有 232221)/()/()/(1)(a l a k a h hkl d ++=(d) 证明对简单立方点阵有 )()()()(222l k h ahkl d ++=6、一个单胞的尺寸为a 1=4 Å ,a 2=6 Å ,a 3=8 Å ,α=β=90°,γ=120°,试求:(a) 倒易点阵单胞基矢;(b)倒易点阵单胞体积;(c) (210)平面的面间距。
习题和思考题
《无机材料科学基础》习题和思考题第一章晶体1.球体按立方最紧密堆积方式堆积,取出立方晶胞,画出立方晶胞中的四面体空隙和八面体空隙的位置分布图。
2.用鲍林规则分析氧化镁晶体结构。
已知镁离子半径为0.65Å,氧离子半径为1.40Å。
(1)确定晶胞中质点的位置坐标;(2)计算每个晶胞中含氧化镁“分子”数,(3)已知晶胞常数a=4.20 Å,求氧化镁堆积系数和密度,(4)氧化镁晶体中最邻近的两个镁离子中心距为多少?次邻近的两个镁离子中心距为多少?最邻近和次邻近的两个氧离子中心距为多少?(5)画出氧化镁晶胞的(111)、(110)、(100)面的质点分布图并在图上标出氧离子的密排方向,求个面的面密度。
3.已知纤锌矿结构中存在两套硫离子和两套锌离子的六方底心格子,并已知锌离子填充在硫离子最紧密堆积体的四面体空隙中,现以一套硫离子的等同点为基准取六方晶胞,画出晶胞中的质点分布图,计算晶胞中所含式量分子数。
4.完成下表5. 六方最紧密堆积与四方最紧密堆积的堆积密度相同,为什么许多氧化物是以氧离子的立方最紧密堆积为基础,而较少以六方最紧密堆积为基础?6. 用鲍林规则分析镁橄榄石的结构:P48 图2-18(1)标记为50的Mg2+与哪几个氧离子配位形成[MgO6]八面体?写出O2+的标高;(2)标记为25的两个O2+与哪几个镁离子配位?写出Mg2+离子的标高;(3)标记为75的O2+离子与哪几个镁离子配位?写出Mg2+离子的标高;(4)标记为0和50的两个Mg2+的[MgO6] 八面体共用几个顶点?写出O2+的标高;(5)[SiO4] 和 [MgO6] 之间、[MgO6]和[MgO6] 八面体之间有那些连接方式?(6)镁橄榄石的晶胞是什么形状?计算晶胞中含有的式量分子数。
第二章晶体缺陷1.氧化镁为氯化钠型结构,氧化锂为反萤石型结构,在两种结构中氧离子都作立方最紧密堆积,为什么在氧化镁中主要的热缺陷是肖特基型,而在氧化锂中却是弗伦克尔型?萤石型结构的氧化物晶体中常见的热缺陷估计主要是什么类型?为什么?2.已知氯化钠晶体中肖特基缺陷形成焓为2.2ev,而氧化镁晶体中肖特基缺陷形成焓为6ev,试分别计算400℃时氯化纳晶体与氧化镁晶体中肖特基缺陷的浓度。
第1章习题解答---(部分)
第一章 晶 体 结 构1. ( 黄1.7; ) 写出体心立方和面心立方晶格结构的金属中,最近邻和次近邻的原子数.若立方边长为a ,写出最近邻和次近邻的原子间距. 解:2. 补充题:对由两种原子构成的配位数是4的复式格子,求小原子半径r 与大原子半径R 之比的下限.解:配位数为4, A 为正四面体结构.如图,四个大球的球心为正四面体的四个顶点A、B、 pC、D;小球球心为正四面体的 o中心0 ;它们都相切. DR AB AP ==21Er R AO += B C∴ RrAP AO +=1225.0130sec 4230sec 42)30cos /(42)()(2222222≈−°−=∴°−=°−=−==Rr R R R BE AB R AE ABAP AO Q 即配位数为4, 225.041.0≥>Rr或利用正方体,225.015.1222223≈−=−=R r3. ( 黄1.8; )画出体心立方和面心立方晶格结构的金属在 (100) , (110) , (111) 面上的原子排列. [ 提示:本题为轴矢系统中的Miller 指数,画出平面点阵的平行四边形晶胞 ]解:设体心立方和面心立方晶胞的晶胞常数为a ,则所求晶面平面点阵的二维晶胞如下:( 1 0 0 ) ( 1 1 0 ) ( 1 1 1 ) ● ● ● ● ● ●bcc a ● 2a● ● ● ● 60 o a 2a ● ● 2a● ● ● ● ●fcc a ● a ● ● ● ● ● ● ● ● ● a 2a 2/a 引申讲解一.问题:1.只在立体图上标出晶面(可能对,但不好).2.只给出平面点阵,无连线、尺度及角度标注(可能对,但不好).二.原则:尽量理解别人的意思;尽量给别人表示清楚:简明、准确、无歧义.三.本题:设……a ;分别画二维晶胞;标明尺度;非90o 之角最好表示.4. ( 黄1.9; )指出立方晶格(111)面与(100)面,(111)面与(110)面交线的晶向.[ 提示:最好画图说明]解:如右图所示,(111)面即为EBG 面;(100)面为ABCD 面或EFGH 面;(110)面即ABGH 面;(111)面与(100)面的交线,可为EG 线,晶向指数为[1,1,0];(111)面与(110)面的交线,可为BG 线,晶向指数为[0,1,1];5. (黄1.3;方3 )试证面心立方的倒格子是体心立方;体心立方的倒格子是面心立方.证明:(1) fcc 的基矢 )(2,)(2,)(2321j i a a k i a a k j a a rr r r r r r r r +=+=+= 原胞体积 341a =Ω相应倒格子基矢 )(2)(2321k j i aa ab r r r r r r ++−π=Ω×π= )(22k j i a b rr r r +−π= )(23k j i ab r r r r −+π=所以面心立方的倒格子是体心立方格子.(2) bcc 的基矢 )(2,)(2,)(2321k j i a a k j i a a k j i a a rr r r r r r r r r r r ++=+−=++−= 原胞体积 321a =Ω相应倒格子基矢 )(2)(2321k j aa ab r r r r r +π=Ω×π= )(22k i a b rr r +π= )(23j i ab r r r +π=所以体心立方的倒格子是面心立方格子.6. ( 黄1.4; ) 证明:倒格子原胞的体积为c v /)2(3π,其中c v 为正格子原胞的体积.ZE H A DF G Y B C X证:倒格子原胞的体积记为∗c v ,由公式CB A BC A C B A rr r r r r r r r )()()(⋅−⋅=××{{}c ccc v a a a a a a a a a a v a a a a a a v b b b v 321131213323321133233321)2(])[(])[()(8)]()[()(8)(*π=⋅×−⋅×⋅×π=×××⋅×π=×⋅=r r r r r r r r r r r r r r rr r r r [解法二]用到一个公式:)()(C B A C B A rr r r r r ×⋅=⋅× , 则有推论:))(())((])()[()]([)()(c b d a d b c a d c b c d b a d c b a d c b a rr r r r r r r r r r r r r r r r r r r r r r ⋅⋅−⋅⋅=⋅−⋅⋅=××⋅=×⋅×本题:323323322323211321321)2()])(())([(2)])()[(()]()][([*π=⋅⋅−⋅⋅π=××⋅=×⋅×⋅=b a b a b a b a b b a a b a b b b a a a v v c c rr r r r r r r r r r r r r r r r rr r 本题易犯的错误及纠正:1. a r 1无定义!×=⋅ab a b r v r r 12. 2a ab a b r r v r r ≠⋅,如j i b a b i a j i b r r r r r rr r r r +=⋅⎩⎨⎧=+=, 而 i a a r r r =2 3. )()]([32211321a a a a a a a rr r r r r r ×≠×⋅7.补充题:有一简单格子,基矢选成)(5.133321k j i a j a i a r r r r r r r r++===、、.其中k j i rr r 、、为笛卡尔坐标系中的单位矢量.证明这种晶格是哪种Bravais 格子?并计算其晶胞体积.解:可选轴矢k a a a c j a b i a a r r r r r s v r r rr 32,3,321321=−−=====;构成立方体;又由3a r可知在体心有格点;且题中所给原胞的体积5.13)(321=×⋅=a a a r r r ;新选晶胞的体积27)(=×⋅=c b a rr r ,故这种晶格必是bcc 格子. 晶胞体积=33=27.8.补充题:六角晶系的基矢: k c c j a i a b j a i a a r r rr r r r r=+−=+=,223,223求其倒格子基矢.解:六角晶系的平行六面体晶胞即原胞,正格子原胞体积:)3()3(4])223[()223()(2i j j i ca k c j a i a j a i a cb a r r v r r r r r r r r r +⋅+=×+−⋅+=×⋅=Ωc a 223=倒格子基矢: )33(2])223[(34)(2*2j i a k c j a i a ca cb a vr r r r rr r +π=×+−π=×Ωπ= )33(2)]223([34)(2*2j i a j a i a k c ca a cb vr r r r r r r +−π=+×π=×Ωπ= )33(3)]223()223[(34)(2*2k k cj a i a j a i a c a b a c r r r r r r r r r +π=+−×+π=×Ωπ= kc r π=2仍为六角晶胞格子.9.补充题 求晶格常数为a 的面心立方和体心立方晶体晶面族)(321h h h 的面间距. 解:(1) fcc 的倒格子基矢: )(21k j i a b r r r r ++−π= )(22k j i a b r r r r +−π= )(23k j i a b r r r r −+π=则])()()[(2321231132332211k h h h j h h h i h h h ab h b h b h K h r rr r r r r −++−++−+π=++=)(2)(32)()()(2323121232221232122312132h h h h h h h h h ah h h h h h h h h aK h ++−++π=−++−++−+π=r ∴ )(2)(32323121232221h h h h h h h h h aK d hh ++−−+=π=r (2) bcc 的倒格子基矢:)(21k j a b r r r +π= )(22k i a b rr r +π= )(23j i a b r r r +π=则])()()[(2213132332211k h h j h h i h h ab h b h b h K h r rr r r r r +++++π=++=3231212322212212312328)()()(2h h h h h h h h h ah h h h h h a K h +++++π=+++++π=r ∴ )(22323121232221h h h h h h h h h aK d hh +++++=π=r 10.补充题 试找出体心立方和面心立方结构中,格点最密的面和最密的线.解:(1)bcc )(22323121232221h h h h h h h h h aK d hh +++++=π=r 格点最密的面为{1,0,0}及{1,-1,0},而最密的线为[1,0,0]. (2)fcc )(2)(32323121232221h h h h h h h h h aK d hh ++−++=π=r 格点最密的面为{1,0,0}及{1,1,1},而最密的线为[1,0,0].11.补充题 对于面心立方晶体,已知晶面族的密勒指数为(hkl ),求对应的原胞坐标系中的面指数(321h h h ),若已知(321h h h ),求对应的(hkl ).解: kac j a b i a a ka c j ab i a a rr r r r r r rr r r r π=π=π====2*,2*,2*;,,基矢和倒格子基矢: )(2,)(2,)(2321j i a a k i a a k j a a rr r r r r r r r +=+=+= ;)(2)(2321k j i a a a b r r r r r r ++−π=Ω×π= )(22k j i a b r r r r +−π= )(23k j i a b r r r r −+π=][2***k l j k i h ac l b k a h K hkl rr r r r r r ++π=++=])()()[(2321231132332211k h h h j h h h i h h h ab h b h b h K h r rr r r r r −++−++−+π=++=)(hkl Q 和)(321h h h 表示同一晶面族,hkl K r ∴∥hK r设h hkl K p K rr 2′=,可解得)](),(),[(1)(321k h l h l k ph h h +++′=(1)因 (hkl )皆为整数,(321h h h )为互质整数,故p ′为整数.再设hkl h K p K rr =,则)](),(),[(1)(321231132h h h h h h h h h phkl −+−+−+=(2)理由同上,p 为整数.由两次所设知2,2=′′=p p K p p K hklhkl rr (1)式和(2)式并保证 (hkl )及(321h h h )都是互质整数,取⎩⎨⎧=′=21p p 或⎩⎨⎧=′=12p p 即为所求.12.补充题 ( 方8 )如X 射线沿简立方瑷胞的OZ 轴负方向入射,求证:当λa l k l =+222 和 2222cos k l k l +−=β时,一级衍射线在YZ 平面内,其中β是衍射光与OZ 轴的夹角.证明: ZβθθYX a (h,k,l )对简立方 d ah k l h k l =++222(1) 设X 射线由OZ 轴的负方向入射,根据布拉格反射条件 2d n h k l sin θλ= (2)2cos 12cossin )(2β+=β=θ∴π=θ+β见图Q (2)式中取n = 1,并将βθcos sin 、分别带入,得代入,得再将222222sin 2k l l a ll k d lk h +=λ+λ=θλ=222222l k a ll k k l la d lk h +=++= 将此式与(1)式比较,可得h =0.(h ,k ,l )是衍射晶面族的密勒指数,h =0表示该晶面族的法线与X 轴垂直,即在YZ 平面内;而入射线又与OZ 轴重合,所以衍射线在YZ 平面内.。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1、回答下列问题(1)金属铜晶胞为面心立方最密堆积,边长为a cm。
又知铜的密度为ρ g·cm-3,阿伏加德罗常数为_______。
(2)下图是CaF2晶体的晶胞示意图,回答下列问题:①Ca2+的配位数是______,F-的配位数是_______。
②该晶胞中含有的Ca2+数目是____,F-数目是_____,③CaF2晶体的密度为a g·cm-3,则晶胞的体积是_______(只要求列出算式)。
2、某些金属晶体(Cu、Ag、Au)的原子按面心立方的形式紧密堆积,即在晶体结构中可以划出一块正立方体的结构单元,金属原子处于正立方体的八个顶点和六个侧面上,试计算这类金属晶体中原子的空间利用率。
(2)(3)3、单晶硅的晶体结构与金刚石一种晶体结构相似,都属立方晶系晶胞,如图:(1)将键联的原子看成是紧靠着的球体,试计算晶体硅的空间利用率(计算结果保留三位有效数字,下同)。
(2)已知Si—Si键的键长为234 pm,试计算单晶硅的密度是多少g/cm3。
4、金晶体的最小重复单元(也称晶胞)是面心立方体,如图所示,即在立方体的8个顶点各有一个金原子,各个面的中心有一个金原子,每个金原子被相邻的晶胞所共有。
金原子的直径为d,用N A表示阿伏加德罗常数,M表示金的摩尔质量。
请回答下列问题:(1)金属晶体每个晶胞中含有________个金原子。
(2)欲计算一个晶胞的体积,除假定金原子是刚性小球外,还应假定_______________。
(3)一个晶胞的体积是____________。
(4)金晶体的密度是____________。
5、1986年,在瑞士苏黎世工作的两位科学家发现一种性能良好的金属氧化物超导体,使超导工作取得突破性进展,为此两位科学家获得了1987年的诺贝尔物理学奖,实验测定表明,其晶胞结构如图所示。
(4)(5)(6)(1)根据所示晶胞结构,推算晶体中Y、Cu、Ba和O的原子个数比,确定其化学式。
(2)根据(1)所推出的化合物的组成,计算其中Cu原子的平均化合价(该化合物中各元素的化合价为、、和)。
试计算化合物中两种价态的Cu原子个数比。
6、(1)NiO(氧化镍)晶体的结构与NaCl相同,Ni2+与最邻近O2-的核间距离为×10-8cm,计算NiO晶体的密度(已知NiO的摩尔质量为g·mol-1)。
(2)天然的和绝大部分人工制备的晶体都存在各种缺陷,例如在某种NiO晶体中就存在如下图所示的缺陷:一个Ni2+空缺,另有两个Ni2+被两个Ni3+所取代。
结果晶体仍呈电中性,但化合物中Ni和O的比值却发生了变化。
某氧化镍样品组成为,试计算该晶体中Ni3+与Ni2+的离子数之比。
7、下图是金属钨晶体中的一个晶胞的结构示意图,它是一种体心立方结构。
实验测得金属钨的密度为g·cm-3,钨的相对原子质量是。
假设金属钨原子为等径刚性球,试完成下列问题:(7)(8)(1)每一个晶胞中均摊到________个钨原子。
(2)计算晶胞的边长a。
(3)计算钨的原子半径r(提示:只有体对角线上的各个球才是彼此接触的)。
8、铁、钴、镍为第四周期第Ⅷ族元素,它们的性质非常相似,也称为铁系元素.(1)铁、钴、镍都是很好的配位化合物形成体.①[Co(H2O)6]2+在过量氨水中易转化为[Co(NH3)6]2+.写出Co2+的价层电子排布图.[Co (H2O)6]2+中Co2+的配位数为:NH3分子的中心原子杂化方式为.H2O分子的立体构型为.②铁、镍易与一氧化碳作用形成羰基配合物,如:Fe(CO)5,Ni(CO)4等.CO与N2属于等电子体,则CO分子中σ键和π键数目比为,写出与CO互为等电子体的一种阴离子的离子符号.(2)+2价和+3价是Fe、Co、Ni等元素常见化合价.NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和F22+的离子半径分别为69pm和78pm,则熔点NiO FeO(选填“<”“>”“=”);某种天然Nio晶体存在如图所示缺陷:一个Niz+空缺,另有两个Ni2+被两个Ni3+所取代.其结果晶体仍呈屯中性.某氧化镍样品组成为.该晶体中Ni3+与Ni2+的离子数之比为.9、CaO与NaCl的晶胞同为面心立方结构,已知CaO晶体密度为a g·cm-3,N A表示阿伏加德罗常数,则CaO晶胞体积为________cm3。
10、原子序数依次递增且都小于36的X、Y、Z、Q、W四种元素,其中X是原子半径最小的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Q原子基态时2p原子轨道上有2个未成对的电子,W元素的原子结构中3d能级有4个未成对电子。
回答下列问题:(1)Y2X2分子中Y原子轨道的杂化类型为,Y2X2分子中σ键和π键个数比为。
(2)化合物ZX3的沸点比化合物YX4的高,其主要原因是。
(3)元素Y的一种氧化物与元素Z的一种氧化物互为等电子体,元素Z的这种氧化物的分子式是。
(4)元素W能形成多种配合物,如:W(CO)5等。
①基态W3+的M层电子排布式为。
②W(CO)5常温下呈液态,熔点为—℃,沸点为103℃,易溶于非极性溶剂,据此可判断W(CO)x 晶体属于(填晶体类型),该晶体中W的化合价为。
(5)下列有关的说法正确的是。
A.分子晶体中,共价键键能越大,该分子晶体的熔沸点越高B.电负性顺序:X<Y<Z<QC.因为晶格能CaO比KCl高,所以KCl比CaO熔点低D.H2YO3的分子结构中含有一个非羟基氧,故其为中强酸(6)Q和Na形成的一种只含有离子键的离子化合物的晶胞结构如图,距一个阴离子周围最近的所有阳离子为顶点构成的几何体为。
已知该晶胞密度为ρ g/cm3,阿伏加德罗常数为N A,求晶胞边长a= cm。
(用含ρ、N A的计算式表示)11、由原子序数由小到大的A、B、C、D、E五种元素构成某配位化合物X,其原子个数比为14:4:5:1:1。
其中C、D元素同主族且原子序数D为C的二倍,E元素的外围电子排布为(n-l)d n+61Ns1,回答下列问题。
(1)该配位化合物X的化学式为。
(2)元素B、C、D的第一电离能的由小到大排列顺序为。
(用元素符号表示)(3)D元素原子的最外层电子轨道表示式为________ 。
(4)C元素可与A元素形成两种常见的化合物,其原子个数比分别为1:1和l:2,两种化合物可任意比互溶,解释其主要原因为。
(5)碳铂是一种含BA3分子的具有抗癌活性的金属配合物,碳铂的结构如下图:其中碳原子的杂化方式有____ 。
碳铂中含有的作用力有(填字母)。
A.共价键 B.配位键 C.金属键 D.键 E.键(6)A元素与E元素可形成一种红色离子化合物Y,其原子个数比为1:1,该化合物Y可与稀硝酸反应,生成一种蓝色溶液和两种无色气体(其中一种为A元素的单质),写出该反应的化学方程式。
单质E的晶胞如图所示,若设该晶胞的边长为acm,阿伏加德罗常数为N A,单质E的摩尔质量为Mg/mol,则表示该晶胞密度的计算式为p= g/cm3。
(11)(12)(13)12、晶体具有规则的几何外形,晶体中最基本的重复单元被称为晶胞。
NaCl晶体结构如图所示。
已知Fe x O晶体晶胞结构为NaCl型,由于晶体缺陷,x值小于1。
测知Fe x O晶体密度为 g/cm3,晶胞边长为×10-10 m。
(1)Fe x O中x值(精确至为____。
(2)晶体中的Fe以Fe2+和Fe3+的形式存在,在Fe2+和Fe3+的总数中,Fe2+的占有率(用小数表示,精确至为___。
(3)与某个Fe2+(或Fe3+)距离最近且等距离的O2-的个数为___。
(4)在晶体中,铁元素的离子间最短距离为______m。
13、金属钨晶体晶胞的结构模型如下图所示。
实验测得金属钨的密度为已知钨的相对原子质量为。
回答下列问题:(1)在钨晶体中每个晶胞占有的钨原子数为__________个。
(2)钨晶体晶胞的边长为__________。
(3)钨原子的半径为__________。
14、1986年,在瑞士苏黎世工作的两位科学家发现一种性能良好的金属氧化物超导体,使超导工作取得突破性进展,为此两位科学家获得了1987年的诺贝尔物理学奖,实验测定表明,其晶胞结构如图所示。
(14)(17)(1)根据所示晶胞结构,推算晶体中Y、Cu、Ba和O的原子个数比,确定其化学式。
(2)根据(1)所推出的化合物的组成,计算其中Cu原子的平均化合价(该化合物中各元素的化合价为、、和)。
试计算化合物中两种价态的Cu原子个数比。
15、用X射线研究某金属晶体,测得在边长为360 pm的立方晶胞中含有4个金属原子,此时金属的密度为 g/cm3。
试回答下列问题:(1)此金属晶胞属于哪一种类型(2)求每个晶胞的质量。
(3)求此金属的相对原子质量。
(4)求此金属原子的原子半径(pm)。
16、NaCl晶体中Na+与Cl-都是等距离交错排列,若食盐的密度是g·cm-3,阿伏加德罗常数为×1023mol-1,食盐的摩尔质量为g·mol-1。
则食盐晶体中两个距离最近的钠离子中心间的距离是多少17、(9分)(2018·全国卷Ⅲ)锌在工业中有重要作用,也是人体必需的微量元素。
回答下列问题:世纪金榜导学号(1)Zn原子核外电子排布式为______________________________。
(2)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。
第一电离能I1(Zn)_______I1(Cu)(填“大于”或“小于”)。
原因是_________________。
(3)ZnF2具有较高的熔点(872 ℃),其化学键类型是_______;ZnF2不溶于有机溶剂而ZnCl2、ZnBr2、ZnI2能够溶于乙醇、乙醚等有机溶剂,原因是_______。
(4)《中华本草》等中医典籍中,记载了炉甘石(ZnCO3)入药,可用于治疗皮肤炎症或表面创伤。
ZnCO3中,阴离子空间构型为_______,C原子的杂化形式为_______。
(5)金属Zn晶体中的原子堆积方式如图所示,这种堆积方式称为。
六棱柱底边边长为a cm,高为_______c cm,阿伏加德罗常数的值为N A,Zn的密度为_______g·cm-3(列出计算式)。
18、砷的一些化合物常用作半导体、除草剂、杀鼠药等。
回答下列问题:(1)基态As原子的核外电子排布式为[Ar]__________,有___________个未成对电子。
(2)Ga、N、As电负性由大至小的顺序是_____________。
(3)As4O6的分子结构如图所示,其中As原子的杂化方式为____________,1mol As4O6含有σ键的物质的量为________mol。
