晶胞计算习题答案
晶体结构的分析与计算题和答案
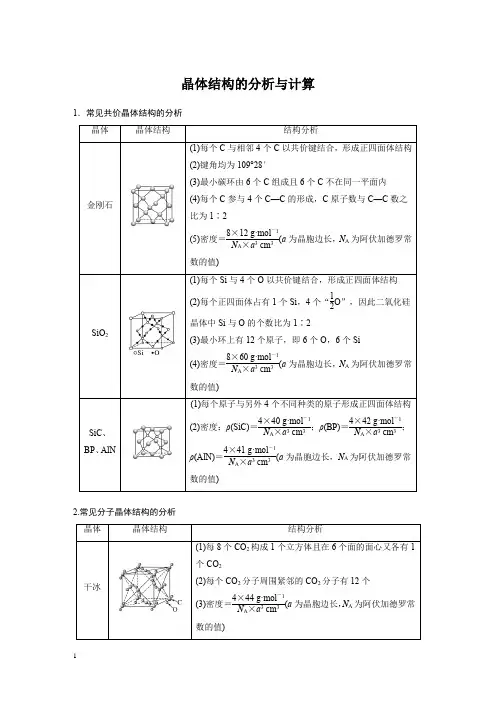
晶体结构的分析与计算1.常见共价晶体结构的分析2.常见分子晶体结构的分析3.常见离子晶体结构的分析684F-:8;Ca2+:41.AB型化合物形成的晶体结构多种多样。
下图所示的几种结构所表示的物质最有可能是分子晶体的是()A.①③B.②⑤C.⑤⑥D.③④⑤⑥2.如图为几种晶体或晶胞的示意图:请回答下列问题:(1)上述晶体中,微粒之间以共价键结合形成的晶体是________。
(2)冰、金刚石、MgO、CaCl2、干冰5种晶体的熔点由高到低的顺序为______________________。
(3)NaCl晶胞与MgO晶胞相同,NaCl晶体的离子键________(填“大于”或“小于”)MgO 晶体的离子键,原因是___________________________________________________________。
(4)CaCl2晶体中Ca2+的配位数________。
(5)冰的熔点远高于干冰,除H2O是极性分子、CO2是非极性分子外,还有一个重要的原因是_______________________________________________________________________________。
3.[2017·全国卷Ⅲ,35(5)]MgO具有NaCl型结构(如图),其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得MgO的晶胞参数为a=0.420 nm,则r(O2-)为________nm。
MnO 也属于NaCl型结构,晶胞参数为a′=0.448 nm,则r(Mn2+)为________nm。
4.Li2O具有反萤石结构,晶胞如图所示。
已知晶胞参数为0.466 5 nm,阿伏加德罗常数的值为N A,则Li2O的密度为________________________________________g·cm-3(列出计算式)。
5.[2018·全国卷Ⅱ,35(5)]FeS2晶体的晶胞如图所示。
2022年高中化学晶胞的相关计算专项训练100含答案

2022年高中化学晶胞的相关计算专项训练100含答案一、晶胞的相关计算1.元素X位于第4周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2;元素Y基态原子的3p轨道上有1对成对电子。
X与Y形成的化合物的晶胞结构如图所示,下列关于该晶体的说法正确的是()A.该晶体属于原子晶体B.X2+的配位数为8,Y2-的配位数为4C.与每个Y2-距离最近且相等的Y2-共有12个D.该晶体的熔点比氧化锌高2.工业上合成氨,CO易与铁触媒作用导致铁触媒失去催化活性:Fe+5CO═Fe(CO)5.为了防止催化剂铁触媒中毒,要除去CO,发生的反应为Cu(NH3)2OOCCH3+CO+NH3═Cu (NH3)3(CO)OOCCH3.回答下列问题:(1)下列氮原子的电子排布图表示的状态中,能量最低的是______(填字母序号)。
a. b.c. d.(2)写出CO的一种常见等电子体分子的结构式:______;C、N、O的第一电离能由大到小的顺序为______(用元素符号表示)。
(3)与O同族的元素还有S、Se、Te,它们氢化物的沸点大小为H2O>H2Te>H2Se>H2S,其原因是______。
(4)配合物[Cu(NH3)2]OOCCH3中,铜显+1价,则其中碳原子的杂化轨道类型是______,NH3分子的价电子对互斥理论模型是______。
(5)已知铜的一种氧化物Cu2O晶体的晶胞结构如图所示:①若坐标参数A为(0,0,0),B为(111,,444),则C的坐标参数为______;②若阿伏加德罗常数为N A,该晶胞的边长为a pm,则晶体的密度为______g•cm-3。
3.铜是人类最早使用的金属之一,其单质及化合物具有广泛的用途。
(1)基态铜原子核外有________对自旋相反的电子。
(2)青铜是铜与锡或铅等元素按一定比例熔铸而成的合金。
第一电离能I1(Sn)____________I1(Pb)(填“大于”或“小于”)。
【原创】物质结构与性质之晶胞计算1

物质结构与性质之晶胞计算21.(2019·高考全国卷Ⅰ,35)在普通铝中加入少量Cu 和Mg 后,形成一种称为拉维斯相的MgCu 2微小晶粒,其分散在Al 中可使得铝材的硬度增加、延展性减小,形成所谓“坚铝”,是制造飞机的主要材料。
回答下列问题:(1)下列状态的镁中,电离最外层一个电子所需能量最大的是________(填标号)。
(3)一些氧化物的熔点如表所示:氧化物 Li 2O MgO P 4O 6 SO 2 熔点/℃1 5702 80023.8-75.5________________________________________________________________________。
(4)图(a)是MgCu 2的拉维斯结构,Mg 以金刚石方式堆积,八面体空隙和半数的四面体空隙中,填入以四面体方式排列的Cu 。
图(b)是沿立方格子对角面取得的截图。
可见,Cu 原子之间最短距离x =__________ pm ,Mg 原子之间 最短距离y =________ pm 。
❻设阿伏加德罗常数的值为N A ,则MgCu 2的密度是❼________ g·cm -3(列出计算表达式)。
2.(2019·高考全国卷Ⅱ,35)近年来我国科学家发现了一系列意义重大的铁系超导材料,其中一类为Fe SmAsFO 组成的化合物。
回答下列问题:(2)Fe 成为阳离子时首先失去________轨道电子,Sm 的价层电子排布式为4f 66s 2,Sm 3+价层电子排布式为________。
(3)比较离子半径:F -________O 2-(填“大于”“等于”或“小于”)。
(4)一种四方结构的超导化合物的晶胞如图1所示。
晶胞中Sm 和As 原子的投影位置如图2所示。
图中F -和O 2-共同占据晶胞的上下底面位置,若两者的比例依次用x 和1-x 代表,则该化合物的化学式表示为__________________;通过测定密度ρ和晶胞参数,可以计算该物质的x 值,完成它们关系表达式:ρ=________ g·cm-3。
《结晶学基础》第十章习题答案9501第一步:计算出金刚石的晶胞参数a...

《结晶学基础》第十章习题答案9501第一步: 计算出金刚石的晶胞参数a 。
d =3A/a N ZM a = (30231051.3)1002.6/()00.128(-⨯⨯⨯)1/3pm = 356.8 pm 第二步: 根据C 原子的坐标参数, 计算键长。
其中,相邻两个C 原子的坐标: (0,0,0); (1/4,1/4,1/4);它们之间的距离即键长是晶 胞对角线长的1/4,晶胞对角线长为3ad c —c = 43a = 48.3563⨯pm = 154 pm9502(B)950334.01%9504(1)硅晶体晶胞中有8个Si 原子, d =23310023.606.288⨯⨯⨯a , a = 543pm (2) r Si —Si =(1/4)3a = 235 pm 9505 a = 31178⨯pm = 540 pm9506 (1)60sin 21642A c a N )(+=866.01037.752.41002.618424223⨯⨯⨯⨯⨯⨯-g ·cm -3=0.917 g ·cm -3(2) O —H …O 氢键存在于各邻近的O …O 之间, 氢键键长为0.375×737 pm=276 pm 。
9506 (1)60sin 21642A c a N )(+=866.01037.752.41002.618424223⨯⨯⨯⨯⨯⨯-g ·cm -3=0.917 g ·cm -3(2) O —H …O 氢键存在于各邻近的O …O 之间, 氢键键长为0.375×737 pm=276 pm 。
9508含有2个B------B 三中心二电子桥键。
9509参看周公度编著,《结构化学基础》,北京大学出版社,1989, p.444 。
4个B------B 三中心二电子硼氢桥键 1个 五中心六电子硼键。
9510(1) 参看周公度编著, 《结构化学基础》,北京大学出版社,1989, p.444 。
晶胞的计算

晶胞的计算一、晶胞在高考中的地位分析:2008、2009年新课标,未对晶胞的计算进行考查;2010年新课标:37(4),一空,化学式的计算;2011年新课标:37(5),三空,晶胞中原子个数及密度的计算;2012年新课标:37(6),两空,晶胞密度、离子距离的计算。
二、常见的晶胞计算题:第一类:金属堆积方式的简单计算(空间利用率和密度)[选三P76] 晶胞密度 =m(晶胞)/V(晶胞)空间利用率=[V(球总体积)/V(晶胞体积)]×100%【注】1m=10dm=102 cm=103 mm=106 um=109 nm=1012 pm①简单立方堆积:假设球的半径为r cm,则该堆积方式的空间利用率为:②体心立方堆积:假设球的半径为r cm,则该堆积方式的空间利用率为:③面心立方最密堆积:假设球的半径为r cm,则该堆积方式的空间利用率为:再假设该金属的摩尔质量为Mg/mol,N A为阿伏伽德罗常数的数值,试计算该晶胞的密度:【总结】必须掌握的常见晶胞及晶体结构分子晶体:干冰、冰晶胞图形、晶胞组成特点;原子晶体:金刚石(晶体硅)、二氧化硅晶胞组成特点、边长(体积、密度、原子最近距离)的计算方式;金属晶体:四种堆积方式的名称、图形、代表金属、边长(体积、密度、原子最近距离)的计算方式;离子晶体:NaCl、CsCl、CaF2晶胞图形、晶胞组成、边长(体积、密度、原子最近距离)的计算方式。
【练习】中学化学教材中展示了NaCl晶体结构,它向三维空间延伸得到完美晶体。
NiO(氧化镍)晶体的结构与NaCl 相同,Ni2+与最临近O2-的核间距离为 a cm,计算NiO晶体的密度(已知NiO的摩尔质量为74.7 g/mol)。
(2)天然和绝大部分人工制备的晶体都存在各种缺陷,例如在某氧化镍晶体中就存在如图所示的缺陷:一个Ni2+空缺,另有两个Ni2+被两个Ni3+所取代。
其结果为晶体仍呈电中性,但化合物中Ni 和O的比值却发生了变化。
突破16 晶胞计算(微粒间距、原子半径、坐标、其他)(解析版)
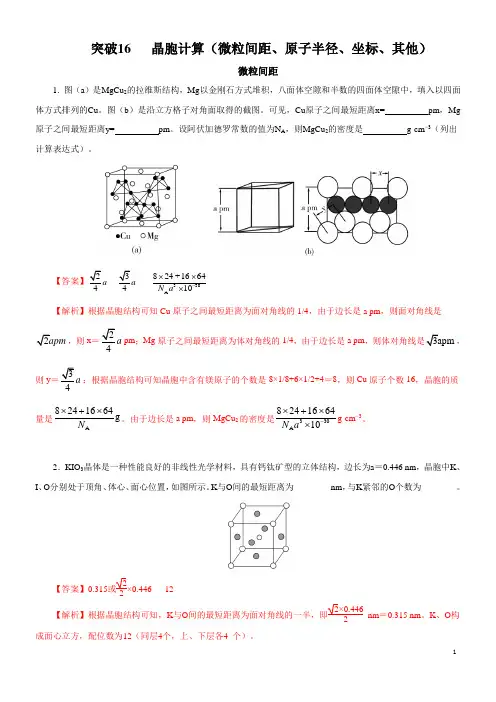
突破16 晶胞计算(微粒间距、原子半径、坐标、其他)微粒间距1. 图(a )是MgCu 2的拉维斯结构,Mg 以金刚石方式堆积,八面体空隙和半数的四面体空隙中,填入以四面体方式排列的Cu 。
图(b )是沿立方格子对角面取得的截图。
可见,Cu 原子之间最短距离x= pm ,Mg 原子之间最短距离y= pm 。
设阿伏加德罗常数的值为N A ,则MgCu 2的密度是 g·cm −3(列出计算表达式)。
【答案】24a 3a330A 824+166410N a -⨯⨯⨯ 【解析】根据晶胞结构可知Cu 原子之间最短距离为面对角线的1/4,由于边长是a pm ,则面对角线是2apm ,则x =24a pm ;Mg 原子之间最短距离为体对角线的1/4,由于边长是a pm ,则体对角线是3apm ,则y =3a ;根据晶胞结构可知晶胞中含有镁原子的个数是8×1/8+6×1/2+4=8,则Cu 原子个数16,晶胞的质量是A8241664g ⨯+⨯N 。
由于边长是a pm ,则MgCu 2的密度是330A 824166410-⨯+⨯⨯N a g·cm −3。
2.KIO 3晶体是一种性能良好的非线性光学材料,具有钙钛矿型的立体结构,边长为a =0.446 nm ,晶胞中K 、I 、O 分别处于顶角、体心、面心位置,如图所示。
K 与O 间的最短距离为________ nm ,与K 紧邻的O 个数为________。
【答案】0.315或22×0.446 12 【解析】根据晶胞结构可知,K 与O 间的最短距离为面对角线的一半,即2×0.4462nm =0.315 nm 。
K 、O 构成面心立方,配位数为12(同层4个,上、下层各4 个)。
3.某镍白铜合金的立方晶胞结构如图所示。
①晶胞中铜原子与镍原子的数量比为________。
②若合金的密度为d g·cm –3,晶胞参数a =________nm 。
晶胞的计算
晶胞的计算一、晶胞在高考中的地位分析:2008、2009年新课标,未对晶胞的计算进行考查;2010年新课标:37(4),一空,化学式的计算;2011年新课标:37(5),三空,晶胞中原子个数及密度的计算;2012年新课标:37(6),两空,晶胞密度、离子距离的计算。
二、常见的晶胞计算题:第一类:金属堆积方式的简单计算(空间利用率和密度)[选三P76]晶胞密度 =m(晶胞)/V(晶胞)空间利用率=[V(球总体积)/V(晶胞体积)]×100%【注】1m=10dm=102 cm=103 mm=106 um=109 nm=1012 pm①简单立方堆积:假设球的半径为r cm,则该堆积方式的空间利用率为:②体心立方堆积:假设球的半径为r cm,则该堆积方式的空间利用率为:③面心立方最密堆积:假设球的半径为r cm,则该堆积方式的空间利用率为:再假设该金属的摩尔质量为Mg/mol,N A为阿伏伽德罗常数的数值,试计算该晶胞的密度:【总结】必须掌握的常见晶胞及晶体结构分子晶体:干冰、冰晶胞图形、晶胞组成特点;原子晶体:金刚石(晶体硅)、二氧化硅晶胞组成特点、边长(体积、密度、原子最近距离)的计算方式;金属晶体:四种堆积方式的名称、图形、代表金属、边长(体积、密度、原子最近距离)的计算方式;离子晶体:NaCl、CsCl、CaF2晶胞图形、晶胞组成、边长(体积、密度、原子最近距离)的计算方式。
【练习】中学化学教材中展示了NaCl晶体结构,它向三维空间延伸得到完美晶体。
NiO(氧化镍)晶体的结构与NaCl 相同,Ni2+与最临近O2-的核间距离为a cm,计算NiO晶体的密度(已知NiO的摩尔质量为74.7 g/mol)。
(2)天然和绝大部分人工制备的晶体都存在各种缺陷,例如在某氧化镍晶体中就存在如图所示的缺陷:一个Ni2+空缺,另有两个Ni2+被两个Ni3+所取代。
其结果为晶体仍呈电中性,但化合物中Ni 和O的比值却发生了变化。
高考化学晶胞的相关计算专项训练与热点解答题组合练附解析
高考化学晶胞的相关计算专项训练与热点解答题组合练附解析一、晶胞的相关计算1.2Mg Si具有反萤石结构,晶胞结构如图所示,其晶胞参数为0.635nm。
下列叙述错误的是()A.Si的配位数为8B.紧邻的两个Mg原子的距离为0.635 2nmC.紧邻的两个Si原子间的距离为20.6352⨯nmD.2Mg Si的密度计算式为()337A76g cm0.63510N--⋅⨯2.Fe、HCN与K2CO3在一定条件下发生如下反应:Fe+6HCN+2K2CO3=K4Fe(CN)6+H2↑+2CO2↑+2H2O,回答下列问题:(1)此化学方程式中涉及的第二周期元素的电负性由小到大的顺序为________。
(2)配合物K4Fe(CN)6的中心离子的价电子排布图为______,该中心离子的配位数是_______。
(3)1mol HCN分子中含有σ键的数目为_______,HCN分子中碳原子轨道杂化类型是_______,与CN-互为等电子体的阴离子是_______。
(4)K2CO3中阴离子的空间构型为_________,其中碳原子的价层电子对数为____________。
(5)冰的晶体结构模型如图,它的晶胞与金刚石相似,水分子之间以氢键相连接,在一个晶胞中有________个氢键,若氢键键长为d nm,则晶体密度(g·cm-3)计算式为_______ (用N A表示阿伏加德罗常数的值)。
3.据《科技日报》报道,我国科学家研制成功一系列石墨烯限域的3d过渡金属中心(Mn、Fe、Co、Ni、Cu)催化剂,在室温条件下以H2O2为氧化剂直接将CH4氧化成C的含氧化合物。
请回答下列问题:(1)在Mn、Fe、Co、Ni、Cu中,某基态原子核外电子排布遵循“洪特规则特例”(指能量相同的原子轨道在全满、半满、全空状态时,体系的能量最低),该原子的外围电子排布式为_____。
(2)在3d过渡金属中,基态原子未成对电子数最多的元素是_____(填元素符号)。
晶胞计算 精编练习含答案
晶胞计算一.选择题(每题2分共60分)1.如图为冰晶体的结构模型,大球代表O原子,小球代表H原子.下列有关说法正确的是()A.冰晶体中每个水分子与另外四个水分子形成四面体B.冰晶体具有空间网状结构,是原子晶体C.水分子间通过H﹣O键形成冰晶体D.冰晶体熔化时,水分子之间的空隙增大2.有关晶体的结构如图所示,下列说法中不正确的是A.在NaCl晶体(图甲)中,距Na+最近的C1-围成正八面体B.该气态团簇分子(图乙)的分子式为EF或FEC.在CO2晶体(图丙)中,一个CO2分子周围有12个CO2分子紧邻D.在碘晶体(图丁)中,存在的作用力有非极性共价键和范德华力3.金属晶体和离子晶体是重要晶体类型。
下列关于它们的说法中,正确的是()A.金属晶体和离子晶体都能导电B.在镁晶体中,1个Mg2+只与2个价电子存在强烈的相互作用C.金属晶体和离子晶体都可采取“紧密堆积”方式,原子晶体都可采取“非紧密堆积”方式D.金属晶体和离子晶体中分别存在金属键和离子键等相互作用,很难断裂,因而都具有延展性4.下列说法正确的是()A.元素的非金属性越强,其单质的活泼性一定越强B.分子中含两个氢原子的酸一定是二元酸C.含有金属阳离子的晶体一定是离子晶体D.分子晶体中一定存在分子间作用力,不一定存在共价键5.下列说法正确的是①若某原子处于能量最低状态时,外围电子排布为4d15s2,则该元素原子最外层有3个电子②d轨道不可以参与化学键的形成③所有元素的共同特点是原子的价电子都排布在最外电子层上④第一电离能是元素的原子失去核外第一个电子需要的能量⑤同周期非金属元素的氧化物对应水化物的酸性从左到右依次增强⑥HF、HCl、HBr、HI的稳定性依次增强⑦因为水中有氢键,所以水分子高温下很稳定⑧电子排布式1s22s22p63s23p10违反了泡利原理A. 只有⑧B. ⑥⑦⑧C. ①③⑤⑥D.都正确6..二氧化硅晶体是立体的网状结构,其结构如图6所示,错误的是()A.晶体中Si、O原子个数比为1:2 B.晶体中Si、O原子最外层都满足8电子结构C.晶体中一个硅原子含有Si﹣O键数目为4 D.晶体中最小环上的原子数为67.已知C3N4晶体很可能具有比金刚石更大的硬度,且原子间以单键结合.下列正确的是()A.C3N4晶体是分子晶体B.C3N4晶体中C﹣N键的键长比金刚石中的C﹣C键的键长短C.C3N4晶体中C、N原子个数之比为4:3D.C3N4晶体中微粒间通过离子键结合8.某研究性学习小组对手性分子提出了以下四个观点:①互为手性异构体的分子互为镜像②利用手性催化剂合成可得到一种或主要得到一种手性分子③手性异构体分子组成相同④手性异构体性质相同你认为正确的是()A.①②③B.①②④C.②③④D.全部9.Al2O3在一定条件下可转化为硬度、熔点都很高的氮化铝晶体,氮化铝的晶胞结构如图所示。
晶体学习题与答案
一、 名词解释(1)阵点;(2)(空间)点阵;(3)晶体结构;(4)晶胞;(5)晶带轴;二、填空(1)晶体中共有 种空间点阵,属于立方晶系的空间点阵有 三种。
(2)对于立方晶系,晶面间距的计算公式为 。
(3){110}晶面族包括 等晶面。
(4){h 1k 1l 1}和{h 2k 2l 2}两晶面的晶带轴指数[u v w]为 。
(5)(110)和(11-0)晶面的交线是 ;包括有[112]和[123]晶向的晶面是 。
三、计算及简答(1)原子间的结合键共有几种?各自有何特点?(2)在立方晶系的晶胞中,画出(111)、(112)、(011)、(123)晶面和[111]、[101]、[111-]晶向.(3)列出六方晶系{101-2} 晶面族中所有晶面的密勒指数,并绘出(101-0)、(112-0)晶面和〔112-0〕晶向。
(4)试证明立方晶系的〔111〕晶向垂直于(111)晶面。
(5)绘图指出面心立方和体心立方晶体的(100)、(110)、及(111)晶面,并求其面间距;试分别指出两种晶体中,哪一种晶面的面间距最大?(6)在立方晶系中,(1-10)、(3-11)、(1-3-2)晶面是否属于同一晶带?如果是,请指出其晶带轴;并指出属于该晶带的任一其他晶面.(7)写出立方晶系的{111}、{123}晶面族和〈112>晶向族中的全部等价晶面和晶向的具体指数。
(8)计算立方晶系中(111)和〔111-〕两晶面间的夹角。
(9)若采用四轴坐标系标定六方晶体的晶向指数,应该有什么约束条件?为什么?答 案二、填空(1)14 简单、体心、面心(2)222hkl d h k l =++(3) (110)、(101)、(011)、(1-10)、(1-01) 、(01-1)(4)1122k l u k l =;1122l h v l h =;1122h k w h k = (5)〔001〕 (111-)三、简答及计算(1)略(2)(3){101-2}晶面的密勒指数为(101-2)、(1-012)、(01-12)、(011-2)、(1-102)、(11-02)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
创作编号:GB8878185555334563BT9125XW创作者:凤呜大王*1、【答案】(1)mol-1(2)①8 4 ②48③【解析】(1)铜晶胞为面心立方最密堆积,1个晶胞能分摊到4个Cu原子;1个晶胞的体积为a3cm3;一个晶胞的质量为a3ρ g;由=a3ρ g,得N A=mol -1。
(2) ①每个Ca2+周围吸引8个F-,每个F-周围吸收4个Ca2+,所以Ca2+的配位数为8,F-的配位数为4。
②F-位于晶胞内部,所以每个晶胞中含有F-8个。
含有Ca2+为×8+×6=4个。
③ρ===a g·cm-3,V=。
2、【解析】试题分析:本考查学生对知识综合利用能力,要求对晶胞知识能够融会贯通。
依题意画出侧面图,设正立方体边长为a,则体积为a3。
,AC=4r,故原子半径,根据均摊法得,每个正立方体包括金属原子8×1/8+6×1/2=4(个),球体体积共4×空间利用率为:.考点:均摊法计算点评:本题考查相对综合,是学生能力提升的较好选择。
3、(1)34.0% (2)2.36 g/cm3【解析】(1)该晶胞中Si原子个数=4+8×1/8+6×1/2=8,设Si原子半径为xcm,该晶胞中硅原子总体积=,根据硬球接触模型可知,体对角线四分之一处的原子与顶点上的原子紧贴,设晶胞边长为a,所以,解得a=,晶胞体积=()3,因此空间利用率=×100%=34.0%。
(2)根据以上分析可知边长=,所以密度==2.36g/cm3。
4、【答案】(1)4(2)金属原子间相接触,即相切(3)2d3(4)【解析】利用均摊法解题,8个顶点上每个金原子有属于该晶胞,6个面上每个金原子有属于该晶胞,故每个晶胞中金原子个数=8×+6×=4。
假设金原子间相接触,则有正方形的对角线为2d。
正方形边长为d。
所以V晶=(d)3=2d3,V m=N A=d3N A,所以ρ==。
5、【答案】(1)YBa2Cu3O7(2)价n(Cu2+)∶n(Cu3+)=2∶1【解析】(1)由题图所示晶胞可知:一个晶胞中有1个Y3+,2个Ba2+。
晶胞最上方、最下方分别有4个Cu x+,它们分别被8个晶胞所共用;晶胞中间立方体的8个顶点各有一个Cu x+,它们分别被4个晶胞共用,因此该晶胞中的Cu x+为n(Cu x+)=(个)。
晶胞最上方、最下方平面的棱边上共有4个氧离子,分别被4个晶胞共用;又在晶胞上的立方体的竖直棱边上和晶胞下方的立方体的竖直棱边上各有4个氧离子,它们分别被4个晶胞共用;中间立方体的水平棱边上共有8个氧离子,它们分别被2个晶胞共用,因此该晶胞中的氧离子个数为n(O2-)=(个)。
所以晶体中Y、Ba、Cu、O原子个数比为1∶2∶3∶7,化学式为YBa2Cu3O7。
(2)设Cu的平均化合价为x,由化合物中元素正负化合价代数为零可得:1×(+3)+2×(+2)+3×x+7×(-2)=0,x=+(价)。
Cu2+与Cu3+原子个数之比为2∶1。
6、【答案】(1)g·cm-3或g·cm-3(2)6∶91【解析】(1)因为NiO的晶体结构与NaCl的晶体结构相同,均为正方体。
从晶体结构模型中分割出一个小立方体,其中小立方体的边长为Ni2+与最邻近O2-的核间距离即×10-8cm,在这个小立方体中含Ni2+:,含O2-:,所以,(×10-8)3×N a cm3是0.5 mol NiO具有的体积,则(×10-8)-3N a cm3×ρ=0.5 mol×74.7 g·mol-1,g·cm-3=g·cm-3。
解题的关键是确定晶胞的组成后,通过晶体组成计算出存在的微粒数。
(2)设1 mol Ni0.97O中,含有Ni3+Xmol,Ni2+为(0.97-)mol,根据晶体显电中性,即3mol+2(0.97-)mol=2×1 mol,解得=0.06,Ni2+为(0.97-)mol=0.91 mol,则离子数之比为Ni3+∶Ni2+=0.06∶0.91=6∶91。
7、【答案】(1)2 (2)3.16×10-8cm (3)1.37×10-8cm【解析】(1)正确应用均摊法确定一个晶胞中包含的各粒子的数目。
(2)应用基本关系式:,先求出晶胞的体积,然后根据V=a3计算晶胞的边长。
8、 6;sp3;V形;②1:2;CN﹣;(2)>;6:91;9、【答案】【解析】依据NaCl晶胞的结构可知,每个CaO晶胞中“实际”拥有4个CaO微粒,则 1 mol CaO微粒可形成个晶胞,设每个晶胞的体积为V cm3,则×V×a=56,解得V=cm3。
10、(1)sp杂化(1分);3:2 (2分);(2)NH3分子间存在氢键(1分);(3)N2O(2分);(4)3s23p63d5(2分);分子晶体(1分) 0(1分);(5)BC(2分);(6)立方体(1分);;(2分)试题分析:原子序数依次递增且都小于36的X、Y、Z、Q、W四种元素,其中X是原子半径最小的元素,则X是H元素;Y原子基态时最外层电子数是其内层电子数的2倍,则Y是C元素;Q原子基态时2p原子轨道上有2个未成对的电子,则Q是O元素,则Z是N元素;W元素的原子结构中3d能级有4个未成对电子。
W是Cr元素或Fe元素,由于W可以形成+3价的离子,因此W只能是Fe元素。
(1)Y2X2分子是乙炔C2H2,结构式是分子中Y原子轨道的杂化类型为sp杂化,Y2X2分子中σ键和π键个数比为3:2。
(2)化合物ZX3是NH3,在氨分子之间除了存在分子间作用力外还存在氢键,增加了分子之间的吸引力,使其的沸点比只有分子间作用力的化合物CH4的高.(3)等电子体是原子数相同,原子最外层电子数也相同的微粒。
元素Y的一种氧化物与元素Z的一种氧化物互为等电子体,它们是CO2与N2O,则元素Z的这种氧化物的分子式是N2O。
(4)①基态W3+的M层电子排布式为3s23p63d5。
②W(CO)5常温下呈液态,熔点为—20.5℃,沸点为103℃,易溶于非极性溶剂,由于其熔沸点较低,易溶于非极性溶剂,所以据此可判断W(CO)x晶体属于分子晶体,在任何化合物水所有元素正负化合价的代数和为0,因此该晶体中W的化合价为0。
(5)A.分子晶体中,共价键键能越大,含有该共价键的物质的分子稳定性越强,而分子晶体的熔沸点与化学键的强弱无关,只与分子之间的作用力作用,因此不能判断物质的熔沸点的高低,错误;B.元素的非金属性越强,其电负性就越大。
元素的非金属性H<C<N<O,所以电负性顺序:X<Y<Z<Q,正确;C.因为晶格能CaO比KCl高,断裂消耗的能量就越大,所以KCl比CaO熔点低,正确;D.H2YO3为弱酸,错误;(6)Q和Na形成的一种只含有离子键的离子化合物的晶胞结构如图,根据图示可知距一个阴离子周围最近的所有阳离子为顶点构成的几何体为立方体。
在一个晶胞中含Na+个数是8×1=8;含有O2-个数是:8×1/8+6×1/2=4;所以一个晶胞中含有4个Na2O,已知该晶胞密度为ρ g/cm3,阿伏加德罗常数为N A,假设晶胞的边长是acm,则根据晶胞的密度计算定义式可得:,整理可得。
11、(1)(1)Cu(NH3)4SO4×H2O (2分)(2)S<O<N (1分)(3)(1分)(4)H2O与H2O2之间形成氢键(2分)(5)sp3和sp2(2分)ABDE(2分)(6)6CuH+16HNO3=6Cu(NO3)2+3H2↑+4NO↑+8H2O(3分);(2分)试题分析:(1)由题意可推知A为H元素,B为N元素,C为O元素,D为S元素,E 元素的外围电子排布为(n-l)d n+6ns1,E为Cu元素,该配位化合物X的化学式为Cu (NH3)4SO4×H2O(2)N、O、S三种元素中,N的2p轨道是半充满状态,所以第一电离能最大,O、S 同主族,同主族元素的第一电离能从上到下逐渐减小,所以N、O、S三种元素的第一电离能从小到大的排列顺序是S<O<N(3)D为S元素,最外层电子是6个电子,电子排布式是3s23p6,轨道表示式为(4)H、O元素可形成化合物H2O与H2O2,二者之间能互溶是因为H2O与H2O2之间形成氢键(5)C原子周围形成4个共价单键为sp3杂化,形成2个共价单键和1个双键是sp2杂化;碳铂中单键为键,双键中有1个为键,且Pt与N原子间形成配位键,所以碳铂中含有的作用力有共价键、配位键、键、键,答案选ABDE;(6)A元素与E元素可形成一种红色离子化合物Y,其原子个数比为1:1,则Y为CuH,与稀硝酸反应得蓝色溶液为硝酸铜溶液,两种气体为氢气、一氧化氮,所以该反应的化学方程式为6CuH+16HNO3=6Cu(NO3)2+3H2↑+4NO↑+8H2O;该晶胞中实际含4个Cu,其质量为4×M/N A,晶胞体积为a3cm3,所以该晶胞密度的计算式为ρ=4×M/N A/ a3=g/cm3考点:考查元素推断、电离能的判断、轨道表示式的写法、化学键的判断、氢键的应用、化学方程式的书写、晶胞计算等知识12、0.92 0.826 6 3.03×10-10根据NaCl晶体结构,1个NaCl晶胞是由8个小立方体〔如下图(1)〕构成的。
每个小立方体含1/2个NaCl,同理在FexO晶体中,每个小立方体含1/2个FexO,完整晶体中〔如下图(2)〕,Fe、O交替出现。
(1)每个小立方体的质量为:m=ρV=5.71 g·cm-3×()3=5.60×10-23 g。
M(Fe x O)=2m·N A=2×5.60×10-23 g×6.02×1023mol-1=67.4 g·mol-1。
56.0 g·mol-1×x+16.0 g·mol-1×1=67.4 g·mol-1x=0.92;(2)设1 mol Fe0.92O中,n(Fe2+)=y mol,则:n(Fe3+)=(0.92-y)mol。
根据化合物中各元素正负化合价代数和为零的原则:2×y mol+3×(0.92-y mol)+(-2)×1 mol=0,y=0.76。
故Fe2+所占有率为=0.826;(3)Fe在晶体中所占空隙的几何形状为正八面体。
