晶体结构的计算历年高考题汇总
新教材适用2024版高考化学二轮总复习:晶体结构分析和有关计算教师用书

突破点3晶体结构分析和有关计算命题角度1原子间距离、原子坐标与配位数判断1.(化学式确定)(1)(2023·浙江1月选考)Si 与P 形成的某化合物晶体的晶胞如图。
该晶体类型是_共价晶体__,该化合物的化学式为_SiP 2__。
(2)(2022·天津选考)钠的某氧化物晶胞如图,图中所示钠离子全部位于晶胞内。
由晶胞图判断该氧化物的化学式为_Na 2O__。
【解析】(1)Si 与P 形成的某化合物晶体的晶胞如图可知,原子间通过共价键形成的空间网状结构,形成共价晶体;根据均摊法可知,一个晶胞中含有8×18+6×12=4个Si,8个P,故该化合物的化学式为SiP 2。
(2)钠的某氧化物晶胞如图,图中所示钠离子全部位于晶胞内,则晶胞中有8个钠,氧有8×18+6×12=4个,钠氧个数比为2∶1,则该氧化物的化学式为Na 2O。
2.(配位数)(2022·重庆选考)X 晶体具有面心立方结构,其晶胞由8个结构相似的组成单元(如图)构成。
(1)晶胞中与同一配体相连的两个[Zn 4O]6+的不同之处在于_与Zn 2+相连的双键氧原子不在对称轴的同侧__。
(2)X 晶体中Zn 2+的配位数为_4__。
【解析】(1)由X 晶胞的组成单元的对角面可知,晶胞中与同一配体相连的两个[Zn 4O]6+的不同之处在于与Zn 2+相连的双键氧原子不在对称轴的同侧。
(2)1个[Zn 4O]6+上、下、左、右、前、后共有6个L 2-,每个L 2-与[Zn 4O]6+形成2个Zn←O 配位键,1个[Zn 4O]6+含有4个Zn←O 配位键,1个[Zn 4O]6+中Zn 2+形成的配位键数目为6×2+4=16,1个Zn 2+的配位数为4。
3.(原子距离与坐标)(2021·山东选考)XeF 2晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,该晶胞中有_2__个XeF 2分子。
2024全国高考真题化学汇编:认识晶体
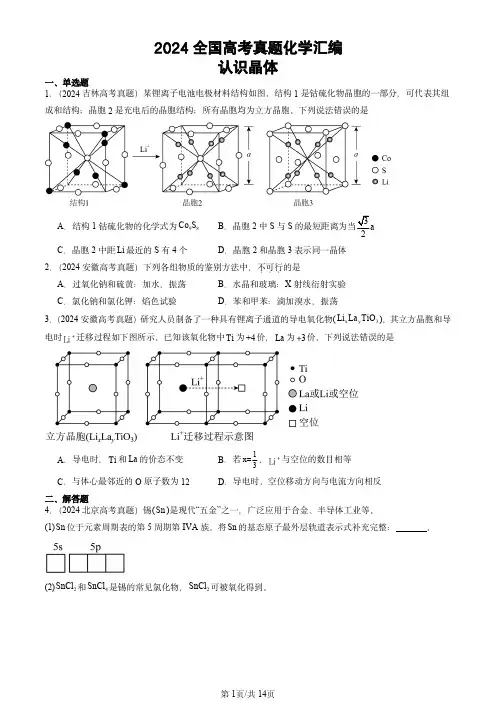
2024全国高考真题化学汇编认识晶体一、单选题1.(2024吉林高考真题)某锂离子电池电极材料结构如图。
结构1是钴硫化物晶胞的一部分,可代表其组成和结构;晶胞2是充电后的晶胞结构;所有晶胞均为立方晶胞。
下列说法错误的是A .结构1钴硫化物的化学式为98Co SB .晶胞2中S 与S 的最短距离为当3a 2C .晶胞2中距Li 最近的S 有4个D .晶胞2和晶胞3表示同一晶体2.(2024安徽高考真题)下列各组物质的鉴别方法中,不可行...的是A .过氧化钠和硫黄:加水,振荡B .水晶和玻璃:X 射线衍射实验C .氯化钠和氯化钾:焰色试验D .苯和甲苯:滴加溴水,振荡3.(2024安徽高考真题)研究人员制备了一种具有锂离子通道的导电氧化物(x y 3Li La TiO ),其立方晶胞和导电时+Li 迁移过程如下图所示。
已知该氧化物中Ti 为+4价,La 为3 价。
下列说法错误的是A .导电时,Ti 和La 的价态不变B .若1x=3,+Li 与空位的数目相等C .与体心最邻近的O 原子数为12D .导电时、空位移动方向与电流方向相反二、解答题4.(2024北京高考真题)锡(Sn )是现代“五金”之一,广泛应用于合金、半导体工业等。
(1)Sn 位于元素周期表的第5周期第IVA 族。
将Sn 的基态原子最外层轨道表示式补充完整:。
(2)2SnCl 和4SnCl 是锡的常见氯化物,2SnCl 可被氧化得到。
①2SnCl 分子的VSEPR 模型名称是。
②4SnCl 的Sn Cl —键是由锡的轨道与氯的3p 轨道重叠形成σ键。
(3)白锡和灰锡是单质Sn 的常见同素异形体。
二者晶胞如图:白锡具有体心四方结构;灰锡具有立方金刚石结构。
①灰锡中每个Sn 原子周围与它最近且距离相等的Sn 原子有个。
②若白锡和灰锡的晶胞体积分别为31v nm 和32v nm ,则白锡和灰锡晶体的密度之比是。
(4)单质Sn 的制备:将2SnO 与焦炭充分混合后,于惰性气氛中加热至800C ,由于固体之间反应慢,未明显发生反应。
晶体结构的分析与计算题和答案
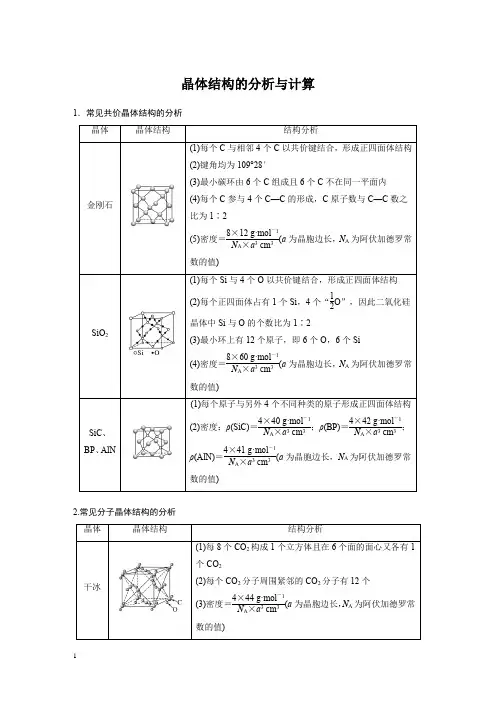
晶体结构的分析与计算1.常见共价晶体结构的分析2.常见分子晶体结构的分析3.常见离子晶体结构的分析684F-:8;Ca2+:41.AB型化合物形成的晶体结构多种多样。
下图所示的几种结构所表示的物质最有可能是分子晶体的是()A.①③B.②⑤C.⑤⑥D.③④⑤⑥2.如图为几种晶体或晶胞的示意图:请回答下列问题:(1)上述晶体中,微粒之间以共价键结合形成的晶体是________。
(2)冰、金刚石、MgO、CaCl2、干冰5种晶体的熔点由高到低的顺序为______________________。
(3)NaCl晶胞与MgO晶胞相同,NaCl晶体的离子键________(填“大于”或“小于”)MgO 晶体的离子键,原因是___________________________________________________________。
(4)CaCl2晶体中Ca2+的配位数________。
(5)冰的熔点远高于干冰,除H2O是极性分子、CO2是非极性分子外,还有一个重要的原因是_______________________________________________________________________________。
3.[2017·全国卷Ⅲ,35(5)]MgO具有NaCl型结构(如图),其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得MgO的晶胞参数为a=0.420 nm,则r(O2-)为________nm。
MnO 也属于NaCl型结构,晶胞参数为a′=0.448 nm,则r(Mn2+)为________nm。
4.Li2O具有反萤石结构,晶胞如图所示。
已知晶胞参数为0.466 5 nm,阿伏加德罗常数的值为N A,则Li2O的密度为________________________________________g·cm-3(列出计算式)。
5.[2018·全国卷Ⅱ,35(5)]FeS2晶体的晶胞如图所示。
2024-2025学年高考化学一轮复习专题卷: 晶体结构与性质(含解析)

2025届高考化学一轮复习专题卷: 晶体结构与性质一、单选题1.下列推论正确的( )A.的沸点高于,可推测的沸点高于B.为正四面体结构,可推测出也为正四面体结构C.晶体是分子晶体,可推测晶体也是分子晶体,D.是碳链为直线型的非极性分子,可推测也是碳链为直线型的非极性分子2.有四种不同堆积方式的金属晶体的晶胞如图所示,有关说法正确的是( )A.①为简单立方堆积②为六方最密堆积③为体心立方堆积④为面心立方最密堆积B.每个晶胞含有的原子数分别为:①1个,②2个,③2个,④4个C.晶胞中原子的配位数分别为:①6,②8,③8,④12D.空间利用率的大小关系为:①<②<③<④3.下列叙述错误的是( )A.金属键无方向性和饱和性,原子配位数较高B.晶体尽量采取紧密堆积方式,以使其变得比较稳定C.因共价键有饱和性和方向性,所以原子晶体不遵循“紧密堆积”原理D.金属铜和镁均以ABAB…方式堆积4.环六糊精(D-吡喃葡萄糖缩合物)具有空腔结构,腔内极性较小,腔外极性较大,可包合某些分子形成超分子。
图1、图2和图3分别表示环六糊精结构、超分子示意图及相关应用。
下列说法错误的是( )4SiH 4CH 3PH 3NH 4NH +4PH +2CO 2SiO 26C H 38C HA.环六糊精属于寡糖B.非极性分子均可被环六糊精包合形成超分子C.图2中甲氧基对位暴露在反应环境中D.可用萃取法分离环六糊精和氯代苯甲醚5.下列反应的离子方程式正确的是( )A.去除废水中的:B.过氧化钠在潜水艇中作为的来源:C.沉淀溶于氨水:D.在溶液中滴加少量溶液:6.碳硼烷酸是一类超强酸,也是唯一能质子化富勒烯(如)但不会将其分解的酸,2Na S 2Hg +2+2-Hg +S HgS ↓2O 22222O 2H O 4OH O --++↑AgCl ()332AgCl 2NH Ag NH Cl⎡⎤+⎣⎦NaOH ()442NH AlSO ()34Al 4OHAl OH -+-⎡⎤+⎣⎦60C其结构如图所示。
2020届高考化学考前冲刺提分训练:晶体结构及简单计算【答案+详解、课后总结】

——晶体结构及简单计算【提分训练】1. (2019·全国卷Ⅱ,节选)一种四方结构的超导化合物的晶胞结构如图1所示。
晶胞中Sm 和As 原子的投影位置如图2所示。
图中F -和O 2-共同占据晶胞的上下底面位置,若两者的比例依次用x 和1-x 代表,则该化合物的化学式表示为________;通过测定密度ρ和晶胞参数,可以计算该物质的x 值,完成它们关系表达式:ρ=________g ·cm -3。
以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图1中原子1的坐标为⎝ ⎛⎭⎪⎫12,12,12,则原子2和3的坐标分别为________、________。
解析:由图1可知,每个晶胞中含Sm 原子:4×12=2,含Fe 原子:4×14+1=2,含As 原子:4×12=2,含O 原子:8×18+2×12(1-x )=2(1-x ),含F 原子:8×18+2×12x =2x ,所以该化合物的化学式为SmFeAsO1-x F x ;根据该化合物的化学式为SmFeAsO 1-x F x ,一个晶胞的质量为2[281+16(1-x )+19x ]N Ag ,一个晶胞的体积为a 2c ×10-30cm 3,则密度ρ=2[281+16(1-x )+19x ]a 2cN A ×10-30g ·cm -3;根据原子1的坐标12,12,12,可知原子2和3的坐标分别为12,12,0,0,0,12。
答案:SmFeAsO 1-x F x2[281+16(1-x )+19x ]a 2cN A ×10-30 ⎝ ⎛⎭⎪⎫12,12,0 ⎝⎛⎭⎪⎫0,0,122.(2019·全国卷Ⅲ,节选)NH 4H 2PO 4和LiFePO 4属于简单磷酸盐,而直链的多磷酸盐则是一种复杂磷酸盐,如:焦磷酸钠、三磷酸钠等。
高考微专题复习——晶体密度计算(附参考答案)
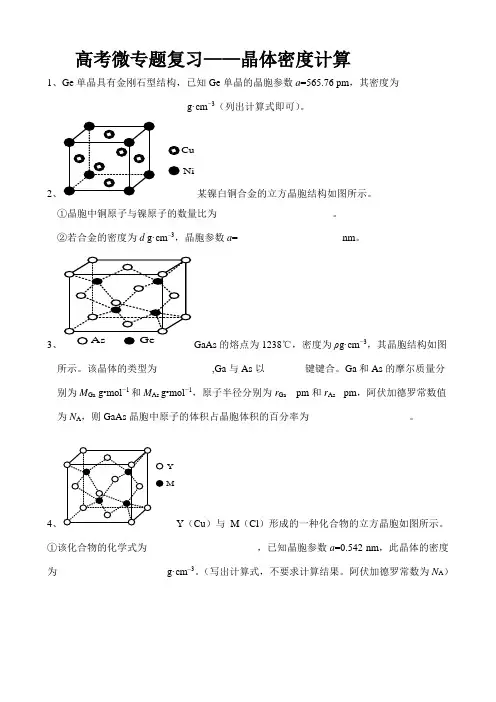
高考微专题复习——晶体密度计算1、Ge单晶具有金刚石型结构,已知Ge单晶的晶胞参数a=565.76 pm,其密度为_________________________g·cm−3(列出计算式即可)。
2、CuNi某镍白铜合金的立方晶胞结构如图所示。
①晶胞中铜原子与镍原子的数量比为_______________________。
②若合金的密度为d g·cm–3,晶胞参数a=_____________________nm。
3、GaAs的熔点为1238℃,密度为ρg·cm−3,其晶胞结构如图所示。
该晶体的类型为___________,Ga与As以________键键合。
Ga和As的摩尔质量分别为M Ga g•mol−1和M As g•mol−1,原子半径分别为r Ga pm和r As pm,阿伏加德罗常数值为N A,则GaAs晶胞中原子的体积占晶胞体积的百分率为____________________。
4、YMY(Cu)与M(Cl)形成的一种化合物的立方晶胞如图所示。
①该化合物的化学式为______________________,已知晶胞参数a=0.542 nm,此晶体的密度为______________________g·cm–3。
(写出计算式,不要求计算结果。
阿伏加德罗常数为N A)5、(O)和B(Na)能够形成化合物F,其晶胞结构如图所示,晶胞参数,a=0.566nm,F的化学式为____________;晶胞中A原子的配位数为____________;列式计算晶体F的密度(g·c m¯3)___________________________________。
6、Al单质为面心立方晶体,其晶胞参数a=0.405nm,晶胞中铝原子的配位数为_________,列式表示Al单质的密度为________________________g·cm¯3(不必计算出结果)7、金刚石晶胞含有_______个碳原子。
选修3高考考点点点过:6.晶体结构的计算(含解析)
【考点概括】1.晶胞化学式的计算晶体中微粒的摆列拥有周期性,晶体中最小的构造重复单元称为晶胞,利用“均派法” 能够计算一个晶胞中的粒子数,进而确立晶体的化学式。
“均派法”的基本思想是晶胞中随意地点上的一个粒子被 n 个晶胞共用,那么每个晶胞对这个原子分得份额就是里波及的晶胞有立方晶胞、六方晶胞、三棱晶胞,以立方晶胞最为常有。
常有考题( 1)立方晶胞:每个极点上的粒子被8 个晶胞共用,每个粒子只有属于该晶胞;每条棱上的粒子被 4 个晶胞共用,每个粒子只有属于该晶胞;每个面心上的粒子被 2 个晶胞共用,每个粒子只有属于该晶胞;晶胞内的粒子完整属于该晶胞。
( 2)六方晶胞:每个极点上的粒子被 6 个晶胞共用;每条横棱上的粒子被 4 个晶胞共用;每条纵棱上的粒子被 3 个晶胞共用;每个面心上的粒子被 2 个晶胞共用;晶胞内的粒子完整属于该晶胞。
( 3)三棱晶胞:每个极点上的粒子被12 个晶胞共用;每条横棱上的粒子被 4 个晶胞共用;每条纵棱上的粒子被 6 个晶胞共用;每个面心上的粒子被 2 个晶胞共用;晶胞内的粒子完整属于该晶胞。
2.晶体密度及微粒间距离的计算(1) 晶体微粒与M、ρ之间的关系:若 1 个晶胞中含有 x 个微粒,则 1mol晶胞中含有 xmol33为晶胞的体积,微粒,其质量为 xM g(M 为微粒的相对“分子”质量 );1 个晶胞的质量为ρag(a33ρ为晶胞的密度 ),则 1mol 晶胞的质量为ρa N A g,所以有xM =ρa N A。
( 2)金属晶体中体心立方聚积、面心立方聚积中的几组公式(设棱长为 a):面对角线长=2 a;体对角线长=3a;体心立方聚积4r= 3a(r 为原子半径 );面心立方聚积4r= 2a(r为原子半径 )。
( 3)空间利用率的计算:空间利用率=晶胞据有的微粒体积晶胞体积。
【过关练习】1.下列图是甲、乙、丙三种晶体的晶胞,则甲晶体中x 与 y 的个数比是 ______,乙中 a 与 b 的个数比是 ______,丙中一个晶胞中有________个 c 离子和 ________个 d 离子。
高考化学晶胞的相关计算专项训练知识点及练习题附解析
高考化学晶胞的相关计算专项训练知识点及练习题附解析一、晶胞的相关计算1.铁(Fe)、铜(Cu)、银(Ag)是常见的金属元素,它们的单质及其化合物在生活中有广泛应用。
(1)Ag 与 Cu 在同一族,则 Ag 在周期表中________ (填“s”、“p”、“d”或“ds”)区;[Ag(NH3)2]+中Ag+空的 5s 轨道和 5p 轨道以sp 杂化成键,则该配离子的空间构型是________。
(2)基态 Cu+的简化电子排布式为________。
(3)表中是 Fe 和 Cu 的部分电离能数据:请解释 I2(Cu)大于 I2(Fe)的主要原因:________。
元素Fe Cu第一电离能 I1/kJ·mol-1759746第二电离能 I2/kJ·mol-115611958(4)亚铁氰化钾是食盐中常用的抗结剂,其化学式为 K4[Fe(CN)6]。
①CN-的电子式是________;1mol 该配离子中含σ 键数目为________。
②该配合物中存在的作用力类型有________ (填字母)。
A.金属键 B.离子键 C.共价键 D.配位键 E.氢键 F.范德华力(5)氧化亚铁晶体的晶胞结构如图所示。
已知:氧化亚铁晶体的密度为ρg•cm﹣3,N A代表阿伏加德罗常数的值。
在该晶胞中,与 Fe2+紧邻且等距离的 Fe2+数目为________,Fe2+与O2﹣最短核间距为________pm。
2.Mg、Ni、Cu、Zn 等元素在生产、生活中有着广泛的应用。
回答下列问题:(1)Mg、Ni、Cu 等金属可能形成金属互化物。
金属互化物的结构类型丰富多样,确定某种金属互化物是晶体还是非晶体可通过___________测定。
(2)根据 Cu、Zn 的原子结构比较第一电离能:I1(Cu)_________ I1(Zn)(填“大于”、“等于”或“小于”),理由是_____________________。
专题75 晶体结构与性质(教师版)十年(2013-2022)高考化学真题分项汇编(全国通用)
专题73晶体结构与性质1.【2022年山东卷】AlN、GaN属于第三代半导体材料,二者成键结构与金刚石相似,晶体中只存在N-Al键、N-Ga键。
下列说法错误的是A.GaN的熔点高于AlN B.晶体中所有化学键均为极性键C.晶体中所有原子均采取3sp杂化D.晶体中所有原子的配位数均相同【答案】A【解析】Al和Ga均为第ⅢA元素,N属于第ⅤA元素,AlN、GaN的成键结构与金刚石相似,则其为共价晶体,且其与金刚石互为等电子体,等电子体之间的结构和性质相似。
AlN、GaN晶体中,N原子与其相邻的原子形成3个普通共价键和1个配位键。
A.因为AlN、GaN为结构相似的共价晶体,由于Al原子的半径小于Ga,N—Al的键长小于N—Ga的,则N—Al的键能较大,键能越大则其对应的共价晶体的熔点越高,故GaN 的熔点低于AlN,A说错误;B.不同种元素的原子之间形成的共价键为极性键,故两种晶体中所有化学键均为极性键,B说法正确;C.金刚石中每个C原子形成4个共价键(即C原子的价层电子对数为4),C原子无孤电子对,故C原子均采取sp3杂化;由于AlN、GaN与金刚石互为等电子体,则其晶体中所有原子均采取sp3杂化,C说法正确;D.金刚石中每个C原子与其周围4个C原子形成共价键,即C原子的配位数是4,由于AlN、GaN与金刚石互为等电子体,则其晶体中所有原子的配位数也均为4,D说法正确。
综上所述,本题选A。
Cu Se是一种钠离子电池正极材料,充放电过程中正极材料立方晶2.【2022年山东卷】2-x胞(示意图)的组成变化如图所示,晶胞内未标出因放电产生的0价Cu原子。
下列说法正确的是A .每个2-x Cu Se 晶胞中2+Cu 个数为xB .每个2Na Se 晶胞完全转化为2-x Cu Se 晶胞,转移电子数为8C .每个NaCuSe 晶胞中0价Cu 原子个数为1-xD .当2x y -Na Cu Se 转化为NaCuSe 时,每转移(1-y)mol 电子,产生(1-x)molCu 原子【答案】BD【解析】A .由晶胞结构可知,位于顶点和面心的硒离子个数为8×18+6×12=4,位于体内的铜离子和亚铜离子的个数之和为8,设晶胞中的铜离子和亚铜离子的个数分别为a 和b ,则a+b=8-4x ,由化合价代数和为0可得2a+b=4×2,解得a=4x ,故A 错误;B .由题意可知,Na 2Se 转化为Cu 2-x Se 的电极反应式为Na 2Se-2e -+(2-x)Cu=Cu 2-x Se+2Na +,由晶胞结构可知,位于顶点和面心的硒离子个数为8×18+6×12=4,则每个晶胞中含有4个Na 2Se ,转移电子数为8,故B 正确;C .由题意可知,Cu 2-x Se 转化为NaCuSe 的电极反应式为Cu 2-x Se+e -+Na +=NaCuSe+(1-x)Cu ,由晶胞结构可知,位于顶点和面心的硒离子个数为8×18+6×12=4,则每个晶胞中含有4个NaCuSe ,晶胞中0价铜而个数为(4-4x),故C 错误;D .由题意可知,Na y Cu 2-x Se 转化为NaCuSe 的电极反应式为Na y Cu 2-x Se+(1-y)e -+Na +=NaCuSe+(1-x)Cu ,所以每转移(1-y)电子,产生(1-x)mol 铜,故D 正确;故选BD 。
高中化学——晶胞的结构与计算专题练习(带答案)
高中化学——晶胞的结构与计算专题练习(带答案解析)一、单选题1.快离子导体是一类具有优良导电能力的固体电解质。
图1(Li3SBF4)和图2是潜在的快离子导体材料的结构示意图。
温度升高时,NaCl晶体出现缺陷,晶体的导电性增强。
该晶体导电时,③迁移的途径有两条:途径1:在平面内挤过2、3号氯离子之间的狭缝(距离为x)迁移到空位。
途径2:挤过由1、2、3号氯离子形成的三角形通道(如图3,小圆的半径为y)迁移到空位。
已知:氯化钠晶胞参数a=564pm,r(Na+)=95pm,r(Cl-)=185pm下列说法不正确的是A.第二周期元素中第一电离能介于B和F之间的元素有4种B.图1所示晶体中,每个Li+与4个呈四面体结构的离子相邻C.氯化钠晶体中,Na+填充在氯离子形成的正八面体空隙中D.温度升高时,NaCl晶体出现缺陷,晶体的导电性增强,该晶体导电时,③迁移的途径可能性更大的是途径12.某铜的氯化物常作工业催化剂,其晶胞结构如图所示,晶胞中C、D两原子核间距为298pm。
N,则下列说法正确的是设阿伏加德罗常数的值为AA.Cu的+2价比+1价稳定,是因为最外层电子达到半充满结构CuClB.此氯化物的化学式为2C.晶胞中Cu位于Cl形成的四面体空隙D .Cu 与Cl倍 3.Al x CoO y 的立方晶胞如图所示,已知处在体心处的原子为Co ,晶胞参数anm ,下列说法错误的是A .x=1,y=3B .该晶胞的密度为23-33A1.3410g cm a N ⨯⋅ C .该晶胞的俯视图为D .晶体中一个Al 周围与其最近的O 的个数为64.某立方晶系的锑钾()Sb K -合金可作为钾离子电池的电极材料,下图表示1/8晶胞。
下列说法中错误的是A .该晶胞的体积为33038a 10cm -⨯B .K 和Sb 原子数之比为3:1C .与K 最邻近的Sb 原子数为4D .该晶胞的俯视图为5.2CaC 的晶胞与NaCl 相似,但由于22C -的结构导致晶胞沿一个方向拉长(如图),已知2CaC 的摩尔质量为1M g mol -⋅,若阿伏加德罗常数的值为A N ,下列说法错误..的是A .2Ca +填充在22C -围成的八面体空隙中B .每个2Ca +周围等距紧邻的22C -有6个C .两个最近2Ca +D .2CaC 晶体密度的计算式为3230A 4g cm 10M N a b --⋅⨯ 6.某镁镍合金储氢后所得晶体的立方晶胞如图1(为便于观察,省略了2个图2的结构),晶胞边长为apm 。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
选修3:物质结构与性质
晶体结构的计算
35.[化学—选修3:物质结构与性质](15分)(2018年全国卷I)
Li是最轻的固体金属,采用Li作为负极材料的电池具有小而轻、能量密度大等优良性能,得到广泛应用。
回答下列问题:
(5)Li2O具有反萤石结构,晶胞如图(b)所示。
已知晶胞参数为0.4665 nm,阿伏加德罗常数的值为N A,则Li2O的密度为g·cm−3(列出计算式)。
35.[化学——选修3:物质结构与性质](15分)(2018年全国卷II)
(5)FeS2晶体的晶胞如图(c)所示。
晶胞边长为a nm、FeS2相对式量为M,阿伏加德罗常数的值为N A,其晶体密度的计算表达式为___________g·cm−3;晶胞中Fe2+位S 所形成的正八面体的体心,该正八面体的边长为______nm。
于2
2
35.[化学——选修3:物质结构与性质](15分)(2018年全国卷III)
锌在工业中有重要作用,也是人体必需的微量元素。
回答下列问题:
(1)Zn原子核外电子排布式为________________。
(5)金属Zn晶体中的原子堆积方式如图所示,这种堆积方式称为_______________。
六棱柱底边边长为a cm,高为c cm,阿伏加德罗常数的值为N A,Zn的密度为
________________g·cm-3(列出计算式)。
35.[化学——选修3:物质结构与性质](15分)(2017年全国卷III)
35.[化学——选修3:物质结构与性质](15分)(2017年全国卷I)
37.[化学——选修3:物质结构与性质](15分)(2016年全国卷III)
37.[化学——选修3:物质结构与性质](15分)(2016年全国卷II)
(4)某镍白铜合金的立方晶胞结构如图所示
①晶胞中铜原子与镍原子的数量比为。
②若合金的密度为d,晶胞参数为nm。
37.[化学——选修3:物质结构与性质](15分)(2016年全国卷I)
(6)已知Ge单晶的晶胞参数a=565.76pm,其密度为(列出计算式即可)
(2016年四川高考)
(2016年海南高考)
37.[化学——选修3:物质结构与性质](15分)(2015年全国卷II)
37.[化学——选修3:物质结构与性质](15分)(2015年全国卷I)
(5) 碳有多种同素异形体,其中石墨烯与金刚石的晶体结构如图所示:
石墨烯晶体金刚石晶体
①在石墨烯晶体中,C原子所连接个六元环,每个六元环占有个C原子在同一平面。
②在金刚石晶体中,C原子所连接的最小环也为六元环,每个C原子连接个六元环,六元环中最多有个C原子在同一平面。
37.[化学——选修3:物质结构与性质](15分)(2014年全国卷II)
37.[化学——选修3:物质结构与性质](15分)(2014年全国卷I)
(4) Al单质为面心立方晶体,其晶胞参数a=0.405nm,晶胞中铝原子的配位数为。
列式表示Al单质的密度(不必计算出结果)
(2013年浙江高考21)
(2013年山东高考32)
37.[化学——选修3:物质结构与性质](15分)(2013年全国卷II)
37.[化学——选修3:物质结构与性质](15分)(2012年全国卷)。
