晶胞计算专题均摊法(课堂PPT)
合集下载
人教版高中化学选修三课件:第三章 专题课 晶体堆积模型及晶胞相关计算ppt

例5 右图为NaCl晶胞结构,已知FexO晶体晶胞结构为 NaCl型,由于晶体缺陷,x值小于1。测知FexO晶体的
密度为ρ=5.71g/cm3,晶胞边长为4.28×10-10m。
探究1:已知铜晶胞是面心立方晶胞,其晶胞特征如右图所示。 若已知该晶体的密度为a g/cm3,NA代表阿伏加德罗常数,相对原子质量为64 , 请回答:
[来源:学科网]
①晶胞中铜原子的配位数为________ ,一个晶胞中原子的数目为________; ②该晶体的边长为_______________,铜原子半径为________(用字母表示)。 列式并计算Cu空间利用率________________
D.YBa2Cu4O7
题型4、 晶体密度、粒子间距离的计算
例4右图为NaCl晶胞结构示意图。 (1)用X射线衍射法测得晶胞的边长为a cm,求该温度下NaCl晶体的密度。
ρ=m/V=
(2)晶体的密度为ρg/cm3,则晶体中Na +与Na+之间的最短距离是多少?
[练习3]. 已知 NaCl 的摩尔质量为 M g·mol-1, 食盐晶体的密度为ρg·cm-3,若下图中Na+与最邻 近的Cl- 的核间距离为 a cm,那么阿伏加德罗常 数的值可表示为 D
【巩固练习】 1.Al2O3在一定条件下可制得AlN,其晶体结构如图2所示,该 晶体中Al的配位数是_________ .
2.六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似, 硬度与金刚石相当,晶胞边长为361.5pm,立方氮化硼晶胞中含有______个 氮原子、_______个硼原子,立方氮化硼的密度是____________g·cm-3(只 要求列算式,不必计算出数值,阿伏加德罗常数为NA)
晶胞计算专题均摊法讲解学习
(2)每个Na+周围等距
且
12
紧(3)邻每的个N晶a胞+有中平均有 4 个Na+, 4 个Cl-
个,。故每个晶胞4 中含有 个“NaCl”结构单元;
N(Na+) ︰ N( Cl-) = 1 ︰1 ,化学为 NaCl 。
CaF2的晶体结构
(1)每个Ca2+周围等距且 紧邻的F-有8 个, Ca2+8配位数为 。
(2)实际含有原子 个数应为?
8×1/8 + 6×1/2 + 4 = 8
金刚石晶体中含有 共价键形成的C原
子环,其6中最小的
C环上有_____个C 原子。
用脑
思考:1.一个金刚石晶胞里有8_
2.平均每个碳原子有__2_个C--C键?
3.每个碳原子为__12__个六元环共用?
4.每个C-C键为___6 _个六元环共用?
算
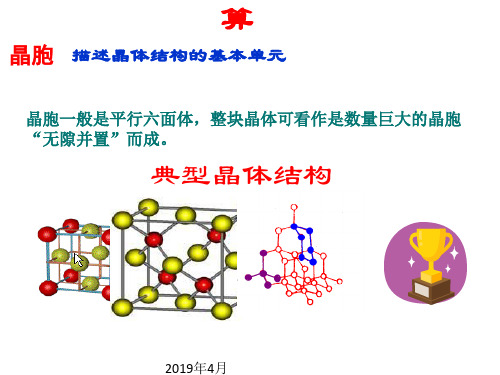
晶胞 描述晶体结构的基本单元
晶胞一般是平行六面体,整块晶体可看作是数量巨大的晶胞 “无隙并置”而成。
典型晶体结构
2019年4月
平行六 面体
无隙并置
请看:
4
8 51
棱边:1/4
1
3 73
62
2
4
面心:1/2
2
顶点:1/8
1
1
体心:1
一、晶胞中粒子个数计算规律
1.立方晶胞
晶胞 顶角
立方体 1/8
碳键数为____个。
(2)层内71个4 六元环完全占有
的C原子数为_____个,2碳:3原子
数目与碳碳化学键数目之比为_ ______.
巩固练习二:
已知晶体硼的基本结构单元 是由硼原子组成的正二十面 体,如图所示:其中有二十 个等边三角形的面和一定数 目的顶点,每个顶点为一个 硼原子,试通过观察1分2 析右 图回答:此基30 本结构单元是 由___个硼原子构成,60有0 ___ 个B-B化学键,相邻BB键的键角为____.
晶胞计算专题均摊法讲解学习共30页

晶胞计算专题均摊法讲解学习
56、死去何所道,托体同山阿。 57、春秋多佳日,登高赋新诗。 58、种豆南山下,草盛豆苗稀。晨兴 理荒秽 ,带月 荷锄归 。道狭 草木长 ,夕露 沾我衣 。衣沾 不足惜 ,但使 愿无违 。 59、相见无杂言,但道桑麻长。 60、迢迢新秋夕,亭亭月将圆。
谢谢你的生
71、既然我已经踏上这条道路,那么,任何东西都不应妨碍我沿着这条路走下去。——康德 72、家庭成为快乐的种子在外也不致成为障碍物但在旅行之际却是夜间的伴侣。——西塞罗 73、坚持意志伟大的事业需要始终不渝的精神。——伏尔泰 74、路漫漫其修道远,吾将上下而求索。——屈原 75、内外相应,言行相称。——韩非
56、死去何所道,托体同山阿。 57、春秋多佳日,登高赋新诗。 58、种豆南山下,草盛豆苗稀。晨兴 理荒秽 ,带月 荷锄归 。道狭 草木长 ,夕露 沾我衣 。衣沾 不足惜 ,但使 愿无违 。 59、相见无杂言,但道桑麻长。 60、迢迢新秋夕,亭亭月将圆。
谢谢你的生
71、既然我已经踏上这条道路,那么,任何东西都不应妨碍我沿着这条路走下去。——康德 72、家庭成为快乐的种子在外也不致成为障碍物但在旅行之际却是夜间的伴侣。——西塞罗 73、坚持意志伟大的事业需要始终不渝的精神。——伏尔泰 74、路漫漫其修道远,吾将上下而求索。——屈原 75、内外相应,言行相称。——韩非
晶胞计算专题均摊法

种粒子数之比是( )
B
A.3∶9∶4
B.1∶4∶2
C.2∶9∶4
D.3∶8∶4
A B C
4.最近发现一种由钛原子和碳原子构成的气态团簇分
子,如右图所示:
7
课堂检测:
1.钛酸钡的热稳定性好,
介电常数高,在小型变
Ba
压器、话筒和扩音器
中都有应用。其晶体
Ti
的结构示意图如右图
O
所示。则它的化学式
为( D)
A.BaTi8O12 C. BaTi2O4
B. BaTi4O6 D. BaTiO3
2.正六棱柱晶胞
顶点: 1/6 面心: 1/2 (上、下)棱: 1/4 中棱: 1/3
立方体
顶角 1/8
棱上 1/4
面上 1/2
中心 1
顶角 棱上
面上 中心
分子晶体 干冰晶体结构 ——晶胞为面心立方体
8个CO2分子位于立方体顶点 6个CO2分子位于立方体面心
在每个CO2周围等距离且相距最近
的CO2共有
12个。
在每个小立方体中平均分摊到的CO2 分子数为: (8×1/8 + 6×1/2) =个4
金刚石晶体中含有共价键 形成的C原子环,其中最
小的C环上有6_____个C原
子。
用脑
思考:1.一个金刚石晶胞里有_ _个碳原子?8
2.平均每个碳原子有___个C--C2键?
3.每个碳原子为____个六12元环共用?
4.每个C-C键为____个六元6 环共用?
用心
思考:1.金刚石晶胞中,每个C原子均可与相邻的___
常见晶体模型及晶胞均摊计算
晶胞 描述晶体结构的基本单元
晶胞一般是平行六面体,整块晶体可看作是数量巨大的晶胞“无隙并置”而成。
晶胞计算ppt课件

钇________
个
12
巩固练习五:
(1) 平均每个正六边形拥有_____个锗原2子, _____个氧原子.3
(2) 化学式为:_____(_G_e_C_H__2C__H_2_C_O_O__H_)2O3
或Ge2C6H10O7
13
巩固练习六:
某离子晶体的晶胞结构如右 图所示: ●表示X离子,位于立 方体的顶点;○表示Y离子,位 于立方体的中心。试分析: ①该晶体的化学式为 Y2X 。 ②晶体中距离最近的2个X与一 个Y形成的夹角为109028′ _____________
4
晶胞中金属原子数目的计算方法(平均值)
1、顶点:一个立 方体的顶点由八 个相同的立方体 在共用,则平均 每个立方体只分 到其1/8. 2、面:1/2
3、棱: 1/4 4、体心:1
5
例1:
右图是石英晶 体平面示意图(它实 际上是立体的网状结 构),其中硅、氧原 子数之比为____.
1:2
6
例2:
解:(1)8 1/8+6 1/2=4
(2)V=a3=(3.6210-10m)3=4.74 10-29m3
m 4 1.05510-25kg
(3)ρ= =
=8.9 103 Kg/m3
V
4.74 10-29m3
16
金晶体的晶胞是面心立方晶胞,金原子的直径 为d,用NA表示阿伏加德罗常数,M表示金 的摩尔质量。
如图直线交点处 的圆圈为NaCl晶体中 Na+或Cl-所处位置, 晶体中,每个Na+周 围与它最接近的且距 离相等的Na+个数为: ____ 12
7
例3:
金刚石晶体中 含有共价键形成的 C原子环,其中最
晶胞计算专题均摊法演示课件.ppt

共价键,而冰融化需要破坏氢键
•(3)实验测得冰中氢键的作用力为18.5 kkJJ//mmooll,,而这冰说的明熔冰化熔热化为成水5.0,氢键_________(填部分全部或部 分)被破坏。
0.0
15
巩固练习一:
石墨晶体的层状结构,层内为
平面正六边形结构(如图),
试回答下列问题:
(1)图中平均2 每个正六边形占 有C原子3 数为____个、占有的碳
0.0
24
例3.某晶体的一部分如右图所示,这种晶
体中A、B、C三种粒子数之比B是( )
A.3∶9∶4
B.1∶4∶2
C.2∶9∶4
D.3∶8∶4
A
B
C
0.0
25
练习
4.最近发现一种由钛原子和碳原子构成的气态团簇分 子,如右图所示: 顶点和面心的原子是钛原子,
棱的中心和体心的原子是碳原子,
它的化学式是( Ti14C13)
_(_只__要__指__出__“__C_6_0_含__3_0_个__双__键__”__即__可__,_但__答__“__因__C_6_0_含__有__双__键__”__不__行_. )
(3)通过可计由算欧,确拉定定C理60分计子算所键含数单(即键棱数边.C数60)分:60子+(所12含+2单0)键-2=数9为0 ___________.
e.3,一摩碳-60中含有碳碳单键和双键的计算:假设1mol
C60有x mol碳碳双键(C=C),y mol碳碳单键(C-
C),从每个顶点来看,y=2x从边的数量来看,x+y=90解
得x=30,y=60因此1mol C60有60mol碳碳单键(C-C)
,30mol碳碳双键(C=C) 0.0
•(3)实验测得冰中氢键的作用力为18.5 kkJJ//mmooll,,而这冰说的明熔冰化熔热化为成水5.0,氢键_________(填部分全部或部 分)被破坏。
0.0
15
巩固练习一:
石墨晶体的层状结构,层内为
平面正六边形结构(如图),
试回答下列问题:
(1)图中平均2 每个正六边形占 有C原子3 数为____个、占有的碳
0.0
24
例3.某晶体的一部分如右图所示,这种晶
体中A、B、C三种粒子数之比B是( )
A.3∶9∶4
B.1∶4∶2
C.2∶9∶4
D.3∶8∶4
A
B
C
0.0
25
练习
4.最近发现一种由钛原子和碳原子构成的气态团簇分 子,如右图所示: 顶点和面心的原子是钛原子,
棱的中心和体心的原子是碳原子,
它的化学式是( Ti14C13)
_(_只__要__指__出__“__C_6_0_含__3_0_个__双__键__”__即__可__,_但__答__“__因__C_6_0_含__有__双__键__”__不__行_. )
(3)通过可计由算欧,确拉定定C理60分计子算所键含数单(即键棱数边.C数60)分:60子+(所12含+2单0)键-2=数9为0 ___________.
e.3,一摩碳-60中含有碳碳单键和双键的计算:假设1mol
C60有x mol碳碳双键(C=C),y mol碳碳单键(C-
C),从每个顶点来看,y=2x从边的数量来看,x+y=90解
得x=30,y=60因此1mol C60有60mol碳碳单键(C-C)
,30mol碳碳双键(C=C) 0.0
选修3晶胞的上课课件

②
①.3:9:4 ②.1:4:2 ③.2:9:4 ⑤.3:8:4
11
例4石墨的层结构如
右图所示,图中每个
平面正六边形占有C
2 原子数为_ _个、占
有的碳碳键数为 个
,
2 : 碳原子数目与 碳 键 12
C.N. (Na+) (每个Na+周围最邻近且等距离的Cl¯的 目)
6
4
1
5
C.N. (Cl- )
2 每个Cl¯
周围最 邻近且
等距离6
的Na+ 13
14
每个Na+周围最邻近且等距离的Na+有几个 ?
11
5
8
12
9 2
4
3 7
1 10
6
12
15
晶胞密度及微粒间距离的计算
若氯化钠的摩尔质量为Mg/mol,Na+和 Cl ━ 间的最近距离为 a cm, 设 德常数为NA,则NaCl晶体的密度为多 少g/cm3。
9
非立方体晶胞:正六棱柱晶胞和三棱柱晶胞
例2.硼化镁晶胞如下图所示,其中镁原子间形 成正六棱柱,且棱柱的上下底面还各有1个镁 原子,6个硼原子位于棱柱内,则该化合物的化
学式可表示为( )
AB..MMggBB2
B
C.Mg2B
D.Mg3B2
10
C例三3.种某粒晶子胞数结之构比如是下图( 所示),晶体中A、B、
3.在金刚石中,碳原子个数与C-C键个数
之比是多少?
4.在金刚石晶胞中含有的碳原子数?
5.在金刚石中每个六元碳环含有几个碳
原子?含有几个碳碳键?
19
均摊法:若某一微粒同时被n个晶胞共 用,此微粒的1/n属于该晶胞
①.3:9:4 ②.1:4:2 ③.2:9:4 ⑤.3:8:4
11
例4石墨的层结构如
右图所示,图中每个
平面正六边形占有C
2 原子数为_ _个、占
有的碳碳键数为 个
,
2 : 碳原子数目与 碳 键 12
C.N. (Na+) (每个Na+周围最邻近且等距离的Cl¯的 目)
6
4
1
5
C.N. (Cl- )
2 每个Cl¯
周围最 邻近且
等距离6
的Na+ 13
14
每个Na+周围最邻近且等距离的Na+有几个 ?
11
5
8
12
9 2
4
3 7
1 10
6
12
15
晶胞密度及微粒间距离的计算
若氯化钠的摩尔质量为Mg/mol,Na+和 Cl ━ 间的最近距离为 a cm, 设 德常数为NA,则NaCl晶体的密度为多 少g/cm3。
9
非立方体晶胞:正六棱柱晶胞和三棱柱晶胞
例2.硼化镁晶胞如下图所示,其中镁原子间形 成正六棱柱,且棱柱的上下底面还各有1个镁 原子,6个硼原子位于棱柱内,则该化合物的化
学式可表示为( )
AB..MMggBB2
B
C.Mg2B
D.Mg3B2
10
C例三3.种某粒晶子胞数结之构比如是下图( 所示),晶体中A、B、
3.在金刚石中,碳原子个数与C-C键个数
之比是多少?
4.在金刚石晶胞中含有的碳原子数?
5.在金刚石中每个六元碳环含有几个碳
原子?含有几个碳碳键?
19
均摊法:若某一微粒同时被n个晶胞共 用,此微粒的1/n属于该晶胞
人教化学选修3第三章物质结构与性质——晶胞计算(共23张PPT)

物质结构与性质——晶胞计算
一、晶胞中原子数目的计算方法(均摊法)
1、体心: 2、面: 3、棱: 4、顶点:
看教材: 学与问(P64)
正三棱柱
顶点: 1/12 面心: 1/2 (上、下)棱:1/4
中棱: 1/6
正六棱柱
顶点: 1/6 面心: 1/2 (上、下)棱:1/4 中棱: 1/3
二、晶体化学式确定
cm3
g/mol-1 mol-1
则密度表达为:
思考
ZnS在荧光体、光导体材料、 涂料、颜料等行业中应用广 泛。立方ZnS晶体结构如图所 示,其晶胞密度为ρ g/cm3, a位置S2-与b位置Zn2+之间的 距离为________pm(列式表示)。
已知铜晶胞是面心立方晶胞,该晶胞的边长为思考 3.6210-10m,每一个铜原子的质量为 1.05510-25kg ,试回答下列问题: (1)该晶胞的体积是多大? (2)利用以上结果计算金属铜的密度。
思考
某晶体的一部分如右图所示,这种晶体中
A、B、C三种粒子数之比是( )
A.3∶9∶4
B.1∶4∶2
C.2∶9∶4
D.3∶8∶4
三、晶胞的密度计算
晶胞中各线段之间的关系如下:
V=a3
晶胞密度的计算: 单位:
(1)晶胞体积(V) (2)晶胞中粒子数(N) (3)摩尔质量(M) (4)阿伏伽德罗NA
晶胞内不同微粒的个数最简整数比
思考
A与B离子的个数比等于
表示为
。
该物质化学式可
A+ B-
思考
该物质化学式可表示为
。
思考
氢气是重要而洁净的能源,要利用氢气作能源,必须 安全有效地储存氢气。某种合金材料有较大的储氢容量 ,其晶胞如图所示。则这种合金的化学式为( )
一、晶胞中原子数目的计算方法(均摊法)
1、体心: 2、面: 3、棱: 4、顶点:
看教材: 学与问(P64)
正三棱柱
顶点: 1/12 面心: 1/2 (上、下)棱:1/4
中棱: 1/6
正六棱柱
顶点: 1/6 面心: 1/2 (上、下)棱:1/4 中棱: 1/3
二、晶体化学式确定
cm3
g/mol-1 mol-1
则密度表达为:
思考
ZnS在荧光体、光导体材料、 涂料、颜料等行业中应用广 泛。立方ZnS晶体结构如图所 示,其晶胞密度为ρ g/cm3, a位置S2-与b位置Zn2+之间的 距离为________pm(列式表示)。
已知铜晶胞是面心立方晶胞,该晶胞的边长为思考 3.6210-10m,每一个铜原子的质量为 1.05510-25kg ,试回答下列问题: (1)该晶胞的体积是多大? (2)利用以上结果计算金属铜的密度。
思考
某晶体的一部分如右图所示,这种晶体中
A、B、C三种粒子数之比是( )
A.3∶9∶4
B.1∶4∶2
C.2∶9∶4
D.3∶8∶4
三、晶胞的密度计算
晶胞中各线段之间的关系如下:
V=a3
晶胞密度的计算: 单位:
(1)晶胞体积(V) (2)晶胞中粒子数(N) (3)摩尔质量(M) (4)阿伏伽德罗NA
晶胞内不同微粒的个数最简整数比
思考
A与B离子的个数比等于
表示为
。
该物质化学式可
A+ B-
思考
该物质化学式可表示为
。
思考
氢气是重要而洁净的能源,要利用氢气作能源,必须 安全有效地储存氢气。某种合金材料有较大的储氢容量 ,其晶胞如图所示。则这种合金的化学式为( )
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
13
•晶胞是构成晶体的基本重复单元.在二氧化 硅晶胞中有8个硅原子位 于立方晶胞的8个 顶角,有6个硅原子位于晶胞的6个面心,还 有4个硅原子与16个氧原子在晶胞内构成4个 硅氧四面体,它们均匀错开排列于晶胞内. 根据图示二氧化硅晶胞结构,每个晶胞内所 含“SiO2”基元数为( C ) A.4个 •B.6个 •C.8个 •D.18个
_ 金刚石属原子晶体,而固体C60不是,故金刚石熔点较高.
___(_答__出__“__金__刚__石__属__原__子__晶__体__”__即__可__)________________________.
(2)试估计C60跟F2在一定条件下,能否发生反应生成C60F60(填“可能”或“ 不可能”)_____可__能________,并简述其理由:
14
•冰晶胞中水分子的空间排列方式与金刚石晶胞类似,如下 图: (1)一个水分子含___2__个孤电子对,水分子能与很多金属 离子形成配合物,请写出它与铜离子形成的一种蓝色的配合 物离子的化学式为__________Cu。(H2O)42+ (2)每个冰晶胞平均占有__8__个水分子,冰的熔点远低于 金刚石熔点的原因是____破__坏_的_作__用_力_不__同_,_金_。刚石融化需要破坏
(2)实际含有原子 个数应为?
8×1/8 + 6×1/2 + 4 = 8
10
金刚石晶体中含有 共价键形成的C原
子环,其6中最小的
C环上有_____个C 原子。
11
用脑
思考:1.一个金刚石晶胞里有8_
2.平均每个碳原子有__2_个C--C键?
3.每个碳原子为__12__个六元环共用?
4.每个C-C键为___6 _个六元环共用?
5
冰
冰的结构模型中,每个水分子与相邻的4
个水分子以氢键相连接,含1 mol
2
H2O的冰中,最多可形 mol“氢键”。
6
离子晶体
NaCl的晶体结 ——简单立方体
(1构)每个Na+( Cl-)周围等 Cl
距且紧邻的Cl- (Na+)有
-
Na+
6 个,构成 正八面体 ,
Na+( Cl-)的配位数为 6 。
(2)每个F周围等距且紧4邻的Ca2+有 个, F4-配位数为 。
(3)每个晶胞中含 4 个Ca2+、含8
Ca2+和F-的个数1︰比2是
。
FCa2+
个F-,
8
原子晶体
金刚石
该晶胞实际分摊到的碳原子数为
(4 + 6 ×1/2 + 8 ×1/8) = 8个。
9
思考
金刚石晶胞
(1)C原子位于晶胞 的哪些位置,分别有 几个?
立方体 1/8 1/4 1/2
中心 1
顶角 棱上 面上 中4 心
分子晶体 干冰晶体结构 ——晶胞为面心立方体
8个CO2分子位于立方体顶点 6个CO2分子位于立方体面心
在每个CO2周围等距离且相距最近 的CO2共有 12 个。
在每个小立方体中平均分摊到的CO2 分子数为:(8×1/8 + 6×1/2) = 4 个
共价键,而冰融化需要破坏氢键
•(3)实验测得冰中氢键的作用力为18.5 kkJJ//mmooll,,而这冰说的明熔冰化熔热化为成水5.0,氢键_________(填部分全部或部 分)被破坏。
15
巩固练习一:
石墨晶体的层状结构,层内为平
面正六边形结构(如图),试回
答下列问题:
(1)图中平均2 每个正六边形占 有C原子3 数为____个、占有的碳
18
巩固练习五:
(1) 平均每个正六边形拥有___2__个锗原子, ___3__个氧原子. (2) 化学式为:__(G__e_C_H__2C__H_2_C_O__O__H_)_2O_ 3 或Ge2C6H10O3
19
拓展练习1:
某晶胞结构如 图所示,晶胞中 各微粒个数分别 为:
铜___3_____个 钡___2_____个 钇___1_____个 氧___7_____个
C60分子中单键为:90-30=60
(4)C70分子也已制得,它的分子结构模型可以与C60同样考虑而推知.通过计算
确定C70分子中五边形和六边形的数目.
28
C70分子中所含五边形数为_______1_2____,六边形数为____2_5____.
_个碳原子
12
No Image
用心
思考:1.金刚石4晶胞中,每个C原子均可与相邻的___
个C构成实心的正四面体? 2
2.在一个小正四面体中平均含6有___个碳原子?
3. 在金刚石中最小的环1/2是____元环?
1个环中平均含有1 ____个C原子?
含C-C键数为____个?
8*2=16
4.一个晶胞中含有C-C键数为_ ___个?
No
习 ②C60分子只含有五边形和六边形; ③多面体的顶点数、面数和棱边数的关系,遵循欧拉定理:
Image
顶点数+面数-棱边数=2
据上所述,可推知C60分子有12个五边形和20个六边形,C60分子所 含的双键数为30.请回答下列问题: (1)固体C60与金刚石相比较,熔点较高者应是______金__刚__石__,理由是:
个正五边形的边和两个正六边形的边。碳原子的三个σ键不
是共平面的,键角约为108°或120°,因此整个分子为球
状。每个碳原子还剩下的一个p轨道互相重叠形成一个含60
个π电子的闭壳层电子结构,因此在近似球形的笼内和笼外
都围绕着π电子云 ;
3,一摩碳-60中含有碳碳单键和双键的计算:假设1mol
C60有x mol碳碳双键(C=C),y mol碳碳单键(C-
20
课堂检测:
1.钛酸钡的热稳定性好,
介电常数高,在小型变
Ba
压器、话筒和扩音器
中都有应用。其晶体
Ti
的结构示意图如右图
O
所示。则它的化学式
为(D)
A.BaTi8O12 C. BaTi2O4
B. BaTi4O6 D. BaTiO3
21
2.正六棱柱晶胞
顶点: 1/6 面心: 1/2 (上、下)棱:1/4 中棱: 1/3 22
24
例3.某晶体的一部分如右图所示,这种晶
体中A、B、C三种粒子数之比B是( )
A.3∶9∶4
B.1∶4∶2
C.2∶9∶4
D.3∶8∶4
A B C
25
练习
4.最近发现一种由钛原子和碳原子构成的气态团簇分 子,如右图所示: 顶点和面心的原子是钛原子,
棱的中心和体心的原子是碳原子,
它的化学式是( Ti14C13)
(2)每个Na+周围等距且 Nhomakorabea12
紧(3)邻每的个N晶a胞+有中平均有 4 个Na+, 4 个Cl-
个,。故每个晶胞4 中含有 个“NaCl”结构单元;
N(Na+) ︰ N( Cl-) = 1 ︰1 ,化学为 NaCl 。
7
CaF2的晶体结构
(1)每个Ca2+周围等距且 紧邻的F-有8 个, Ca2+8配位数为 。
因C60分子含30个双键,与极活泼的F2发生加成反应即可生成C60F60
_(_只__要__指__出__“__C_6_0_含__3_0_个__双__键__”__即__可__,_但__答__“__因__C_6_0_含__有__双__键__”__不___行. )
(3)通过可计由算欧,确拉定定C理60分计子算所键含数单(即键棱数边.C数60)分:60子+(所12含+2单0)键-2数=9为0 ___________.
例2.氢气是重要而洁净的能源,要利用氢气作能源, 必须安全有效地储存氢气。某种合金材料有较大的储氢
容量,其晶胞如图所示。则这种合金的化学D式为( )
A.LaNi6 B. LaNi3 C.LaNi4 D. LaNi5
23
3.正三棱柱
顶点: 1/12 面心: 1/2 (上、下)棱:1/4 中棱: 1/6
图回答:此基30 本结构单元是
由___个硼原子构成,60有0 ___
个B-B化学键,相邻B-
B键的键角为____.
17
巩固练习三:
已知晶体的基本单元是由 12个硼原子构成的(如右 图),每个顶点上有一个 硼原子,每个硼原子形成 的化学键完全相同,通过 观察图形和推算,可知此 基本20结构单元是一个正__ __面体。
算
晶胞 描述晶体结构的基本单元
晶胞一般是平行六面体,整块晶体可看作是数量巨大的晶胞 “无隙并置”而成。
典型晶体结构
1
2019年4月
平行六 面体
无隙并置
2
请看:
4
8 51
棱边:1/4
1
3 73
62
2
4
面心:1/2
2
顶点:1/8
1
体心:1
1
3
一、晶胞中粒子个数计算规律
1.立方晶胞
晶胞 顶角 棱上 面上
C),从每个顶点来看,y=2x从边的数量来看,x+y=90解
得x=30,y=60因此1mol C60有60mol碳碳单键(C-C)
,30mol碳碳双键(C=C)
27
课
外 1996年诺贝化学奖授予对发现C60有重大贡献的三位科学家.C60分子是形如 球状的多面体(如图),该结构的建立基于以下考虑:
练 ①C60分子中每个碳原子只跟相邻的3个碳原子形成化学键;
--Ti --C
26
b.
课外阅读
碳60介绍
对碳60的结构的初步认识:
