医疗器械包装灭菌验证输液器环氧乙烷灭菌验证方案
环氧乙烷灭菌器的验证

第一章总则1.1 目的根据GB18279--2000标准(《医疗器械的灭菌――环氧乙烷灭菌的验证及日常控制》)的要求,对环氧乙烷灭菌器进行有效性确认(验证),以保证满足一次性医疗器械无菌的要求。
1.2 围本验证方案仅适用于电达消毒设备厂生产(及改造)的HDX系列环氧乙烷灭菌器的验证。
注意:本验证资料仅作为本厂对使用单位(用户)技术服务的延伸,不宜作为任何方式的认证(如CE认证、ISO9000认证等)的依据。
1.3 验证1.3.1 验证方案:验证方案由供应方(电达消毒设备厂,下同)制定,并经使用单位(用户)管理者代表确认后,方可实施。
1.3.2 验证实施:使用(用户)单位应由相关职能部门的人员组成验证小组,并负责按照验证方案组织实施环氧乙烷灭菌器的验证;供应方可派技术人员提供协助。
1.3.3 验证结论:应由双方人员共同对验证的过程和所取得的数据进行确认,形成验证结论并会签。
1.3.4 验证资料:所有有关验证的资料、所取得的数据、记录和验证报告由使用(用户)单位妥善保管、存档。
第二章验证方案2.1 物理性能确认2.1.1 真空速率试验要求:预真空至-15Kpa的时间≤6min预真空至-50Kpa的时间≤30min条件:温度──恒定2.1.2 真空泄漏试验要求:预真空── -50Kpa泄漏速率──≤0.1Kpa/min条件:温度──恒定时间── 60min2.1.3 正压泄漏试验要求:正压──+50Kpa泄漏速率──≤0.1Kpa/min条件:温度──恒定时间── 60min2.1.4 加湿试验要求:湿度明显变化并在30~85%RH围条件:温度──恒定预真空── -25~-50Kpa2.1.5 灭菌室空载箱壁温度均匀性试验要求:控制温度──℃,最大温差≤±3℃条件:压力──常压24点温度传感器分布见附图2.1.6 灭菌室空载空间温度均匀性试验要求:控制温度──℃,最大温差≤±3℃,并确定冷点位置条件:压力──常压25点温度传感器分布见附图2.1.7 满载温度均匀性试验要求:控制温度──℃,最大温差≤10℃条件:压力──常压负载──箱,负载分布见附图25点温度传感器分布见附图2.2 微生物性能确认(半周期法)要求:⑴.通过半周期法,在保持其它灭菌工艺不变的条件下,将灭菌作用时间进行变化,并将不同灭菌作用时间的灭菌指示物(枯草杆菌的黑色芽胞变种――Atcc9372)在无菌环境下进行培养,检测试验微生物生长,找出细菌全部杀灭的时间临界值(最短有效灭菌时间)。
环氧乙烷灭菌器的验证

第一章总则1.1 目的根据GB18279--2000标准(《医疗器械的灭菌――环氧乙烷灭菌的验证及日常控制》)的要求,对环氧乙烷灭菌器进行有效性确认(验证),以保证满足一次性医疗器械无菌的要求。
1.2 围本验证方案仅适用于电达消毒设备厂生产(及改造)的HDX系列环氧乙烷灭菌器的验证。
注意:本验证资料仅作为本厂对使用单位(用户)技术服务的延伸,不宜作为任何方式的认证(如CE认证、ISO9000认证等)的依据。
1.3 验证1.3.1 验证方案:验证方案由供应方(电达消毒设备厂,下同)制定,并经使用单位(用户)管理者代表确认后,方可实施。
1.3.2 验证实施:使用(用户)单位应由相关职能部门的人员组成验证小组,并负责按照验证方案组织实施环氧乙烷灭菌器的验证;供应方可派技术人员提供协助。
1.3.3 验证结论:应由双方人员共同对验证的过程和所取得的数据进行确认,形成验证结论并会签。
1.3.4 验证资料:所有有关验证的资料、所取得的数据、记录和验证报告由使用(用户)单位妥善保管、存档。
第二章验证方案2.1 物理性能确认2.1.1 真空速率试验要求:预真空至-15Kpa的时间≤6min预真空至-50Kpa的时间≤30min条件:温度──恒定2.1.2 真空泄漏试验要求:预真空── -50Kpa泄漏速率──≤0.1Kpa/min条件:温度──恒定时间── 60min2.1.3 正压泄漏试验要求:正压──+50Kpa泄漏速率──≤0.1Kpa/min条件:温度──恒定时间── 60min2.1.4 加湿试验要求:湿度明显变化并在30~85%RH围条件:温度──恒定预真空── -25~-50Kpa2.1.5 灭菌室空载箱壁温度均匀性试验要求:控制温度──℃,最大温差≤±3℃条件:压力──常压24点温度传感器分布见附图2.1.6 灭菌室空载空间温度均匀性试验要求:控制温度──℃,最大温差≤±3℃,并确定冷点位置条件:压力──常压25点温度传感器分布见附图2.1.7 满载温度均匀性试验要求:控制温度──℃,最大温差≤10℃条件:压力──常压负载──箱,负载分布见附图25点温度传感器分布见附图2.2 微生物性能确认(半周期法)要求:⑴.通过半周期法,在保持其它灭菌工艺不变的条件下,将灭菌作用时间进行变化,并将不同灭菌作用时间的灭菌指示物(枯草杆菌的黑色芽胞变种――Atcc9372)在无菌环境下进行培养,检测试验微生物生长,找出细菌全部杀灭的时间临界值(最短有效灭菌时间)。
环氧乙烷验证方案及结论

第一章总则1.1目的根据GB 18279-2000(《医疗器械环氧乙烷灭菌确认和常规控制》)的要求,对环氧乙烷灭菌器及灭菌工艺进行有效性确认(验证),以保证满足一次性医疗器械无菌的要求。
1.2 范围本验证方案仅适用于环氧乙烷灭菌器及灭菌工艺的验证(确认)。
1.3 验证1.3.1 验证(确认)方案:验证(确认)方案制定后,经管理者代表确认后,方可实施。
1.3.2 验证(确认)实施:由职能部门的人员(人员资质见附件1)组成验证(确认)小组,并负责按照验证(确认)方案组织实施环氧乙烷灭菌器及灭菌工艺的验证(确认);供方可派技术人员提供协助。
1.3.3 验证(确认)结论:应由双方人员共同对验证(确认)的过程和所取得的数据进行确认,形成验证结论并会签。
1.3.4 验证(确认)资料:所有有关验证(确认)的资料、所取得的数据、表单和验证(确认)报告应妥善保管、存档。
1.4 再验证(确认)1.4.1 再验证(确认)的条件当发生以下情况时,应进行再验证(确认):(1)当引入新产品或产品的结构、材料发生变化时;(2)当产品的包装型式、包装材料发生变化时;(3)当灭菌室内负载的装载方式发生变化时;(4)当灭菌工艺发生变化时;(5)灭菌器大修后或连续出现灭菌质量事故(灭菌不合格)时;(6)正常情况下,应至少每年进行一次再验证(确认);1.4.2 再验证(确认)的组织实施1.4.2.1 再验证(确认)申请当需要进行再验证(确认)时,由生产部提出申请,报请管理者代表批准。
1.4.2.2 再验证(确认)方案的制定管理者代表批准再验证(确认)申请后,应指定技术部制定再验证(确认)方案,经管理者代表确认后方可组织实施。
1.4.2.3再验证(确认)的组织实施由生产部、技术部、质管部、灭菌间等相关部门的人员组成验证(确认)小组,按照再验证(确认)方案组织实施验证。
1.4.3 再验证(确认)结论的确认验证(确认)小组负责对验证(确认)的过程和所取得的数据进行确认、形成验证(确认)结论并会签。
环氧乙烷灭菌柜验证方案(ISO11135-2007灭菌器验证)

HMG-C型环氧乙烷灭菌柜验证方案(25m3设备编号:)1.目的:通过一年的运行,对灭菌柜进行重新确认,以确保灭菌工艺参数的正确以及符合新标准的规定。
2.验证依据:ISO11135:2007(医疗器械的灭菌-环氧乙烷的验证和日常控制)3.验证所需设备更改:灭菌确认中的设备确认和物理性能确认必须要用到温、湿度记录仪(或称传感器),在国内绝大多数是由灭菌柜生产厂家提供的有线型,它的缺点是精度差、使用极不方便(无法在加入ETO后使用),只有温度记录或只有湿度记录,最重要的是它体积长且带线,无法装入到小包装内部,而按ISO11135标准中规定的要求是:对确认灭菌作用时期负载内部温、湿度的分布情况,即,我们要的是真正的产品内部温、湿度的分布情况。
而以往传统用的温、湿度传感器只能置于产品的外部,最多置于外包装箱内,因此,严格来讲是不符合标准要求的。
还有一种是国外的温、湿度记录仪,如,美国Madge Tech 的RHTemp1000IS。
它的优点是精度高,可以在加入ETO气体后使用,同时能记录温度和湿度。
但同样它的最大缺点也是体积较大(长约20cm,直径2cm),无法置入产品内部,且与PC相连,一次只能读取一个数据,很不方便。
2008年5月我们采用了美国iBtton 温、湿度记录仪,精度高,温度精度为0.0625℃,湿度精度为0.04%RH。
体积极小,比1角钱硬币直径还略小,厚度仅为5.7mm,甚至可以放入输液器滴斗内或5ml注射器内部。
与读卡器、软件配合使用,一次能放置4个。
本安型,耐ETO气体灭菌。
因此,通过该设备,我们可以真正掌握产品内部的温、湿度分布情况。
4.验证日期:5.具体人员分工::负责制定灭菌重新验证方案、组织协调灭菌验证工作、验证工作汇总:负责设备的维修、检测:负责设备的具体操作和运行:负责仪表、测量设备的维护、验证的实施:负责生物指示物的检测6.验证项目:6.1 IQ确认(安装确认)目的:重新确认灭菌设备及其辅助系统的安装符合设备规格及设计规范.6.1.1 应具备设备,辅助系统及设计规范的确认说明书(若重新验证时,则不再进行确认)6.1.2应确认和制定灭菌设备及辅助设备系统的清单。
环氧乙烷灭菌过程确认验证计划和实施方案
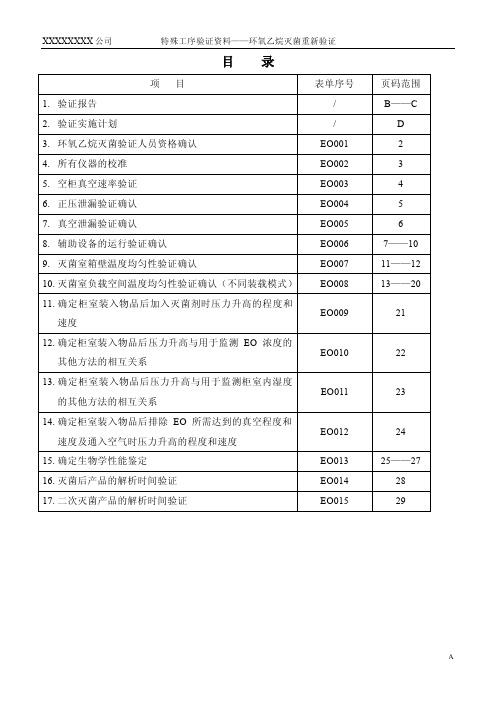
目录环氧乙烷灭菌工艺验证实施计划环氧乙烷重新灭菌过程确认实施方案一、验证目的:1.环氧乙烷灭菌器年度灭菌工艺验证,确认目前的灭菌设备及灭菌工艺符合产品的要求。
2.对产品灭菌工艺进行周期验证确认,确认灭菌常规控制相关文件。
3.提高了环氧灭菌浓度后的半周期验证4.提高了环氧灭菌浓度后的环氧乙烷残留量验证二、验证小组人员组成:1.组长:2.组员:三、验证依据GB18279-2000 医疗器械环氧乙烷来菌确认与常规控制GB18282-2000 医疗保健产品灭菌化学指示物GB18281.1-2000 环氧乙烷灭菌用生物指示物GB/T19633-2005 最终灭菌医疗器械的包装四、验证产品名称:1.一次性使用xxxx2..一次性使用xxxx;3.一次性使用xxxx;4.一次性使用xxxx;5.一次性使用XXXX;五、验证过程(一)验证对象我公司现有10m3环氧乙烷灭菌器—台,灭菌器的使用状态良好,灭菌工艺也是多年来的成熟工艺。
为了完成这次的工艺验证计划,我们依据GB18279-2000《医疗器械环氧乙烷确认与常规控制》的要求,按以下验证方案进行验证。
(二)人员分工1.验证前准备、灭菌工艺的确定验证:2.灭菌器运行验证:;3.灭菌验证过程的操作:4.灭菌过程验证中物理性能、生物性能、试验鉴定:;5.验证过程中的审核:6.验证报告、作业文件的批准:7.重新验证方案及验证数据1.环氧乙烷灭菌验证人员资格确认2.所有仪器的校准3.空柜真空速率确认4.正压泄漏验证确认5.真空速率及泄漏验证确认6.8.灭菌室负载空间温度均匀性验证灭菌室负载温度均匀性试验确认表(装载模式一)灭菌室负载温度均匀性试验布点示意图(装载模式一)装载模式一图灭菌室负载温度均匀性试验确认表(装载模式二)灭菌室负载温度均匀性试验布点示意图(装载模式二)EO 008-4装载模式2图灭菌室负载温度均匀性试验确认表(装载模式三)灭菌室负载温度均匀性试验布点示意图(装载模式三)EO 008-6装载模式3图灭菌室负载温度均匀性试验确认表(装载模式四)灭菌室负载温度均匀性试验布点示意图(装载模式四)装载模式4图9.确定柜室装入物品后加入灭菌剂时压力升高的程度和速度10.11.12.确定柜室装入物品后排除EO所需达到的真空程度和速度及通入空气时压力升高的程度和速度(三次)13.灭菌工艺确认生物指示物布点图验证布点14.灭菌后产品的解析时间验证15.二次灭菌产品的解析时间验证附图:装载模式一附图:装载模式二附图:装载模式三附图:装载模式四1。
无菌医疗器械环氧乙烷灭菌的验证方法

无菌医疗器械环氧乙烷灭菌的验证方法【作 者】朱瑞银 陆蓓 何忠平 金华市食品药品检验所(金华 321000)【内容提要】环氧乙烷灭菌是目前多数无菌医疗器械生产企业采用的灭菌方法。
本文介绍了环氧乙烷灭菌的原理及验证方法。
【关键词】医疗器械 环氧乙烷灭菌 验证方法Validation method of Ethylene Oxide Sterilization forSterile Medical Device【Writer 】ZHU Rui-yin, LU Bei, HE Zhong-ping Jinhua Institute for Food and Drug Control (Jinhua321000)【Abstract 】Ethylene oxide sterilization is a sterilization method for numerous manufacturers of sterile medical device adopted at present. This article introduces the principle andvalidation method of ethylene oxide sterilization.【Key words】Medical Device, Ethylene Oxide Sterilization, Validation Method1 概述无菌医疗器械是指产品上无存活微生物的医疗器械,当医疗器械必须以无菌形式供应时,应使用一切可行的手段对医疗器械上的存活微生物进行灭活,以达到无菌要求。
有关研究表明,微生物灭活近似于一个指数关系,这就意味着无论灭菌程度如何,微生物总是难免以一个有限概率存活下来,这种存活概率由微生物的数量、抵抗力以及在灭菌过程中微生物所处的环境所决定。
所谓“无菌”是指微生物存活概率低于10-6,这是公认的无菌保证水平(Sterile Assurance Level,简称SAL)。
医疗器械-包装灭菌验证-输液器-环氧乙烷灭菌-验证方案

HDX-20环氧乙烷灭菌验证方案文件编号:受控状态:编制/日期:审核/日期:批准/日期:一、目的:根据ISO11135-1:2007标准《医疗器械环氧乙烷灭菌确认和常规控制》对我公司的HDX-20环氧乙烷灭菌器(CE标准)和产品的灭菌工艺按照规定验证方案进行有效性验证,以保证满足一次性医疗器械无菌的要求。
二、验证准备:(二)、确认时间:(三)、确认依据:a、ISO11135-1:2007 Sterilization of health care products-Ethylene oxide-Part 1: Requirements for development,validation androutine control of a sterilization process for medicaldevicesb、EN1422:1998 Sterilizers for medical purposes-Ethylene oxide sterilizers- Requirements and test methodsc、GB18281.2-2000医疗保健产品灭菌、化学指示物;d、GB18281.1-2000环氧乙烷灭菌用生物指示物;e、ISO11607《最终灭菌医疗器械包装》;(四)、产品确认:1.名称:一次性使用无菌注射器36箱:一次性使用无菌注射器主要配置:外套、芯杆、胶塞、注射针。
一次性使用无菌注射器单包装为纸塑包装袋或PE袋,中包装为纸箱,大包装为瓦楞纸箱。
一次性使用输液器38箱:一次性使用输液器主要配置:护针套、插瓶针、药液过虑网。
滴瓶、导管、注射件、注射针。
一次性使用输液器单包装为PE带透析纸包装袋,中包装为PE袋加孔或纸箱,大包装为瓦楞纸箱。
一次性使用尿袋36箱一次性使用尿袋主要由袋体、联接器、联接器护帽、排放阀等构成,袋体为软PVC 膜。
一次性使用尿袋单包为纸塑包装,中包为PE袋加孔或纸箱,大包装为瓦楞纸箱2.产品适合EO灭菌:1)一次性使用无菌注射器产品设计方面a.公司内部自检,产品经EO灭菌后,物理性能、化学性能、EO残留量达到标准要求。
3产品环氧乙烷灭菌验证方案

3产品环氧乙烷灭菌验证方案一、背景介绍环氧乙烷(EO)灭菌是一种常见的灭菌方法,广泛用于医疗保健行业。
灭菌的目的是杀灭或彻底去除产品中所有存在的微生物,确保产品的安全性和无菌状态。
灭菌验证是验证灭菌过程的有效性和可靠性的过程,以确保灭菌过程符合规定的标准和要求。
本文将介绍产品环氧乙烷灭菌验证的方案。
二、实验设计1.实验目的:验证环氧乙烷灭菌过程对产品的有效灭菌作用。
2.实验流程a.准备试验样本:从生产线上抽取一定数量的产品样本进行灭菌验证实验。
b.建立灭菌参数:根据产品特性和相关标准,确定灭菌过程中的参数,如温度、压力、湿度和时间等。
c.环境监测:在灭菌过程中,对环境条件进行实时监测,确保其符合标准要求。
d.均匀分布导致菌:在试验样本中均匀分布导致菌,以确保灭菌过程可以有效杀灭这些菌。
e.灭菌过程:将试验样本放入灭菌器中,按照设定的参数进行灭菌处理。
计数试验。
g.数据分析:根据试验结果,分析灭菌过程是否达到要求的灭菌效果。
三、实验设备和材料1.环氧乙烷灭菌器:确保能够提供适当的温度、湿度和压力等参数。
2.试验样本:符合产品特性和使用标准的样本。
3.菌液:采用符合标准的菌液进行试验。
4.菌落计数平板:用于菌落计数试验。
5.环境监测设备:用于监测灭菌过程中的环境条件。
四、实验步骤1.环境监测:在灭菌过程开始前,对环境条件进行监测,确保其符合标准要求。
2.准备试验样本:从生产线上抽取一定数量的产品样本进行实验。
3.建立灭菌参数:根据产品特性和相关标准,确定灭菌过程中的参数,如温度、压力、湿度和时间等。
4.均匀分布导致菌:将菌液均匀涂抹在试验样本上,确保样本中均匀分布导致菌。
5.灭菌过程:将试验样本放入灭菌器中,按照设定的参数进行灭菌处理。
计数试验,确定菌落数量。
7.数据分析:根据试验结果,分析灭菌过程的灭菌效果是否达到要求。
8.结论和总结:根据数据分析的结果,给出针对灭菌过程的改进建议,并总结验证过程。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
HDX-20环氧乙烷灭菌验证方案文件编号受控状态:编制/ 日期:审核/ 日期:批准/ 日期:一、 目的:根据ISO11135-1:2007标准《医疗器械 环氧乙烷灭菌确认和常规控制》对我公司的 HDX-20环氧乙烷灭菌器(CE 标准)和产品的灭菌工艺按照规定验证方案进行有效性验证, 以保证满足一次性医疗器械无菌的要求。
二、 验证准备: (一)、验证小组组成(二)、确认时间: (三八确认依据:a 、ISO11135-1:2007 Sterilization of health care products— Ethylene oxide—Part 1: Requirements for development,validationandrouti ne con trol of a sterilizati on p rocess for medical devicesEN1422:1998Sterilizers for medical purposes — Ethylene oxide sterilizers— Requireme nts and test methods医疗保健产品火菌、化学指示物; 环氧乙烷灭菌用生物指示物; ISO11607《最终灭菌医疗器械包装》 产品确认:一次性使用无菌注射器36箱:一次性使用无菌注射器主要配置:外套、芯杆、胶塞、注射针。
一次性使用无菌注射器单包装为纸塑包装袋或 PE 袋,中包装为纸箱,大包装为 瓦楞纸箱。
b 、 d 、 e 、(四八 1.名称:一次性使用输液器 38 箱:一次性使用输液器主要配置:护针套、插瓶针、药液过虑网。
滴瓶、导管、注射件、注射针。
一次性使用输液器单包装为 PE带透析纸包装袋,中包装为 PE袋加孔或纸箱,大包装为瓦楞纸箱。
一次性使用尿袋 36 箱一次性使用尿袋主要由袋体、联接器、联接器护帽、排放阀等构成,袋体为软膜。
PVC 一次性使用尿袋单包为纸塑包装,中包为 PE袋加孔或纸箱,大包装为瓦楞纸箱2.产品适合E0灭菌:1 )一次性使用无菌注射器产品设计方面a.公司内部自检,产品经E0灭菌后,物理性能、化学性能、E0残留量达到标准要求。
b.产品送国家医药管理局检验中心进行检验,产品经E0灭菌后,物理性能、化学性能、生物性能均符合标准要求。
2)一次性使用输液器产品设计方面a.公司内部自检,产品经E0灭菌后,物理性能、化学性能、E0残留量达到标准要求。
b.产品送国家医药管理局检验中心进行检验,产品经E0灭菌后,物理性能、化学性能、生物性能均符合标准要求。
3)一次性使用尿袋产品设计方面a.公司内部自检,产品经E0灭菌后,物理性能、化学性能、E0残留量达到标准要求。
b.产品送国家医药管理局检验中心进行检验,产品经E0灭菌后,物理性能、化学性能、生物性能均符合标准要求。
五)、包装确认1)包装材料描述注射器大包装为瓦楞纸箱,规格: 690mm380 mm325 m;m 中包装为纸箱,规格: 360mmX 370mX 150m;m 单包装为纸塑包装袋,注射器装入一个包装袋封口。
一个大包装含 4 个中包装,一个中包装含 400个单包装。
大包装为灭菌时包装,灭菌时单包装、中包装、大包装装箱封口。
灭菌难点为:注射器:注射针针座与外套连接处。
输液器大包装为瓦楞纸箱,规格: 660mm*380 mm*325 m ;m 中包装为PE 袋,规格:270mmX 450m单包装为纸塑包装袋,输液器装入一个包装袋封口。
一个大包装含 20 中包装,一个中包装含 30 个单包装。
大包装为灭菌时包装,灭 菌时单包装、中包装、大包装装箱封口。
灭菌难点为:输液器:滴斗内部及产品导管加长后 6:100 与护帽的连接处。
一次性尿袋的大包装为瓦楞纸箱,规格为 690mm*380mm*325mm 中包装为PE 袋,规格为270mm X 380mm一个大包装装 20个中包,一个中包内装 10个单包。
大包装为灭菌时包装,灭菌 时单包装、中包装、大包装装箱封口。
灭菌难点为:尿袋管路内部及袋体内部。
(2)、包装灭菌后性能a ) 包装材料适合EO 灭菌 单包装的一面为高分子材料,隔绝性好,另一面带透析窗,气体可以自由穿透,微粒和粉尘不能穿过,适合于 EO 灭菌。
经检验EO 灭菌后可保证产品无菌。
b ) 包装材料经灭菌后化学性能符合要求。
c ) 包装经灭菌后,油墨无渗透、扩散,印刷颜色无明显变化,字体、图案清晰, 印刷不会产生不良影响。
d ) e ) f ) j )(六) 、灭菌负载产品放置形式: (灭菌器柜体规格:内腔容积 20M 3) 一次性使用无菌注射器产品放置 36箱大包装.一次性使用一次性使用输液器放 置38箱,一次性使用尿袋产品放置 36箱。
共 5个托盘车,每车 22箱,共 110箱, 三种产品随意分布,容量为灭菌器总容积的 70%。
装载图见附二《灭菌装载模式图》 (七) 、灭菌器生产厂家 : 杭州电达消毒设备厂 型号: hdx-20 规格: 内腔容积 20 M 3 制造编号: 08-20-16安全分类:I 类B 型三、 安装验证 : 灭菌器的安装环境、设备安装、辅助设备、电器控制系统、计算机系统的安装符合 EN1422标准,应进行安装验证。
相关文件资料见附件 18、19、20、21、22、23、24、25 等相关文件 四、 试运行 :包装经EO 灭菌后密封性和封口强度达到标准要求。
包装在-30Kpa 的压力环境下保证包装完好。
包装经EO 灭菌后密封性能完好包装经EO 灭菌后密封性能在有效期内不自然破坏目的:通过试运行证明设备符合规范要求确认内容:1、所有计量器具应进行校验。
2、灭菌器设备:真空泵、气泵、循环泵、气化装置、加热系统及各控制开关指示灯在接通电源后试运行,按照其各有关工作特点,通过反复运转和过程测试,应达到正常状态。
3、电器控制系统:包括加热系统、压力系统、气化系统在加热(水箱)、温度、灭菌湿度、灭菌压力名显示仪表控制准确、可靠。
4、报警系统:超高温、超高压、计时器报警装置经测试、灵敏、正确、有效。
5、微电脑控制、打印机经过改变参数的试验都达到预期功能。
五、空载情况下的运行1、真空速率验证真空度到一35KPa真空速率为min。
2、真空泄漏验证在—50KPa的条件下,保压60min后,泄漏速率应w min。
3、正压泄漏验证在+50KPa的条件下,保压60min后,泄漏速率应w min。
4、湿度验证通过加湿装置对灭菌柜内进行加湿,使柜内在加药前湿度有保证。
5、箱壁温度均匀性验证在温度设定为52 r,常压状态下,在灭菌器柜壁上布置 25根温度传感器进行测试,验证标准中各测点之间的最大温差±w 3C的要求。
见附件四《灭菌柜壁温度传感器均匀分布图》6、空间温度均匀性验证在温度设定为52r,常压状态下,在灭菌器空间距柜壁 10CM处布置25根温度传感器进行测试,验证标准中各测点之间的最大温差应±w3r的要求。
7、负载温度均匀性验证在温度设定为52r,常驻压状态下,在灭菌器空间内布置 25根温度传感器放进包装内进行测试,验证标准中各测点之间的最大温差应w I0r的要求。
8、灭菌器通风验证在一定的温度下,抽空后进入经过过滤的空气,如此反复换气次数以减少物品中 EO 的残留量,产品包装应完好。
六、微生物性能验证 :对环氧乙烷灭菌设备在灭菌周期中的灭菌工艺及灭菌过程的有效性进行确认。
根据£011135-1:2007标准,在进行微生物性能确认时,采用对环氧乙烷具有较强耐药性的枯草杆菌的黑色芽胞变种(Atcc9372 )作为灭菌指示物,其原始微生物含量为 X 106 cfu ;在预热阶段开始前,按均匀分布原则,将 40片灭菌指示物用透析纸单个包装后装进注射针针座与外套连接处,再用装进透析纸包装袋内封口。
本公司所使用菌片是:北京紫光四环生物科技发展有限公司生产经检验合格的枯草杆菌的黑色芽胞变种(Atcc9372 ),(检验报告见附件35)根据灭菌负载的产品构造、包装形式及其在灭菌器内的分布方式,设定微生物性能确认时的相关灭菌工艺参数如下:(以下参数是按照本公司多年来灭菌经验设定)七、重复灭菌对产品的影响根据设定的参数,对产品进行重复灭菌一次,并对产品进行检验。
八、验证结论:所有的确认试验均已完成,灭菌参数能达到预期效果,此次确认结果将被作为日常灭菌工艺参数,我们进入了文件化的程序操作,包括设备的日常维护和核准。
九、复审和重新确认的规定:1.确认和重新确认参数,每年复审一次;2.再验证的条件:当发生以下情况时,应进行再验证:a. b. c. d. e. 当引入新产品或产品结构,材料发生变化时; 当产品的包装型式,包装材料发生变化时; 当灭菌室内负载的装载模式发生变化时; 当灭菌工艺发生变化时; 灭菌器大修后或连续出现灭菌质量事故(灭菌不合格)时; 3.再验证的组织实施; 各职能部门经培训合格的人员组成验证小组,按验证方案组织验证; 验证小组负责对验证过程和所取得的数据进行分析,形成结论并会签; 所有再验证资料应由质管部存档,妥善保管; 重新确认验证后,改变的参数,要贯彻落实,包括操作人员的培训。
a. b. c. d.。
