元素化合物之间的相互转化
元素化合物知识

1.氯气及其化合物相互转化关系(1)铁与氯气:H:3Cl2+2Fe 2FeCl3 (固体是红棕色,溶液为黄色)(2)氯气通入水中:L:Cl2+H2O==H++Cl–+ HClO(3)氯气尾气吸收:L:Cl2+2OH–=Cl–+ClO–+H2O(4)氯气通入溴化亚铁溶液中:2Fe2++4Br-+3Cl2===2Fe3++2Br2+6Cl-;(足量氯气)2Fe2++2Br-+2Cl2===2Fe3++Br2+4Cl- (1:1)(5)氯气通入碘化亚铁溶液中:2I-+Cl2===I2+2Cl-(少量氯气);2Fe2++4I-+3Cl2===2Fe3++2I2+6Cl-(足量氯气)(6)实验室制氯气:L:4H++2Cl–+MnO2 Mn2++Cl2↑+2H2O2.硫及其化合物相互转化关系(1)铁与硫:H:S+Fe FeS (2)铜与硫:H:S+2Cu Cu2S(3)硫与氧气:H:S+O2 SO2 (4)SO2与O2:H:2SO2+O2 2SO3 (5)SO2与H2S混合:H:2H2S+SO2===3S↓+2H2O(6)SO2通入到卤水中:H:X2+SO2+2H2O===H2SO4+2HX (X2=Cl2、Br2、I2)(7)卤素单质加入到亚硫酸钠溶液中:L:SO32-+X2+H2O=2H++SO42-+2X–(X2=Cl2、Br2、I2)(8)铜与浓硫酸:H:2H2SO4(浓)+Cu CuSO4+SO2↑+2H2O(浓硫酸表现强氧化性和酸性)(9)碳与浓硫酸:H:2H2SO4(浓)+C CO2↑+2SO2↑+2H2O (浓硫酸仅表现强氧化性)3.氮及其化合物相互转化关系(1)工业合成氨:H:N2+3H2 2NH3(2)实验室制氨气:H:Ca(OH)2+2NH4Cl CaCl2+2NH3↑+2H2O(3)氨与氯化氢:H:NH3+HCl===NH4Cl (沾有浓盐酸与沾有浓氨水的玻璃棒靠近产生“白烟”)(4)氨的催化氧化:H:4NH3+5O2 4NO+6H2O(5)氯化铵分解:H:NH4Cl NH3+HCl (6)铵根离子的检验:L:NH4++OH- NH3+H2O (7)硝酸分解:H:4HNO3 4NO2↑+O2↑+2H2O (保存在棕色瓶中)(8)铜与浓硝酸:H:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O(9)铜与稀硝酸:L: 3Cu+8H++2NO3- = 3Cu2++2NO↑+4H2O(10)碳与浓硝酸:H:4HNO3(浓)+C CO2↑+4NO2↑+2H2O(11)铁与稀硝酸:L:(铁不足)4H++NO3-+Fe=Fe3++NO↑+2H2O;(铁过量)3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O4.硅及其化合物之间的相互转化关系(1)硅与氧气:H:Si(粉)+O2 SiO2 (2)工业制粗硅:H:2C+SiO2 Si+2CO(制得粗硅) (3)二氧化硅与氢氧化钠:H:SiO2+2NaOH===Na2SiO3+H2O(常温下强碱缓慢腐蚀玻璃) (4)二氧化硅与氢氟酸:H:4HF+SiO2===SiF4+2H2O(5)制玻璃:H:SiO2+Na2CO3 Na2SiO3+CO2 ;SiO2+CaCO3 CaSiO3+CO25.钠的转化关系(1)钠投入水中:L:2Na+2H2O==2Na++2OH-+H2↑。
碳硅及其重要化合物间的转化关系

碳硅及其重要化合物间的转化关系全文共四篇示例,供读者参考第一篇示例:碳硅是一种重要的元素,它们在自然界中广泛存在并且具有许多重要的化合物。
碳和硅是两种非金属元素,它们在化学性质上有一些相似之处,因此在一些化学反应中可以相互转化。
在本文中,我们将探讨碳硅及其重要化合物之间的转化关系。
让我们来看一下碳的化合物。
碳是一种非金属元素,它在自然界中存在于多种形式中,如石墨、金刚石和全新炭等。
碳在化学反应中通常以四价的形式存在,它可以与氧、氢、氮等元素形成许多不同的化合物。
碳酸盐是碳循环中的一个重要环节,它在地壳中有着广泛的存在,并且可以通过各种化学反应转化为其他碳化合物,如石灰石、煤炭等。
硅是一种具有金属性质的元素,它在自然界中存在于硅石、石英和硅酸盐等形式中。
硅与氧形成的硅酸盐是地壳中的主要组成,它们可以通过地球内部的热液作用、熔融作用等过程来形成。
硅也可以与其他元素形成许多重要化合物,如硅烷、硅酸等。
碳硅在化学性质上有一些相似之处,因此它们在一些化学反应中可以相互转化。
碳可以与硅直接反应,生成碳硅化合物,如碳化硅。
碳化硅是一种重要的半导体材料,它具有优良的导电性能和热导率,被广泛应用于电子器件、太阳能电池等领域。
碳硅材料还可以通过不同的方法制备,如化学气相沉积、烧结等。
碳硅及其重要化合物之间存在着多种转化关系,它们在材料科学、化工等领域中有着广泛的应用前景。
通过深入研究碳硅化学性质及其相互转化关系,我们可以更好地利用这些重要元素和化合物,推动科学技术的发展,实现材料的创新和应用。
希望本文能够帮助读者更深入地了解碳硅及其重要化合物之间的转化关系,激发对这一领域的兴趣和热情。
希望碳硅化学的研究能够为人类社会的可持续发展做出更大的贡献。
【2000字】。
第二篇示例:碳硅是一种重要的元素,其在自然界中的存在形式有许多,包括石墨、金刚石等,而碳硅也是一种重要的金属loid,其在化学反应中具有独特的性质和作用。
碳硅及其重要化合物间的转化关系,既包括碳硅之间的相互转化,也包括碳硅与其他元素形成的化合物之间的转化关系。
元素化合物的转化关系网络图
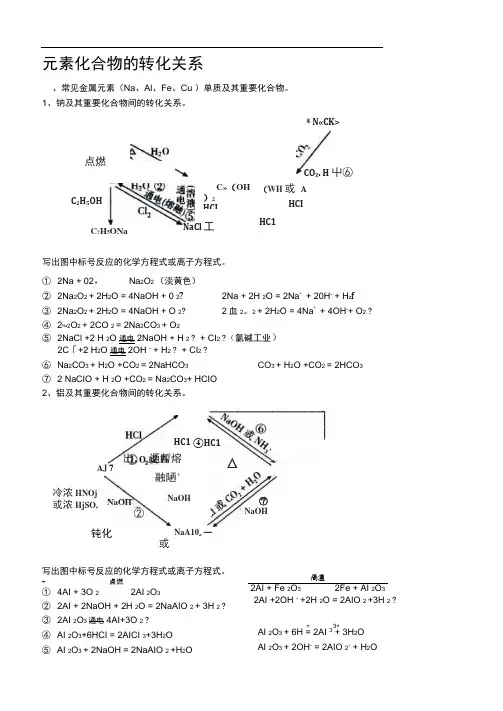
元素化合物的转化关系、常见金属元素(Na 、Al 、Fe 、Cu )单质及其重要化合物。
1、钠及其重要化合物间的转化关系。
(WH 或 AHCIHC1写出图中标号反应的化学方程式或离子方程式。
① 2Na + 02,Na 2O 2 (淡黄色)② 2Na 2O 2 + 2H 2O = 4NaOH + 0 2? 2Na + 2H 2O = 2Na ++ 20H - + H z f③ 2Na 2O 2 + 2H 2O = 4NaOH + O 2?2血2。
2 + 2H 2O = 4Na ++ 4OH -+ O 2 ?④ 2Na 2O 2 + 2CO 2 = 2Na 2CO 3 + O 2⑤ 2NaCl +2 H 2O 通电 2NaOH + H 2 ? + CI 2 ?(氯碱工业) 2C 「+2 H 2O 通电 2OH - + H 2 ? + CI 2 ? ⑥ Na 2CO 3 + H 2O +CO 2 = 2NaHCO 3CO 3 + H 2O +CO 2 = 2HCO 3⑦ 2 NaCIO + H 2O +CO 2 = Na 2CO 3+ HCIO 2、铝及其重要化合物间的转化关系。
HC1 出, 通暫熔融陋'NaOHAJ 7冷浓HNOj或浓HjSO, NaOH②钝化④HC1△NaA10a — 或 ⑦NaOH写出图中标号反应的化学方程式或离子方程式。
- 点燃 ① 4AI + 3O 2 2AI 2O 3 ② 2AI + 2NaOH + 2H 2O = 2NaAIO 2 + 3H 2 ? ③ 2AI 2O 3 通电 4AI+3O 2 ? ④ AI 2O 3+6HCI = 2AICI 3+3H 2O⑤ AI 2O 3 + 2NaOH = 2NaAIO 2 +H 2O咼温2AI + Fe 2O 3 2Fe + AI 2O 32AI +2OH - +2H 2O = 2AIO 2 +3H 2 ?+3+AI 2O 3 + 6H = 2AI 3+ 3H 2O AI 2O 3 + 2OH - = 2AIO 2- + H 2O点燃* N«CK>CO Z . H 屮⑥NaCl 工C 2H 5OHC ?H 5ONaC»(OH )2 HCIAICI 3+3NH 3 H 2O = AI(OH) 3 J + 3NH 4CI AICI3 +3NaOH = AI(OH) 3J + 3NaCI AI(OH) 3 +NaOH =NaAIO 2 +2 H 2O AI 3+ +3 AIO 2- +6H 2O = 4AI(OH) 铁及其重要化合物间的转化关系。
高中化学第7讲 常见元素及其化合物的性质及转化(教案)

第7课时 核心价值——常见元素及其化合物的性质及转化(学科本质价值)常见元素及其化合物的性质及转化是高考命题的热点,该类试题体现《化学课程标准》对“宏观辨识与微观探析”“变化观念与平衡思想”“证据推理与模型认知”等学科核素素养的要求,要求考生能从元素和原子、分子水平认识物质的组成、结构、性质和变化,形成“性质决定性质”的观念,能从宏观和微观相结合的视角分析与解决实际问题。
1.直线型转化关系A ――→XB ――→XC (1)X 为O 2Na ―→Na 2O ―→Na 2O 2N 2―→NO ―→NO 2或NH 3―→NO ―→NO 2 S ―→SO 2―→SO 3或H 2S ―→SO 2―→SO 3 C ―→CO ―→CO 2或CH 4―→CO ―→CO 2 醇―→醛―→羧酸 (2)X 为CO 2NaOH ――→CO 2Na 2CO 3――→CO 2NaHCO 3 (3)X 为强酸,如HClNaAlO 2――→HCl Al(OH)3――→HCl AlCl 3Na 2CO 3――→HClNaHCO 3――→HClCO 2 (4)X 为强碱,如NaOHAlCl 3――→NaOHAl(OH)3――→NaOHNaAlO 2 2.交叉型转化3.三角型转化4.注意反应形式与物质的关系,特别是置换反应 (1)金属―→金属:金属+盐―→盐+金属,铝热反应。
(2)金属―→非金属:活泼金属+H 2O(或H +)―→H 2,2Mg +CO 2=====点燃2MgO +C 。
(3)非金属―→非金属:2F 2+2H 2O===4HF +O 2,2C +SiO 2=====高温Si +2CO ↑,C +H 2O(g)=====高温CO +H 2,X 2+H 2S===2HX +S ↓。
(4)非金属―→金属:用H 2、C 冶炼金属。
(2020·江苏卷)下列选项所示的物质间转化均能实现的是( )A .NaCl(aq)――→电解Cl 2(g)――→石灰水漂白粉(s)B .NaCl(aq)――→CO 2(g )NaHCO 3(s)――→加热Na 2CO 3(s)C .NaBr(aq)――→Cl 2(g )Br 2(aq)――→NaI (aq )I 2(aq)D .Mg(OH)2(s)――→HCl (aq )MgCl 2(aq)――→电解Mg(s)C [由Cl 2制备漂白粉应通入石灰乳而不是石灰水中,A 项错误。
元素化合物之间的相互转化

元素化合物之间的相互转化元素化合物之间的相互转化是化学反应的基本过程。
化学反应是指两种或多种物质在一定条件下发生物理和化学性质的变化,而生成新的物质。
这些化学反应可以分为各种类型,例如加和反应、分解反应、置换反应、还原反应等。
下面将对一些常见的元素化合物相互转化反应进行详细介绍。
1.加和反应:两个或多个物质结合在一起形成新的化合物。
例如氧气与氢气加和反应生成水:2H2+O2-->2H2O。
这是一种常见的合成水的方法,也被称为氢气与氧气的燃烧反应。
2.分解反应:化合物分解为两个或多个物质。
例如烧碱(氢氧化钠)分解为氢氧化钠和氢氧化钾:2NaOH-->NaOH+KOH。
这是一种通常用于制备其他化合物或纯化物质的方法。
3.置换反应:一个元素取代另一个化合物中的元素,生成新的化合物。
例如金属铁和盐酸发生置换反应生成铁盐和氢气:Fe+2HCl-->FeCl2+H2、这是一种常见的金属与酸反应的情况。
4.氧化还原反应:涉及到电子转移的化学反应。
氧化反应是指一个物质失去电子,还原反应是指一个物质获得电子。
例如氯气和亚硫酸钠发生氧化还原反应生成次氯酸钠和硫酸钠:Na2S2O3+2Cl2-->2NaCl+SO2+H2O。
这是一种常见的氧化剂和还原剂反应的情况。
上述反应只是化学反应中的一部分示例,实际上还有很多其他类型的反应。
在化学反应中,元素化合物之间的相互转化是通过破坏和重组化学键来实现的。
化学键的形成和断裂是化学反应发生的关键步骤。
化学反应的发生需要满足一定的条件,例如适当的温度、压力、反应物的摩尔比等。
此外,还可能需要使用催化剂来促进反应的发生或加速反应速率。
总结起来,元素化合物之间的相互转化是化学反应的基本过程。
这些反应包括加和反应、分解反应、置换反应和氧化还原反应等。
化学反应的发生需要满足一定的条件,并且常常涉及到化学键的形成和断裂。
镁和锌的置换反应

镁和锌是两种常见的金属元素,它们可以通过置换反应来相互转化。
置换反应是一种化学反应,在这种反应中,两种元素或化合物在分子水平上相互交换位置,并生成新的化合物。
镁和锌之间的置换反应可以通过加热完成,具体方法如下:
1 准备镁和锌的溶液。
可以使用镁粉末或镁锭加水溶解得到镁溶
液,使用锌粉末或锌锭加水溶解得到锌溶液。
2 将镁溶液和锌溶液分别倒入两个独立的容器中。
3 将镁溶液加热至60-70°C,将锌溶液加热至80-90°C。
4 将加热后的镁溶液倒入锌溶液中,将加热后的锌溶液倒入镁溶液
中。
5 观察反应过程,等待反应完成。
在反应过程中,镁和锌会在分子水平上相互交换位置,并生成新的化合物。
反应完成后,可以使用化学分析方法来确定新的化合物中镁和锌的含量。
总镁和锌之间的置换反应可以通过加热来完成,并生成新的化合物。
这种反应可以用于研究镁和锌的化学性质,也可以用于制造新的化合物。
在实际应用中,镁和锌之间的置换反应还有许多其他应用。
例如,可以使用这种反应来制造新的镁合金或锌合金,并利用新合金的性质来改善产品的质量。
另外,镁和锌之间的置换反应还可以用于生物化学研究。
例如,研究人员可以使用这种反应来研究镁和锌在生物体内的代谢过程,并为解决生物医学问题提供有价值的信息。
总之,镁和锌之间的置换反应是一种有用的化学反应,可以用于许多不同的应用领域。
铁及其化合物之间的转化关系-PPT课件
探究1
探究2
素养脉络
随堂检测
知识归纳 (1)若溶液中只存在Fe2+,加入氢氧化钠溶液,溶液中出现白色沉 淀并迅速变成灰绿色,最后变成红褐色。若同时存在Fe3+,加入氢 氧化钠溶液生成红褐色沉淀,会掩盖Fe2+的检验。故溶液中有 Fe2+和Fe3+同时存在时不能用氢氧化钠溶液检验Fe2+。 (2)检验某未知溶液中是否含Fe2+时,不能先滴加氯水,后滴加 KSCN溶液。因为若未知溶液中含有Fe3+,滴加KSCN溶液时,溶液 变成红色,会干扰Fe2+的检验。
探究1
探究2
素养脉络
随堂检测
(4)Fe3+→Fe2+:加还原剂,如 Fe、Cu、I-等。Fe+2Fe3+ 3Fe2+,Cu+2Fe3+ Cu2++2Fe2+,2Fe3++2I- 2Fe2++I2。
(5)Fe2+→Fe:加强还原剂,如 Zn、Al、C、CO 等。Zn+Fe2+
Zn2++Fe,CO+FeO Fe+CO2。
知识铺垫
新知预习
自主测试
2.补铁剂中铁元素价态的检验 (1)Fe3+的检验方法很多,但在没有特殊要求的条件下,最好选择 KSCN溶液,此法灵敏且现象明显。 (2)检验Fe2+的最好方法是加KSCN溶液(无明显现象),然后加氯 水(溶液变红色)。 【微思考1】如何检验某铁的氧化物中含有Fe2+? 提示:取少量固体置于试管中,向其中加入稀盐酸配制成溶液,加 入酸性高锰酸钾溶液,高锰酸钾溶液褪色,证明氧化物中含有Fe2+。 【微思考2】碱性氧化物是否都能与水反应生成相应的碱?FeO 与硝酸(具有强氧化性)反应是氧化还原反应吗? 提示:碱性氧化物不一定都能溶于水与水反应,如FeO、Fe2O3都 难溶于水,与水不反应,因此不能与水反应生成相应的碱。FeO具有 还原性,与硝酸反应生成硝酸铁和氮的氧化物,属于氧化还原反应。
非金属元素及其重要化合物之间的相互转化关系
-2-2-2-22Cl Br 2Br Cl 2Cl I 2I Cl )1(+→++→+O8H 5Cl 2KCl 2MnCl 16HCl 2KMnO O2H Cl MnCl )4HCl(Conc.MnO2 (2)2224222Δ+↑++→++↑+−→−+O2H CaCl Ca(ClO)2Ca(OH)2Cl OH NaClO NaCl 2NaOH Cl (3)222222Cold 2++→+++−−→−+O 3H 5KCl KClO KOH 63Cl )4(23Δ2++−→−+2KCl KClO KClO 3 )5(3OH Δ,-+−−→−O 2H CaCl 2Cl 4HCl Ca(ClO) )6(2222++→+ 2KCl KClO KClO 3 )7(3OHΔ,-+−−→− KCl 3KClO KClO 4 )8(43+→溴及其重要化合物之间的相互转化关系:2Br I 2I Br )1(-2-2+→+ -22-2Cl Br Cl Br 2 (2)+→+O 2H Br S O 2NaHS O (Conc.)S O 3H 2NaBr 2224Δ42+++−→−+ O H NaBrO KBr 2KOH Br (3)2Cold 2++−−→−+O 3H 5KBr KBrO KOH 63Br )4(23Δ2++−→−+2KBr KBrO KBrO 3 )5(3OH Δ,-+−−→−O H 2KCl Br 2HCl KBr KBrO )6(22++→++ 2KBr KBrO KBrO 3 )7(3OHΔ,-+−−→−Xe2HF BrO O H XeF BrO OH 2F BrO 2OH F BrO (8)--2--4-2-3++→++++→++2Br I 2I Br 2Cl I 2I Cl )1(-2-2-2-2+→++→+2NaI O S Na O S 2Na I (2)6423222+→+HIO HI O H I (3)-O HCold,22+−−−→−+O 3H 5KBr KIO KOH 63I )4(23Δ2++−→−+O3H 3I 6H 5I IO OH 3H 5SO I 5HSO 2IO )5(22--3224233+→+++++→+++--- O 3H 2Cl IO Cl 6OH IO )6(2562--3++→++--O 7H 5IO 2MnO 14H 5IO Mn 2 (7)2-3-4-562++→++++↑+−−−−→−O 4H 2HIO IO H 2 (8)24373Kvacuum,65↑+↑−→−++↑−→−+HCl NH Cl NH OH NaCl NH NaOH Cl (1)NH 3Δ423Δ4 3HClO NH O 3H NCl (2)323+↑=+3773K ~673 atalyst,c 700atm,~300222NH 3H N (3)−−−−−−−−→−+ O6H 2N 3O 4NH O3H N 3Cu 3CuO 2NH (4)2223223+=+++=+O 6H 4NO 5O 4NH (5)2800KPt,23+−−→−+↑+−→−++↑+−→−+5NO PO 3H O 2H 5HNO 3P 2NO SO H 2HNO S (6)43boil2342boil 3 22NO 2O 2NO (7)=+O2H O 4NO 4HNO O2H 2NO )Cu(NO Cu 4HNO (8)222322233+↑+↑−→−+↑+=+∆O 5H O N )4Zn(NO 4Zn (dilute)10HNO (9)22233+↑+=+↑+−→−22Δ3O 2NaNO 2NaNO (10) O 3H 5NO 2Mn 6H 5NO 2MnO (11)2322-4++=++-++- O 2H I 2NO 4H 2I 2NO (12)222++↑=+++-- O H NaCl H N NaOCl 2NH (13)2423++=+ O H NaNO NaOH HNO (14)233+=+↑+−→−+342Δ4232HNO S O Na S O H 2NaNO (15) 3433NO NH (aq)NH HNO (16)=+ O 2H O N NO NH (17)22Δ34+↑−→−↑+=+++S H Fe 2H FeS (1)22S H S H (2)2Δ2−→−+S2HI I S H 2SO 2H O S H 2 (3)22222+=++=+2773K铝矾土,22CO S 2CO S O (4)+−−−−→−+22SO O S (5)=+3O V 222S O O 2S O (6)52−−→−+5223O P 5S O 2P 5S O (7)+=+ O H S O Na 2NaOH S O (8)2423+=+ 2NaCl S H 2HCl S Na (9)22+↑=+x x S Na S )1(S Na (10)2Boil 2−→−-+ 3222S nS Na S nS S Na (11)=+O 3H 3S 6H 2S S O (12)22-23+↓=+++-62SF 3F S (13)=+O 2H S 3SO 4H O 2S (14)22-242+↓+↑=++3222S O H O H S O (16)=+O H NaHS O NaOH S O H (17)2332+=+2422Δ3Zn(OH)O S Na Zn 2NaHS O (18)+−→−+ O H S O 2H S O (19)22-23+↑=++O H S O Na 2NaOH S O (20)2322+=+ 2Hg O S Na 2SO 2Na[Hg] (21)4222+=+322Boil 32O S Na S S O Na (22)−→−+NaX ])O [Ag(S Na AgX O S 2Na (23)2323322+=+ NaI 2O S Na I O S 2Na (24)6422322+=+O 2H 2S O CO C (conc.)S O 2H (25)22242+↑+↑=+ 8HBr SO H O 4H 4Br S H (26)42222+=++O 4H 4I S H 8KHS O 8KI (conc.)S O 9H (27)222442+↓+↑+=+ 4223S O H O H S O (28)=+722423O S H (Conc.)S O H S O (29)=+ 422722SO 2H O H O S H (30)=+O H NaHSO NaOH SO H (31)2442+=+ 4442424HSO NH 2SO H SO )(NH (32)=+↑++−−→−+-++22824电解-44H O S 2NH 2HS O 2NH (33) 2242Cold 25242522282O H SO H O H SO H SO H SO H O H 2H O (34)S +−−→−++=+++-O H SO Na NaOH (35)NaHSO 2424+=+2HClSO Na O H Cl SO Na SO 2Na O SO (36)2Na 42223242232+=++=+6HCl 2NaCl SO 2H O 5H 4Cl O S (37)Na 4222322++=++64点燃24O P )不足(O 3P (1)−−→−+ 104点燃24O P )充足(O 5P (2)−−→−+22324PO 3KH PH O 3H 3KOH P (3)+↑=++3点燃244PCl )不足(Cl 6P (4)−−→−+5点燃24PCl 4)充足(Cl 10P (5)−−→−+ 3HCl PO H O 3H PCl (6)3323+=+ 33264PO 4H O 6H O P (7)=+ 321044HPO O 2H O P (8)=+ 72423O P H O H 2HPO (9)=+ O H 2HPO O P H (10)23724+= 432724PO 2H O H O P H (11)=+ O H O P H PO 2H (12)272443+= 5HCl PO H O 4H PCl (13)4325+=+2S CCl 2Cl CS (1)4FeS340K ,22+−−−→−+21170K CS 2S C (2)−−→−+2CO O 2C (3)不完全燃烧2−−−→−+O H Cu(CO)Cl O H CuCl CO (4)2盐酸溶液2⋅−−−→−++ CO CaC CaO 3C (5)22273K +−−→−+4高压Ni(CO))粉Ni(4CO (6)−−→−+ Ni 4CO Ni(CO) (7)593K ~5134+↑−−−→−C 2MgO 2Mg CO (8)点燃2+−−→−+2完全燃烧2CO O C (9)−−−→−+2CO C CO (10)高温2−−→−+ 2点燃22CO O 2CO (11)−−→−+O H CO CaCO )Ca(HCO (12)223Δ23+↑+↓−→−23223)Ca(HCO O H CO CaCO (13)=++2煅烧3CO CaO CaCO (14)+−−→− O H CaCO Ca(OH)CO (15)2322+↓=+ 32NaHCO NaOH CO (16)=+O H CO CO Na NaHCO 2 (17)2232Δ3+↑+−→−↑+=++23222H S iO Na O H 2NaOH S i (1)4773K~7232S iCl 2Cl S i (2)−−−→−+↑+−−−→−+4HCl )纯S i(2H S iCl (3)1453K ~137324O 8H 4NO S iF 3H 18HF 4HNO S i (4)2623+↑+=++ 624424S iF 2H S iO H O H 43S iF (5)+=+3444AlCl LiCl S iH LiAlH S iCl (6)+↑+=+ ↑+−−→−+2CO S i 2C S iO (7)3273228732SiO O Si (8)−→−+O 2H S iF H 6HF(aq)S iO (9)2622+=+ O 2H S iF 4HF S iO (10)242+↑=+O H S iO Na )浓2NaOH(S iO (11)232Δ2+−→−+322348HNO S iO 8Ag O 2H 8AgNO S iH (12)+↓+↓=++ 2NaCl 2NH S iO H Cl 2NH SiO (13)Na 332432+↑+↓=+ O H S iO S iO (14)H 2232+−→−∆ 2MgO S i Mg 4Mg (15)S iO 2灼烧2+−−→−+32973K 2O 2B 3O (1)4B −−→−+3MgO 2B 3Mg O (2)B 32+−→−+∆ 33232BO 2H O(l)3H O (3)B =+O 3H O B BO (4)2H 23233+−→−∆O 7H O B Na 9)2NaOH(pHBO (5)4H 274233+=<+ 2NaCl BO 4H O 5H 2HCl O B (6)Na 332742+=++(7) H 3BO 3+ 2 HCOH = HCCOH H 2COHH 2OCOH H 2C H 2BOO O CH 2CH 2OH -+ H + + 3H 2O+-+=+H B(OH)O H BO (8)4H 4233O 3H B(OR)3ROH BO (9)H 23S O 浓H 3342+−−−→−+3573K 22BCl 3Cl (10)2B −−→−+3CO 2BCl 3C 3Cl O (11)B 3773K 232+−−→−++> O 3H 3CaS O 2BF S O 3H 3CaF O (12)B 24342232++−→−++∆ O(g)3H O B 3O H (13)B 232262+=+ 433233HBF BO H O 3H (14)4BF +=+ 6243H B 6LiBF 6LiH (15)8BF +=+ 2332626H BO 2H O 6H H (16)B +=+ 3HCl BO H O 3H (17)BCl 3323+=+ O 3H )Co(BO CoO BO (18)2H 22233+=+ 2227422NaBO )Co(BO CoO O B (19)Na ⋅=+ 6HCl (l)2BCl 6Cl H (20)B 3262+=+-4232362BH ])(NH [BH 2NH H (21)B +⋅=+。
物质的分类及转化
物质的分类及转化
物质转化是化学中极为重要的概念,其概念涉及物质的分类和相互转化。
该领域关乎大量的科学研究及社会管理,对于高校和高等教育具有深远的影响。
物质的分类
按照物质的组成及内部结构,物质可以分为三类:化合物、元素和混合物。
化合物是由原子组成,其内部结构受到化学键的控制,特性会因组成元素的不同而有所不同,比如水和乙醇就是两种不同的化合物;元素就是单独的组分,它们的内部结构不受外界的改变,它们的特性由其本身决定,比如氢、氧和铁都是元素;混合物就是由两种或更多的组分混合在一起的物质,它的内部结构受外界的改变,它的特性由其本身决定,但它由于混合,而呈现出特有的特性,比如混合气体、混合液体和混合固体都是由多种物质混合而成的混合物。
物质的转化
物质不仅可以分类,在高校和高等教育中,也要求学生掌握物质的转化知识。
物质的转化包括四种基本形式:化学转化、物理转化、核转化和生物转化。
化学转化是指两种物质之间在反应条件下相互转化,其中包括几类转化:分解反应、复分解反应、合成反应、氧化还原反应等;物理转化是指物质在物理作用下,改变形态和性质,但不改变其化学组成,常见的物理转化有渗透、冻结、沸腾和熔融等;核转化是指破坏原子核的稳定性而发生的核反应,常见的核转化有核衰变和核裂变等;生物转化是指物质在生物的影响下,发生的生化反应,典型的例子是光合作用,在其中物质能够实现从光合电子传递和产生氧化还原反应。
物质转化为高校和高等教育产生了重要影响,当学生能够掌握并利用物质的分类和转化时,能够更好地理解生活中的化学现象,从而获得更多的学科知识。
化学反应中单质与化合物的相互转化
化学反应中单质与化合物的相互转化化学反应是物质之间发生变化的过程,其中单质与化合物的相互转化是化学反应中常见的现象。
单质是由同一种元素组成的纯净物质,而化合物则是由两种或更多种元素组成的物质。
在化学反应中,单质和化合物之间的相互转化可以通过不同的反应类型实现。
一种常见的单质与化合物的相互转化是氧化还原反应。
氧化还原反应是指物质失去或获得电子的过程。
在这类反应中,单质可以被氧化或还原为化合物。
例如,氢气可以与氧气发生反应,生成水。
这是一种氧化还原反应,其中氢气被氧化为水,而氧气则被还原为水。
除了氧化还原反应外,酸碱中和反应也是单质与化合物相互转化的一种常见形式。
在酸碱中和反应中,酸和碱反应生成盐和水。
例如,盐酸和氢氧化钠反应生成氯化钠和水。
在这个反应中,盐酸和氢氧化钠分别是酸和碱,它们通过反应生成了化合物氯化钠和水。
此外,还有一类重要的反应是置换反应。
置换反应是指一个元素被另一个元素取代的过程。
在置换反应中,单质可以与化合物反应生成另一种化合物。
例如,铁可以与硫酸反应生成硫酸铁。
在这个反应中,铁是单质,硫酸是化合物,它们通过反应生成了另一种化合物硫酸铁。
除了上述反应类型外,还有许多其他类型的反应可以实现单质与化合物的相互转化。
例如,加热反应是一种常见的反应类型,通过加热可以使单质转化为化合物。
另外,还有一些特殊的反应,如光合作用和光解反应,它们可以将光能转化为化学能,从而实现单质与化合物的相互转化。
化学反应中单质与化合物的相互转化在日常生活中有着广泛的应用。
例如,烹饪中的食物加热过程就是一种将单质转化为化合物的反应。
当我们加热食材时,其中的单质会与其他成分发生反应,形成新的化合物,从而改变食物的味道、质地和颜色。
此外,化学反应中单质与化合物的相互转化也在工业生产中起着重要作用。
许多化学工艺过程都依赖于单质与化合物的相互转化。
例如,炼钢过程中,铁矿石中的铁元素被还原为纯净的铁,然后与其他元素结合形成不同种类的钢材。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
【典题示例】 角度1 元素及其化合物的性质与转化 一定条件下,一种反应物过量,另一种反应物仍不能 完全反应的是( ) A.过量的氢气与氯气 B.过量的浓盐酸与二氧化锰 C.过量的铜与浓硫酸 D.过量的锌与18 mol·L-1硫酸
【解析】选C。氢气与氯气反应生成氯化氢,可完全反 应,A项不符合题意;过量的浓盐酸与二氧化锰反应, 二氧化锰可以完全反应,B项不符合题意;过量的铜与 浓硫酸反应,随着反应的进行,浓硫酸变为稀硫酸反 应停止,C项符合题意;过量的锌与18 mol·L-1硫酸反 应,先生成二氧化硫,变为稀硫酸后生成氢气,硫酸 可以完全反应,D项不符合题意。
元素化合物之间的相互转化
【考情播报】 以元素及其化合物的知识为主,集基本概念、基本理论和基本 实验为一体,进行综合考查,以选择、综合分析题等考查元素 及其化合物的知识、基本概念、基本理论及实验操作等。常见 的命题角度有: (1)元素及其化合物的性质与转化; (2)工业生产流程和工业生产中的除杂净化。
(1)反应②中除去的杂质离子是Fe2+和Mn2+,发生反应的离子
方2M程n式为+3MOM4nn2+++32FeH22+O+=7=H52OM=n=O32F↓+e(4OHH+)在3↓加+M 高锰nO酸2↓钾+O之54 H前+,, 若溶液的pH较低,则铁离子和锰离子不能生成沉淀而除去。
(2)反应③的反应类型是置换反应,过滤所得的滤渣中除了过量
2.A、B……I、J 10种物质的相互转化关系如图所示,其中A、 B、G为单质,A和G在常温下为气体,B为金属固体,金属B的冶 炼方法与Na相同;D为常见的无色液体;气体E能使湿润的红色 石蕊试纸变蓝;I的水溶液中滴加AgNO3溶液有不溶于稀硝酸的 白色沉淀产生;J是实验 室中常用的中性干燥剂, 还可以用作雪天道路的融 雪剂;反应①为水解反应。 (图中反应条件未列出, 但所涉及的反应物与生成 物均已全部列出)
角度2 工业生产流程和工业生产中的除杂净化 氧化锌为白色粉末,可用于湿疹、癣等皮肤病的治疗。纯化工 业级氧化锌(含有Fe(Ⅱ)、Mn(Ⅱ)、Ni(Ⅱ)等杂质)的流程①如 下:
提示:在本实验条件下,Ni(Ⅱ)不能被氧化;高锰酸钾的还原 产物是MnO2。
回答下列问题: (1)反应②中除掉的杂质离子是______________,发生反应的 离子方程式为_____________________; 在加高锰酸钾溶液前,若pH较低⑤,对除杂的影响是 ____________。
Mn
O
4
[紫(红)色]。Br2在水中显黄(橙)色,在有机溶剂中显橙(红)
色,I2在水中显黄(褐)色,在有机溶剂中显紫(红)色。
(3)有色固体:(淡)黄(棕)色固体:Na2O2、S、FeS2、FeCl3;黑 色固体:MnO2、C、CuO、FeO、Fe3O4;紫(黑)色固体: KMnO4、I2;(紫)红色固体:Cu。 (4)有色沉淀:①白色沉淀:H2SiO3、AgCl、BaSO4(不溶于酸)、 BaSO3、Mg(OH)2、Fe(OH)2、Al(OH)3、BaCO3、CaCO3、 CaSO3、MgCO3等;②(浅)黄色沉淀:AgBr、AgI、S;③红褐 色沉淀:Fe(OH)3;④蓝色沉淀:Cu(OH)2;⑤黑色沉淀:CuS、 FeS。
2.物质的特征性质:
(1)能使品红溶液褪色的气体。
SO2(加热后又恢复红色)、Cl2(加热后不恢复红色)。 (2)特殊的沉淀颜色的变化。
①白色沉淀先变灰绿色,再变红褐色:
Fe(OH)2
Fe(OH)3;
②白色沉淀迅速变棕褐色:AgOH→Ag2O。
(3)在空气中变为红棕色的气体:
NO(无色)
NO2(红棕色)。
请根据上面的文字信息及框图中的物质转化信息回答下列问 题: (1)B、E、F、I中属于电解质的是________(写化学式),既属 于电解质又能抑制水的电离的是______________(写化学式)。
(2)金属B的经典生产方法是在1072 K下电解熔融的J。 该反应的化学方程式为________________。
HC
O
3
、SO32
、HS
O
3
(S2-、HS-)等
与强碱溶液反应产生气体的溶液一般含 NH+4
5.抓住化学反应与反应条件的关系 多数化学反应需要一定条件,条件不同化学反应也不同。 (1)“催化剂”:无机化学反应需要的催化剂不同,但是根据“催 化剂”这一条件,可将氯酸钾分解、双氧水分解、工业合成氨 、SO2催化氧化、氨催化氧化联系起来,形成知识链。 (2)“通电”或“电解”:可以锁定在电解水、氯化钠、氯化镁、氯 化铜、硫酸铜、硝酸盐等溶液,熔融氯化钠和氧化铝范围内。 (3)“高温”:常见的有碳酸钙分解、SiO2和C的置换反应、制造 普通玻璃的反应、铝热反应等。
(4)能使澄清石灰水变浑浊的气体:CO2、SO2。 (5)通入CO2气体变浑浊的溶液:石灰水(过量则变澄清)、 Na2SiO3溶液、饱和Na2CO3溶液、浓苯酚钠溶液、NaAlO2溶液等。 (6)使湿润的红色石蕊试纸变蓝的气体:NH3。 (7)使湿润的淀粉KI试纸变蓝的物质:NO2、Cl2、Br2、FeCl3等。 (8)能与SO2、Cl2、O2等氧化性较强的气体(或其水溶液)反应析 出淡黄色沉淀的物质:H2S。 (9)在一定条件下具有漂白性的物质:Na2O2、H2O2、SO2、氯水、 O3、活性炭等(注意原理不同)。
【类题备选】1.(2017·衡水模拟)常见物质A、B、C、D、E、X, 存在下图转化关系(部分生成物和反应条件略去)。下列推断不 正确的是( )
A.若D是一种强碱,则A、B、C均可与X反应生成D B.若D为NaCl,且A可与C反应生成B,则E可能是CO2 C.若D是一种白色沉淀,在空气中最终变为红褐色,则A可能是 铁 D.若D是一种强酸,则A既可以是单质,也可以是化合物,且D可 与铜反应生成B或C
(10)常温下能溶解SiO2固体的物质:氢氟酸和NaOH溶液。 (11)能与浓硫酸、铜片共热产生红棕色气体(NO2)的溶液:硝酸 盐(或硝酸)溶液。 (12)滴入沸水中可得到红褐色胶体的溶液:含Fe3+的盐溶液。 (13)烟雾现象。 ①棕(黄)色的烟:Cu或Fe在Cl2中燃烧; ②白烟:Na在Cl2中或P在空气中燃烧;NH3遇到HCl气体; ③白雾:由HX等极易溶于水的气体产生; ④白色烟雾:P在Cl2中燃烧。
6.常考的特征数据:
(1)常见10电子微粒及相互转化关系。
①分子:Ne、HF、H2O、NH3、CH4;
②阳离子:Na+、Mg2+、Al3+、 NH+4 、H3O+; ③阴离子:F-、O2-、N3-、OH-、N H-2 等。
常见的等电子微粒的一些转化:
NH+4 +OH-
NH3↑+H2O;H3O++OH-==2H2O。
(3)在25℃下,将amol·L-1的E的水溶液与0.01 mol·L-1的H的
(2)常见18电子微粒。
①分子:Ar、HCl、H2S、PH3、SiH4、H2O2; ②阳离子:K+、Ca2+;
③阴离子:Cl-、S2-、P3-、O22; ④有机物:CH3OH、CH3NH2、CH3F、CH3CH3等。 (3)常见物质的相对分子质量。
①相对分子质量为28的物质:CO、N2、C2H4等; ②相对分子质量为26的物质:C2H2等; ③相对分子质量为32的物质:S、O2等; ④相对分子质量为78的物质:Na2S、Na2O2、Al(OH)3、C6H6等; ⑤相对分子质量为100的物质:CaCO3、KHCO3、Mg3N2等。
(2)三角型转化关系。 (3)交叉型转化关系。
4.特殊的反应现象:
燃烧 焰色反应
H2+Cl2(苍白色火焰), H2(CH4)+O2(淡蓝色火焰), C2H2(C6H6)+O2(明亮火焰,浓烈黑 烟)
Na+(黄色)、K+(紫色)
淀粉遇I2变蓝,蛋白质遇浓硝酸变黄
使湿润的红色石蕊试纸变 蓝
NH3
使品红溶液褪色
的锌外还有置换出来的金属镍。
(3)⑤煅烧发生反应的关系式为
ZnCO3·xZn(OH)2~(x+1)ZnO
125+99x
81(x+1)
11.2 g
8.1 g
列比例式(125+99x)÷[81(x+1)]=11.2 g÷8.1 g,解得x=1。
【答案】(1)Fe2+和Mn2+ MOn4 +3Fe2++7H2O==3Fe(OH)3↓+MnO2↓+5H+, 2MOn4 +3Mn2++2H2O==5MnO2↓+4H+ 铁离子 和锰离子不能生成沉淀,从而无法除去铁和锰杂质 (2)置换反应 镍 (3)1
在空气中由无色变为红棕 色的气体
SO2(加热后又恢复红色)、 Cl2(加热后不恢复红色)
NO
Fe3+遇OH-生成红褐色沉淀,遇苯酚显紫色,遇SCN显红色
Fe2+遇OH-生成白色沉淀,并迅速变成灰绿色,最后变
成红褐色;Fe2+遇SCN-无明显变化,通入Cl2后溶液显 红色
与酸反应产生气体的溶液一般可能含:CO32 、
3.物质的特征转化关系:
(1)直线型转化关系
A――――X―――→B――――X―――→C
①X为O2 Na―→Na2O―→Na2O2 N2―→NO―→NO2或NH3―→NO―→NO2 S―→SO2―→SO3或H2S―→SO2―→SO3 C―→CO―→CO2或CH4―→CO―→CO2 醇―→醛―→羧酸
②X为CO2
锌与镍离子反应置换出金属镍,且锌单质是 过量的
关键信息
