常见化学结构
有机化学常见官能团及结构式

有机化学常见官能团及结构式有机化学是研究有机物的合成、结构和性质的科学。
在有机化学中,官能团是有机分子中具有特定化学性质和一定结构的基团。
它们决定了有机物的性质和反应类型。
下面将介绍几种常见的官能团及其结构式。
1. 烷基(Alkyl group)烷基是碳原子组成的链状基团,只有单键,通常用R表示。
常见的烷基有甲基(-CH3)、乙基(-C2H5)、丙基(-C3H7)等。
2. 烯基(Alkenyl group)烯基是含有碳碳双键的基团,通常用R'表示。
常见的烯基有乙烯基(-CH2CH=CH2)、丙烯基(-CH2CH=CH-CH3)等。
3. 炔基(Alkynyl group)炔基是含有碳碳三键的基团,通常用R''表示。
常见的炔基有乙炔基(-C≡CH)、丙炔基(-C≡C-CH3)等。
4. 羟基(Hydroxyl group)羟基是一个氢原子被一个氧原子取代的官能团,通常用-OH表示。
常见的化合物有乙醇(CH3CH2OH)、丙醇(CH3CH2CH2OH)等。
5. 羧基(Carboxyl group)羧基由一个羰基和一个羟基组成,通常用-COOH表示。
常见的羧基化合物有甲酸(HCOOH)、乙酸(CH3COOH)等。
6. 醛基(Aldehyde group)醛基由一个羰基和一个氢原子组成,通常用-CHO表示。
常见的醛基化合物有乙醛(CH3CHO)、丙醛(CH3CH2CHO)等。
7. 酮基(Ketone group)酮基由一个羰基和两个碳原子组成,通常用-CO-表示。
常见的酮基化合物有丙酮(CH3COCH3)、丁酮(CH3CH2COCH3)等。
8. 胺基(Amino group)胺基是一个氮原子连接一个或多个碳原子的官能团,通常用-NH2表示。
常见的胺基化合物有甲胺(CH3NH2)、乙胺(CH3CH2NH2)等。
以上是有机化学中常见的官能团及其结构式。
通过组合这些官能团可以合成复杂的有机化合物,这些化合物不仅存在于化学实验室中,也广泛存在于生物体内和我们日常生活中的各种物质中。
常见化学结构范文

常见化学结构范文化学结构是指描述化学物质的分子、离子和原子排列方式的图示。
化学结构的解析和理解对于研究和应用化学具有重要意义。
以下是一些常见的化学结构。
1.分子结构分子结构是描述分子中原子之间的连接方式和空间排列的表示方法。
常见的分子结构包括Lewis结构、Kekulé结构、球棍模型、空间填充模型等。
以水(H2O)分子为例,其Lewis结构表示为H-O-H,表示氢原子与氧原子之间是共用电子对连接。
2.离子结构离子结构用于描述离子化合物中阳离子和阴离子之间的排列方式。
例如,氯化钠(NaCl)是一种常见的离子化合物,其离子结构表示为Na+Cl-,表示钠离子与氯离子之间是离子键连接。
3.均匀结构均匀结构描述均匀晶体中晶格的排列方式,是晶体学研究的重要内容。
均匀结构可以通过X射线衍射等方法进行分析。
例如,钻石是一种由碳原子组成的晶体,其均匀结构由密堆积的化学基元组成。
4.非晶态结构非晶态结构是一些化学物质的特殊结构,其中原子或分子没有明确的周期性排列。
非晶体具有无定形的外观和随机的结构。
例如,玻璃就是一种非晶态结构的物质,其分子排列没有规律性。
5.生物大分子结构生物大分子结构描述生物分子(如蛋白质、核酸和多糖等)的分子结构和空间构型。
例如,DNA的结构由双螺旋的排列方式组成,而蛋白质的结构可以分为四个层次:原初结构、次级结构、三级结构和四级结构。
6.网状结构网状结构是一种特殊的结构,其中原子或分子之间通过共价键或离子键连接成为大的网络结构。
例如,金刚石是由碳原子通过共价键连接成为网状结构的晶体。
7.聚合物结构聚合物结构描述由单体通过共价键连接而成的大分子化合物。
聚合物可以具有直线链状结构、支链状结构或三维网状结构。
例如,聚乙烯是由乙烯单体通过共价键连接形成的线性聚合物。
8.微观结构微观结构描述了物质在微观尺度上的排列方式,包括晶体的晶胞和晶格结构、粗晶粒内部的晶界和位错等。
微观结构的研究对于理解材料的性质和行为具有重要意义。
有机化学结构

二嗪(Diazine)是含有两个氮原子的六元杂环化合物,即二氮杂苯,分子式为C4H4N2。
它有以下三种异构体:三嗪(Triazine)是含有三个氮原子的六元杂环化合物,分子式为C3H3N3,有三种异构体:∙1,2,3-三嗪,也称“连三嗪”;∙1,2,4-三嗪,也称“不对称三嗪”;∙1,3,5-三嗪,也称“均三嗪”、“对称三嗪”。
1,2,3-及1,2,4-三嗪均未见其单独存在,但衍生物都已制得。
六嗪也称作“六氮苯”,是氮元素的一种单质,分子式为N6。
六嗪与N2、N4等互为同素异形体。
六嗪是氮苯(吖嗪)类物质的最后一个成员,其分子是由六个氮原子围成的六元环,相当于六个次甲基都被氮原子代替了的苯分子。
虽然吡啶(一氮杂苯)、哒嗪(邻二氮杂苯)、嘧啶(间二氮杂苯)、吡嗪(对二氮杂苯)、1,3,5-三嗪(1,3,5-三氮杂苯)和四嗪(四氮杂苯)等氮苯都已被发现,但六嗪与五嗪实际上仍未被观察到。
酸酐是具有两个酰基键合于同一氧原子上的有机化合物。
[1]若两侧酰基由同种羧酸衍生而来则称为对称酸酐,分子式可表达为:(RC(O))2O。
对称酸酐命名取决于相应羧酸命名,即词缀“酸”改为“酸酐”。
[2]因此(CH3CO)2O称为:“乙酸酐”(或醋酸酐、醋酐)。
混合酸酐(或不对称酸酐)以两侧酰基分别对应的羧酸命名,如:甲酸乙酸酐。
胺(拼音:àn;英文:Amine)是氨分子(NH3)中的氢被烃基取代后形成的一类有机化合物。
氨基(-NH2、-NHR、-NR2)是胺的官能团。
如果氮原子连着羰基(C=O),那么该化合物则称为酰胺,其化学性质与胺并不相同。
胺分子可根据烃基的种类,分为脂肪胺和芳香胺。
此外,胺还可根据氨分子上被取代的氢原子数量,顺次分为伯胺(一级胺)、仲胺(二级胺)、叔胺(三级胺)。
此外,还有季铵盐(四级铵盐),可以看成是铵根离子(NH4+)的四个氢都被取代的产物。
酰胺可以看作羧酸与氨或胺缩合形成的化合物,是羧酸衍生物的一类。
知识点总结化学物质结构

第一章物质结构元素周期律一、原子结构1、原子A ZX中,质子有Z 个,中子有A-Z 个,核外电子有Z 个。
2、质量数(A)= 质子数(Z)+ 中子数(N)(质量数在数值上等于其相对原子质量)原子中:原子序数= 核电荷数= 质子数= 核外电子数阳离子中:质子数=核电荷数=离子核外电子数+ 离子电荷数阴离子中:质子数=核电荷数=离子核外电子数- 离子电荷数3、电子层划分电子层数 1 2 3 4 5 6 7符号K L M N O P Q离核距离近远能量高低低高4、核外电子排布规律(一低四不超)(1)核外电子总是尽先排布在能量低的电子层,然后由里向外从能量低的电子层逐步向能量高的电子层摆布(即排满K层再排L层,排满L层再排M层)。
(2)各电子层再多容纳的电子数是2n2 个(n表示电子层)(3)最外层电子数不超过8个(K层是最外层时,最多不超过2 个);次外层电子数不超过18 个;倒数第三层不超过32 个。
5、概念元素:具有相同核电荷数的同一类原子的总称核电荷数决定元素种类核素:具有一定数目质子和一定数目中子的一种原子。
同位素:质子数相同而中子数不同的同一元素的不同原子之间的互称。
例:氕(1 1H)、氘(2 1D )、氚(3 1T )同素异形体:同种元素原子组成结构不同的不同单质之间的互称。
例:O2与O3,白磷与红磷,石墨与金刚石等6、粒子半径大小的比较(1)同周期元素的原子或最高价阳离子的半径随着核电荷数的增大而逐渐减小(除稀有气体外)。
例:Na>Mg>Al>Si, Na+>Mg2+>Al3+(2)同主族元素的原子或离子随核电荷数增大而逐渐增大。
例:Li<Na<K, Li+<Na+<K+ (3)电子层结构相同(核外电子排布相同)的离子半径(包括阴阳离子)随核电荷数的增加而减小。
例:O2->F->Na+>Mg2+>Al3+(上一周期元素形成的阴离子与下一周期元素形成的阳离子有此规律)(4)同种元素原子形成的粒子半径大小为:阳离子<中性原子<阴离子;价态越高的粒子半径越小。
化学结构式
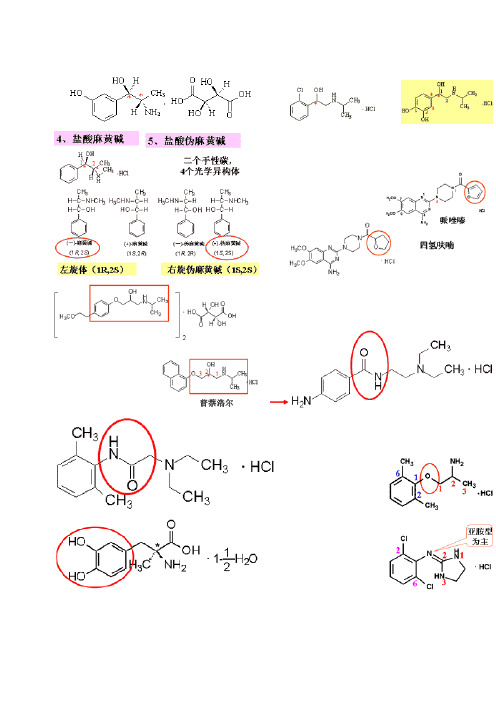
硝苯2,6-二甲基-4-(2-硝基苯基)-1,4-二氢–3,5-吡啶二甲酸二甲酯
尼群2,6-二甲基 2 –[(2 -氨基乙氧基)-甲基]- 4-(2–氯苯基)-1,4-二氢- 6 -甲基– 3,5 -吡啶二甲酸- 3 -乙酯- 5 -甲酯
尼莫2,6-二甲基-4-(3-硝基苯基-1,4-二氢-3,5吡啶二甲酸-2-甲氧乙基-(1-甲乙基)酯
盐酸维拉帕米
α-〔3-[[2-(3,4-二甲氧苯基)乙基]甲氨基]丙基〕-3,4-二甲氧基-α-异丙基苯乙腈盐酸盐1个手性碳
盐酸地尔硫 顺–(+)–5-[(2-二甲氨基)乙基]-2-(4 -甲氧基苯基)-3-乙酰氧基-2 ,3 -二氢- 1,5-苯并硫氮杂 –4(5H)-酮盐酸盐
化学物质名称与结构

41608-64-4
S-(+)-叔丁基缩水甘油醚
130232-97-2
产品名称
CAS 号码
结构式
1,3-噻唑-4-羧酸
3973-08-8
1-苄基-4-哌啶酮
3612-20-2
1-Boc-4-羟基哌啶
109384-19-2
1-溴-2,3-二氟苯
38573-88-5
1-溴-2,3-二甲基苯
576-23-8
3,5-二氯苯甲酸
51-36-5
3,5-Dichlorobenzonitrile 211
6575-00-4
3,5-Dichlorobenzoyl chloride 212
2905-62-6
3,5-Dimethoxyaniline 222
10272-07-8
3-氨基-1-Boc-哌啶
184637-48-7
619-14-7
3-甲氧基-4-硝基苯甲酸
5081-36-7
产品名称
CAS 号码
结构式
4-氨基-3-羟基苯甲酸
2374-03-0
4-氨基-3-甲氧基苯甲酸
2486-69-3
4-溴靛红
20780-72-7
4-溴间苯二甲酸
6939-93-1
4-氯-3-乙基苯酚
14143-32-9
4-氯-3-羟基苯甲酸
6-Aminonicotinic acid 304
3167-49-5
6-Aminonicotinic acid methyl ester 305
36052-24-1
6-Chloroanthranilic acid 306
2148-56-3
6-Chloronicotinotiniile 309
化学知识结构框图(超详细)
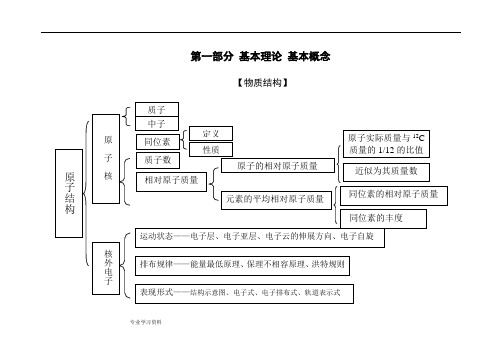
. 专业学习资料 .第一部分 基本理论 基本概念【物质结构】. 专业学习资料.晶体结构. 专业学习资料.晶体熔沸点比较表. 专业学习资料.【元素周期律】. 专业学习资料.【化学反应速率与化学平衡】. 专业学习资料.. 专业学习资料.. 专业学习资料... . .. . ... 专业学习资料 .【胶体】【电解质溶液】.. 专业学习资料.. 专业学习资料.【氧化还原反应电化学】. 专业学习资料.【各种化学反应的关系】. 专业学习资料..专业学习资料.【化学反应规律】. 专业学习资料.. 专业学习资料.. 专业学习资料 .【物质的量】nVV n m =→nm M =Vn C =nN N A =M=a 1%·M 1+ a 2%·M 2+…(a%为体积分数). 专业学习资料..第二部分 元素及其化合物【元素化合物概述】【非金属元素】. 专业学习资料.【卤族元素】. 专业学习资料.PbS. 专业学习资料.. 专业学习资料... . .. . ... 专业学习资料 .【金属元素】.. . .. . ..【铝及其化合物】. 专业学习资料.. 专业学习资料.. 专业学习资料.【化工生产】. 专业学习资料.第三部分 有机物【有机物导学】[有机物推断]浓H2SO4加热苯的硝化醇分子内、间脱水酯化光照——烷基卤代[官能团特征反应]聚酯反应类型与官能团的关系官能团(或物质)的特征反应[各类有机物之间的相互关系]2 =CH 2CH 3 —CH 3 CH CH CH 2 O HCH 3 CH 3 C H 2 C lCH 2 CH 2 Cl CH C HO CHClCH 2-CH NH 2n2HOCH 2 CH 2OHCH 3 C OOHCH 3 C OO CH 2 CH 3第四部分 化学实验导学[物质的分离和提纯][物质的检验][常见气体的实验室制法]第五部分 化学计算。
化学知识结构框图(超详细)!

化学知识结构框图(超详细)!第一部分基本理论基本概念质子和中子是构成原子核的基本粒子。
物质结构指的是物质的构成方式,包括原子的相对原子质量、原同位素、质子数等概念。
原子的相对原子质量可以近似看作其质量数,同位素的相对原子质量和丰度也是物质结构的重要概念。
原子的结构包括核和核外电子。
电子排布规律包括能量最低原理、保里不相容原理和洪特规则,可以用结构示意图、电子式、电子排布式和轨道表示式等形式表现。
化学键是化合物形成的基础。
极性共价键和非极性共价键是常见的两种共价键类型。
离子键和金属键也是化合物中常见的键类型。
晶体结构包括分子晶体、离子晶体、原子晶体和金属晶体。
元素周期律是元素周期性变化的规律。
周期表的结构包括短周期、周期长周期和不完全周期。
元素周期律可以用来预测元素的性质,如农药、半导体、合金、催化剂、光电管等应用。
化学反应速率是指化学反应中物质消失或生成的速度。
它可以用平均速率来表示,受内因、温度等多种因素影响。
化反应中,元素守恒和电荷守恒都得到满足,但能量高的物质生成能量低的物质的作用更大,因此反应发生。
化学反应是化学变化的过程,可以分为不同类型的反应。
其中,分解反应是一种将一种物质分解成两种或更多种物质的反应,化合反应是两种或更多种物质结合成一种物质的反应,氧化还原反应是指物质的氧化产生电子,还原则是指物质的还原接受电子。
离子反应是指离子之间的反应,包括置换反应和复分解反应。
在化学反应中,有一些规律需要遵守。
电荷守恒规律指的是反应前后电荷总量不变,元素守恒规律指的是反应前后元素总量不变,溶解度规律指的是溶解度较大的物质生成溶解度较小的物质,强弱规律指的是能量高的物质生成能量低的物质。
在实际应用中,需要根据具体情况确定哪种规律影响更大,以此决定反应的发生。
氧化还原反应是一种特殊的化学反应,涉及到还原剂和氧化剂的作用。
还原剂具有还原性,可以引起氧化反应,被氧化的物质叫做还原剂。
氧化剂具有氧化性,可以引起还原反应,被还原的物质叫做氧化剂。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
S-O間為單鍵
(大學會考慮d軌域形成 鍵)
SF6
六氟化硫
sp3d2(S)
正八面體形
第三週期以後的元素才會到d軌域的混成
H2S2O7
焦硫酸根
sp3(S)
兩個H2SO4脫去一個水
S2O32-
硫代硫酸根
sp3(S)
兩個S的氧化數各為+5,-1
平均氧化數為+2
P4
白(黃)磷
sp3
正四面體
P上含有孤電子對
H4P2O7
焦磷酸
sp3
四面體(P)
兩個酸脫去一個水稱為焦酸
HClO
次氯酸
ClO-
次氯酸根
Cl上有三對孤電子對
HClO2
亞氯酸
sp3
角形(Cl)
ClO2-
亞氯酸根
sp3
角形(Cl)
Cl上有二對孤電子對
HClO3
氯酸
sp3
角錐形(Cl)
ClO3-
氯酸根
sp3
角錐形(Cl)
Cl上有一對孤電子對
化學式
中文命名
一些常見分子的結構
1.VSEPR:判斷分子形狀
2.路以士電子點式:判斷鍵結
化學式
中文命名
結構式
中心原子混成軌域
中心原子鍵結形狀
備註
CO
一氧化碳
sp(C)
直線形
鍵能CO>N2
CO2
二氧化碳
sp
直線形
H2CO3
碳酸
sp2(C)
三角形
CO32-
碳酸根
sp2
三角形
鍵
CH4
甲烷
sp3
正四體形
C2H6
乙烷
sp3(C)
二氧化硫
sp2(S)
角形
S-O間為 鍵
SO3
三氧化硫
sp2(S)
平面三角形
S-O間為 鍵
H2SO3
亞硫酸
sp3(S)
角錐形
S-O間為單鍵
SO32-
亞硫酸根
sp3(S)
角錐形
S-O間為單鍵
化學式
中文命名
結構式
中心原子混成軌域
中心原子鍵結形狀
備註
H2SO4
硫酸
sp3(S)
四面體形(S)
SO42-
硫酸根
sp3(S)
P4
紅(赤)磷
sp3
聚合物
P上含有孤電子對
PH3
磷化氫
sp3
角錐形
P上含有孤電子對
化學式
中文命名
結構式
中心原子混成軌域
中心原子鍵結形狀
備註
PCl3
三氯化磷
sp3
角錐形
P上含有孤電子對
PCl5
五氯化磷
sp3d
雙三角錐
P上無孤電子對
P4O6
六氧化四磷
sp3
P4的六個鍵斷,接上O
P上含有孤電子對
P4Oபைடு நூலகம்0
結構式
中心原子混成軌域
中心原子鍵結形狀
備註
HClO4
過氯酸根
sp3
四面體形(Cl)
ClO4-
過氯酸根
sp3
正四面體
Cl上無孤電子對
KHF2
二氟氫化鉀
含有氫鍵
I3-
三碘離子
sp3d
直線形
中心I含有三對孤電子對
BeF2
氟化鈹
sp
直線形
不符合八偶體
BF3
氟化硼
sp2
平面三角形
不符合八偶體
BF4-
四氟化硼離子
立體形
C2H4
乙烯
sp2(C)
平面
C2H2
乙炔
sp(C)
直線形
HCN
氰化氫
sp(C)
直線形
C6H6
苯
sp2
平面
鍵
金剛石
sp3
立體
石墨
sp2
平面層狀
層與層間為凡得瓦力
C-C鍵為 鍵
化學式
中文命名
結構式
中心原子混成軌域
中心原子鍵結形狀
備註
C60
碳-60
sp2
足球形
鍵
N2
氮
直線
NH3
氨
sp3
角錐形
鍵角為
NH4+
銨根
sp3
正四面體
鍵角為
NO
一氧化氮
sp2(N)
直線
N不符合八偶體
NO2
二氧化氮
sp2(N)
角形
N不符合八偶體
HNO2
亞硝酸
sp2(N)
角形(N)
N符合八偶體
NO2-
亞硝酸根
sp2
角形
N-O鍵為
HNO3
硝酸
sp2(N)
NO3-
硝酸根
sp2
正三角形
N-O鍵為
N2O4
四氧化二氮
sp2(N)
為非平面分子
N-O鍵為
化學式
中文命名
結構式
中心原子混成軌域
中心原子鍵結形狀
備註
N2F2
二氟化二氮
sp2
平面形分子
有順反異構物
N2H4
聯胺(胼)
sp3(N)
為火箭燃料
O2
氧
直線
O3
臭氧
sp2
角形
O-O鍵為 鍵
H2O
水
sp3
角形
O上之lp=2
H3O+
sp3
角錐形
有一個O-H鍵為配位共價鍵
S8
硫
sp3(s)
皇冠形
彈性硫為鏈形
SO2
十氧化四磷
sp3
P4的六個鍵斷接上O ,四個磷頂端再接O
P上無孤電子對
H3PO4
磷酸
sp3
四面體(P)
1.為三元酸
2. P原子上無孤電子對
H3PO3
亞磷酸
sp3
四面體(P)
有一個H接在P上,為二元酸
化學式
中文命名
結構式
中心原子混成軌域
中心原子鍵結形狀
備註
H2PO2
次磷酸
sp3
四面體(P)
有二個H接在P上,為一元酸
sp3
正四面體形
符合八偶體
化學式
中文命名
結構式
中心原子混成軌域
中心原子鍵結形狀
備註
Si
矽
sp3
正四面體形
為共價網狀固體
SiO4-
正矽酸根
sp3
正四面體形
所有矽酸鹽的基礎結構
SiO2
石英
sp3(Si)
正四面體形
共價網狀晶體
