准静态过程一个过程
准静态过程 功 热量 内能 热力学第一定律 等体过程 等压过程 摩尔热容等温过程和绝热过程

V2 V
Qp
E2
E1
W
等压膨胀过程:气体吸收的热 量,一部分用于内能的增加, 一部分用于对外作功。
p
等 压
p
( p,V2 ,T2 )
2
( p,V1,T1)
1
压
W
缩
o V2
V1 V
Qp
E1
W
E2
等压压缩过程:外界对气体作 的功和内能的减少均转化为热 量放出。
等压过程中,W 与 △E始终同号
Q
m' M
解 1)等温过程
W12 '
RT ln V2 ' V1
2.80104 J
2)氢气为双原子气体
(i 2) i 1.40
T2
T1
(V1 V2
)
1
753K
p
p2
2 T2
p2' T2' T1
Q0
p1
2'
T1
T 常量 1
o V2 V2' V1 10 V1 V
怎么求?
由热力学第一定律
dQT dWT pdV
Q T
WT
p RT
V2 V1
pdV
V
p
p1
1 ( p1,V1,T )
p2
( p2 ,V2 ,T )
2
o V1 dV V2 V
恒
温
谁做功?
热
源
T
QT
WT
V2
V1
RT V
dV
RT
ln V2 V1
RT ln p1
“工程热力学及传热学”教学中关于准静态过程和可逆过程的几点思考-最新作文

“工程热力学及传热学”教学中关于准静态过程和可逆过程的几点思考-最新作文“工程热力学及传热学”教学中关于准静态过程和可逆过程的几点思考Reflections on T eaching Reform about the Course of EngineeringThermodynamics and Heat TransferWU Hequan, LIU Zhihong(College of Automotive and Mechanical Engineering,Changsha University of Science and Technology, Changsha,Hu'nan 410114)Abstract This paper analyzes the relationship and difference between the quasi-static process and reversible process in the course of engineering thermodynamics and heat transfer. It has enhanced the understanding of these concepts,in order to deal with the issues related to thermodynamics better.0 引言“工程热力学与传热学”是汽车服务工程、热能与动力工程等专业的必修课程。
它是研究热能与机械能相互转换及热量传递规律的一门学科。
作为工科类的一门专业基础课,对机械工程专业也有重大意义。
准静态过程和可逆过程是工程热力学中的基本概念,弄清这两个概念在本学科的学习中显得尤为重要。
1 准静态过程1.1 平衡状态在不受外界影响的条件下(重力场除外),如果系统的状态参数不随时间变化,则该系统处于平衡状态。
平衡的本质即无不平衡势,包含以下几个方面:(1)无温差,即无热不平衡势;(2)无压差,即无力不平衡势;(3)无相变,即无相不平衡势;(4)无化学反应,即无化学不平衡势。
准静态热力学过程

准静态热力学过程热力学过程是指物质由一个状态变为另一个状态的过程,而准静态热力学过程是指在此过程中物质的每一个中间状态都可以近似看作平衡态。
这种过程可以用于研究热力学系统的性质与特性,为我们理解物质的热力学行为提供了重要的参考依据。
1. 热力学基本概念回顾在讨论准静态热力学过程之前,我们先回顾一下一些热力学的基本概念:系统、状态、过程、平衡等。
•系统:指将研究对象从周围环境中分离出来研究的部分,可以是封闭系统、开放系统或孤立系统。
•状态:指系统所具有的一组确定的宏观性质的集合,如压力、温度、体积等。
•过程:指系统从一个状态变为另一个状态的演化过程。
•平衡:指热力学系统的某个状态与周围环境没有任何差别,即系统处于静止状态。
2. 准静态过程与非准静态过程的区别在热力学中,准静态过程是指系统的每个中间状态都可以近似看作平衡态的过程。
而非准静态过程则是指系统的中间状态不能近似看作平衡态的过程。
准静态过程与非准静态过程的主要区别在于过程中的热力学状态变化的速度。
在准静态过程中,系统的变化速度非常缓慢,使得系统在每一个中间状态都有足够的时间达到平衡。
而在非准静态过程中,系统的变化速度较快,使得系统无法达到平衡态。
准静态过程的特点包括:•系统内部各点温度、压力等宏观性质基本相等;•系统与外界之间处于无限接近平衡的状态,能够实现最大的功输出。
非准静态过程的特点包括:•系统内部各点温度、压力等宏观性质存在差异;•系统与外界之间存在较大的非平衡状态,能够实现的功输出较小。
对于实际系统,准静态过程是一个理想化的过程,因为真实系统难以达到无限接近平衡的状态,但准静态过程的概念仍然对热力学的研究有重要的指导意义。
3. 热力学第一定律与准静态过程热力学第一定律是能量守恒定律在热力学中的体现。
对于一个封闭系统,在准静态过程中,热力学第一定律可以写作:ΔU=Q−W其中,ΔU表示系统内能的变化,Q表示系统吸收的热量,W表示系统对外界做的功。
准静态过程

等温过程 等容过程
等压过程
循环过程
V
二 功(过程量) 宏观运动能量
热运动能量
功是能量传递和转换的量度,它引起系统热运动 状态的变化 . 准静态过程功的计算
dW Fdl pSdl
dW pdV
W V2 pdV V1
注意:作功与过程有关 .
三 热 量(过程量)
通过传热方式传递能量的量度,系统和外界之间
准静态过程 功 热量
一 准静态过程(理想化的过程)
准静态过程:从一个平衡态到另一平衡态所经 过的每一中间状态均可近似当作平衡态的过程 .
砂子 活塞 气体
p
p1 1 ( p1,V1,T1)
p2
பைடு நூலகம்
2 ( p2 ,V2 ,T2 )
o V1 V2 V
准静态过程 Quasi-static process
只有把这种理想而简单的情况搞清楚,才有助 于我们对实际问题 的探讨。下面我们主要研究平衡 态和准静态过程。
程,则: 从 T1
T2 是准静态过程 Quasi-static process
系统T1
如果系统 温度 T1 直接与 热源 T2 接触,最终达到热平衡,则 不是 准静态过程。
T1+△T T1+2△T T1+3△T
P T2
因为状态图中任何一点都表示 系统的一个平衡态,故准静态 过程可以用系统的状态图,如 P-V图(或P-T图,V-T图)中 一条曲线表示,反之亦如此。 o
存在温差而发生的能量传递 .
功与热量的异同 1)过程量:与过程有关;
T1 T2
T1 Q T2
2)等效性:改变系统热运动状态作用相同;
1卡 = 4.18 J , 1 J = 0.24 卡
准静态实验测定材料力学性能的关键步骤

准静态实验测定材料力学性能的关键步骤材料力学性能是材料科学中非常重要的一个研究方向,它涉及到材料的强度、刚度、塑性变形等多个方面。
对于工程应用而言,知晓材料的力学性能是必不可少的。
而准静态实验,则是一种常用的测定材料力学性能的方法之一。
本文将重点讨论准静态实验的关键步骤,并探讨它在材料研究中的意义。
首先,进行准静态实验的第一步是试样的准备。
试样的准备直接影响到实验结果的准确性和可重复性。
试样的形状、尺寸以及制备方法都需要严格控制。
通常情况下,试样的形状可以根据不同实验要求进行选择,常见的有圆柱形、方形等。
试样尺寸的选择要能够代表材料的整体性能,同时要保证在实验过程中不会出现失效。
此外,试样的表面质量也需要注意,应保持光洁度,以避免表面缺陷对实验结果的影响。
接下来是实验装置的搭建。
准静态实验通常需要使用一台拉伸机,该机器具备固定试样并施加加载的功能。
在搭建实验装置时,需要确保试样牢固地固定,以避免在加载过程中产生误差。
另外,实验过程中的加载方式也需要注意。
如果材料的力学性能是各向同性的,通常采用均匀加载。
如果材料具有各向异性,加载时需要根据实际需要进行选择,以保证实验结果的准确性。
在实验过程中,保持准静态状态是非常重要的。
准静态状态是指在加载过程中,试样的变形速度远小于材料的变形速度。
这意味着在实验中需要控制加载速度,使其尽可能慢,以保证试样的变形过程可以近似为静态状态。
这样可以避免动态加载带来的影响,得到更准确的实验结果。
当然,在实际操作中,为了节约时间,慢速加载可能并不可行。
此时,可以通过分析试样的应力-应变曲线,找出一个代表静态响应的阈值,保证在该阈值下进行实验。
最后,准静态实验的结果分析是非常关键的。
通过实验获取的力学性能数据需要经过合理的处理和解读。
在分析数据时,可以利用材料力学模型进行拟合,并计算出各项力学参数。
同时,还应结合理论知识和其他实验结果进行讨论和比较,以验证实验结果的准确性。
准静态过程一个过程

a
d
Q1
b
W
c
V2
o
Q2
V1
V
Q2 Q1 W 或 Q1 Q2 W
从低温热源吸收的热量
外界对工质 所作的净功
致冷系数:
Q2 Q2 e W Q1 Q2
三、卡诺循环
1824 年卡诺(法国工程师 1796-1832 )提出了一 个能体现热机循环基本特征的理想循环。后人称 之为卡诺循环。
正循环过程对应热机,
逆循环过程 对应致冷机。
正循环的特征: P Q 1 一定质量的工质在一次循环 a b 过程中要从高温热源吸热Q1, W 对外作净功W,又向低温热 c d 源放出热量 Q2 。而工质回到 Q2 o V 初态,内能不变。。 V2 V 1
W Q1 Q2 0
净功为循环过程曲线所包围的面积。
Cp
(dQ ) p ,mol dT (dQ ) p ,mol dT
(dQ ) p dE PdV
dE dV P dT dT
C p
对1mol的气体, dE C v dT, PdV RdT
Cp (dQ) p, mol dT i R R Cv R 2
不是全微分
(功,热均为在过程中传递的能 E
或
v
v2
1
Pdv
dQ dE Pdv
Q>0,系统吸收热量;Q<0,系统放出热量;W>0,系统
对外作正功;W<0,系统对外作负功;E>0,系统内能
增加,E<0,系统内能减少。
适用范围:
与过程是否准静态无关。即准静态过程和 非静态过程均适用。但为便于实际计算,要求 初终态为平衡态。
热力学第一定律
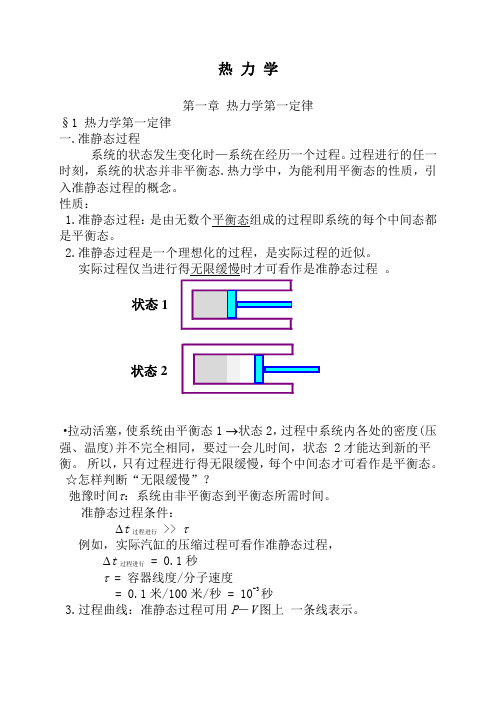
热 力 学第一章 热力学第一定律§1 热力学第一定律 一.准静态过程系统的状态发生变化时—系统在经历一个过程。
过程进行的任一时刻,系统的状态并非平衡态.热力学中,为能利用平衡态的性质,引入准静态过程的概念。
性质:1.准静态过程:是由无数个平衡态组成的过程即系统的每个中间态都是平衡态。
2.准静态过程是一个理想化的过程,是实际过程的近似。
实际过程仅当进行得无限缓慢时才可看作是准静态过程 。
·拉动活塞,使系统由平衡态1 →状态2,过程中系统内各处的密度(压强、温度)并不完全相同,要过一会儿时间,状态 2才能达到新的平衡。
所以,只有过程进行得无限缓慢,每个中间态才可看作是平衡态。
☆怎样判断“无限缓慢”?弛豫时间τ:系统由非平衡态到平衡态所需时间。
准静态过程条件: ∆t 过程进行 >> τ例如,实际汽缸的压缩过程可看作准静态过程, ∆t 过程进行 = 0.1秒τ = 容器线度/分子速度= 0.1米/100米/秒 = 10-3秒3.过程曲线:准静态过程可用P -V 图上 一条线表示。
状态1状态2二.功、内能、热量1.功 ·通过作功可以改变系统的状态。
·机械功(摩擦功、体积功)2.内能·内能包含系统内:(1)分子热运动的能量;(2)分子间势能和分子内的势能;(3)分子内部、原子内部运动的能量; (4)电场能、磁场能等。
·内能是状态的函数*对于一定质量的某种气体,内能一般是T 、V 或P 的函数; *对于理想气体,内能只是温度的函数 E = E (T )*对于刚性理想气体分子, i :自由度; ν :摩尔数 ·通过作功改变系统内能的实质是:分子的有规则运动能量和分子的无规则运动能量的转化和传递。
3.热量·传热也可改变系统的状态,其条件是系统和外界的温度不同。
·传热的微观本质:是分子的无规则运动能量从高温物体向低温物体传递。
new热力学第一定律
A dA PdV
I v1
说明
A= pdV
V1
V2
P
•系统所作的功与系统的始末状态有关, 而且还与路径有关,是一个过程量。
•气体膨胀时,系统对外界作功 气体压缩时,外界对系统作功 系统对外界所作的 •作功是改变系统内能的一种方法 •本质:通过宏观位移来完成的:机械运动→ 功等于pV 图上过 分子热运动 程曲线下面的面积
V2 M i Q R(T2 T1 ) pdV V1 2 理想气体的压强保持不变,p=const
•过程方程:
•内能、功和热量的变化
A
V2
V1 V2 T1 T2
pdV p(V
2
V 1)
•特征:
系统吸收的热量一部分 用来增加系统的内能, 另一部分使系统对外界 作功。
V1
Q p U 2 U1 p(V2 V1 )
为从平衡态破坏到新平 衡态建立所需的时间称 为弛豫时间。
3、准静态过程
如果一个热力学系统过程在始末两平衡态之间所经历的之 中间状态,可以近似当作平衡态,则此过程为准静态过 程。 •准静态过程只有在进行的“无限缓慢”的条件下才可 能实现。 •对于实际过程则要求系统状态发生变化的特征时间远 远大于弛豫时间才可近似看作准静态过程。
又根据PV n C,有P1V1n P2V2n C,所以
A
P2V2nV 21n 1 n
PV1nV11n P2V2 PV1 PV1 P2V2 1 1 1 1 n 1 n n 1
15.3 内能 热力学第一定律
一、内能
热力学系统的能量取决于系统的状 态——内能。 M i
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
在热力学中经常讨论的理想气体自由膨胀 程是一个非静态过程。“自由”指气体不受阻力 冲向右边。如图:
准静态过程
理想气体自由膨胀
一个过程,如果任意时刻的中间态都无限 接近于一个平衡态,则此过程为准静态过程。 显然,这种过程只有在进行的 “ 无限缓慢 ” 的 条件下才可能实现。对于实际过程则要求系统 状态发生变化的特征时间远远大于弛豫时间τ 才可近似看作准静态过程。
不是全微分
(功,热均为在过程中传递的能量,即过程量)
如果系统对外作功是通过体积的变化来实现的,则
Q E
或
v
v2
1
Pdv
dQ dE Pdv
Q>0,系统吸收热量;Q<0,系统放出热量;W>0,系统
对外作正功;W<0,系统对外作负功;E>0,系统内能
增加,E<0,系统内能减少。
适用范围:
过程中的每一状态都是平衡态 (Equilibrium state ) 不受外界影响时,系统的宏观性质不随时间改变。
显然作为准静态过程中间状态的平衡态,具 有确定的状态参量值,对于简单系统可用P—V图 上的一点来表示这个平衡态。系统的准静态变化 过程可用P—V图上的一条曲线表示,称之为过程 曲线。这条曲线的方程称为过程方程。准静态过 程是一种理想的极限,但作为热力学的基础,我 们要首先着重讨论它。
过程中的每一状态都是平衡态 (Equilibrium state ) 不受外界影响时,系统的宏观性质不随时间改变。
在热力学中经常讨论的理想气体自由膨胀 程是一个非静态过程。“自由”指气体不受阻力 冲向右边。如图:
准静态过程
理想气体自由膨胀
一个过程,如果任意时刻的中间态都无限 接近于一个平衡态,则此过程为准静态过程。 显然,这种过程只有在进行得 “ 无限缓慢 ” 的 条件下才可能实现。对于实际过程则要求系统 状态发生变化的特征时间远远大于弛豫时间τ 才可近似看作准静态过程。
(功是过程量)
• 特殊:
等容过程:W等容 = 0
W
V2 V1
PdV
等压过程:W等压 = P(V2-V1) (不一定是准静态过程)
准静态过程中热量的计算常用摩尔热容:
(dQ) mol cm dT
摩尔物质吸收的热量
Q
M
C m (T2 T1 )
热容量 c m 和热量 Q 均为过程量
2-2 热力学第一定律 (The first law of thermodynamics)
与过程是否准静态无关。即准静态过程和 非静态过程均适用。但为便于实际计算,要求 初终态为平衡态。
2-3 热力学第一定律对理想气体等值过程的应用
dQ dE dW
一.等容过程 V=恒量,dv=0,dw=pdv=0,
M i (dQ)v dE RdT 2
P
I ( P1 ,V1 , T1 )
II ( P2 ,V2 , T2 )
o
V
三、 准静态过程的功和热量
无摩擦准静态过程,其特点是没有摩擦力,外 界在准静态过程中对系统的作用力,可以用系统本 身的状态参量来表示。
[例] 右图活塞与汽缸无摩擦,当气体作准静态压缩 或膨胀时,外界的压强Pe必等于此时气体的压强P, 否则系统在有限压差作用 dx 下,将失去平衡,称为非 静态过程。若有摩擦力存 P 在,虽然也可使过程进行 S Pe 的“无限缓慢”,但Pe= P.
• 某一过程,系统从外界吸热 Q,对外界做功 W, 系统内能从初始态 E1变为 E2,则由能量守恒:
Q E 2 E1 W
Q E W
规定: 外界对系统做功W>0系统从外界吸热Q>0。
对无限小过程:
dQ dE dW
其中
dE为全微分(E为内状态函数)
dQ与dW仅表示元过程中的无限小改变量,
• 为简化问题,只考虑无摩擦准静态过程的功。
当活塞移动微小位移dx时,外力所作的元功为:
dW Fdx Pe Sdx
在无摩擦准静态过程中:
dx
S
dW PSdx PdV
W
讨论
V2 V1
P
Pe
系统体积由V1变为V2,外界对系统作总功为:
PdV
系统对外作正功; 系统对外作负功;
dv 0, w 0,
dv o, w 0,
dv 0,
பைடு நூலகம்
系统不作功。
• 功的图示:
由积分意义可知,用
V W V PdV
2 1
P
I
b
求出功的大小等于P—V 图
II
P
o
V1
a
上过程曲线P=P(V)下的面积。
V V dV V2
V
比较 a , b下的面积可知,
功的数值不仅与初态和末态有 关,而且还依赖于所经历的中 间状态,功与过程的路径有关。
i 理想气体 : E RT 2
内能的改变只决定于初、末状态而与所经历的过程无关。
二 准静态过程
• 热力学过程
准静态过程
非静态过程
当系统从一个状态到另一个状态变化过程,我们 就说系统在经历一个热力学过程,简称过程。
例:推进活塞压缩汽缸内的气体时,气 体的体积,密度,温 度 或压强都将变化,在过 程中的任意时刻,气体 各部分的密度, 压强, 温度都不完全相同。
第二章 热力学第一定律
2-1 内能
一 内能
功和热量
准静态过程
功和热量(Work, Heat, Internal energy) 的总和,即热力系的内能就是热力系 的热能.
热力系的内能:所有分子热运动的动能和分子间势能
• 做功可以改变系统的状态
• 摩擦升温(机械功)、电加热(电功)
• 功是过程量 作功是系统热能与外界其它形式能量转换的量度,
摩擦功:
dw f r dl
电功: dw
IUdt Udq
系统和外界温度不同,就会传热,或称能量交换,
热量传递可以改变系统的状态。 只对系统传热也能使系统的状态改变,在这一点上传 热和作功是等效的。
热量是过程量, 热量是系统与外界热能转换的量度。 是热力系状态的单值函数。
系统的内能是状态量,
• 非静态过程
显然过程的发生,系统往往由一个平衡状态到 平衡受到破坏,再达到一个新的平衡态。从平衡态 破坏到新平衡态建立所需的时间称为弛豫时间,用
τ表示。实际发生的过程往往进行的较快,(如前
例)在新的平衡态达到之前系统又继续了下一步变 化。这意味着系统在过程中经历了一系列非平衡态,
这种过程为非静态过程。作为中间态的非平衡态通
