碘钟实验(新、选)
碘钟实验

实验药品29%过氧化氢溶液、丙二酸、硫酸锰、可溶性淀粉、碘酸钾、1mol/L硫酸实验步骤1.配置甲溶液:量取97mL29%的过氧化氢溶液,转移入250mL容量瓶里,用蒸馏水稀释到刻度,得3.6mol/L过氧化氢溶液。
2.配置乙溶液:分别称取3.9g丙二酸和0.76g硫酸锰,分别溶于适量水中。
另称取0.075g可溶性淀粉,溶于50mL左右沸水中。
把三者转移入250mL容量瓶里,稀释到刻度,得到含0.15mol/L丙二酸、0.02mol/L硫酸锰、和0.03%淀粉的混合溶液3.配置丙溶液:称取10.75g碘酸钾溶于适量热水中,再加入20mL1mol/L硫酸溶液酸化。
转移入250mL容量瓶里,稀释到刻度,得到0.2mol/L碘酸钾和0.08mol/L硫酸的混合溶液。
4.将甲、乙、丙三组溶液以等体积混合在锥形瓶中,这混合溶液分别含过氧化氢1.2mol/L、丙二酸0.05mol/L、硫酸锰0.0067mol/L、碘酸钾0.067mol/L、淀粉0.01%。
“时钟反应”就是一种自催化反应,如碘酸盐与亚硫酸氢盐的反应,产物I-又是反应物,因而在经历一定诱导期后,反应速率急速增加。
2KIO3+5H2O2+H2SO4→I2+K2SO4+6H2O+5O2↑(1)I2+5H2O2+K2SO4→2KIO3+4H2O+H2SO4(2)I2+CH2(COOH)2→CHI(COOH)2+I-+H+(3)I2+CHI(COOH)2→CI2(COOH)2+I-+H+(4)I-+I2=I3-(5)丙二酸的加入是为了以I3-的形式“贮存”I2,以增大I2的溶解度。
这样能延长变色时间周期和循环次数。
显然蓝色是由碘分子与淀粉溶液作用的结果。
5个反应累加结果发现是H2O2→H2O+O2↑。
如果向反应器中不断加入碘酸盐、丙二酸、双氧水反应物,同时产物通过溢流管不断离开反应器,这样可以使化学钟无限期走下去。
也存在其它时钟反应:IO3- + 3SO32-===I- + 3SO42-IO3- + 5I- + 6H+ ===3I2 + 3H2O3I2 + 3SO32- + 3H2O===6I- + 6H+ + 3SO42-或5H2O2 + 2HIO3===5O2 + I2 + 6H2OI2 + 5H2O2===2HIO3 + 4H2O在KIO3、KHSO3的酸性混合溶液中加入少量KI和淀粉,不断地搅拌,有下列反应发生:IO3-+5I-+6H+=3I2+3H2OI2+HSO3-+H2O=2I-+]+HSO4-+2H+当反应进行到15min时,溶液突然变成蓝色,随之又很快消失,这一反应被称为时钟反应。
碘钟实验报告

碘钟实验报告碘钟实验报告引言:碘钟实验是一种经典的化学实验,通过观察碘化钾与过氧化氢反应产生的气泡数量和速度变化,可以了解化学反应速率与浓度之间的关系。
本实验旨在通过实验操作和数据处理,探究反应物浓度对反应速率的影响,以及通过实验结果验证反应速率与浓度的关系。
实验目的:1. 掌握碘钟实验的操作方法;2. 通过实验数据分析,验证反应速率与反应物浓度的关系。
实验原理:碘钟实验的反应方程式为:2H2O2 + 2KI + H2SO4 → I2 + K2SO4 + 2H2O。
在此反应中,过氧化氢与碘化钾反应,生成碘分子和水。
碘分子在反应中呈现黄棕色,并且在酸性条件下,碘分子与淀粉反应生成蓝黑色的淀粉碘复合物。
通过观察淀粉碘复合物的颜色变化,可以间接反映出反应速率的变化。
实验步骤:1. 准备实验器材:玻璃烧杯、滴定管、试管架等;2. 预先准备浓度不同的碘化钾溶液;3. 将一定量的碘化钾溶液倒入玻璃烧杯中;4. 加入适量的过氧化氢溶液,并快速搅拌;5. 观察气泡的生成情况,并记录下时间;6. 重复实验多次,取平均值。
实验结果与讨论:在实验过程中,我们分别使用了浓度为0.1mol/L、0.2mol/L和0.3mol/L的碘化钾溶液进行了实验。
观察到,在浓度较低的碘化钾溶液中,气泡的生成速率较慢,并且气泡的数量也较少。
而在浓度较高的碘化钾溶液中,气泡的生成速率明显增加,气泡的数量也明显增多。
这说明反应速率与反应物浓度之间存在正相关关系。
通过实验数据的处理,我们还可以计算出反应速率与浓度之间的定量关系。
根据实验结果,我们可以得到一个经验公式:反应速率与浓度的关系可以近似表示为速率 = k * [I-]^x,其中k为常数,[I-]为碘化钾的浓度,x为反应级数。
通过进一步的实验和数据处理,可以确定反应级数和常数k的具体数值。
结论:通过碘钟实验的操作和数据处理,我们验证了反应速率与反应物浓度之间的关系。
实验结果表明,反应速率与反应物浓度呈正相关关系,即浓度越高,反应速率越快。
碘钟实验

图1 十二烷基硫酸钠水溶液的物理性质和浓度的关系
这个特征行为可用生成分子聚集体或胶束来说明,当表面活性剂溶于水中后,不但定向地吸附在溶液表面,而且达到一定浓度时还会在溶液中发生定向排列而形成胶束。表面活性剂为了使自己成为溶液中的稳定分子,有可能采取的两种途径:一是把亲水基留在水中,亲油基伸向油相或空气;二是让表面活性剂的亲油基团相互靠在一起,以减少亲油基与水的接触面积。前者就是表面活性剂分子吸附在界面上,其结果是降低界面张力,形成定向排列的单分子膜,后者就形成了胶束。由于胶束的亲水基方向朝外,与水分子相互吸引,使表面活性剂能稳定溶于水中。
式中:к是A=1m2、L=1m的电导,称作比电导或电导率,其单位为Ω-1·m-1;L/A称作电导常数。
电导率к和摩尔电导Λ有下列关系
Λ为1mol电解质溶液的导电能力,C为电解质溶液的摩尔浓度。
Λ随电解质浓度而变,对强电解质的稀溶液
碘钟反应实验报告

碘钟反应实验报告碘钟反应实验报告引言:碘钟反应是一种经典的化学实验,通过观察反应物浓度变化来研究反应速率。
本实验旨在探究碘钟反应中反应物浓度对反应速率的影响,并分析反应机理。
实验原理:碘钟反应是一种氧化还原反应,反应涉及到亚硫酸钠、过氧化氢和淀粉等物质。
亚硫酸钠与过氧化氢反应生成硫酸和水,过程中产生的硫酸与淀粉反应生成蓝色复合物。
该反应是一个自催化反应,其中过氧化氢起到催化剂的作用。
实验中,我们可以通过改变亚硫酸钠和过氧化氢的浓度来观察反应速率的变化。
实验步骤:1. 准备实验所需的试剂和器材,包括亚硫酸钠溶液、过氧化氢溶液、淀粉溶液、滴定管、烧杯等。
2. 将一定量的亚硫酸钠溶液倒入烧杯中,加入适量的淀粉溶液,搅拌均匀。
3. 在另一个烧杯中加入过氧化氢溶液。
4. 缓慢将过氧化氢溶液滴加到含有亚硫酸钠和淀粉的烧杯中,并同时用计时器计时。
5. 观察反应液颜色的变化,当颜色由无色变为蓝色时停止计时。
6. 记录反应时间,并根据不同浓度条件下的实验结果进行对比分析。
实验结果与讨论:我们进行了多组实验,分别改变了亚硫酸钠和过氧化氢的浓度。
实验结果表明,亚硫酸钠和过氧化氢的浓度对反应速率有明显的影响。
当亚硫酸钠浓度较高时,反应速率更快,反应时间更短;而当过氧化氢浓度较高时,反应速率也更快,反应时间更短。
进一步分析发现,亚硫酸钠的浓度增加会提供更多的反应物分子,增加反应物之间的碰撞频率,从而加快反应速率。
而过氧化氢的浓度增加则会提供更多的催化剂,加速反应过程中的氧化还原反应。
因此,实验结果与反应物浓度的变化相符。
此外,我们还观察到反应过程中颜色的变化。
初始时,反应液呈无色,随着反应的进行,颜色逐渐变为淡蓝色,最终变为浓蓝色。
这是由于反应过程中产生的硫酸与淀粉形成的蓝色复合物。
颜色变化的观察也可以作为反应速率的指标之一。
结论:通过碘钟反应实验,我们发现亚硫酸钠和过氧化氢的浓度对反应速率有显著影响。
亚硫酸钠浓度和过氧化氢浓度的增加都会加快反应速率。
碘钟实验解释

碘钟实验解释
碘钟实验是一种化学实验,它用硫酸和碘化钾处理淀粉溶液,产
生一个明显的颜色变化。
这个颜色变化是由于碘离子与淀粉分子结合
形成的蓝黑色物质引起的。
这个实验典型地展示了化学反应中的催化和动力学原理。
碘离子
是一个氧化剂,它能够促进淀粉的氧化,同时淀粉是一个还原剂,它
能够还原碘离子。
在反应中,碘离子和淀粉分子结合,形成了一个中
间物质,它被称为碘淀粉复合物。
这个复合物可以捕获周围的碘离子,这样继续形成复合物,最终导致剩余碘离子的浓度降低,使得反应结束。
这导致颜色的变化,从最开始淡黄色到最终的蓝黑色。
在实验中,可以通过改变溶液温度、淀粉和碘离子的浓度以及添
加催化剂等方法来影响颜色变化的速度。
此外,这项实验还是一个有
趣的教学工具,可以帮助学生更好地理解化学反应的基本原理。
总之,碘钟实验是一项有趣和有启发性的实验,它可以帮助学生
更深入地理解化学反应的基本原理。
通过实验,学生可以学习反应机制、催化和动力学,以及如何控制反应速度。
这个实验可以应用于许
多不同领域,从学术研究到化工工程领域,以及教育和教学。
碘钟反应方案

碘钟反应方案
碘钟反应是一种显著的化学反应,能够引起人们的极大兴趣。
在此,我们将讨论这个反应的方案及相关内容。
一、碘钟反应的方案
碘钟反应的实验步骤如下:
1.将30ml浓度为0.125mol/L的硫酸(H2SO4)倒入250ml的试管中。
2.加入5ml KI/KIO3混合液,其中KI的浓度为0.25mol/L,KIO3的浓度为0.1mol/L,同时加入4ml淀粉溶液,淀粉的浓度为2.5g/L。
3.不断摇晃试管,此时试管内出现蓝色反应混合液。
4.继续观察,等待5-10分钟左右,可以看到反应混合液逐渐变成深蓝色,然后再逐渐变浅,最终变成无色透明。
二、碘钟反应的相关内容
1.反应机理
碘钟反应是一种氧化还原反应,反应中涉及到氧气、锰离子、碘离子、三碘化物离子等。
反应机理非常复杂,尚未完全解析清楚。
2.反应速率
碘钟反应的速率是一个动态过程,会随着时间的推移而不断改变。
在反应初期,速率很快,深蓝色产生得很快,而随着时间的推移,速率逐渐减慢,最终反应停止。
3.应用与意义
碘钟反应是一种经典的化学反应,被广泛应用于教学、科学研究以及实际生产中,尤其是在化学分析、药物研究和可控释放材料等领域具有广泛的应用前景。
碘钟反应方案不仅把普通化学实验变得更加有趣,同时也深度探究了一种新的化学反应,为科学家们提供了新的研究途径。
在未来,这种反应有着极广泛的应用前景,仍有待进一步的研究与探索。
碘钟反应实验报告

碘钟反应实验报告碘钟反应⼀实验⽬的1.了解浓度、温度对反应速率的影响。
2.学习测定K 2S 2O 8 氧化KI 的反应速率常数及活化能的原理和⽅法。
3.练习⽤计算法、作图法处理实验数据。
⼆实验原理⽔溶液中,K2S2O8 与KI 发⽣如下反应的离⼦⽅程式S 2O 82-+2I -=I 2+2SO 42-在温度和离⼦强度不变,反应速率与反应物浓度的关系可近似表⽰为即动⼒学⽅程:V=-d [S 2O 82-]/dt =k [S 2O 82-]m [I-]n通常⼈们认为S 2O 82-氧化I -通常经历两个步骤S 2O 82-+I -= [IS 2O 8]3-。
(1)[IS 2O 8]3-+ I - = I 2+2SO 42-。
(2)反应(1)为速控步骤,则其速率⽅程为-d[S 2O 82-]/dt =k[S 2O 82-][I -]若[I -]不变( [I -] > >[S 2O 82-])则其速率⽅程为-d[S 2O 82-]/dt =k 1[S 2O 82-]k 1=k[I -],上述反应假定为准⼀级反应,则㏑[S 2O 82-] =-k 1t +㏑[S 2O 82-]0以㏑[S 2O 82-] 对时间t 作图,即可求得反应速率常数k 1为了保持[I-] 不变,本实验采⽤加⼊S2O32⽅法:2S2O32-+I2=2I-+S4O62- 此反应很快,可认为瞬间完成。
由加⼊的Na2S2O3的体积及其浓度,可以算出每次溶液呈现蓝⾊时所消耗的Na2S2O3的量,从⽽求出此时刻的S2O82-,得到⼀系列K2S2O8的浓度及其对应的反应时间,从⽽求的速率常数k1,改变反应温度,可求得不同反应温度的k1值,根据阿仑尼乌斯公式K=Ae-Ea/RT 取对数㏑K=-Ea/RT+㏑A以㏑K对1/T 作图,求出直线斜率,即可求得活化能Ea三装置和流程简图四原始数据及数据处理五实验结果及讨论思考题:1.碘钟反应的基本条件是什么?答:(1)在反应过程中维持[I-]不变,为此本实验采⽤补偿法,通过加⼊⼀定浓度的Na2S2O3来维持[I-]在反应过程中不变。
碘钟实验-反应级数与活化能之测定
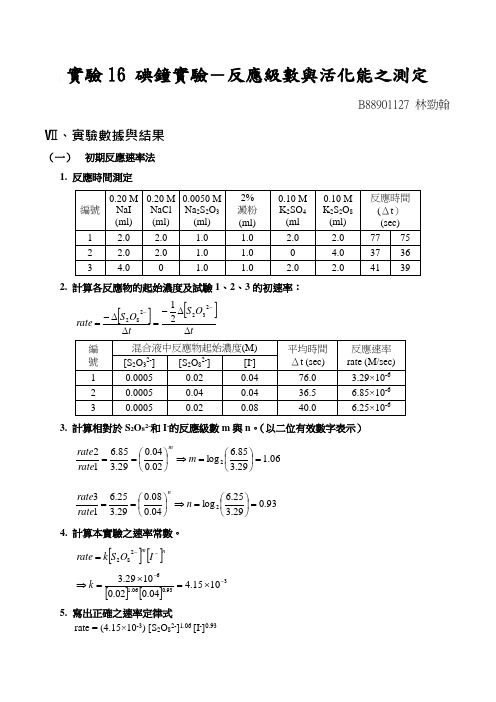
實驗16 碘鐘實驗-反應級數與活化能之測定B88901127 林勁翰Ⅶ、實驗數據與結果(一) 初期反應速率法 1. 反應時間測定2. 計算各反應物的起始濃度及詴驗1、2、3的初速率:[][]tO S t O S rate ∆∆-=∆∆-=--23228221 3. 計算相對於S 2O 82-和I -的反應級數m 與n 。
(以二位有效數字表示)06.129.385.6log 02.004.029.385.6122=⎪⎭⎫⎝⎛=⇒⎪⎭⎫ ⎝⎛==m rate rate m93.029.325.6log 04.008.029.325.6132=⎪⎭⎫⎝⎛=⇒⎪⎭⎫ ⎝⎛==n rate rate n4. 計算本實驗之速率常數。
[][]nmI O S k rate --=282[][]393.006.161015.404.002.01029.3--⨯=⨯=⇒k5. 寫出正確之速率定律式rate = (4.15×10-3) [S2O82-]1.06 [I-]0.936. 自行設計實驗之取量預定變色時間:73 sec ;實測變色時間:73 secCompared with sample 1 (let [K 2S 2O 8] = x):08.2767320.2767306.1106.1=⎥⎦⎤⎢⎣⎡=⇒⎥⎦⎤⎢⎣⎡=x x(二) 積分作圖法 1. 反應時間測定:2. 在此六次詴驗中,反應物(NaI 、K 2S 2O 8)之濃度均相同,僅是計時劑,Na 2S 2O 3, 用量不同。
由於Δ[S 2O 32-] = 2Δ[S 2O 82-],因此,當經時間t ,反應液變色時(即溶液中計時劑Na 2S 2O 3用盡,溶液呈現深藍色),溶液中剩餘之[S 2O 82-],可由反應液內所加入之Na 2S 2O 3的量來計算:(1) 由各瓶中所加Na 2S 2O 3體積及濃度,計算S 2O 32-莫耳數。
(2) 計算溶液中S2O82-之莫耳數。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1.碘钟反应
2 碘钟反应
1.1过氧化氢型碘钟
药品:硫酸,双氧水,碘酸钾,硫代硫酸钠,淀粉
向硫酸酸化的过氧化氢溶液中加入碘酸钾、硫代硫酸钠和淀粉的混合溶液。
此时在体系中存在两个主要反应,化学方程式为:
H2O2(aq)+3I−(aq)+2H+→I3−+2H2O
I3−(aq)+2S2O32−(aq) →3I−(aq)+S4O62−(aq)
1.2碘酸盐型碘钟
药品:硫酸,碘酸钾,亚硫酸氢钠,淀粉
向用硫酸酸化的碘酸盐中加入亚硫酸氢钠(以及少量淀粉溶液),此时体系中出现如下反应:
IO3− (aq) + 3HSO3− (aq) →I− (aq) + 3HSO4−(aq)
然后过量的碘酸根离子与碘离子发生归中反应:
IO3− (aq) + 5I− (aq) + 6H+ (aq) →3I2 + 3H2O (l)
接着亚硫酸氢钠将生成的碘还原:
I2 (aq) + HSO3− (aq) + H2O (l) →2I− (aq) + HSO4−(aq) + 2H+ (aq)
药品:硫酸,过硫酸钾,碘化钾,淀粉,硫代硫酸钠
通过过硫酸钾、过硫酸钠或过硫酸铵将碘离子氧化成碘单质。
加入硫代硫酸钠可以将碘单质还原回碘离子。
化学方程式如下:
2I−(aq) + S2O82−(aq) →I2 (aq)+ 2SO42−(aq)
I2 (aq) + 2S2O32−(aq) →2I−(aq) + S4O62−(aq)
将卢戈氏碘液、氯酸钠和高氯酸混合,化学方程式如下:
I3− →I− + I2
ClO3− + I− + 2H+ →HIO +HClO2
ClO3− + HIO + H+ →HIO2 + HClO2
ClO3− + HIO2 →IO3− + HClO2[1]
最新文件仅供参考已改成word文本。
方便更改。
