身边的化学物质
身边的化学物质-知识点

主题三身边的化学物质知识点一空气1.空气的成分按体积分数计算,大约是氮气占78%、氧气占21%、稀有气体占0.94、二氧化碳占0.03,其他气体和杂质占0.03。
因此空气是混合物。
2.通过实验测定了空气组成的科学家是( ) A.门捷列夫,B.达尔文,C.拉瓦锡3.空气中氧气含量的测定(见图1-3-1):实验步骤如下:先用弹簧夹夹住乳胶管,再点燃红磷,伸入瓶中,并塞上瓶塞,打开弹簧夹(1)红磷燃烧时可观察到的主要现象是冒白烟,产生黄色火焰,待红磷熄灭并冷却后,打开弹簧夹,可观察到的现象是水倒吸入集气瓶,约占瓶内空气体积的1/5,说明空气中的氧气被消耗了,约占空气体积的1/5。
图1-3-1(2)实验完毕后,发现某同学所做实验的广口瓶中水面上升明显小于瓶内空气体积的1/5,产生问题的原因可能是红磷量不足、没等冷却就打开了弹簧夹。
某同学所做实验的广口瓶中水面上升明显大于瓶内空气体积的1/5,产生问题的原因可能是红磷点着后没有迅速伸入集气瓶中、点燃红磷前没有夹好弹簧夹。
(3)通过该实验可推出氮气的性质有氮气不燃烧,不支持燃烧,不与水反应,难溶于水。
(4)此实验中能否用铁、铝代替红磷?不能,原因:铁、铝不能在空气中燃烧。
此实验中能否用碳、硫代替红磷?不能,原因:碳、硫燃烧后会生成新的气体。
(5)此实验中,瓶底预先放水的作用是吸收热量和白烟。
(6)此实验中选用红磷做可燃物的原因是红磷能在空气中燃烧;红磷燃烧后的产物是固态;红磷不能与氮气反应。
4.氧气的物理性质:通常情况下,氧气是一种无色无味的气体,在标准状况下,氧气的密度比空气大,不易溶于水。
5.氧气的化学性质:(1)氧气是一种化学性质比较活泼的气体。
(2)氧气具有助燃性,能支持燃烧。
6.氧气用途:供给呼吸:医疗急救、登山、潜水等助燃性:物质燃烧时作助燃剂、气割、气焊等。
7.二氧化碳的物理性质:通常状况下,二氧化碳是无色无味的气体,密度比空气大,能溶于水。
降温条件下,会变为固体,称作“干冰”。
身边的化学物质复习课

身边的化学物质复习课【学习目标】1.通过复习二氧化碳、氧气的性质、用途和实验室制法,掌握一般气体的实验室制法和常见气体的性质、用途。
2.通过复习有关“水”的一系列知识,引导学生认识以发展的眼光看待与水相关的知识以及水的用途。
3.通过复习,我们要关注生活中的化学、关注身边的化学物质并主动探究,学会保护我们的环境,并用所学的知识解决生产、生活中的问题。
【重难点】1、氧气的物理性质和化学性质。
2、二氧化碳的化学性质和水的组成。
3、氧气和二氧化碳的实验室制取。
4、水资源的保护和利用。
【教学过程】一、自主学习1、在通常情况下,氧气是一种、的气体,在0℃,1.01×105Pa下,密度为g.L-1,液态氧为色,固态氧为的状固体,溶于水。
2、在通常情况下,二氧化碳是一种、的气体,固态的二氧化碳常被称为,常用于、、。
3、氧气的检验方法:4、二氧化碳的检验方法:二、合作探究(一)O2和CO21、O2和CO2的性质和用途O2CO2物理性质化学性质用途功与过讨论:1、铝、铁是“同门”两兄弟,为何“自我保护能力”却截然不同呢?到底谁惹的祸呢?2、空气中的二氧化碳能不能更少,能不能更多?2、O2和CO2的实验室制取O2CO2原料反应原理仪器装置收集方法(二)水1.水的电解实验。
如右图所示,通直流电后,电极上出现气泡,一段时间后停止通电,试管1和试管2中所收集到的气体的体积比约为。
试管1中的气体能使带火星的木条,说明是;试管2中的气体能够,火焰呈色,说明是;该实验说明水是由元素组成。
写出该反应的文字表达式式。
2.水的净化(1)蒸馏:获取较纯净水的最好方法(2)过滤①过滤操作中有哪些注意事项?一贴:二低:三靠:。
②玻璃棒的作用是。
③过滤后的滤液仍浑浊的原因有哪些?(3)自来水的生产过程:3.借助水完成实验检查装置气密性。
如何检查装置的气密性?4.鉴别硬水和软水是。
5.水的保护和利用:水质污染的原因,:。
如何防止水污染:。
沪教版九年级上册化学解读课件:第2章 身边的化学物质(共47张PPT)

知识点 氧气的化学性质(重点)
氧气是一种化学性质非常活泼的气体,在一定条件下 能与许多物质发生化学反应,但不是与所有物质都能 发生化学反应。
知识点二氧化碳的制备与利用(重、难点) 利用生活中的用品制二氧化碳。
实验用品:塑料水瓶一个(带盖),一次性塑料杯一个,废弃注射 器一个,玻璃片一个,废弃塑料吸管,蛋壳,食醋,澄清石灰水。
知识点二氧化碳的制备与利用(重、难点) 检验和验满在试剂选择和方法上的区别:
检验是利用某气体的特性,使用某种方法证明该气体是什么 气体。验满是已知该气体是什么气体,使用某种方法来检验 该气体是否收集满。因此检验二氧化碳一般用澄清石灰水, 而不用燃着的木条,因为不支持燃烧除了二氧化碳之外,还有 氮气等也不支持燃烧。
知识点 水资源的综合利用
赤潮和水华:
(2)水华的危害 “水华”,就是水体中藻类大量繁殖的一种现象,水体呈蓝、 绿或暗褐色,是水体富营养化的一种特征。“水华”主要由 于生活及工农业生产中含有大量氮、磷的废水、污水进入水 体后,藻类大量繁殖,成为水体中的优势种群,“水华”现象便 随之出现。出现“水华”现象后,面积会逐年扩散,持续时间 逐年延长。“水华”主要发生在静态水体,近年来太湖、滇 池、巢湖、洪泽湖都出现过水华现象。
知识点水的净化(重、难点)
过滤后滤液仍然浑浊可能的原因: ①滤纸破损。 ②液面高于滤纸边缘,导致液体没有经过充分过滤就流入 到滤液中。 ③滤纸高于漏斗边缘,使滤液从漏斗外壁直接进入滤液中。 ④盛装滤液的仪器本身就不干净。
知识点水的净化(重、难点) 区分明矾吸附作用与活性炭吸附作用:
身边的化学物质

(二)二氧化碳的性质、用途和制取
1、物理性质:无色、无味、密度比空气大、微溶于水。 其固态物俗称 干冰 。 2、化学性质:(酸性氧化物性质及氧化性)
(1)二氧化碳通入紫色石蕊试液: CO2+H2O ═ H2CO3
(2)CO2+C ═ 2CO (氧化性) (3) CO2+2Mg ═ 2MgO+C (氧化性) (4)检验二氧化碳: CO2+Ca(OH)2 ═ CaCO3↓+H2O (5)吸收二氧化碳或氢氧化钠变质: CO2+2NaOH ═ Na2CO3+H2O
肥皂水
区分。
4、水污染源:工业的废水、废渣、农业中农药、化肥的滥用,
生活污水、垃圾的任意排放水
溶液
1、溶液是 均一 的、 稳定 的混合物。 溶液由溶剂和溶质组成。 常见的溶剂有水、酒精、汽油。 初中溶液的溶剂为 水 。 溶液的质量= 溶质的质量+溶剂的质量 悬浊液:固体小颗粒与液体形成的要分层的混合物。 乳浊液:由小液滴与液体形成的要分层的混合物。 汽油——油污能溶解在汽油里,形成溶液,随着汽油挥发 油污就能被带走。 洗涤剂——乳化作用,它能使油污分散成无数细小的液滴, 随水流去。 + NH 4 含 的化合物溶于水会吸热,使溶液温度降低。 浓H2SO4、固体NaOH、CaO 溶解时会放热, 使溶液温度升高。
从A溶液中获取A晶体可用 降温结晶 的方法获取晶体。
从B的溶液中获取晶体,适宜采用 蒸发结晶 的方法获取晶体。
7、溶质质量分数
溶液中溶质的质量与溶液的质量之比——溶质质量分数,即: 溶质质量 溶质质量分数(w)= ×100% 溶液质量 8、溶液稀释、混合计算
①、溶液稀释:稀释前后溶质质量不变,即:m×a%=n×b%
身边的化学物质
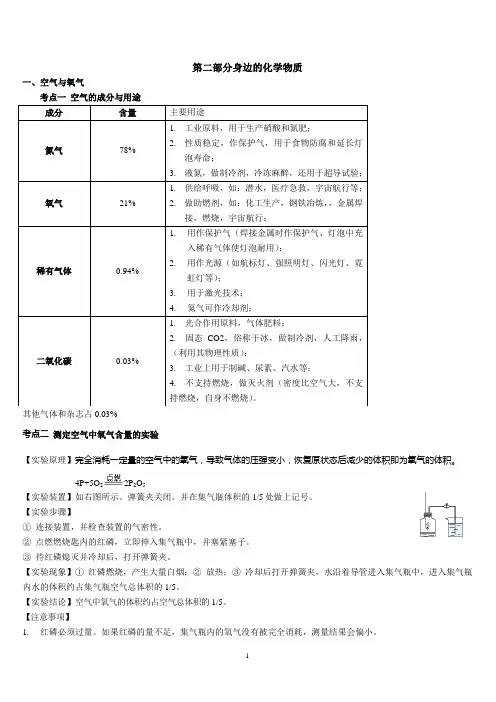
第二部分身边的化学物质一、空气与氧气考点一 空气的成分与用途其他气体和杂志占0.03%考点二 测定空气中氧气含量的实验【实验原理】完全消耗一定量的空气中的氧气,导致气体的压强变小,恢复原状态后减少的体积即为氧气的体积。
4P+5O 22P 2O 5【实验装置】如右图所示。
弹簧夹关闭。
并在集气瓶体积的1/5处做上记号。
【实验步骤】① 连接装置,并检查装置的气密性。
② 点燃燃烧匙内的红磷,立即伸入集气瓶中,并塞紧塞子。
③ 待红磷熄灭并冷却后,打开弹簧夹。
【实验现象】① 红磷燃烧,产生大量白烟;② 放热;③ 冷却后打开弹簧夹,水沿着导管进入集气瓶中,进入集气瓶内水的体积约占集气瓶空气总体积的1/5。
【实验结论】空气中氧气的体积约占空气总体积的1/5。
【注意事项】1. 红磷必须过量。
如果红磷的量不足,集气瓶内的氧气没有被完全消耗,测量结果会偏小。
2.装置气密性要好。
如果装置的气密性不好,集气瓶外的空气进入集气瓶,测量结果会偏小。
3.导管中要注满水。
否则当红磷燃烧并冷却后,进入的水会有一部分残留在试管中,导致测量结果偏小。
4.冷却后再打开弹簧夹,否则测量结果偏小。
5.如果弹簧夹未夹紧,或者塞塞子的动作太慢,测量结果会偏大。
考点三空气污染和防治1.空气污染的污染物是有害气体和烟尘。
污染源包括煤、石油等化石燃料燃烧产生的二氧化硫、二氧化氮、一氧化碳(三大有害气体),还包括工业废气等方面。
2.计入空气污染指数的项目为:二氧化硫、一氧化碳、二氧化氮、可吸入颗粒物和臭氧等。
3.空气污染的危害:造成世界三大环境问题(温室效应、臭氧层破坏、酸雨)、损害人体健康、破坏生态平衡、影响作物生长、破坏生态平衡等。
4.防治空气污染:加强大气质量监测;改善环境状况;减少使用化石燃料;使用清洁能源;积极植树、造林、种草;禁止露天焚烧垃圾等。
考点四氧气的性质1.物理性质氧气通常是无色、无味的气体,密度比空气大,不易溶于水,液态、固态时呈淡蓝色。
身边的化学物质知识梳理

身边的化学物质(第1课时)一、知识梳理1.通常状况下,氧气是一种无气无味的气体,密度比空气密度略大,因而可用向收集,_______溶于水,因此,也可用排水法法收集2.铁在氧气中燃烧的现象是反应方程式为.做该实验时要在细铁丝末端系上一根火柴梗的目的是.氧气瓶底铺少量的纱子或加少量水的目的是.3.镁条在空气中燃烧的最能说明发生了化学变化的现象是, 反应方程式为.4.红磷在空气中燃烧的反应方程式为是该反应产生大量的而不是雾。
.5.硫在空气中燃烧产生的火焰是色,在氧气中燃烧燃烧产生的火焰是色6.分别写出氢气、一氧化碳、甲烷在氧气中燃烧的反应方程式这三种物质都是无色气体,鉴别它们可以根据它们的不同。
7.氧气的化学性质比较活泼,许多物质会与氧气发生反应,物质与氧气发生的缓慢的氧化反应叫缓慢氧化, 如生活中的。
8.举出氧气的两个重要用途9.工业上制取O2是用的分离液态空气法,其原理是根据氧气和氮气的不同.该过程属于____________变化。
10.写出用高锰酸钾和过氧化氢制氧气的反应方程式____________________________ _________________________________11.现有下图所示的实验装置,请回答问题:(1)在加入药品之前应对实验装置进行。
(2)若选用A装置制备气体时应考滤的因素是。
(3)可用于实验室用高锰酸钾制备和收集O2的一套装置是(填字母,下同)。
⑷写出实验室用过氧化氢溶液和二氧化锰制取氧气的发生装置是,并据此选择上图中组装一套制取于燥氧气的装置,收集氧气时,验满的方法是。
⑸写出实验室用用金属锌和稀硫酸制取氢气的化学方程式__________________________.制备和收集较纯净的氢气的一套装置是(填字母)。
二、牛刀小试1.(1)要证实“氢气的密度比空气小”,这属于氢气的_____(填“物理”或“化学”)性质,请设计一种简单的实验方案,简述该方案的操作方法和有关的现象________________________ 。
化学笔记第2章身边的化学物质
通常情况下,氧气是一种无色无味的气体,密度稍大于空气,氧气不易溶于水。
液态氧气呈淡蓝色液体,固态氧气呈淡蓝色雪花状固体。
2.氧气的化学性质:比较活泼的气体,能与许多物质发生化学反应。
例如:⑴木炭在氧气中的燃烧:化学方程式:C+O2点燃CO2实验现象:剧烈燃烧,发白光,放大量热,生成使澄清石灰水变浑浊的气体。
⑵蜡烛的燃烧:文字表达式:石蜡+氧气点燃→二氧化碳+水;实验现象:剧烈燃烧,发白光,瓶内壁有水雾出现,生成使澄清石灰水变浑浊的气体。
⑶铁丝在氧气中燃烧:化学方程式:3Fe+2O2点燃Fe3O4实验现象:剧烈燃烧,火星四射..固体。
....,放出大量热,生成黑色※铁丝在氧气中燃烧实验的注意事项:(如图甲)①铁丝绕成螺旋状的目的是增大铁丝与氧气的接触面积及受热面积;②铁丝一端系根火柴的目的是引燃(预热);③等火柴即将燃尽时,再放入集气瓶内,防止:火柴燃烧消耗过多氧气;④集气瓶内放少量水或铺一层细沙的目的是:防止灼热的生成物溅落瓶底,使集气瓶炸裂。
⑷硫在氧气中燃烧:(如图乙)化学方程式:S+O2点燃SO2实验现象:剧烈燃烧,产生明亮的蓝紫色火焰,放大量热,生成有刺激性气味的气体。
注意点:该实验集气瓶内装少量水或氢氧化钠溶液,用于吸收生成的二氧化硫气体,减少大气污染。
3.氧化反应:⑴定义:物质与氧气的反应都是氧化反应。
⑵种类:①剧烈氧化反应,如:物质的燃烧。
②缓慢氧化反应,如:金属生锈,食物腐败,新陈代谢,有机肥的腐熟等。
4.氧气的用途:⑴供给呼吸;如:宇航、潜水、登山、急救等。
⑵支持燃烧;(即助燃性)如:富氧炼钢、氧炔焰焊接金属、火箭助燃剂等。
自然界中氧气的获得途径:绿色植物的光合作用;●工业上制氧气:根据氮气和氧气的沸点不同,分离液态空气法制取氧气;(物理变化)●实验室制取氧气的方法:一、加热高锰酸钾制氧气1.药品:高锰酸钾(化学式:KMnO4,紫黑色晶体颗粒。
)2.反应原理:文字表达式:高锰酸钾加热→锰酸钾+二氧化锰+氧气;化学方程式:2KMnO4△K2MnO4+MnO2+O2↑3.实验装置仪器名称:①铁架台,②试管,③酒精灯,④集气瓶,⑤水槽。
50例生活中的化学现象及解释
化学就在我们身边,今天给大家整理了50例生活中的化学现象及解释。
一起看看吧,涨知识啦~1.在山区常见粗脖子病〔甲状腺肿大〕,呆小病〔克汀病〕,医生建议多吃海带,进行食物疗法。
上述病患者的病因是人体缺一种元素:碘。
2.用来制取包装香烟、糖果的金属箔〔金属纸〕的金属是:铝。
3.黄金的熔点是1064.4℃,比它熔点高的金属很多。
其中比黄金熔点高约3倍,通常用来制白炽灯泡灯丝的金属是:钨。
4.有位妇女将6.10克的一个旧金戒指给金银匠加工成一对耳环。
她怕工匠偷金或掺假,一直守在旁边不离开。
她见工匠将戒指加热、捶打,并放人一种液体中,这样屡次加工,一对美丽的耳环加工完毕了。
事隔数日,将这对耳环用天平称量,只有5.20克。
那么工匠偷金时所用的液体是:王水。
5.黑白相片上的黑色物质是:银。
6.很多化学元素在人们生命活动中起着重要作用,缺少它们,人将会生病。
例如儿童常患的软骨病是由于缺少:钙元素。
7.在石英管中充入某种气体制成的灯,通电时能发出比萤光灯强亿万倍的强光,因此有“人造小太阳〞之称。
这种灯中充入的气体是:氙气。
8.在紧闭门窗的房间里生火取暖或使用热水器洗澡,常产生一种无色、无味并易与人体血红蛋白〔Hb〕结合而引起中毒的气体是:CO。
9.地球大气圈的被破坏,则形成臭氧层空洞,致使作为人们抵御太阳紫外线损害的臭氧层受到损坏,引起皮肤癌等疾病的发生,并破坏了自然界的生态平衡。
造成臭氧层空洞的主要原因是:冷冻机里氟里昂泄漏。
10.医用消毒酒精的浓度是:75%。
11.医院输液常用的生理盐水,所含氯化钠与血液中含氯化钠的浓度大体上相等。
生理盐水中NaCl的质量分数是:0.9%。
12.发令枪中的“X纸〞〔火子〕打清脆,产生的白烟是:五氧化二磷。
13.萘卫生球放在衣柜里变小,这是因为:萘在室温下缓慢升华。
14.人被蚊子叮咬后皮肤发痒或红肿,简单的处理方法是:擦稀氨水或碳酸氢钠溶液。
15.因为某气体A在大气层中过量累积,使地球红外辐射不能透过大气,从而造成大气温度升高,产生了“温室效应〞。
身边的化学物质
(空气和水、金属与金属矿物)
一.身边的化学物质考试要求
1. 空气、氧气、二氧化碳、水、金属、 金属矿物
(1) ★知道层次 8个知识点 (2) ★★认识层次5个知识点 (3) ★★★理解应用层次2个知识点
用氧气的性质解释一些常见的现象 用二氧化碳的性质解释一些常见的现象
2.身边的化学物质知识的特点
b c
判断:
1 活动性最强的金属是(A )
二.知识点的梳理与落实
(一) 物质间的相互关系织成网 (二) 金属单质及化合物间的转化穿成串 (三) 用途与性质的关系结合实际
(一)物质间的相互关系织成网
1、氧气的制取和性质关系网
Fe3O4、Fe2O3、MgO、Al2O3
KMnO4
CO2或CO
H2O2
SO2
H2O HgO
O2
H2O P2O5
(一)物质间的相互关系织成网
O2
基本反应类型为
。
(3)已知反应④、⑤、⑥中,
CO 一还同个有元有一素沉个,D淀没、生有F成明只C,显含O另现一22一象种个。相有B同、气元E体不素生含。成相,
H2O
CO2
反应④的化学方程式为
,
反应⑤的化学方程式为
C
CO
(二)金属单质及化合物间的转化穿成串
Fe3O4
Fe2+ Fe Fe2O3 Fe3+
(一)、空气和 水
2、水
例电解1、水的小微华观过用程右图电解水装置 探究水的组成,通电后两个电 极都有气体放出,一段时间后, 左侧试管内的气体体积是右侧 试管内气体体积的两倍。经过 检验左侧试管内气体能够燃烧, 右侧水分试子管内气体氧能分使子 带火氢星分的子 dfdf 木条复燃。
生活中常见的化合物1
中考回顾:
考点4 生活中常见酸、碱、盐的用途
命题角度:结合物质分析用途
考点聚焦
考点5、常见酸、碱、盐的性质及题型分析。
如果把初中化学看做是一部长篇小说的话, 那么酸碱盐部分就是这部小说的高潮部分, 可谓是重中之重,在中招考试中有着非常 重要的地位,尤其是酸碱盐的化学性质.这 部分内容有很大的灵活性和一定的深度,
中考回顾:
考点7 有机物 命题角度:认识常见的有机物
红 ,遇碱变 蓝 无色酚酞试液:遇酸 不变色 , 遇碱变 红
. .
3、物质的俗称: 氧化钙— 生石灰 ; 氢氧化钙— 熟石灰、消石灰 ; 食盐 碳酸钙— 大理石、石灰石 ; 氯化钠— ; 氢氧化钠— ;碳酸钠— 纯碱 .
火碱、烧碱、苛性钠
4、必须密封保存的有: 浓盐酸( 挥发 性)、浓H2SO4( 石灰水(与 CO2 反应) 氢氧化钠(易 吸水 性)、
考点聚焦
pH
考点1
酸碱指示剂 与pH
pH
pH图像变化
碱中加水的图像
酸中加水的图像
7
7
0
m( 水 )
0
m( 水 )
pH 为酸中加碱的图像
pH
碱中加酸的图像
7
7
0
m( 碱 )
0
m(酸 )
考点聚焦
考点1
酸碱指示剂 与pH
(下)P63
溶液酸碱度的重要意义 1.化工生产中许多反应必须控制在一定pH范围内。 2.农作物适宜在pH为____ 7 的土壤中生长。 7 或接近____ 5.6 3.测定雨水的pH(酸雨的pH小于________) ,可以了解 空气的污染情况。 4.测定人体内或排泄出的体液的pH,可以了解人体的健 康状况。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
重难点2 氧气和二氧化碳的实验室制取法比较 1.氧气和二氧化碳的实验室制取对比
气体 氧气 二氧化碳 ①氯酸钾和二氧化锰;②高锰酸 大理石或石灰石与稀 药品 钾;③双氧水和二氧化锰 盐酸 ① 2KMnO △ K MnO + 4 2 4 CaCO3+2HCl MnO2+ O2↑ CaCl2 + MnO 反应 2KCl+3O2↑ ② 2KClO3 Δ H2O+CO2↑ 原理
15Βιβλιοθήκη 主题一身边的化学物质
(3) 实验室制取二氧化碳,应选择的药品是
稀盐酸和石灰石(或大理石)用C装置收集二氧化
碳时,证明已经收集满的方法是 将燃着的木条放在集 .
气瓶口,木条熄灭,说明二氧化碳已满 。
(4)小马同学要收集一瓶氧气,供细铁丝在氧气中
燃烧的实验使用,最好选择的气体收集装置是 E , 理由是 集气瓶底要留少量水 。
9
主题一
身边的化学物质
【方法指导】解答该类试题时,首先对框图进行分 析,然后联系初中化学常涉及的物质进行综合分析, 如能和氧气连续2次发生化学反应的常见物质为碳单 质,中间产物为CO,终产物为CO2,然后确定框图 的中心是CO2,最后联系CO2的相关转化对本题解答 即可。
返回重难点
10
主题一
身边的化学物质
31
主题二
水与常见的溶液
【方法指导】甲、乙两种物质的溶解度随温度
的变化趋势不同,温度升高后,甲物质溶解度
增大,乙物质溶解度减小,甲的饱和溶液变为
不饱和溶液,乙的饱和溶液中有晶体析出,溶
液质量减小,但乙仍为饱和溶液。解答此类题 时,需将题干中给出的信息与溶解度曲线相结 合,综合分析后才能正确解答。
返回重难点
体或沉淀的质量,即反应后溶液的总质量=所给物质的质
量之和-生成气体的质量[-生成沉淀的质量(包括固体 杂质或其他不溶物)]
34
主题二 例3
水与常见的溶液 将氯化钙和碳酸钙的混合物12g放入一个烧
杯中,然后往其中加入123.4g稀盐酸,恰好完全
反应,称量反应后剩余物质的总质量为131g。
29
主题二 例2
水与常见的溶液 甲、乙两种固体的溶解度曲线如图。将①②两
试管中的甲、乙饱和溶液(均有少量未溶解的固体)
放进盛有热水的烧杯里。升高温度后,下列有关说法
正确的是( C )
A.①②两溶液的质量一定相等 B.①②两溶液均变为不饱和溶液 C.①溶液质量增加,②溶液质量 减少 D.①溶液中溶质的质量分数一定大于②溶液
22
主题二
水与常见的溶液
5.曲线表示物质的溶解度随温度的变化而变化
的趋势。如图,A、B两物质的溶解度都随温度的
升高而增大。
6.曲线的倾斜程度可表示物质的溶解度受温度
变化的影响程度。如图,相比之下,A物质的溶 解度受温度影响较大,B物质的溶解度受温度影响 较小。
23
主题二
水与常见的溶液
7.根据曲线可选择合适的结晶方法。
25
主题二
水与常见的溶液
【解析】(1)m点为t℃时,甲、乙两物质溶解度曲 线的交点,表示在t℃时,甲、乙两物质的溶解度相 等。(2)t℃时,甲的溶解度为40g,且甲物质的溶 解度随温度升高而增大,故当温度大于t2时,100g水 中加入40g甲物质所形成的溶液为不饱和溶液。 (3)甲物质的溶解度受温度的影响较大,乙物质的 溶解度受温度的影响较小,故将甲物质中混有的少量 乙物质分离可用的方法是冷却热饱和溶液。
4
O2
CO2+H2O
CuO
主题一
身边的化学物质
2.化合物分解后产生氧气的反应(如图2,其中 ①②③为实验室制取O2的原理) H2O2 ② ① O2
KMnO4
③ H2O
KClO3
HgO
5
主题一
身边的化学物质
3.物质与二氧化碳的反应及转化关系图
CH4
C
CaCO3
C2H5OH
CO2
CO
H2CO3
Cu
Cu2(OH)2CO3
2
③ H2O2
MnO2
H2O + O2 ↑
11
主题一
身边的化学物质
实验装置
排水法(不易溶于水)或 向上排空气法(能溶 收集方法 向上排空气法(密度比空 于水且密度比空气大) 气大)
收集装置
12
主题一
身边的化学物质
将带火星的木条伸入集 通入澄清石灰水中,澄
检验方法
气瓶内,木条复燃
清石灰水变浑浊
将带火星的木条靠近集 将燃着的木条放在集气
8
主题一
身边的化学物质
【解析】这是一道框图型推断题,解题的关键是抓住 “突破口”,熟练掌握物质之间相互转化的关系。因 A为黑色固体,能与氧气反应生成两种不同物质,故A 为C,完全燃烧生成CO2,不完全燃烧生成CO,CO还 能和氧气反应,故B为CO,E为CO2;C为难溶性钙 盐,则C为CaCO3,D为H2CO3。C转化为CO和CO2为 化合反应,CaCO3与CO2之间的转化可以是复分解反 应或分解反应,故一定不包含置换反应。
14
主题一 例2
身边的化学物质 实验室里有高锰酸钾、过氧化氢溶液、二氧化
锰、稀盐酸、稀硫酸和石灰石以及下列装置:
请回答下列问题: (1)仪器①的名称 长颈漏斗 。 (2)实验室用过氧化氢溶液和二氧化锰制取氧 气,应选择的发生装置为 A (填字母序号,下同) MnO2 2H O 2H2O+O2↑ 。 ,反应的化学方程式为 2 2
4.饱和溶液加热蒸发掉一部分水,再降温 至原来的温度,则溶质、溶剂会按一定比例 减小,溶质质量分数不变。 说明:对于饱和溶液来说,若恒温蒸发溶剂,
则溶质质量分数不会改变。
28
主题二
水与常见的溶液
5.不饱和溶液加热蒸发掉一部分水,使其恰好 饱和,则溶剂质量减小,溶质质量不变,溶液的 溶质质量分数增大。 6.影响溶质质量分数的因素是溶质、溶剂的质 量,与温度、是否饱和无关。在改变温度的过程 中若引起溶质、溶剂质量改变,则溶质的质量分 数也会发生改变。
如图,若要从饱和溶液中析出晶体A,宜采
用降温结晶的方法;若要从饱和溶液中析出 晶体B,宜采用蒸发溶剂的方法。
24
主题二
水与常见的溶液
例1甲、乙两种物质的溶解度曲线如图所示,请回答 (1)图中m点表示的意义:t1℃时, . 甲、乙两物质的溶解度相等 。 (2)当温度大于t2℃,向100g水 中加入40g甲物质,所形成的溶液是不饱和 (填“饱 和”或“不饱和”)溶液。 (3)甲物质中混有少量乙物质时,提纯甲物质的 方法是 冷却热饱和溶液(或降温结晶) 。
32
主题二
水与常见的溶液
重难点3 溶液中溶质质量分数与化学方程式相结合 的计算方法 1.认真审题,弄清已知数据是溶质质量还是溶液 质量。溶液中参加反应的一般是溶质,因此,代入 化学方程式进行计算的相应物质质量应是溶质质量 ,切不可将溶液质量误认为溶质质量代入计算。若 题中已知溶液质量和溶液中溶质的质量分数,可利
验满方法
气瓶瓶口,如果木条复 瓶瓶口,火焰立即熄灭,
燃,说明已收集满
①组装仪器;②检查气密性; ③装药品;④固定试管;⑤加 热;⑥收集;⑦将导管移出水 槽;⑧熄灭酒精灯
说明已收集满
①组装仪器;②检查气密性; ③加入石灰石;④加入稀盐酸; ⑤收集
操作步骤
13
主题一
身边的化学物质
注意 事项
①试管口应略向下倾斜; ①不能用稀H2SO4代替 ②当用高锰酸钾制氧气时, 稀盐酸;②长颈漏斗的 试管口处应塞一团疏松棉 末端应伸入液面以下; 花;③排水法收集时,当 ③反应器中的导管刚露 气泡连续、均匀放出后再 出橡皮塞即可;④用向 收集;④排水法收集完后, 上排空气法收集时,导 先移出导管,再熄灭酒精 管口应伸入集气瓶并接 近集气瓶的底部 灯;⑤若用双氧水和 MnO2制O2,操作步骤同 CO2的制取
用公式换算成溶质质量:溶质质量=溶液质量×溶
质的质量分数。
33
主题二
水与常见的溶液
2.计算反应后溶液中溶质的质量分数时,首先要找到两 个量:即反应后溶质的质量和溶液的质量。有些物质与水
的反应容易被忽略,导致溶质质量分数的计算错误。也有
些反应由于生成了沉淀、气体或含有杂质,使溶液的质量 较难计算。若生成物只有液体,反应物不含杂质,则生成 物溶液的质量等于反应物的质量之和;若生成物有气体或 沉淀,则生成物溶液的质量等于反应物溶液的质量减去气
返回主题目录
主题二
水与常见的溶液
主题二
水 与 常 见 的 溶 液
水与常见的溶液(第四、九单元)
水→ 水的组成、硬水和软水、水的净化方法
组成、特征、物质溶解时的放热与吸热现象 分类:饱和溶液、不饱和溶液(判断与转化)
溶液
量度
溶解性的量度:溶解度→ 溶解度曲线
溶液的浓度:溶质质量分数
乳化现象
模块一
身边的化学物质
第二部分 基础专题攻略
模块一 身边的化学物质
主题一
主题二
我们周围的空气
水与常见的溶液
主题三
主题四
金属与金属矿物
生活中常见的化合物
1
主题一
身边的化学物质
主题一
我们周围的空气
我 主要成分→按体积计算:N2约占78%、O2约占21% 们 周 氧气→ 物理性质、化学性质、实验 围 室制法、用途 的 空 重要成分 二氧化碳→物理性质、化学性质、实 气 验室制法、用途
返回重难点
26
主题二 重难点2
水与常见的溶液 溶液中的变与不变
1.溶液稀释后,溶质质量不变,溶剂质量增加,溶 质质量分数减小。 2.饱和溶液中加入一定量的溶质,溶质质量、溶剂 质量、溶质质量分数均不变。 3.不饱和溶液继续溶解溶质后,溶质质量、溶液质 量、溶质质量分数均增大。
