金属材料课件2
合集下载
第八单元 课题2 金属的化学性质课件—九年级化学人教版下册

学习目标
1.通过学习知道镁、铝、铁、铜等金属与氧气的反 应及剧烈程度。 2.认识常见金属与稀盐酸、稀硫酸的反应,了解反 应现象,知道什么是置换反应。 3.探究铝和铜、银和铜的金属活动性强弱。 4.知道金属活动性顺序,会应用金属活动性顺序解 决实际问题。
讲授新知
一、金属和氧气的反应
知识回顾 镁条在空气中燃烧
知识小结
1.判断金属活动性的方法一: 可根据金属与氧气反应的难易程度或者相同条件下反应现 象的剧烈程度进行判断。 通过以上实验现象,可知金属的活动性顺序: Mg>Al>Fe,Cu>Au
2. 大多数金属都能与氧气发生反应,生成相应的金属氧化 物,但反应的难易程度和剧烈程度是不相同的。
讲授新知
二、金属与稀盐酸、稀硫酸的反应
躬行实践 探究实验2 比较金属铝、铜、银的活动性
以上反应类型都属于置换反应,得出金属活动性顺序为 Al>Cu>Ag。
讲授新知 金属活动性顺序
1.在金属活动性顺序中,金属的位置越靠前,它的活动性越 强。 2.在金属活动性顺序中,位于氢前面的金属能置换出盐酸、 稀硫酸中的氢。 3.在金属活动性顺序中,位于前面的金属能把位于后面的金 属从它们化合物的溶液里置换出来(钾钙钠除外)。
行成于思
可否用铁桶盛放硫酸铜溶液?或者说:能否用铁桶配制农药 波尔多液(配制波尔多液时用到硫酸铜溶液)?
根据金属活动性顺序,铁的金属活动性大于铜,如果用铁桶 配制农药波尔多液,铁会把硫酸铜溶液中的铜置换出来,所 以不能用铁桶盛放硫酸铜溶液,不能用铁桶配制农药波尔多 液。
知识总结
1.金属的化学性质:与氧气反应,与稀盐酸(稀硫酸)反应,金 属越活泼,反应越容易,越剧烈。 2.置换反应:由一种单质与一种化合物反应,生成了另一种单质 和另一种化合物的反应叫做置换反应, A+BC===B+AC。 3.判断金属活动性的方法:金属与氧气反应的剧烈程度、金属与 酸反应的剧烈程度、金属能否与其他金属化合物的溶液反应。 4.金属活动性顺序:
常见的金属材料2

炉渣出口
炼铁: 思考:1、炼铁的原料是什么?反应的原理?
集气袋
Fe2O3
CO
澄清石灰水
思考:2、该实验的操作步骤怎样?有何现象? 要注意哪些问题?
炼铁的原料: 石灰石、焦炭、铁矿石
炼铁的原理: 高温
e
思考:炼钢的原料及原理?
原料主要是炼钢生铁。钢冶炼主要是减低含碳量
原理主要是: C+O2 ====CO2
点燃
4、主要反应 问题1:原料中
焦炭和石灰石 (1)还原剂的形成 的作用是什么? 点燃 C+O2=CO2+Q 高温 答:焦炭的作 CO2+C=2CO-Q 用是作燃料和 (2)铁的还原 高温 形成还原剂。 Fe2O3+3CO=2Fe+3CO2 石灰石的作用 (3)炉渣的形成 是作熔剂,除 高温 CaCO3=CaO+CO2 脉石。
第一节:常见的金属材料2
有关铁的常识 1、铁元素在自然界中的存在 铁在地壳中大量存在,占有4.75%,居第四位.主要以铁 矿石的形式存在(如赤铁矿、磁铁矿等)生活中常见 的铁制品多为铁的合金,不是纯铁。 思考:实验器材哪些是用铁制成的? 2、人体中的铁元素
铁
焦炭
石灰石
铁矿石
炼铁高炉
生 铁 出 口
12:100= m :0.12克 C%=0.0144克/3克=0.48%
m =0.0144克
高温
CaO+SiO2=CaSiO3
练习题:
某铁合金样品3g在纯氧中完全燃烧,将所得气体全部通入足量的 澄清石灰水中只生成沉淀0.12克,则此铁合金属于( ) A
A 钢 B 生铁 C 赤铁矿 D 纯铁 解题步骤: 点燃 C+O2===CO2
12 m
金属材料(第2课时 常见的合金及应用)-高一化学课件(人教2019必修第一册)

A.a点时溶液中存在的金属阳离子仅有Cu2+和Fe2+
√B.b点时溶液中发生的反应为Fe+Cu2+===Cu+Fe2+
C.c点时加入的铁粉与Cu2+反应
√D.原溶液中Fe2(SO4)3和CuSO4的物质的量之比为1∶2
11.硫酸铁铵[NH4Fe(SO4)2·xH2O]是一种重要铁盐。为充分利用资源,
6.将m g镁铝合金投入500 mL 2 mol·L-1的盐酸中,固体完全溶解, 收集到气体5.6 L(标准状况下)。向反应所得溶液中加入4 mol·L-1的氢 氧化钠溶液,沉淀质量的最大值为13.60 g,则m的值为( A ) A.5.10 B.8.50 C.9.35 D.11.48
7.将一定质量的Al、Mg混合物加入足量的盐酸中,充分反应后得 到标准状况下的氢气8.96 L;如果将等质量的该混合物加入足量的 NaOH溶液中,充分反应后得到标准状况下的氢气6.72 L。 (1)混合物与NaOH溶液反应的离子方程式为 ___2_A_l_+__2_O__H__-_+__2_H__2_O_=__=_=__2__A_l_O_2_-__+__3_H_2_↑_________。 (2)求混合物中各成分的质量。
A.①② B.①③ C.①④ D.②④
(3)镁、铝合金与盐酸完全反应后,加入过量的氢氧化钠溶液,最后的结 果是 C 。 A.没有沉淀物生成 B.只有氢氧化铝沉淀生成 C.只有氢氧化镁沉淀生成 D.有氢氧化铝和氢氧化镁沉淀生成
10.现代建筑的门窗架常用电解加工成的古铜色硬铝制造。取硬铝样品 进行如下实验(每一步试剂均过量),由此可以推知硬铝的组成可能为
第三章 第二节 金属材料
第2课时 常见的合金及应用 Nhomakorabea一、铁合金
一 铁合金 1.合金:合金属于混合物,合金的机械性能一般 优于 各成分金属;合金的 硬度一般 高于 它的各成分金属。 2.铁合金 生铁和钢是含碳量不同的两种铁碳合金。 (1)生铁:含碳量为2%~4.3% 的铁碳合金称为生铁。生铁硬度 大 、抗压, 性脆、可以铸造成型,是制造机座、管道的重要材料。
√B.b点时溶液中发生的反应为Fe+Cu2+===Cu+Fe2+
C.c点时加入的铁粉与Cu2+反应
√D.原溶液中Fe2(SO4)3和CuSO4的物质的量之比为1∶2
11.硫酸铁铵[NH4Fe(SO4)2·xH2O]是一种重要铁盐。为充分利用资源,
6.将m g镁铝合金投入500 mL 2 mol·L-1的盐酸中,固体完全溶解, 收集到气体5.6 L(标准状况下)。向反应所得溶液中加入4 mol·L-1的氢 氧化钠溶液,沉淀质量的最大值为13.60 g,则m的值为( A ) A.5.10 B.8.50 C.9.35 D.11.48
7.将一定质量的Al、Mg混合物加入足量的盐酸中,充分反应后得 到标准状况下的氢气8.96 L;如果将等质量的该混合物加入足量的 NaOH溶液中,充分反应后得到标准状况下的氢气6.72 L。 (1)混合物与NaOH溶液反应的离子方程式为 ___2_A_l_+__2_O__H__-_+__2_H__2_O_=__=_=__2__A_l_O_2_-__+__3_H_2_↑_________。 (2)求混合物中各成分的质量。
A.①② B.①③ C.①④ D.②④
(3)镁、铝合金与盐酸完全反应后,加入过量的氢氧化钠溶液,最后的结 果是 C 。 A.没有沉淀物生成 B.只有氢氧化铝沉淀生成 C.只有氢氧化镁沉淀生成 D.有氢氧化铝和氢氧化镁沉淀生成
10.现代建筑的门窗架常用电解加工成的古铜色硬铝制造。取硬铝样品 进行如下实验(每一步试剂均过量),由此可以推知硬铝的组成可能为
第三章 第二节 金属材料
第2课时 常见的合金及应用 Nhomakorabea一、铁合金
一 铁合金 1.合金:合金属于混合物,合金的机械性能一般 优于 各成分金属;合金的 硬度一般 高于 它的各成分金属。 2.铁合金 生铁和钢是含碳量不同的两种铁碳合金。 (1)生铁:含碳量为2%~4.3% 的铁碳合金称为生铁。生铁硬度 大 、抗压, 性脆、可以铸造成型,是制造机座、管道的重要材料。
金属材料与热处理第2版课件王学武

热处理的应用与效果
提高机械性能
通过改变金属的内部组织结构,提高其硬度 、韧性和强度等机械性能。
改善切削加工性
通过改变金属的内部组织结构,改善其切削 加工性能,提高生产效率和产品质量。
提高耐腐蚀性
通过改变金属的表面组织结构,提高其耐腐 蚀性,延长使用寿命。
消除残余应力
通过热处理消除金属内部的残余应力,提高 其稳定性和可靠性。
分类
金属材料按成分可分为纯金属、合金和金 属间化合物三大类;按用途可分为结构材 料和功能材料;按形态可分为块状、板状 、箔状、粉状、丝状和带状等。
金属材料的性能特点
物理性能
01
金属材料的物理性能包括密度、熔点、热膨胀性、导热性、导
电性和磁性等。
化学性能
02
金属材料的化学性能是指其在一定温度和介质条件下抵抗各种
03
金属材料的力学性能
强度与塑性
强度
金属材料抵抗外力作用而不被破坏的能力,通常用抗拉强度、抗压强度、抗弯强度等指标来衡量。
塑性
金属材料在外力作用下产生不可逆的永久变形而不被破坏的能力,通常用延伸率和断面收缩率等指标 来衡量。
硬度与韧性
硬度
金属材料抵抗硬物压入表面的能力,常用的硬度指标有布氏硬度、洛氏硬度和维氏硬度等。
热处理定义
通过加热、保温和冷却的方式改变金 属材料的内部组织结构,以达到改善 其性能的目的。
热处理分类
根据加热温度、冷却方式和加热介质 的不同,热处理可分为多种类型,如 退火、正火、淬火和回火等。
热处理的基本原理
相变
金属在加热和冷却过程中会发生相变,即固态、液态和气 态之间的转变。相变会影响金属的内部组织结构,进而影 响其性能。
8.1.2 金属材料(2)【教学课件】2021-2022学年九年级化学下册同步备课系列(人教版)

纯铝,强度不够,为了确保飞机的机身材质能够抵抗得住高速飞行时的阻 力压强,又要兼顾减轻机体重量,所以选用了高强度的铝合金。
典例精讲
【例1】金属材料的性质在很大程度上决定了它们的用途,下列相关说法中不
正确的是( D )
A.钛合金与人体具有很好的“相容性”,可以用来制造人造骨骼 B.铁具有良好的导热性,可以用于制造炊具 C.不锈钢抗腐蚀性好,常用于制造医疗器械 D.铅锑合金的熔点较低,电阻率较大,常用于制成发热体
中一定不含非金属。
A.①④⑤
B.①②③
C.①③④
D.③④⑤
解析:合金是在金属中加热熔合某些金属或非金属制得的具有金属特性的混合物 。从组成上看,它可以是金属与金属熔合,也可以是金属与非金属熔合,至少含 一种金属,且熔合时没有发生化学变化,因此合金中的元素均以单质形式存在。
及时演练
1.下列物质不属于合金的是( D )
解析:用查资料法了解金属及合金的用途。钛合金与人体有很好的“相容性”,且 性质稳定,抗腐蚀性强,所以可用来制造人造骨骼;金属具有导热性,可用来制造 炊具;不锈钢是一种特殊的合金,由于其抗腐蚀性好,可以制造医疗器械;铅锑合 金由于其熔点低,不适合制造发热体。
及时演练
1.下列有关金属材料的说法中正确的是( B )
随堂演练
4.下列有关金属及合金的说法中正确的是 ( B ) A.合金是由两种或两种以上金属熔合而成的具有金属特性的物质 B.在日常生活中,大量使用的常常不是纯金属,而是它们的合金 C.“真金不怕火炼”说明黄金的硬度非常大 D.铜的化学性质不活泼,所以铜制品不会生锈
拓展延伸
贮氢合金 贮氢合金是指能在室温下吸收氢气,稍稍加热即能很快放出氢气的合金。它是以 镁或稀土金属为主形成的合金。氢气是21世纪要开发的新能源之一。贮氢合金不但 能解决氢气的贮存和输送问题,而且可用于氢气的回收、分离、净化等方面。
典例精讲
【例1】金属材料的性质在很大程度上决定了它们的用途,下列相关说法中不
正确的是( D )
A.钛合金与人体具有很好的“相容性”,可以用来制造人造骨骼 B.铁具有良好的导热性,可以用于制造炊具 C.不锈钢抗腐蚀性好,常用于制造医疗器械 D.铅锑合金的熔点较低,电阻率较大,常用于制成发热体
中一定不含非金属。
A.①④⑤
B.①②③
C.①③④
D.③④⑤
解析:合金是在金属中加热熔合某些金属或非金属制得的具有金属特性的混合物 。从组成上看,它可以是金属与金属熔合,也可以是金属与非金属熔合,至少含 一种金属,且熔合时没有发生化学变化,因此合金中的元素均以单质形式存在。
及时演练
1.下列物质不属于合金的是( D )
解析:用查资料法了解金属及合金的用途。钛合金与人体有很好的“相容性”,且 性质稳定,抗腐蚀性强,所以可用来制造人造骨骼;金属具有导热性,可用来制造 炊具;不锈钢是一种特殊的合金,由于其抗腐蚀性好,可以制造医疗器械;铅锑合 金由于其熔点低,不适合制造发热体。
及时演练
1.下列有关金属材料的说法中正确的是( B )
随堂演练
4.下列有关金属及合金的说法中正确的是 ( B ) A.合金是由两种或两种以上金属熔合而成的具有金属特性的物质 B.在日常生活中,大量使用的常常不是纯金属,而是它们的合金 C.“真金不怕火炼”说明黄金的硬度非常大 D.铜的化学性质不活泼,所以铜制品不会生锈
拓展延伸
贮氢合金 贮氢合金是指能在室温下吸收氢气,稍稍加热即能很快放出氢气的合金。它是以 镁或稀土金属为主形成的合金。氢气是21世纪要开发的新能源之一。贮氢合金不但 能解决氢气的贮存和输送问题,而且可用于氢气的回收、分离、净化等方面。
第二章 金属材料的凝固与固态相变
1.合金的使用性能与相图的关系 溶质的溶入量越多,晶格畸变越大,则 合金的强度、硬度越高,电阻越大。
两相组织合金的力学和物理性能与成分 呈直线关系变化。
2 .合金的工艺性能与相图的关系 铸造性能:纯组元和共晶成分的合金的流动 性最好,缩孔集中,铸造性能好。 锻造性能:单相合金的锻造性能好。单相组 织时变形抗力小,变形均匀,因而变形能力 大。双相组织的合金变形能力差些,特别是 组织中存在有较多的化合物相时。
固溶体结晶时成分是变化的,如果冷却较快,原子扩散不能充 分进行,则形成成分不均匀的固溶体。
2 .共晶相图
(1)相图分析 在共晶合金相图中,acb为液相线,adceb为固相线,合金系有 三种相,相图中有三个单相区(L、α 、β );三个两相区(L+α 、 L+β 、α +β );一条三相(L+α +β )共存线(水平线dce)。 dce为共晶线( c点为共晶点)。 Lc → α d+ β
2.2.3 铸锭(件)的凝固
把金属熔化注入铸模,冷却后获得一定形状的铸件的工艺叫做 铸造。 1.铸锭(件)结晶组织 最典型的铸造结构,整 个铸锭明显地分为三个各具 特征的晶区。 ⑴细等轴晶区 在铸锭的 表层形成的一层厚度不大、 晶粒很细的区域。
⑵柱状晶区
⑶粗等轴晶区
2.3 铁碳合金 2.3.1 Fe-Fe3C相图
2.3.2 铁碳合金在平衡状态下的相变
根据Fe—Fe3C相图,铁碳合金可分为三类: 1)工业纯铁[wc ≤0.0218%] 2)钢[0.0218%< wc ≤2.11%
3)白口铸铁[2.11%< wc <6.69%]
工业纯铁的室温平衡组织为铁素体(F),呈白色状。由于其强 度低、硬度低、不宜用作结构材料。
两相组织合金的力学和物理性能与成分 呈直线关系变化。
2 .合金的工艺性能与相图的关系 铸造性能:纯组元和共晶成分的合金的流动 性最好,缩孔集中,铸造性能好。 锻造性能:单相合金的锻造性能好。单相组 织时变形抗力小,变形均匀,因而变形能力 大。双相组织的合金变形能力差些,特别是 组织中存在有较多的化合物相时。
固溶体结晶时成分是变化的,如果冷却较快,原子扩散不能充 分进行,则形成成分不均匀的固溶体。
2 .共晶相图
(1)相图分析 在共晶合金相图中,acb为液相线,adceb为固相线,合金系有 三种相,相图中有三个单相区(L、α 、β );三个两相区(L+α 、 L+β 、α +β );一条三相(L+α +β )共存线(水平线dce)。 dce为共晶线( c点为共晶点)。 Lc → α d+ β
2.2.3 铸锭(件)的凝固
把金属熔化注入铸模,冷却后获得一定形状的铸件的工艺叫做 铸造。 1.铸锭(件)结晶组织 最典型的铸造结构,整 个铸锭明显地分为三个各具 特征的晶区。 ⑴细等轴晶区 在铸锭的 表层形成的一层厚度不大、 晶粒很细的区域。
⑵柱状晶区
⑶粗等轴晶区
2.3 铁碳合金 2.3.1 Fe-Fe3C相图
2.3.2 铁碳合金在平衡状态下的相变
根据Fe—Fe3C相图,铁碳合金可分为三类: 1)工业纯铁[wc ≤0.0218%] 2)钢[0.0218%< wc ≤2.11%
3)白口铸铁[2.11%< wc <6.69%]
工业纯铁的室温平衡组织为铁素体(F),呈白色状。由于其强 度低、硬度低、不宜用作结构材料。
第二章金属材料的结构[2]
![第二章金属材料的结构[2]](https://img.taocdn.com/s3/m/442e1d620b1c59eef8c7b400.png)
一、常见金属晶体的结构 1)体心立方晶胞BCC Body Centered Cube 晶格常数:a(a=b=c)
3 原子半径:r a 4
原子个数:2 配位数: 8 致密度:0.68 常见金属:-Fe、Cr、 W、Mo、V、Nb等
2)面心立方晶胞FCC Face-Centered Cube
晶格常数:a
一、纯金属的结晶过程
二、细化晶粒的方法 雾 凇
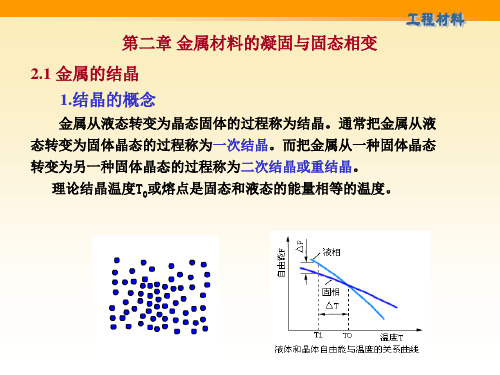
一、纯金属的结晶过程 (一)纯金属结晶的冷却曲线 1.结晶驱动力 ΔF≤0 (不是过冷度ΔT) 自然界的自发过程进行的热力学条件都是ΔF≤0 • 体系中各种能量的总和叫做内能→U,其中可以对外 做功或向外释放的能量叫自由能→F,F=U-TS(熵)
a.当温度T>T0时,Fs>FL, 液相稳定 b.当温度T<T0时,Fs<FL, 固相稳定 c.当温度T=T0时,Fs=FL, 平衡状态 T0:理论结晶温度(熔点或平衡结晶温度) 在该温度下, 液体和晶体处于动平衡状态 2.冷却曲线 金属结晶时温度与时间的关系曲线 称冷却曲线。曲线上水平阶段所对 应的温度称实际结晶温度T1。 曲线上水平阶段是由于结晶时放出 结晶潜热引起的。
三元相图
Fe-C二元相图
2、相图的建立 几乎所有的相图都是通过实验得到的,最常用的 是热分析法。
2、金属化合物 合金中其晶体结构与组成元素的晶体结构均不相同的 固相称金属化合物。金属化合物具有较高的熔点、硬
度和脆性,并可用分子式表示其组成。
当合金中出现金属化合物时,可
提高其强度、硬度和耐磨性,但
降低塑性。
铁碳合金中的Fe3C
金属化合物也是合金的重要组成相。
⑴ 正常价化合物—符合正常原子价规律。如Mg2Si。 ⑵ 电子化合物—符合电子浓度规律。如Cu3Sn。
3 原子半径:r a 4
原子个数:2 配位数: 8 致密度:0.68 常见金属:-Fe、Cr、 W、Mo、V、Nb等
2)面心立方晶胞FCC Face-Centered Cube
晶格常数:a
一、纯金属的结晶过程
二、细化晶粒的方法 雾 凇
一、纯金属的结晶过程 (一)纯金属结晶的冷却曲线 1.结晶驱动力 ΔF≤0 (不是过冷度ΔT) 自然界的自发过程进行的热力学条件都是ΔF≤0 • 体系中各种能量的总和叫做内能→U,其中可以对外 做功或向外释放的能量叫自由能→F,F=U-TS(熵)
a.当温度T>T0时,Fs>FL, 液相稳定 b.当温度T<T0时,Fs<FL, 固相稳定 c.当温度T=T0时,Fs=FL, 平衡状态 T0:理论结晶温度(熔点或平衡结晶温度) 在该温度下, 液体和晶体处于动平衡状态 2.冷却曲线 金属结晶时温度与时间的关系曲线 称冷却曲线。曲线上水平阶段所对 应的温度称实际结晶温度T1。 曲线上水平阶段是由于结晶时放出 结晶潜热引起的。
三元相图
Fe-C二元相图
2、相图的建立 几乎所有的相图都是通过实验得到的,最常用的 是热分析法。
2、金属化合物 合金中其晶体结构与组成元素的晶体结构均不相同的 固相称金属化合物。金属化合物具有较高的熔点、硬
度和脆性,并可用分子式表示其组成。
当合金中出现金属化合物时,可
提高其强度、硬度和耐磨性,但
降低塑性。
铁碳合金中的Fe3C
金属化合物也是合金的重要组成相。
⑴ 正常价化合物—符合正常原子价规律。如Mg2Si。 ⑵ 电子化合物—符合电子浓度规律。如Cu3Sn。
高中化学第3章铁金属材料第2节金属材料第2课时物质的量在化学方程式计算中的应用课件新人教版必修第一册

结论:化学方程式中化学计量数之比等于___粒__子__个__数___之比,也等
于___物__质__的__量___之比,对于有气体参与的反应还等于__体__积____之比。
应用体验
1.对于反应:2A(g)+2B(g)══3C(g)+D(g),化学计量数之比与下
列各项不等的是
( C)
A.分子数之比
B.物质的量之比
二、化学方程式中化学计量数与各化学计量间的关系
2Na 计量数之比: 2
+ 2H2O ══ 2NaOH
∶2
∶2
+ H2↑ ∶1
扩大 NA 倍: 2NA 物质的量之比:2 mol
∶ 2NA ∶ 2 mol
∶ 2NA ∶ 2 mol
∶ NA ∶ 1 mol
质量之比: 46 g
∶ 36 g
∶ 80 g
∶ 2g
第三章 铁 金属材料
第二节 金属材料 第2课时 物质的量在化学方程式计算中的应用
学习目标
核心素养
1.复习回顾有关物质的量n与微粒数N、 1.通过对“物质的量相关公 物质的质量m、气体体积V、溶液浓度c间
式”的回顾,提升定量探究的 的计算公式,巩固以物质的量为中心的各
学习能力及证据推理意识。 物理量之间的换算方法。
Fe+CuSO4══FeSO4+Cu Δm(质量增加)
56
64 64-56=8
m(Fe)=28 g
4g
典 例 镁铝合金具有很好的强度、刚性和尺寸稳定性,常用来制 作又轻又薄的笔记本电脑、手机等的外壳。把10.2 g镁铝合金的粉末放 入过量的烧碱溶液中,在标准状况下生成6.72 L氢气。试计算:
(1)该合金中铝的质量分数是___5_2_._9_%____。 (2)该合金中镁与铝的物质的量之比是___1_∶__1__。 (3) 该 合 金 溶 于 足 量 的 盐 酸 中 , 标 准 状 况 下 产 生 氢 气 的 体 积 是 __1_1_._2_L__。
