绝热过程、多方过程
热力学2

共同特点 对外作功 工质吸热增加内能 热量散发
热机的工作原理
上页
下页
AaB为膨胀过程:Aa 为膨胀过程: 为膨胀过程 BbA为压缩过程:-Ab 为压缩过程: 为压缩过程
PA
P A a
净功: 净功:
PB
b
B V
A = Aa Ab
VA
VB
结论:在任何一个循环过程中,系统所作的净功 结论:在任何一个循环过程中, 在数值上等于P-V图上循环曲线所包围的面积。 图上循环曲线所包围的面积。
两边微分得: 两边微分得:
M PdV +VdP = RdT Mmol
(2)
)、(2)式可得: 由(1)、( )式可得: )、(
(Cp CV )PdV RPdV = PdV +VdP = CV CV
CVVdP + Cp PdV = 0
γ=
Cp CV
dP dV +γ =0 P V
两边积分: 两边积分:
M RdT 由理想气体方程: 由理想气体方程: PdV +VdP = Mmol
微分: 微分: PV
n
= 恒量
dP dV +n =0 P V
解方程组: 解方程组:
n γ C= CV n 1
多方过程功的推导: 多方过程功的推导:
PV = PV
n 1 1
V2
n
A = ∫ PdV = ∫
V 1
n 1 1
V2
QAB
V2 M = AAB = RT1 ln Mmol V1
吸热
A
T1=300K B D T2=200K C
QBC = EBC
M 5 = R(T2 T1 ) Mmol 2
理想气体的绝热过程和多方过程

由pγ-1Vγ(γ-1) = C1γ-1,V (γ-1)γTγ = C2γ,得pγ-1T-γ = C1γ-1/C2γ= C3,
这些都是理想气体准静态绝热过程的状态方程。
(容易记忆)
{范例8.7} 理想程?绝热方程是什么?理想气体在多方过程中的p-V有什么特点?
理想气体在准静态绝热过程中有关系dQ = dE+pdV = 0,
因此得
利用理想气体状态方程
两边同时微分得
其中利用了迈耶公式Cp – CV = R。
两式相除可得
根据比热容比的定义
可得
积分得lnp + γlnV = C,
即 pVγ = eC = C1,
除以理想气体方程可得Vγ-1T = C1μ/MR = C2,
下列方程组中的任何一个都能表示理想气体的多方过程
pVn = C1,Vn-1T = C2,pn-1T -n = C3,
C1、C2和C3是不同的常数。
方程组可化为
①当n = 1时,方程组表示等温过程:pV = p0V0,T = T0 。
②当n = 0时,方程组表示等压过程:p = p0,V/T = V0/T0 。
在同一点,绝热过程的斜率大于等温过程的斜率,这是因为在等温过程中,外力做功时压缩体积而不使气体温度升高,从而使压强增加;在绝热过程中,外力做同样多的功还使气体温度升高,因而使压强增加得更快。
分子的自由度越小,比热容比就越大,绝热过程的斜率就越大。
当温度一定时,对理想气体状态方程求微分得pdV + Vdp = 0,因此
对第一个绝热方程求微分得pγVγ-1dV + Vγdp = 0,因此
由于γ > 1,所以有
说明:在p-V图中的同一点,绝热线比等温线陡峭。
§13.3 绝热过程 多方过程
对始、末两平衡态可用气体状态方程。
Chapter 13作. 热者力:学杨基茂础田
§13. 3 绝热过程 多方过程
自由膨胀过程: Q E W E 0
T1 T2
初态: p1V0 RT1
Q0 , W 0
p2 , 2V0 ,T2
☻自由膨胀过程为非准静态过程,绝热方程不适应! ☻虽为非准静态过程,但仍可应用热力学第一定律;
m k
2
mV
pS2
振动频率:
f
1 T
1
2
pS2
mV
m
dx 平衡位置
(
p
p0
mg S
)
(解毕)
S
(2 f )2
pS2
mV
测量比热比的一种方法。
V
Chapter 13作. 热者力:学杨基茂础田
§13. 3 绝热过程 多方过程
课堂练习 如图,判断acb过程Q、△E、W的正负号。
TV n1 C pn1T n C
p
n
n1 绝
等热 温
n0
定压
o
n
定 体
V
Chapter 13作. 热者力:学杨基茂础田
§13. 3 绝热过程 多方过程
1. 绝热方程:
pV C1 TV 1 C2
p 1T C3
2. 绝热过程的功:
Chapter 13作. 热者力:学杨基茂础田
§13. 3 绝热过程 多方过程
1. 绝热过程的功 WQ:
p
pV C1 p V
p1
pV p1V1 p2V2 C1
WQ
热力学第一定律应用

3 2 V1(
pa
pc )
450R
300
c
b
循环过程中系统吸热
O
1
2 V(10-3m3)
Q1 Qab Qca 600R ln 2 450R 866R
循环过程中系统放热
此循环效率
Q2 Qbc 750R
1
Q2 Q1
1
750R 866R
13.4 00
29
例 逆向斯特林致冷循环的热力学循环原理如图所示
当高温热源的温度T1一定时,理想气体卡诺循环的致 冷系数只取决于T2 。 T2 越低,则致冷系数越小。
26
三、 卡诺定理
1. 在温度分别为T1 与T2 的两个给定热源之间工作的一切可 逆热机,其效率 相同,都等于理想气体可逆卡诺热机的
效率,即
1 Q2 1 T2
Q1
T1
2. 在相同的高、低温热源之间工作的一切不可逆热机,其
曲线起始于同一点. n可取任意值,不同n对应不同的过程曲线。
16
3种多方过程方程:
理想气体多方过程的定义 :
pV n C
再根据理想气体的状态方程:
PV RT
以T、V或T、p为独立变量,还可有如下多方过程方程 :
TV n1 C
p n1 Tn
C
17
二、多方过程摩尔热容
设多方过程的摩尔热容为Cn.m ,则:
dQ Cn,mdT
根据理想气体的热一律,可得:
Cn,m dT CV ,m dT pdV
在两边分别除以 dT
Cn,m
CV ,m
p( dVm dT
)n
CV ,m
p( Vm T
)n
式中的下标n 表示是沿多方指数为n 的路径变化。
物理化学知识点总结

热力学第一定律一、基本概念1、体系和环境(1)、体系和环境体系:作为研究对象的物质及其所在的空间称为体系;环境:体系以外且与体系密切相关的物质及其所在空间称为环境;界面:体系和环境之间存在有界面,界面可以是容器的器壁,也可以是假想的界面,本质上,界面是认为设想的几何面,其中不包含物质,不具备物理和化学性质。
(2)、体系的分类体系和环境之间可以有物质和能量的交换,依据此,可将体系分为敞开体系、封闭体系、隔离体系。
①、敞开体系:体系与环境之间既有能量交换又有物质交换;②、封闭体系:体系与环境之间只有能量交换而无物质交换;③、隔离体系:体系与环境之间既无能量交换也无物质交换。
2、状态和状态函数(1)、状态和状态函数的定义状态:状态是指体系所有性质的总体表现;状态函数:体系的热力学性质称为状态函数。
(2)、状态函数的性质:①、体系的状态一定,状态函数就有定值。
②、状态函数的变化值只取决于始、末状态,与变化的经历无关。
③、状态函数的微分为全微分。
(3)、状态函数的分类。
①、广度性质:体系的广度量与物质的数量成正比,如V,U等,它具有加和性②、强度性质:体系的强度量与物质的数量无关,如T,p等,它不具有加和性。
(4)、热力学平衡态一定条件下,体系中各个相的宏观性质不随时间变化,将体系与环境隔离体系的性质仍不改变的状态。
热力学平衡态应满足如下条件:①、热平衡:体系中的各个部分温度相等,即体系内部处于热平衡,有单一的温度;②、力学平衡:体系内部处于力平衡,有单一的压力;③、相平衡:体系内部各相之间的分布达到平衡,宏观上没有任何一种物质从一个相转移到另一个相;④、化学平衡:体系内部处于化学平衡,宏观上表现为体系的组成不随时间变化。
(5)、状态函数的数学性质若状态函数①、单值性:环形积分等于零,,或可写作全微分性质:③、归一化关系④、复合函数的偏微分,则⑤、偏微商的分离⑥、完全微分3、过程与途径在一定环境条件下,体系发生由始态到终态的变化,则称体系发生了一个热力学过程,(1)、变化过程①、等温过程:体系始态与终态温度相同,且变化过程中温度始终等于环境温度、等于;②、等压过程:体系始态与终态压力相同,且变化过程中压力始终等于环境压力、等于;④、体系由变化到,程,计算其热力学函数,如热力学能、熵变等要设计过程。
大学物理第二十五讲 绝热过程、多方过程、循环过程、卡诺循环

C p ,m
c a,绝热过程。
Qca 0
循环效率
p p2
a
Q2 1 Q1 1 | Qp | QT 8ln 4 1 1/ 7(4 4 )
p1
c
Va Vc
b
Vb V
o
21
例:效率为20%的热机的机械功率为1GW。求: 1.热机 工作时吸热和放热的速率;2.若热机吸热和放热是分 别在5ºC和25ºC的表层和深层的海水间完成的,则吸 热时每秒需要多少海水?(设海水比热 c = 4.18kJ/kgK)
热机
Q2
A
U 0, A Q1 Q2
p
低温热源T2
Q1
p
a
b
Q2
A
V
o
o
d
V1
c
V2
V
10
热机效率
●在循环过程中,热机对外做的静功与吸收的热 量之比。
A Q1 Q2 Q2 1 Q1 Q1 Q1
p
♠效率反映一个循环中吸收的 热量有多少转化为有用的功。 ♠一般情况,不同的工作物质 具有不同的效率。
5. n : V c, Cn CV ,m —等容过程 pV n c p1/ nV c
证明
n V c 等容
8
§12-7 循环过程、卡诺循环
♠热力学理论的发展与热机的研制和使用密切相关。
♠热机就是不断把热量转换为机械功的装置。
♠热机中用于吸热做功的物质叫工作物质。
2.理想气体的绝热过程方程 绝热过程
AQ dU pdV CV ,m dT
pV RT pdV Vdp RdT
状态方程
两式消去 dT 得
22.多方过程+循环过程
V4 Q2 RT2 ln V3
V3 V2 RT1 ln - RT1 ln Q1 Q2 V1 V4 c V Q1 RT1 ln 2 V1
b c : T1V2 1 T2V3 1 V3 V2 1 1 d a : T2V4 T1V1 V4 V1 Q1 Q2 + 0 从以上诸式还可得到: T1 T2
p1V1 RT1 p1 1.52 10 7 Pa V1 p1V1 p2V2 p2 ( ) p1 0.11.4 p1 6.05 10 5 Pa V2
( pV ) p2V2 p1V1 ... 3751 .5 3751 .5 A 9.38 10 3 J 1 .4 1
显然,系统经历一个循 环内能变化 E 0。
( a ) 正循环 系统对外界作功
( b ) 负循环 外界对系统作功
二、热机效率 利用正循环将吸收的热 量转变为对外作功的机 器叫热机。
设系统在一个循环中吸 热 Q1,放热 Q2 ,对外作净功 A,
A Q1 Q 2 Q1 Q1
叫热机效率。
§8.6 卡诺循环
由两个等温准静态过程 和两个绝热准静态过程 组成的循环 叫卡诺循环。
这是因 如果在一个循环中只有 两个热源,则必为卡诺 循环。 为,除等温和绝热过程 外,其它准静态过程都 需要无限多个温差 无限小的热源。
一、卡诺热机的效率 V2 Q1 Rபைடு நூலகம்1 ln V1
(a b) ( c d)
绝热线较陡。
Q绝热 0 C 绝热 0
A E CV T CV
( pV ) R CV CV ( pV ) ( pV ) ( pV ) 1 R C p CV E CV T 或由热力学第一定律求 解。
13-4 等温、绝热过程,多方过程
CV dT pdV 0 ( 1 )
由 pV RT 两边取微分,得
pdV Vdp RdT (2)
由 (1),(2) 两式,得
CV pdV CVVdp RpdV
(CV R) pdV CVVdp
由 得到
R Cp CV ; Cp / CV
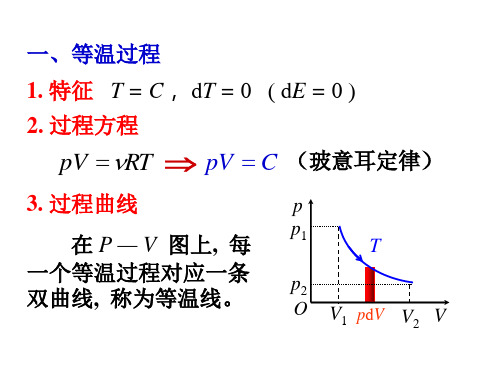
3. 过程曲线 在P - V 图上,每一个绝热过程对应一条 双曲线,称为绝热线。 4. 热量 dQ = 0
5. 内能变化 dE CV dT 6. 绝热功 p2
P p1
Q
(1) 由温度变化引起的
O
V1
pdV V2
V
dA dE CV dT
A CV T
(2) 用功的定义计算
V1 1.41 992K T2 T1 V 320 (16.9) 2
1
终了时的压强为
V1 P2 P 1 V 2
1.013 10 (16.9)
5
1.4
45.110 pa
5
例2 一热机用5.8×10-3Kg的空气作为工质,从 初态1(p1=1.013×105pa , T1=300K)等体加热 到状态2(T2=900K),再经绝热膨胀到状态3 (p3=p1),最后经等压过程又回到1,如图。 假定空气可视为理想气体,且γ=1.4, CV=20.8J/(mol· K), p 2 Cp=29.09J/(mol· K)摩尔质量 p2 M=29×10-3Kg· mol。试求各 3 过程中气体所做的功及从外 p1 1 O 界吸收的热量。 V1 V3 V
V1
V2
V2
V1
dV V
T V1 pdV V2 V
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
C n, m
n CV , m n1
( 1 )当n 时,V 常量,等容过程, Cn, m CV,m
( 2 )当n 0时,P 常量,等压过程, Cn, m C p, m
( 3 )当n 1时,PV 常量,等温过程, Cn, m
( 4 )当n 时,PV 常量,绝热过程, Cn, m 0
上页 下页
由上可见, 0 C n, m
思考
Cn, m 可能取负值吗?
答案
- Cn,m
1 n 时,Cnm 0. ①当系统在热力学过程中对 外界所作的功大于它从外界吸收的热量时,系统虽然 吸热但温度反而下降;②外界对系统所作的功大于其 放热的绝对值时,系统虽然放热但温度反而升高。
上页 下页
推导多方过程方程:
对理想气体状态方程求微分,得
PdV VdP RdT
再由热一律的微分形式,得
CV ,m dT Cn,m dT PdV
削去dT,可得 其中
PV 常量
n
n
C p,m C n,m CV , m C n , m
上页 下页
由上式可解得多方过程的摩尔热容
上页 下页
绝热过程中 ,理想气体不吸收热量。 若系统对外界做功,内能减少,温度降低; 若外界对系统做功,内能增加,温度升高。 即,因为 Q 0,
W U nCV ,m (T2 T1 ) nCV ,m (T1 T2 )
所以, W 0 U 0 T2 T1
dU dQ dW
所以:
上页 下页
dQ 0
dW dU
由 pV n RT
微分
pdV n CV,mdT
pdV Vdp n RdT
( 1)
削去dT, 得 令
C P ,m CV , m
—— 比热比( 大于1 )
则(1)为:
dp dV 0 p V
pV C
上页 下页
W PdV
V1 V2 V2
P1V1 V
V1
V1
dV
1 P1V1 1 1 P1V1 V1 1 1 1 1 V2 V1 1 V2 1 P1V1 P2V2 1 7 R 7 2Fra bibliotek 5 5 R 2
由 P1V1 P2V2
T1V1
1
V1 p2 p1 ( ) 1 5 9.52 atm V2
V1 1 T2 T1 ( ) 300 5 V2
上页
7 1 5
7 5
T2V2
1
571K
下页
五.多方过程: 理想气体在准静态过程中若热容C保持为常 量,则称为多方过程。前面的四种过程是多方 过程的特例。 n 1.过程方程: PV 常量 , n称为多方指数. n 1 , 等温过程 n , 绝热过程 n 0 , 等压过程 n , 等容过程 一般情况1 n ,多方过程可近似代表气体 内进行的实际过程。
四、绝热过程:
系统始终不与外界交换热量的过程。 良好绝热材料包围的系统发生的过程。 进行得较快,系统来不及和外界交换 热量的过程。
绝热壁
p
上页
下页
1.特点:
Q0
W U n CV ,m (T2 T1 )
2. 过程方程:
PV 常量
—— 泊松方程
推导: 由热一律的微分形式 对绝热过程,
上页 下页
系统在多方过程中内能的增量:
U CV , m (T2 T1 )
对外界所做的功:
1 A ( P1V1 P2V2 ) n1
从外界吸收的热量
Q Cn, m T2 T1
例题:课本P86例2-7 ;笔记P33-34例2.
上页 下页
W 0 U 0 T2 T1
上页 下页
4. 绝热线与等温线
p
绝热线
A
O
等温线
V
上页
下页
例1 一定量氮气,其初始温度为300K,压强为 1atm。将其绝热压缩,使其体积变为初始体 积的1/5 .已知CV = 20.8J/mol· K 求:压缩后氮气的压强和温度。
解:
C p,m CV,m
由 削去P,可得 削去V,可得 所以
PV nRT PV 常量
TV
P
1
常量
常量
1
T
pV C1
TV C2 1 P T C3
1
绝热过程方程
上页
下页
3.关于绝热功的计算 除了借助热一律计算功外,对于准静态绝热 过程还可利用泊松公式计算如下: V2 将泊松公式 PV P1V1 代入 W PdV 得
