29 绝热过程 循环过程 卡诺循环
循环过程--卡诺循环(四川农业大学大学物理)

p
b
a 净负正正 功dd功功 c
O V1
V2
V
特征: Q净 A净 0
热机的循环:
从外界吸热—对外做功
T1
A
T2
实例:蒸汽机的循环
A净 A1 A2
Q净 Q1 Q2
效率: A净
Q吸
Q Q
1
2
Q 1
A2
Q 1 2
Q 1
Q1 A1
Q2
热机的能量转换:
从高温热源吸热 Q 1
p p2
p1
o
V1
V2
V V3
解:1-2:
E1
M
CV
(T2
T1)
5
5
2 R(2T1 T1) 2 RT1
A1
1 2
(
p2V2
p1V1 )
1 2
R(T2
T1)
1 2
RT1
p p2
p1
o
V1
V2
V V3
Q1 A E 3RT 1
2-3: 绝热膨胀 Q2 0
致冷机的循环: 外界对系统做功 —— 系统向外界放热
T1 Q1
A=Q1-Q2 Q2 T2
实例:电冰箱
Q1 A
Q2
能量转换:
致冷系数: w Q2 A
从低温热源吸热
Q 2
(效果)
向高温热源放热
外界对系统做功 A (代价) Q1 Q2 A 注意:这里的Q2 仅是循环过程中系统从冷库吸收的热 量 —— 衡量致冷的效力
T2 V
32 1 4
循环过程卡诺循环PPT课件

第十三章 热力学基础
一 循环过程
13-5 循环过程 卡诺循环
系统经过一系列变化状态过程后,又回到原来 的状态的过程叫热力学循环过程 .
特征: E 0 由热力学第一定律
pA
Q W
净功 W Q1 Q2 Q
总吸热
Q1
o VA
总放热
Q2 (取绝对值)
净吸热
D — A 绝热过程
V1 1T1 V4 1T2
V2 V3 V1 V4
第十三章 热力学基础
13-5 循环过程 卡诺循环
W 1 Q2 1 RT2 ln(V2 /V1) 1 T2
Q1
Q1
RT1 ln(V3 /V4 )
T1
卡诺热机效率
1 T2
T1
卡诺热机效率与工 作物质无关,只与两个 热源的温度有关,两热 源的温差越大,则卡诺 循环的效率越高 .
第十三章 热力学基础
卡诺逆循环
13-5 循环过程 卡诺循环
由两个绝热过程和两个等温过程组成的逆循环称为卡诺逆循环. 如图所示. 卡诺逆循环过程: 设工作物质为理想气体.
p
A Q1
T1 T2
T1 B
W
D Q2 T2
C
V
o
(i) A D,绝热膨胀;系统对外做功,气体 温度T1 T2(降低).
(ii) D C,等温膨胀;此过程中气体从低 温做热功.源中吸收热量Q2; 系统对外界
(iii) C B,绝热压缩;外界对气体做功, 气体温度T2 T1(升高),.
(iv) 最后, B A,等温压缩;此过程中外界对气体做功使气体将气 量Q1传 递给高温热源, 从而完成一个逆循环.
绝热过程循环过程

例1 设有 5 mol 的氢气,最初的压强为 1.013105 Pa 温度为 20 ,求在下列过程中,把氢气压缩为原体积的 1/10 需作的功: 1)等温过程,2)绝热过程 . 3)经这 两过程后,气体的压强各为多少?
p
p2
2 T2
p2' T2' T1 Q 0
p1
2'
T1
T 常量 1
*循环工作的物质称为工作物质,简称工质。
*特点:E=0
*若循环的每一阶段都是准静态过程,则此循环 可用p-V 图上的一条闭合曲线表示。
*沿顺时针方向进行的循环称为正循环。 沿反时针方向进行的循环称为逆循环。
正循环
工质在整个循环过程中对外作
pA
的净功数值等于曲线所包围的面积。
整个循环过程
工质从外界吸收热量的总和为Q1 放给外界的热量总和为Q2
二、 自由膨胀 特点:迅速 来不及与外界交换热量 则Q = 0 非静态过程 无过程方程 办法:只能靠普遍的定律(热律)
绝热热律
dW dE
W ΔE
自由膨胀 因为自由膨胀
V2
2 能量
V2
守恒
所以系统对外不作功
即
W 0
由 W ΔE
得
E 0
理气 T 0 状态方程 P
(
dp dV
)
a
pA VA
等温过程曲线的斜率
pV 常量
pdV Vdp 0
(
dp dV
)T
pA VA
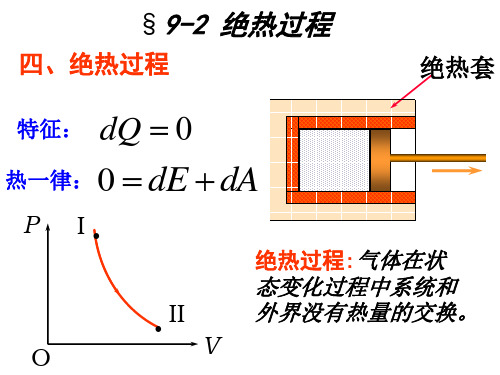
3.绝热过程: 特征:dQ=0
热一律 dW dE 0
dW dE
dE
m M
CV
,mdT
物理化学:2.04卡诺循环

例:一水蒸汽机在120C 和 30C 之间工作,欲 使此蒸汽机做出 1000 J 的功,试计算最少需 从120C 的热库吸收若干热量?
解:此水蒸汽机的最高效率为:
max = 1 T1/ T2 = 1 (303/393) = 0.229 Q2, min = W / max = 1000 / 0.229 = 4367 J
由于过程 2、过程 4 为理气绝热可逆过程,
其中的:T V -1 = 常数 (过程方程) 即过程 2:T2V2-1 = T1V3-1
过程 4:T2V1-1 = T1V4-1
上两式相比:
V2 / V1= V3 / V4 (∵ 1 0)
将 V2 / V1= V3 / V4 代入W表达式: W = RT2 ln (V2/V1) + RT1ln (V4/V3) = RT2 ln (V2/V1) RT1ln(V2/V1) = R ( T2 T1) ln (V2/V1)
在 两 个 热 库 T2、T1 之间有一个卡诺热机 R, 一 个 任 意 热 机 I,
如果热机 I 的效率比
卡诺机 R 的效率大,则同样从热库 T2 吸取 热量 Q2,热机 I 所作的 W 将大于卡诺机 R 所作的功 W,即 W W,或表达成:
Q1 + Q2 Q1+ Q2 Q1 Q1 ∵ Q1 0,Q1 0 (体系放热) Q1 Q1 即此任意热机 I 的放热量小于卡诺机。
过程2:
绝热可逆膨胀。把恒温膨胀后的气体(V2, P2)从热库 T2 处移开,将气缸放进绝热袋, 让气体作绝热可逆膨胀。
• 此时,气体的温度 由T2 降到T1,压力 和体积由 P2, V2 变 到 P3 , V3。
• 此 过 程 在 P-V 状 态 图中以 BC 表示。
大学物理(13.4.1)--循环过程

一、循环过程的定义及其特点1.定义:工作物质的状态经过一系列变化过程后,又回到原来状态的过程称为热力学系统的循环过程,简称循环。
2.特点:1)系统的内能没有变化 0=∆E 2)如果组成某一循环的各个过程都是准静态过程,则此循环过程可以用P —V 图上的一条闭合曲线来表示。
系统完成一个循环所做的净功等于P —V 图上循环过程曲线所围的面积。
二、循环过程的分类及其应用1.正循环:在P —V 图上按顺时针方向进行的循环过程。
热机:工作物质作正循环的机器。
1)工作原理:从高温热源吸收热量Q 1,一部分用来对外做功W ,一部分向低温热源放出热量Q 2(在计算中取正值)。
2)循环的效率:1211 Q Q Q W -==η吸收同样多的热量,对外界作的功越多,表明热机把热量转化为有用功的本领越大,效率就越高。
2.逆循环:在P—V 图上按逆时针方向进行的循环过程致冷机:工作物质作逆循环的机器。
1)工作原理:从低温热源吸收热量Q 2,外界做功W ,向高温热源放出热量Q 1。
2)制冷系数:2122Q Q Q W Q e -==三、卡诺循环1.卡诺循环1)定义:卡诺循环:两个等温过程和两个绝热过程组成的循环。
2)分类正循环——卡诺热机逆循环——卡诺制冷机2.卡诺热机的效率1)卡诺热机的四个过程中功、内能增量和热量(1)AB:等温膨胀过程,内能变化为零,吸收的热量全部用来对外做功12111ln V V RT M m Q W == (1)(2)BC 绝热膨胀过程:系统不吸收热量,对外所作的功等于系统减少的内能 )(21,2T T C Mm E W m V -=∆-= (2)(3)CD 等温压缩过程:内能变化为零,外界对系统做功等于向低温热源放出的热量 34223ln V V RT M m Q W ==-- (3)(4)DA 绝热压缩过程:系统不吸收热量,外界对系统做功等于系统增加的内能 )(21,4T T C Mm E W m V -=∆=- (4)把以上四式左、右两边相加得系统对外界所作的净功为⎪⎪⎭⎫ ⎝⎛=432121ln ln V V T V V T R M m W -总的内能变化 0=E ∆从高温热源吸收的热量1211ln V V RT M m Q =向低温热源放出的热量4322ln V V RT M m Q =2)卡诺热机的效率由热机效率定义: 121432121ln ln11V V T V V T Q Q Q W -=-==η应用绝热方程const T V =-1γ得BC 过程 213112T V T V --=γγDA 过程 214111T V T V --=γγ两式相除得4312V V V V = 因而 121 T T -=η——仅适宜卡诺热机3)说明:(1)要完成一个卡诺循环必须有个热源。
工程热力学-第五章热力学第二定律之卡诺循环

q
2 1
Tds
Tm
s2
s1
2
Tds
Tm
1
s2
s1
注意:1)Tm 仅在可逆过程中有意义
2)
Tm
T1
T2 2
循环热效率归纳:
t
wnet q1
1 q2 q1
1 Tm放 Tm吸
1 TL TH
适用于一切工质,任意循环 适用于多热源可逆循环,任意工质 适用于卡诺循环,概括性卡诺循环,任意工质
wnet q1
wnet w12 w23 w34 w41
1
w12
RT1
1
1
p2 p1
?
w23
RT2
ln
v3 v2
?
01
q2 q放 q41 TL s1 s4
q1 q吸 q23 TH s3 s2
qnet q1 q2
TH TL s23 wnet
c
TH TL s23 1 TL
THs23
TH
01
讨论:
1)
c
f TH,TL TH ,TL
c
2) TL 0,TH c 1
即 wnet q1 循环净功小于吸热量,必有放热q2。
THANK YOU
3) 若TL TH ,c 0 第二类永动机不可能制成。
4)实际循环不可能实现卡诺循环,原因: a)一切过程不可逆; b)气体实施等温吸热,等温放热困难; c)气体卡诺循环wnet太小,若考虑摩擦, 输出净功极微。
9-3 卡诺循环
卡诺致冷机: 卡诺致冷机:
Q2 T2 卡诺致冷系数: 卡诺致冷系数: w = = Q − Q2 T1 −T2 1
注:由于循环从低温热源吸热,可导致低温热 由于循环从低温热源吸热, 源的温度降得更低, 源的温度降得更低,这就是制冷机可以制冷的 原理。其代价就是必须外界对气体作功。 原理。其代价就是必须外界对气体作功。
M Q1 = Cp (TB − TA ) Mmol P2
D
C
M Q2 = Cp (TC − TD ) Mmol
V
TC −TD Q2 η =1− =1− Q TB −TA 1
等压过程中: 等压过程中:
P P1
A B
VA VB = TA TB
绝热过程中: 绝热过程中:
γ −1
VD VC = P2 TD TC
γ −1
γ −1
D
C
TAVA = TDVD
TA ∴ TD = TC TB
TBVB = TCVC
γ −1
V
TA TC − TC TC TB =1− η =1− TB −TA TB
[例3] 1mol 氧气作如图所示的循环。 氧气作如图所示的循环。 p Q ab 求:循环效率 a b Q bc 等 p0 温 解: c Q ca Q ab = M C P (Tb T a) o V0 2V0 V M mol Q bc = M C V (Tc T b ) M mol Q ca V0 M RT = M mol c ln 2V0
等温方程: 等温方程: PV
dP P A =− dV VA
A
等温
dP P A = −γ dV VA
V
结论: 结论:绝热线在A点的斜率的 绝对值大于等温线在A点的斜 率。
29 绝热过程 循环过程 卡诺循环

2. 卡诺致冷机的致冷系数
Q1
RT1
ln V2 V1
p
p1 a
p2
T1
Q1 b
Q2
RT2
ln V3 V4
由bc﹑ da绝热过程方程,有
V2 V3 V1 V4
p4 p3 O V1
d T2 c
V4 V2
V3 V
Q2
卡诺致冷循环的致冷系数为 w Q2 Q2 T2 A Q1 Q2 T1 T2
n pV C1
n 1
n n
V
·多方过程中的功﹑内能﹑热量﹑摩尔热容的计算
功
A
V2 pdV
V1
V2 V1
p1V1n
dV Vn
1( n 1
p1V1
p2V2 )
nR1(T2 T1)
内能增量 热量 摩尔热容
E CV (T2 T1)
Qn E A
Cn
Qn T
CV (T2 T1) R T2 T1 n 1
dp dV 0
pV
利用上式和状态方程可得
pV C1
TV 1 C2
p 1T C3
2. 过程曲线
p
pV C1
微分
pV C2
dp p
dV V dp p dV V
由于 >1 ,所以绝热线要比
等温线陡一些。
O
绝热线
A• 等温线
V
3. 绝热过程中功的计算
A (E2 E1) CV (T2 T1)
系统(工质)对外所作的净功
Ⅰ·
Ⅱ·
O
V
2. 正循环、逆循环
· p Ⅰ
·正循环(循环沿顺时针方向进行)
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
A Q1 Q2 Q Q2 T2 循环的致冷系数为 w 2 A Q1 Q2 T1 T2
V2
V
§8.11 卡诺循环
卡诺循环是由两个等温过程和两个绝热过程组成
1. 卡诺热机的效率 气体从高温热源吸收 的热量为 p p1 p2
a
V2 Q1 RT1 ln V1
气体向低温热源放出 的热量为
(系统对外作负功)
逆循环也称为致冷循环
Ⅱ ·
V
Q1 A Q2
O
二. 循环效率
在热机循环中,工质对外所作的功 A 与它吸收的热量Q1的比值,称为 热机效率或循环效率
Q1
A
Q2
A Q1 Q2 Q2 1 Q1 Q1 Q1
一个循环中工质从冷库中吸取的 热量 Q2 与外界对工质作所的功 A 的比值,称为循环的致冷系数
然后经等温膨胀达到D (V1, T2) 状态,最后经等体升温 回到初状态A,完成一个循环。 p B Q1 求 该致冷循环的致冷系数 解 在过程CD中,工质从冷库吸取 A V1 的热量为 Q2 RT2 ln C
在过程中AB中,向外界放出的 V1 热量为
V2
Q2 D
O
Q1 RT1 ln
整个循环中外界对工质所作的功为
O
Q1 Qab Qca 600R ln 2 450R 866R
循环过程中系统放热
Q2 Qbc 750R
此循环效率
Q2 750R 1 1 13.4 0 0 Q1 866 R
例 逆向斯特林致冷循环的热力学循环原理如图所示,该循环 由四个过程组成,先把工质由初态 A( V1 , T1 )等温压缩 到B(V2 , T1) 状态,再等体降温到C (V2, T2)状态,
n 1 n n
pd(V ) V dp 0
n
dP p n dV V 可见: n 越大, 曲线越陡
O
V
多方过程中的功﹑内能﹑热量﹑摩尔热容的计算 · 功
A
V2 V1
n 1 E CV (T2 T1 ) 内能增量 热量 Qn E A Qn CV (T2 T1 ) R 摩尔热容 Cn T T2 T1 n 1 C p CV n CV CV n 1 n 1 热量计算 Qn Cn (T2 T1 ) E A
bc是等压过程,有
Qbc C p T 750 R
600
a
300
O
c
1 2
b
V(10 m )
-3 3
ca是等体过程
p(103R)
600
300
Qca E CV (Ta Tc ) 3 V ( pa pc ) 450R 2
循环过程中系统吸热
a c
1
b
2 V(10-3m3)
由热力学第一定律,有
dQ CV dT pdV
p0V 15 (4 p0 )dV V0 2
由上式可知 ,吸热和放热的区域为
15 V0 V V0 8 15 V V0 8 15 V0 V 2V0 8
dQ 0 dQ 0 dQ 0
吸热
放热
将理想气体的状态方程 代入上式并消去 p,有
p0 p V 3 p0 V0
p
2p0 p0
·
·
V0 2V0 V
p0V0 V 2 V T ( ) 3( ) R V0 V0
对该过程中的任一无限小的过程,有
O
p0 V dT 2( ) 3 dV R V0
§8.7 绝热过程
一. 绝热过程
系统在绝热过程中始终不与外界交换热量。 良好绝热材料包围的系统发生的过程 · 进行得较快,系统来不及和外界交换热量的过程 ·
1. 过程方程 对无限小的准静态绝热过程 有
dA dE 0
pdV CV dT
pdV Vdp RdT
pV RT
Q2 Q2 w A Q1 Q2
例 1 mol 单原子分子理想气 体的循环过程如图所示。 求 (1) 作出 pV 图 (2) 此循环效率 解 (1) pV 图
(2) ab是等温过程,有
T(K) 600
a
b c
O
1 p(103R)
2 V(10-3m3)
Vb Qab A RT ln Va 600R ln 2
2. 卡诺致冷机的致冷系数
p p1 p2 p4 p3
V2 Q1 RT1 ln V1 V3 Q2 RT2 ln V4
由bc﹑ da绝热过程方程,有
a
Q1 T1 b d
T2
Q2
c
V3 V
V2 V3 V1 V4
O
V1
V4 V2
卡诺致冷循环的致冷系数为 w
Q2 Q2 T2 A Q1 Q2 T1 T2
(7 2) 7 CV (5 2) 5
根据绝热过程方程的p﹑V 关系,有
7 5
Cp
p2 p1 (V1 V2 ) 1 5 9.52 atm
根据绝热过程方程的T﹑V 关系,有
T2 T1 (V1 V2 ) 1 300 5
7 1 5
571K
例 温度为25℃,压强为1atm 的1mol 刚性双原子分子理想气 体经等温过程体积膨胀至原来的3倍。
(CV R) pdV CV Vdp 0
dp dV 0 p V
利用上式和状态方程可得
pV C1
TV 1 C2
2. 过程曲线
p 1T C3
p
绝热线
pV C1
微分
pV C2
dp p dV V dp p dV V
A
等温线
由于 >1 ,所以绝热线要比 等温线陡一些。
说明 当高温热源的温度 T1 一定时,理想气体卡诺循环的致冷系 数只取决于T2 。 T2 越低,则致冷系数越小。
pV图与pT、TV图的转换,由 pV RT 分析
p
b
p
b
a
d
a
d
c
T
c
V
T
a
绝热线
b
p
a
b
绝热线
c
V
c
V
例 v 摩尔的单原子分子理想气体,经历如图的热力学过程, 求 在该过程中,放热和吸热的区域。 解 从图中可以求得过程线的方程为
Q1 E1 A1 2.99 104 J
§8.8 循环过程
一. 循环过程
1. 循环过程 如果物质系统的状态经历一系列的变化后,又回到了原状 态,就称系统经历了一个循环过程。 如果循环是准静态过程,在P–V 图上就构成一闭合曲线
E 0
A dA 闭合曲线包围的面积
系统(工质)对外所作的净功
O
V
3. 绝热过程中功的计算
A ( E2 E1 ) CV (T2 T1 )
A
V2 V1
pdV
V2 V1
1 dV ( p1V1 p2V2 ) p1V1 1 V
绝热过程中 ,理想气体不吸收热量,系统减少的内能,等
于其对外作功 。
例 一定量氮气,其初始温度为 300K,压强为1atm。将其绝热 压缩,使其体积变为初始体积的1/5。 求 压缩后的压强和温度 解 氮气是双原子分子
d T2
V4 V2
Q2 T2 1 1 Q1 T1
讨论
c Q2
V3 V
O V1
(1) 理想气体可逆卡诺循环热机效率只与 T1,T2 有关,温差 越大,效率越高。提高热机高温热源的温度T1 ,降低低 温热源的温度T2 都可以提高热机的效率。但实际中通常 采用的方法是提高热机高温热源的温度T1。 (2) 可逆卡诺循环热机的效率与工作物质无关。
由理想状态方程得
(2)Ⅰ中气体内能的增量为
Ⅰ中气体对外作的功为
5 E1 CV (T1 T0 ) R(T1 T0 ) 2 5 4 ( p1V1 p0V0 ) 2.69 10 J 2
A1 A2 E2 2.92 103 J
根据热力学第一定律, Ⅰ中气体吸收的热量为
求 (1) Ⅰ中气体末态的压强和温度。
T
Ⅰ
Ⅱ
(2) 外界传给Ⅰ中气体的热量。
解 (1) Ⅱ中气体经历的是绝热过程,则
p0V0 p2V2
刚性双原子分子
7 5
又
V0 p2 p0 ( ) 2.674 105 Pa V2 p1 p2 2.674 105 Pa p1V1 T1 T0 1.081 103 K p0V0
1
3V
V
192 K
将热力学第一定律应用于绝热过程有
A E CV (T2 T1 ) 2.2 103 J
二. 多方过程
多方过程方程 ·
pV n C
(n 多方指数,1<n< )
满足这一关系的过程称为多方过程 多方过程曲线 · 根据多方过程 方程,有
p
n
n 1 pV C n pV C1
R
pdV
V2 V1
dV 1 pV n ( p1V1 p2V2 ) V n 1
n 1 1
(T2 T1 )
多方过程曲线与四种常见基本过程曲线 ·
例 如图, 一容器被一可移动、无摩擦且绝热的活塞分割成Ⅰ, Ⅱ 两部分。容器左端封闭且导热,其他部分绝热。开始时 在Ⅰ, Ⅱ中各有温度为0℃,压强1.013×105 Pa 的刚性双原 子分子的理想气体。两部分的容积均为 36升 。 现从容器左 端缓慢地对Ⅰ中气体加热,使活塞缓慢地向右移动,直到 Ⅱ中气体的体积变为18升为止。
