第三课时 盐类水解的应用(30张)
合集下载
盐类的水解盐类水解的应用人教版高中化学选修四教学课件

A.a=b=c
B.c>a>b B
C.b>a>c
D.a>c>b
盐类的水解盐类水解的应用课件人教 版高中 化学选 修四
盐类的水解盐类水解的应用课件人教 版高中 化学选 修四
1.多元弱酸盐和多元弱酸溶液
CH3COONa溶液:
CH3COO-+ H2O
CH3COOH + OH-
[Na +] >[CHCOO -] >[OH -] >[H +]
热水:升温能够促进水解
配制CuCl2溶液,为防止出现浑浊,应加少量的_______
稀盐酸
盐类的水解盐类水解的应用课件人教 版高中 化学选 修四
Na 2S溶液 S2-+H2O
HS-+OH-
HS-+H2O OH- + H 2S
[Na +] > [S2- ] >[OH -] > [HS- ] >[H +]
H 2S: H 2S H + + HS- HS-
H + + S2-
[H +] > [HS- ] > [S2- ] >[OH -]
盐类的水解盐类水解的应用课件人教 版高中 化学选 修四
盐类的水解盐类水解的应用课件人教 版高中 化学选 修四
(二)比较盐溶液中各离子浓度的相对大小
练:25℃时,在浓度均为1mo/L的(NH4)2SO4、(NH4)2CO3、 (NH4)2Fe(SO4)2三种溶液中,若测得其中c(NH4+)分别为a、b、 c(单位为moI/L),则下列判断正确的是( )
(四)解释某些实验现象及在生产、生活中的应用
1.配制易水解的盐溶液时,需考虑抑制盐的水解,如在 配制强酸弱碱盐溶液时,需滴加几滴对应的强酸,来抑 制盐的水解。
第三节盐类的水解第课时水解应用

条件
移动方向
H+数目
pH
Fe3+水解率
现象
升温
正反应 增加 降 增大 颜色变深
通HCl 加H2O 加NaHCO3
逆反应 正反应 正反应
增加 降 增加 升 减少 升
减小 增大 增大
颜色变浅
颜色变浅 红褐色沉淀, 无色气体
2024/8/2
影响盐类水解的主要因素和盐类水解反应的利用
2)
外因:符合勒夏特列原理
5)判断酸碱的强弱 例:NaA溶液呈碱性,问HA是强酸或是弱酸? 弱酸
M(NO3)2溶液呈酸性?问M(OH)2是强碱或是弱碱? 弱碱
例:物质的量浓度相同的三种盐NaX、NaY、NaZ,
pH值依次为7、8、9,那么相应的酸HX,HY,HZ的
由强到弱的顺序是:
HX > HY > HZ
6)制备某些无水盐 例:将挥发性酸对应的盐(AlCl3,FeBr3,Fe(NO3)3等) 的溶液加热蒸干,得不到盐本身。
6. 为什么不能从溶液中直接制取Al2S3? 因Al3+、S2-均能水解,Al3+水解使溶液呈酸 性,S2-水解使溶液呈碱性。如Al3+、S2-在 同一溶液中,它们将相互促进水解而使水解 完全,从而得不到Al2S3。
2024/8/2
影响盐类水解的主要因素和盐类水解反应的利用
4、电解质溶液中有关离子浓度的计算
②浓度:稀释溶液可以促进水解,使水解平衡向右 移动,即盐的浓度越小其水解程度越大
越稀越水解
③溶液的酸碱度: 酸碱能够抑制或促进水解
问题:配制FeCl3溶液需要注意什么问题?
Fe3+ + 3H2O
Fe(OH)3 + 3H+
《盐类水解》课件人教

NaOH>Na2CO3>NaHCO3>CH3COONa>Na2SO4 >(NH4)2SO4>NaHSO4
2、易水解盐的配制和保存
Fe3+ + 3H2O
Fe(OH)3 +3H+
配制 FeCl3溶液:加少量 稀盐酸 ; 加相应的酸
配制 Fe2(SO4)3溶液:加少加少量 稀盐酸和Fe粉 ;
第三节 盐类的水解
第3课时 盐类水解反应的应用
河北南宫中学
目录
CONTENTS
1、在生产生活中的应用 2、在科学研究中的应用
水解利用实则:抑制或促进
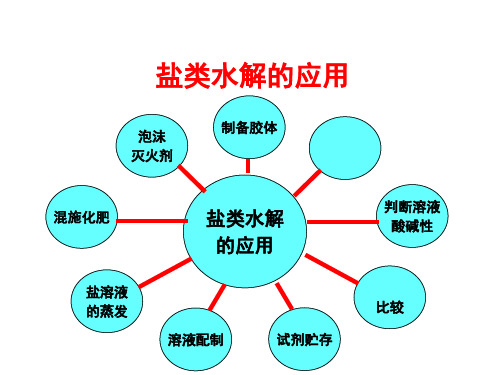
泡沫 灭火剂
制备胶体
明矾净水
混施化肥
盐溶液 的蒸发
盐类水解 的应用
溶液配制
试剂贮存
判断溶液 酸碱性
离子浓度 比较
3
PART 1 在生产生活中的应用
6、制备纳米材料 如:用TiCl4制备TiO2
课本 P58
PART 2 在科学研究中的应用
1、比较盐溶液酸碱性的强弱
例:相同条件,相同物质的量浓度的下列七种溶液:Na2CO3、 CH3COONa 、 Na2SO4 、 NaHCO3 、 NaOH 、 (NH4)2SO4 、 NaHSO4等溶液,pH值由大到小的顺序为?为什么?
2、净水剂原理
明矾[KAl(SO4)·12H2O]、FeCl3 等
Al 3+ + 3H2O
Al(OH)3 (胶体) + 3H +
Fe 3+ + 3H2O
Fe (OH)3 (胶体) + 3H +
胶体本身无毒,胶体可吸附不溶性杂质,起到净水作用。
2、易水解盐的配制和保存
Fe3+ + 3H2O
Fe(OH)3 +3H+
配制 FeCl3溶液:加少量 稀盐酸 ; 加相应的酸
配制 Fe2(SO4)3溶液:加少加少量 稀盐酸和Fe粉 ;
第三节 盐类的水解
第3课时 盐类水解反应的应用
河北南宫中学
目录
CONTENTS
1、在生产生活中的应用 2、在科学研究中的应用
水解利用实则:抑制或促进
泡沫 灭火剂
制备胶体
明矾净水
混施化肥
盐溶液 的蒸发
盐类水解 的应用
溶液配制
试剂贮存
判断溶液 酸碱性
离子浓度 比较
3
PART 1 在生产生活中的应用
6、制备纳米材料 如:用TiCl4制备TiO2
课本 P58
PART 2 在科学研究中的应用
1、比较盐溶液酸碱性的强弱
例:相同条件,相同物质的量浓度的下列七种溶液:Na2CO3、 CH3COONa 、 Na2SO4 、 NaHCO3 、 NaOH 、 (NH4)2SO4 、 NaHSO4等溶液,pH值由大到小的顺序为?为什么?
2、净水剂原理
明矾[KAl(SO4)·12H2O]、FeCl3 等
Al 3+ + 3H2O
Al(OH)3 (胶体) + 3H +
Fe 3+ + 3H2O
Fe (OH)3 (胶体) + 3H +
胶体本身无毒,胶体可吸附不溶性杂质,起到净水作用。
第三课时 盐类水解的应用

中性→强酸 酸性→弱碱 中性→强碱
某碱的强酸盐水溶液呈
酸、碱是弱电解质的判断方法
• 1、已知浓度的酸碱实际电离出的H+、 OH-的浓度比对应浓度同元强酸、强碱 电离出的H+、OH-少
• 2、已知浓度的酸碱的实测PH值比对 应浓度同元强酸、强碱的PH酸大碱小 • 3、对强盐溶液不呈中性 • 4、稀释10n倍,PH变化小于 n
B. Al3+、Cl-、HCO3-、Na+ C. Fe2+、 NO3-、SO42-、H+
D. NH4+、 Na+、 Cl-、 HCO3-
②泡沫灭火器的原理
Al2(SO4)3 + 6NaHCO3 = 2Al(OH)3 ↓+ 6CO2↑ + 3Na2SO4
5、选择制备盐的途径时,需考虑 盐的水解。
如制备 Al2S3 、 Mg3N2 时,因无法在溶液中 制取,会完全水解,只能由干法直接反应 制取。
9、Mg、Zn等较活泼金属及某些难溶碱、 盐溶于强酸弱碱盐溶液中产生H2。
练1. 在NH4Cl饱和溶液中加入Mg条,观察
到有气泡产生,点燃有爆鸣声,此气体 是 ,产生该气体的原因是 (离子方程式表示),微热后,能放出有 刺激性气味的气体,它能使湿润的红色石 蕊试纸变蓝,该气体是 ,产生该气体 的原因是 ,总的离子方程式 是 。
(四)盐类水解的应用
1、判断盐溶液的酸碱性 如:硫酸铵溶液: 显酸性 显碱性 氟化钠溶液: 强碱酸式盐 (1) 强酸酸式盐只电离,不水解,一定显酸性。 如:HSO4(2) 弱酸酸式盐既电离又水解。 电离强于水解,显酸性,如 H2PO4-、HSO3水解强于电离,显碱性,如 HCO3-、 HPO42-
将溶液经蒸干、灼烧最终所得物质填入下表
某碱的强酸盐水溶液呈
酸、碱是弱电解质的判断方法
• 1、已知浓度的酸碱实际电离出的H+、 OH-的浓度比对应浓度同元强酸、强碱 电离出的H+、OH-少
• 2、已知浓度的酸碱的实测PH值比对 应浓度同元强酸、强碱的PH酸大碱小 • 3、对强盐溶液不呈中性 • 4、稀释10n倍,PH变化小于 n
B. Al3+、Cl-、HCO3-、Na+ C. Fe2+、 NO3-、SO42-、H+
D. NH4+、 Na+、 Cl-、 HCO3-
②泡沫灭火器的原理
Al2(SO4)3 + 6NaHCO3 = 2Al(OH)3 ↓+ 6CO2↑ + 3Na2SO4
5、选择制备盐的途径时,需考虑 盐的水解。
如制备 Al2S3 、 Mg3N2 时,因无法在溶液中 制取,会完全水解,只能由干法直接反应 制取。
9、Mg、Zn等较活泼金属及某些难溶碱、 盐溶于强酸弱碱盐溶液中产生H2。
练1. 在NH4Cl饱和溶液中加入Mg条,观察
到有气泡产生,点燃有爆鸣声,此气体 是 ,产生该气体的原因是 (离子方程式表示),微热后,能放出有 刺激性气味的气体,它能使湿润的红色石 蕊试纸变蓝,该气体是 ,产生该气体 的原因是 ,总的离子方程式 是 。
(四)盐类水解的应用
1、判断盐溶液的酸碱性 如:硫酸铵溶液: 显酸性 显碱性 氟化钠溶液: 强碱酸式盐 (1) 强酸酸式盐只电离,不水解,一定显酸性。 如:HSO4(2) 弱酸酸式盐既电离又水解。 电离强于水解,显酸性,如 H2PO4-、HSO3水解强于电离,显碱性,如 HCO3-、 HPO42-
将溶液经蒸干、灼烧最终所得物质填入下表
三节三时盐类的水解的应用PPT课件
“焊药”—金属焊接时常用于除去金属表 面的氧化膜,常用ZnCl2、NH4Cl。
灭火器原理
消防灭火中的盐类水解知识
塑料筒里面放入的什么药品? 外筒放入的是什么药品?
泡沫灭火器里的药品是NaHCO3溶液和Al2(SO4)3溶液。
问题:泡沫灭火器中装的是那两种溶液,其作用原理 是什么?
药品:Al2(SO4)3溶液、NaHCO3溶液
了肥效。
双水解
(三)工业生产中的盐类水解问题
问题10:金属镁与水反应比较困难,若
加一些NH4Cl马上产生大量气体?为什么?
NH4++H2O
NH3•H2O + H+
Mg+ 2H+ = Mg2+ + H2↑ △
NH3•H2O = NH3 ↑ + H2O
总方程式:
Mg+2NH4Cl=MgCl2+2NH3 +H2
(3)强碱弱酸盐水溶液蒸干后一般得到原物质。
如:蒸干 Na2CO3 溶液仍得到 Na2CO3 固体。 (4)对于具有强还原性的盐,如 FeCl2、Na2SO3 等, 在空气中将其溶液蒸干并灼烧时,会发生氧化还原
CO32- + H2O
HCO3- + OH-
SiO2 + 2OH- = SiO32- + H2O
6、加热蒸发可水解的盐溶液析出?固体
问题4:把FeCl3溶液蒸干灼烧,最后得到的固体 产物是什么,为什么?
FeCl3+3H2O ⑴加热促进水解
Fe(OH)3+3HCl ⑵HCl挥发
△
2Fe(OH)3 = Fe2O3 + 3H2O
Al3++3H2O
第三章第三节第3课时盐类水解在化学实验中的典型应用PPT25张

碱
本课时栏目开关
学习·探究 区
本课时栏目开关
学习·探究 区
本课时栏目开关
本课时栏目开关
学习·探究 区
NH4Cl、NH3·H2O
碱
学习·探究 区
本课时栏目开关
Hale Waihona Puke 课时栏目开关学习·探究 区
答案 ①②④⑤⑥
学习·探究 区
①③⑤
本课时栏目开关
学习·探究 区
B
本课时栏目开关
学习·探究 区
本课时栏目开关
第三章第三节第3课时盐 类水解在化学实验中的
典型应用PPT25张
2020/8/16
本课时栏目开关
知识·回顾 区
碱 酸
知识·回顾 区
本课时栏目开关
知识·回顾 区
本课时栏目开关
学习·探究 区
本课时栏目开关
学习·探究 区
本课时栏目开关
学习·探究 区
本课时栏目开关
学习·探究 区
本课时栏目开关
学习·探究 区
学习·探究 区
A
本课时栏目开关
学习·探究 区
本课时栏目开关
自我·检测 区
D
本课时栏目开关
自我·检测 区
C
本课时栏目开关
自我·检测 区
C
本课时栏目开关
自我·检测 区
C
本课时栏目开关
自我·检测 区
D
本课时栏目开关
本课时栏目开关
学习·探究 区
本课时栏目开关
学习·探究 区
本课时栏目开关
本课时栏目开关
学习·探究 区
NH4Cl、NH3·H2O
碱
学习·探究 区
本课时栏目开关
Hale Waihona Puke 课时栏目开关学习·探究 区
答案 ①②④⑤⑥
学习·探究 区
①③⑤
本课时栏目开关
学习·探究 区
B
本课时栏目开关
学习·探究 区
本课时栏目开关
第三章第三节第3课时盐 类水解在化学实验中的
典型应用PPT25张
2020/8/16
本课时栏目开关
知识·回顾 区
碱 酸
知识·回顾 区
本课时栏目开关
知识·回顾 区
本课时栏目开关
学习·探究 区
本课时栏目开关
学习·探究 区
本课时栏目开关
学习·探究 区
本课时栏目开关
学习·探究 区
本课时栏目开关
学习·探究 区
学习·探究 区
A
本课时栏目开关
学习·探究 区
本课时栏目开关
自我·检测 区
D
本课时栏目开关
自我·检测 区
C
本课时栏目开关
自我·检测 区
C
本课时栏目开关
自我·检测 区
C
本课时栏目开关
自我·检测 区
D
本课时栏目开关
高中化学 第3课时 盐类水解原理的应用 鲁科版

A.Na2CO3、NaHCO3、NaCl、AlCl3、HCl B . NaOH 、 Na2CO3 、 NaHCO3 、 NH4Cl 、 NaCl
C . H2SO4 、 (NH4)2SO4 、 NH4Cl 、 NaNO3 、 NaHS
D.NH4Cl、(NH4)2SO4、NaNO3、NaHS、 Ba(OH)2
A.②③①④
B.④①③②
C.①④③②
D.②④①③
解析:(1)因为Al3++3H2O
Al(OH)3+
3H+,加入少量盐酸,增大溶液中c(H+),使
Al3+水解平衡向左移动,可抑制Al3+水解。
配制Na2S溶液时,因为S2-+H2O
HS-
+OH-,加入少量的NaOH,增大溶液中
c(OH-),使S2-的水解平衡向左移动,可抑
pH 由 大 到 小 的 顺 序 为 : Na2SiO3 、 Na2CO3 、 NaHCO3、NaCl、NH4Cl。 (2)用最简便的方法区别NaCl、NH4Cl、 Na2CO3三种无色透明溶液:用pH试纸鉴别, pH=7的是NaCl溶液,pH<7的是NH4Cl溶 液,pH>7的是Na2CO3溶液。
要点突破讲练互动
盐类水解的应用
探究导引1 盐类水解有哪些应用? 提示:配制盐溶液;分析盐的制备方法;盐 的净水作用;纯碱的去污原理;泡沫灭火器 的原理,化学肥料的施用;蒸干盐溶液下应用:
1.某些物质水溶液的配制
配制FeCl3的水溶液,FeCl3溶于水后发生如 下水解反应:Fe3++3H2O Fe(OH)3+ 3H+,因Fe(OH)3的生成而使溶液变浑浊, 通常先将FeCl3溶于浓盐酸中,可抑制Fe3+的 水解,使溶液保持澄清,
制S2-水解。
(2)四种溶液中均存在水解平衡:NH+ 4 +H2O
C . H2SO4 、 (NH4)2SO4 、 NH4Cl 、 NaNO3 、 NaHS
D.NH4Cl、(NH4)2SO4、NaNO3、NaHS、 Ba(OH)2
A.②③①④
B.④①③②
C.①④③②
D.②④①③
解析:(1)因为Al3++3H2O
Al(OH)3+
3H+,加入少量盐酸,增大溶液中c(H+),使
Al3+水解平衡向左移动,可抑制Al3+水解。
配制Na2S溶液时,因为S2-+H2O
HS-
+OH-,加入少量的NaOH,增大溶液中
c(OH-),使S2-的水解平衡向左移动,可抑
pH 由 大 到 小 的 顺 序 为 : Na2SiO3 、 Na2CO3 、 NaHCO3、NaCl、NH4Cl。 (2)用最简便的方法区别NaCl、NH4Cl、 Na2CO3三种无色透明溶液:用pH试纸鉴别, pH=7的是NaCl溶液,pH<7的是NH4Cl溶 液,pH>7的是Na2CO3溶液。
要点突破讲练互动
盐类水解的应用
探究导引1 盐类水解有哪些应用? 提示:配制盐溶液;分析盐的制备方法;盐 的净水作用;纯碱的去污原理;泡沫灭火器 的原理,化学肥料的施用;蒸干盐溶液下应用:
1.某些物质水溶液的配制
配制FeCl3的水溶液,FeCl3溶于水后发生如 下水解反应:Fe3++3H2O Fe(OH)3+ 3H+,因Fe(OH)3的生成而使溶液变浑浊, 通常先将FeCl3溶于浓盐酸中,可抑制Fe3+的 水解,使溶液保持澄清,
制S2-水解。
(2)四种溶液中均存在水解平衡:NH+ 4 +H2O
盐类水解的应用 PPT

总结
泡沫 灭火剂
判断离 子共存
判断离子种 类、数目
混施化肥
盐类水解 的利用
明矾净水 物质提纯
盐溶液 的蒸发
判断溶液 酸碱性
盐的配 制和存放
三、溶液酸碱性的判断
练习和思考:相同温度下同物质的量 浓度的下列溶液PH值由小到大的排序 是:
①NaOH
②NH3·H2O
④NaHSO4 ⑤NH4Cl
⑦NaHCO3 ⑧Ba(OH)2
⑩CH3COOH
③H2SO4 ⑥Na2CO3 ⑨NaCl
答案:③④⑩⑤⑨⑦⑥②①⑧
四、水解的盐的配制和存放
观察思考:
Fe(OH)3〔胶体〕+3H+ Al(OH)3〔胶体〕+3H+
3、农家谚语:“灰混粪,粪混灰,灰粪相混损肥分.” 为什么?
草木灰的成分:K2CO3,水解呈碱性.
CO32-+H2O HCO3-+H2O
HCO3- +OHH2CO3 +OH-
铵态氮肥——铵盐,水解呈酸性.
NH4++H2O
NH3·H2O+ H+
①观察新制和久置的FeCl3溶液,解释不同的原因? ②在溶液配制和存放的过程中如何解决此问题?
答案:
①久置的FeCl3溶液变得浑浊, 是因为Fe3++3H2O Fe(OH)3+3H+ ②配制FeCl3溶液的时候要入少量HCl防止Fe3+水解 【小结】:配制易水解的金属盐溶液应加少
量的___同___种__酸______
4、泡沫灭火器能灭火,为什么?
玻璃筒里面放入的什么药品?外筒(钢质)放入的是 什么药品? 泡沫灭火器里的药品是NaHCO3溶液和Al2(SO4)3溶液。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
固体为Al2(SO4)3 。
(3)在空气中操作,空气中有强氧化性物质氧气, 如有还原性,会被氧化
如:Na2SO3等盐在加热蒸干过程中要发生 氧化还原反应,最后得到的固体为Na2SO4。
总结:将溶液经蒸干灼烧,最终所得物质填入下表
AlCl3 FeCl3 CuCl2 MgCl2 Al2(SO4)3 FeCl2 Na2SO3 NaHCO3
1、用纯碱去油污,加热去油污效果好,请用平衡原理 加以解释
纯碱为Na2 CO3 ,水解的离子方程式为:
CO32— + H2O
HCO3— + OH— ,水
解是吸热的,温度高,溶液碱性强,去油
污效果好。
2、用明矾和铁盐可以净化水的原因分析
Al 3+ + 3H2O
Al(OH)3 (胶体) + 3H +
Fe 3+ + 3H2O
原因:NH4Cl+H2O NH3 ·H2O+HCl
Mg+2HCl = MgCl2 + H2↑
HCl消耗,平衡正移, NH3 ·H2O浓度 增大,分解产生NH3
7、判断加热蒸干并灼烧某些盐溶液得到固体产物
(1)将氯化铁溶液蒸干并灼烧得到红综色固体 Fe2O3,结合化学用语和适当的文字加以解释。
原因: FeCl3+ 3H2O
HCl
8、MgCl2稀溶液得到无水MgCl2固体(分两步) 第一步:加热、浓缩、冷却、结晶、过滤
得到: MgCl2 ·6H2O
第二步:MgCl2 ·6H2O在干燥的HCl的气流中加热
MgCl2 + 2H2O
Mg(OH)2 + 2HCl
HCl
HCl的作用:将生成水带走,
且抑制氯化镁的水解,
二、盐类水解在生活、工农业生产中的应用
(3)氯化亚铁溶液的配制和保存
FeCl2 + 2H2O
Fe(OH)2 + 2HCl
将氯化亚铁固体溶解在一定浓度的盐酸中,再稀释 到所需的浓度。再加入少量的铁屑(或铁丁)
加盐酸,为了抑制水解 加入铁屑,为了抑制氧化
6、较活泼的金属和某些盐溶液反应出氢气
例:将镁条投入到氯化铁溶液中,有啥现象?
现象:有无色无味气体产生,且差生红褐色 沉淀。
2018——2019学年北京高三化学一轮复习 盐类 水解的应用(25张)
一、盐类水解在化学实验中的应用 1、判断盐对应的酸或碱的相对强弱
例1:(1)常温下,测定NaA 溶液PH>7, 证明HA酸为弱酸。
原因是: NaA 溶液PH>7,说明A—能水解, 则证明HA为弱酸。
(2)常温下,等浓度溶液PH:NaHCO3<NaClO,则 说明酸性:H2CO3 >HClO
原因是:酸越弱,该酸对应的盐水解程度大, 同浓度同温度的溶液碱性强,PH大
2、鉴别NH4Cl 、NaCl、CH3COONa三种溶液的简单 方法。
用pH试纸测定三种溶液的PH, pH<7的为NH4Cl pH=7的为NaCl pH >7的为CH3COONa
理论依据:单一盐溶液,谁强显谁性、两 强显中性
FeCl3+ 3H2O
Fe (OH)3 + 3HCl
Mg+2H+ =Mg2+ +H2↑
上述平衡右移动,产生氢氧化铁沉淀。
5、胶体的制备
将氯化铁饱和溶液滴入到沸水中,继续加热到溶 液出现红褐色,停止加热。
加热
Fe3+ + 3H2O == Fe(OH)3 + 3H+
胶体
例2:将镁条放入到氯化铵溶液,产生有刺激 性气味的气体。
MgSO4 +2H2 O Mg(OH)2+H2SO4
但是硫酸不挥发,浓度大了有反应,逆方向 移动,水挥发。得到MgSO4
11
归纳总结:关于溶液的蒸干灼烧问题
(1)本身稳定性问题 如KMnO4溶液蒸干后得到K2MnO4和MnO2 , NaHCO3溶液蒸干后得到Na2CO3
(2)水解产物是否挥发。 如:AlCl3、Al(NO3)3等盐水解后生成的酸能挥发, 加热促进水解,最终所得固体产物为Al2O3。 如:Al2(SO4)3水解后生成的酸难挥发,最后所得
Na2CO3
Al2O3 Fe2O3 CuO
MgO
Al2(SO4)3 Fe2O3
Na2SO4 Na2CO3
Na2CO3
(2)MgCl2·6H2O直接加热,也得不到无 水MgCl2
原因是: 加热
MgCl2·6H2O == Mg(OH )Cl+HCl+5H2O
如果要得到无水MgCl2 ,应该将晶体在 干燥的HCl气流中加热。
Fe (OH)3 + 3HCl
水解吸热,升高温度,平衡右移动,盐酸浓度大了, 平衡继续正移,生成Fe (OH)3 ,加热分解得到Fe2O3
思考:AlCl3溶液溶液蒸干并灼烧得到到什么物质?
AlCl3溶液 蒸干 Al(OH)3 灼烧 Al2O3
MgCl2
△ Mg(OH)2 △ MgO
分析:如果加热蒸干:MgSO4 溶液,可 以得到无水MgSO4。
3 .试剂的贮存考虑盐的水解。 如Na2CO3溶液贮存时用橡胶塞
CO32- + H2O
HCO3- + OH-
SiO2 + 2OH- = SiO32- + H2O
注意:实验室贮存碱性溶液的试剂瓶一律使
用橡胶塞
4、易水解盐溶液的配制与保存:
FeCl3+ 3H2O
Fe (OH)3 + 3HCl
溶液的配制和保存:主要考虑两个问题,一是水解酸碱性的问题,二
CO32— 浓度降低,上述平衡逆向移动,碱 性减弱或消失。
4、制备纳米材料 如用TiCl4制备TiO2的反应可表示如下: TiCl4+(x+2)H2O(过量) Ti O2.x H2 O + 4 H Cl 制备时加入大量的水,同时加热(为什么?)
是该盐在空气中是否被氧化的问题(空气中有强氧化剂氧气)。如果
水解显酸性,应该加入相应的酸,抑制水解,如果还原性强,应该加
入强还原性,抑制氧化。
(1)氯化铁溶液的配制:
将氯化铁固体,溶解在盐酸中,在稀释到所需的浓 度。加盐酸抑制水解
(2)硫酸铜溶液额配制
将硫酸铜固体加入到硫酸中,在稀释到所需的浓度, 加入硫酸是为了,抑制硫酸铜的水解
Fe (OH)3 (胶体) + 3H +
本身无毒,胶体可吸附不溶性杂质,起到净水作用。
17
3、盐碱地(含有较多的NaCl 、Na2 CO3)不利 于农作物的生长,可以加入石膏,降低土壤的碱
性,用平衡移动原理加以解释
原因是:碳酸钠水解
CO32— +H2Oห้องสมุดไป่ตู้
HCO3— +OH—
加入石膏,CO32— +Ca2+=CaCO3
(3)在空气中操作,空气中有强氧化性物质氧气, 如有还原性,会被氧化
如:Na2SO3等盐在加热蒸干过程中要发生 氧化还原反应,最后得到的固体为Na2SO4。
总结:将溶液经蒸干灼烧,最终所得物质填入下表
AlCl3 FeCl3 CuCl2 MgCl2 Al2(SO4)3 FeCl2 Na2SO3 NaHCO3
1、用纯碱去油污,加热去油污效果好,请用平衡原理 加以解释
纯碱为Na2 CO3 ,水解的离子方程式为:
CO32— + H2O
HCO3— + OH— ,水
解是吸热的,温度高,溶液碱性强,去油
污效果好。
2、用明矾和铁盐可以净化水的原因分析
Al 3+ + 3H2O
Al(OH)3 (胶体) + 3H +
Fe 3+ + 3H2O
原因:NH4Cl+H2O NH3 ·H2O+HCl
Mg+2HCl = MgCl2 + H2↑
HCl消耗,平衡正移, NH3 ·H2O浓度 增大,分解产生NH3
7、判断加热蒸干并灼烧某些盐溶液得到固体产物
(1)将氯化铁溶液蒸干并灼烧得到红综色固体 Fe2O3,结合化学用语和适当的文字加以解释。
原因: FeCl3+ 3H2O
HCl
8、MgCl2稀溶液得到无水MgCl2固体(分两步) 第一步:加热、浓缩、冷却、结晶、过滤
得到: MgCl2 ·6H2O
第二步:MgCl2 ·6H2O在干燥的HCl的气流中加热
MgCl2 + 2H2O
Mg(OH)2 + 2HCl
HCl
HCl的作用:将生成水带走,
且抑制氯化镁的水解,
二、盐类水解在生活、工农业生产中的应用
(3)氯化亚铁溶液的配制和保存
FeCl2 + 2H2O
Fe(OH)2 + 2HCl
将氯化亚铁固体溶解在一定浓度的盐酸中,再稀释 到所需的浓度。再加入少量的铁屑(或铁丁)
加盐酸,为了抑制水解 加入铁屑,为了抑制氧化
6、较活泼的金属和某些盐溶液反应出氢气
例:将镁条投入到氯化铁溶液中,有啥现象?
现象:有无色无味气体产生,且差生红褐色 沉淀。
2018——2019学年北京高三化学一轮复习 盐类 水解的应用(25张)
一、盐类水解在化学实验中的应用 1、判断盐对应的酸或碱的相对强弱
例1:(1)常温下,测定NaA 溶液PH>7, 证明HA酸为弱酸。
原因是: NaA 溶液PH>7,说明A—能水解, 则证明HA为弱酸。
(2)常温下,等浓度溶液PH:NaHCO3<NaClO,则 说明酸性:H2CO3 >HClO
原因是:酸越弱,该酸对应的盐水解程度大, 同浓度同温度的溶液碱性强,PH大
2、鉴别NH4Cl 、NaCl、CH3COONa三种溶液的简单 方法。
用pH试纸测定三种溶液的PH, pH<7的为NH4Cl pH=7的为NaCl pH >7的为CH3COONa
理论依据:单一盐溶液,谁强显谁性、两 强显中性
FeCl3+ 3H2O
Fe (OH)3 + 3HCl
Mg+2H+ =Mg2+ +H2↑
上述平衡右移动,产生氢氧化铁沉淀。
5、胶体的制备
将氯化铁饱和溶液滴入到沸水中,继续加热到溶 液出现红褐色,停止加热。
加热
Fe3+ + 3H2O == Fe(OH)3 + 3H+
胶体
例2:将镁条放入到氯化铵溶液,产生有刺激 性气味的气体。
MgSO4 +2H2 O Mg(OH)2+H2SO4
但是硫酸不挥发,浓度大了有反应,逆方向 移动,水挥发。得到MgSO4
11
归纳总结:关于溶液的蒸干灼烧问题
(1)本身稳定性问题 如KMnO4溶液蒸干后得到K2MnO4和MnO2 , NaHCO3溶液蒸干后得到Na2CO3
(2)水解产物是否挥发。 如:AlCl3、Al(NO3)3等盐水解后生成的酸能挥发, 加热促进水解,最终所得固体产物为Al2O3。 如:Al2(SO4)3水解后生成的酸难挥发,最后所得
Na2CO3
Al2O3 Fe2O3 CuO
MgO
Al2(SO4)3 Fe2O3
Na2SO4 Na2CO3
Na2CO3
(2)MgCl2·6H2O直接加热,也得不到无 水MgCl2
原因是: 加热
MgCl2·6H2O == Mg(OH )Cl+HCl+5H2O
如果要得到无水MgCl2 ,应该将晶体在 干燥的HCl气流中加热。
Fe (OH)3 + 3HCl
水解吸热,升高温度,平衡右移动,盐酸浓度大了, 平衡继续正移,生成Fe (OH)3 ,加热分解得到Fe2O3
思考:AlCl3溶液溶液蒸干并灼烧得到到什么物质?
AlCl3溶液 蒸干 Al(OH)3 灼烧 Al2O3
MgCl2
△ Mg(OH)2 △ MgO
分析:如果加热蒸干:MgSO4 溶液,可 以得到无水MgSO4。
3 .试剂的贮存考虑盐的水解。 如Na2CO3溶液贮存时用橡胶塞
CO32- + H2O
HCO3- + OH-
SiO2 + 2OH- = SiO32- + H2O
注意:实验室贮存碱性溶液的试剂瓶一律使
用橡胶塞
4、易水解盐溶液的配制与保存:
FeCl3+ 3H2O
Fe (OH)3 + 3HCl
溶液的配制和保存:主要考虑两个问题,一是水解酸碱性的问题,二
CO32— 浓度降低,上述平衡逆向移动,碱 性减弱或消失。
4、制备纳米材料 如用TiCl4制备TiO2的反应可表示如下: TiCl4+(x+2)H2O(过量) Ti O2.x H2 O + 4 H Cl 制备时加入大量的水,同时加热(为什么?)
是该盐在空气中是否被氧化的问题(空气中有强氧化剂氧气)。如果
水解显酸性,应该加入相应的酸,抑制水解,如果还原性强,应该加
入强还原性,抑制氧化。
(1)氯化铁溶液的配制:
将氯化铁固体,溶解在盐酸中,在稀释到所需的浓 度。加盐酸抑制水解
(2)硫酸铜溶液额配制
将硫酸铜固体加入到硫酸中,在稀释到所需的浓度, 加入硫酸是为了,抑制硫酸铜的水解
Fe (OH)3 (胶体) + 3H +
本身无毒,胶体可吸附不溶性杂质,起到净水作用。
17
3、盐碱地(含有较多的NaCl 、Na2 CO3)不利 于农作物的生长,可以加入石膏,降低土壤的碱
性,用平衡移动原理加以解释
原因是:碳酸钠水解
CO32— +H2Oห้องสมุดไป่ตู้
HCO3— +OH—
加入石膏,CO32— +Ca2+=CaCO3
