第一章《常用逻辑用语》知识总结
常用逻辑用语知识点总结

常用逻辑用语知识点总结命题:1、定义:我们把用语言、符号或式子表达的,可以判断真假的陈述句叫做命题。
其中判断为真的语句叫做真命题,判断为假的语句叫做假命题.注:1、疑问句、祈使句、感叹句都不是命题.2、还有一种语句,如“5x >”、“210x -=”等,语句中含有变量x 或y ,在没有给定这些变量的值之前,是无法确定语句的真假的,这种含有变量的语句叫做开语句(条件命题).开语句不是命题.含有全称量词的命题,叫做全称命题.含有存在量词的命题,叫做存在性命题全称命题q: ()x q A ,x ∈∀的否定: 存在性命题p: ()x p A ,x ∈∃的否定:基本逻辑联结词“且”“或”“非”用联结词“且”把命题p 和q 联结起来,得到一个新命题,记作p q ∧,读作:“p 且q ” 命题p q ∧真假判断规律:用联结词“或”把命题p 和q 联结起来,得到一个新命题,记作p q ∨,读作:“p 或q ” 命题p q ∨真假判断规律:对命题p 加以否定,得到一个新命题,记作p ⌝,读作“非p ”或“p 的否定” 命题p ⌝真假判断规律:充分条件与必要条件如果p ,则q ,记作p q ⇒,则称p 是q 的 条件;q 是p 的 条件。
如果p q ⇒,且q p ⇒,简称p 是q 的充要条件。
记作p q ⇔设满足条件p 的集合为数集A ,满足条件q 的集合为数集B,若A 是B 的子集,则p 是q 的 条件若A 是B 的真子集,则p 是q 的 条件若A=B ,则p 是q 的 条件若B 是A 的子集,则p 是q 的 条件若B 是A 的真子集,则p 是q 的 条件规律总结: 。
命题的四种形式• 原命题:如果p ,则q ; • 逆命题:如果q ,则p ;• 否命题:如果非p ,则非q ; • 逆否命题:如果非q ,则非p .原命题与逆命题,否命题与逆否命题是 的命题;原命题与否命题,逆命题与逆否命题是 的命题;原命题与逆否命题,逆命题与否命题是 的命题。
第一章 集合与常用逻辑用语

第一章集合与常用逻辑用语第一章集合与常用逻辑用语§1.1集合的概念与运算一、知识导学1.集合:一般地,一定范围内某些确定的、不同的对象的全体构成一个集合.2.元素:集合中的每一个对象称为该集合的元素,简称元.3.子集:如果集合A的任意一个元素都是集合B的元素(若则),则称集合A为集合B的子集,记为AB或BA;如果AB,并且AB,这时集合A称为集合B的真子集,记为AB或BA.4.集合的相等:如果集合A、B同时满足AB、BA,则A=B.5.补集:设AS,由S中不属于A的所有元素组成的集合称为S的子集A的补集,记为.6.全集:如果集合S包含所要研究的各个集合,这时S可以看做一个全集,全集通常记作U.7.交集:一般地,由所有属于集合A且属于B的元素构成的集合,称为A与B的交集,记作AB.8.并集:一般地,由所有属于集合A或者属于B的元素构成的集合,称为A与B的并集,记作AB.9.空集:不含任何元素的集合称为空集,记作.10.有限集:含有有限个元素的集合称为有限集.11.无限集:含有无限个元素的集合称为无限集.12.集合的常用表示方法:列举法、描述法、图示法(Venn 图).13.常用数集的记法:自然数集记作N,正整数集记作N+或N,整数集记作Z,有理数集记作Q,实数集记作R.二、疑难知识导析1.符号,,,,=,表示集合与集合之间的关系,其中“”包括“”和“=”两种情况,同样“”包括“”和“=”两种情况.符号,表示元素与集合之间的关系.要注意两类不同符号的区别.2.在判断给定对象能否构成集合时,特别要注意它的“确定性”,在表示一个集合时,要特别注意它的“互异性”、“无序性”.3.在集合运算中必须注意组成集合的元素应具备的性质.4.对由条件给出的集合要明白它所表示的意义,即元素指什么,是什么范围.用集合表示不等式(组)的解集时,要注意分辨是交集还是并集,结合数轴或文氏图的直观性帮助思维判断.空集是任何集合的子集,但因为不好用文氏图形表示,容易被忽视,如在关系式中,B=易漏掉的情况.5.若集合中的元素是用坐标形式表示的,要注意满足条件的点构成的图形是什么,用数形结合法解之.6.若集合中含有参数,须对参数进行分类讨论,讨论时既不重复又不遗漏.7.在集合运算过程中要借助数轴、直角坐标平面、Venn图等将有关集合直观地表示出来.8.要注意集合与方程、函数、不等式、三角、几何等知识的密切联系与综合使用.9.含有n个元素的集合的所有子集个数为:,所有真子集个数为:-1三、经典例题导讲[例1] 已知集合M={y|y=x2+1,x∈R},N={y|y =x+1,x∈R},则M∩N=()A.(0,1),(1,2)B.{(0,1),(1,2)}C.{y|y=1,或y=2}D.{y|y≥1}错解:求M∩N及解方程组得或∴选B错因:在集合概念的理解上,仅注意了构成集合元素的共同属性,而忽视了集合的元素是什么.事实上M、N的元素是数而不是实数对(x,y),因此M、N是数集而不是点集,M、N分别表示函数y=x2+1(x∈R),y=x+1(x∈R)的值域,求M∩N即求两函数值域的交集.正解:M={y|y=x2+1,x∈R}={y|y≥1},N={y|y=x+1,x∈R}={y|y∈R}.∴M∩N={y|y≥1}∩{y|(y∈R)}={y|y≥1},∴应选D.注:集合是由元素构成的,认识集合要从认识元素开始,要注意区分{x|y=x2+1}、{y|y=x2+1,x∈R}、{(x,y)|y=x2+1,x ∈R},这三个集合是不同的.[例2] 已知A={x|x2-3x+2=0},B={x|ax-2=0}且A∪B=A,求实数a组成的集合C.错解:由x2-3x+2=0得x=1或2.当x=1时,a=2,当x=2时,a=1.错因:上述解答只注意了B为非空集合,实际上,B=时,仍满足A∪B=A.当a=0时,B=,符合题设,应补上,故正确答案为C={0,1,2}.正解:∵A∪B=A ∴BA又A={x|x2-3x+2=0}={1,2}∴B=或∴C={0,1,2}[例3]已知mA,nB, 且集合A=,B=,又C=,则有:()A.m+nA B. m+nB C.m+nC D.m+n不属于A,B,C中任意一个错解:∵mA,∴m=2a,a,同理n=2a+1,aZ,∴m+n=4a+1,故选C错因是上述解法缩小了m+n的取值范围.正解:∵mA,∴设m=2a1,a1Z, 又∵n,∴n=2a2+1,a2 Z ,∴m+n=2(a1+a2)+1,而a1+a2 Z , ∴m+nB, 故选B.[例4]已知集合A={x|x2-3x-10≤0},集合B={x|p+1≤x≤2p-1}.若BA,求实数p的取值范围.错解:由x2-3x-10≤0得-2≤x≤5.欲使BA,只须∴p的取值范围是-3≤p≤3.错因:上述解答忽略了"空集是任何集合的子集"这一结论,即B=时,符合题设.正解:①当B≠时,即p+1≤2p-1p≥2.由BA得:-2≤p+1且2p-1≤5.由-3≤p≤3.∴2≤p≤3②当B=时,即p+1>2p-1p<2.由①、②得:p≤3.点评:从以上解答应看到:解决有关A∩B=、A∪B=,AB 等集合问题易忽视空集的情况而出现漏解,这需要在解题过程中要全方位、多角度审视问题.[例5] 已知集合A={a,a+b,a+2b},B={a,ac,ac2}.若A=B,求c的值.分析:要解决c的求值问题,关键是要有方程的数学思想,此题应根据相等的两个集合元素完全相同及集合中元素的确定性、互异性,无序性建立关系式.解:分两种情况进行讨论.(1)若a+b=ac且a+2b=ac2,消去b得:a+ac2-2ac=0,a=0时,集合B中的三元素均为零,和元素的互异性相矛盾,故a≠0.∴c2-2c+1=0,即c=1,但c=1时,B中的三元素又相同,此时无解.(2)若a+b=ac2且a+2b=ac,消去b得:2ac2-ac-a=0,∵a≠0,∴2c2-c-1=0,即(c-1)(2c+1)=0,又c≠1,故c=-.点评:解决集合相等的问题易产生与互异性相矛盾的增解,这需要解题后进行检验.[例6] 设A是实数集,满足若a∈A,则A,且1?A.⑴若2∈A,则A中至少还有几个元素?求出这几个元素.⑵A能否为单元素集合?请说明理由.⑶若a∈A,证明:1-∈A.⑷求证:集合A中至少含有三个不同的元素.解:⑴2∈A ? -1∈A ? ∈A ? 2∈A∴A中至少还有两个元素:-1和⑵如果A为单元素集合,则a=即=0该方程无实数解,故在实数范围内,A不可能是单元素集⑶a∈A ? ∈A ? ∈A?A,即1-∈A⑷由⑶知a∈A时,∈A,1-∈A.现在证明a,1-, 三数互不相等.①若a=,即a2-a+1=0,方程无解,∴a≠②若a=1-,即a2-a+1=0,方程无解∴a≠1-③若1-=,即a2-a+1=0,方程无解∴1-≠.综上所述,集合A中至少有三个不同的元素.点评:⑷的证明中要说明三个数互不相等,否则证明欠严谨. [例7] 设集合A={|=,∈N+},集合B={|=,∈N+},试证:AB.证明:任设∈A,则==(+2)2-4(+2)+5(∈N+),∵n∈N*,∴n+2∈N*∴a∈B故①显然,1,而由B={|=,∈N+}={|=,∈N+}知1∈B,于是A≠B②由①、②得AB.点评:(1)判定集合间的关系,其基本方法是归结为判定元素与集合之间关系.(2)判定两集合相等,主要是根据集合相等的定义.四、典型习题导练1.集合A={x|x2-3x-10≤0,x∈Z},B={x|2x2-x-6>0,x∈Z},则A∩B的非空真子集的个数为()A.16B.14C.15 D.322.数集{1,2,x2-3}中的x不能取的数值的集合是()A.{2,-2 } B.{-2,-}C.{±2,±} D.{,-}3.若P={y|y=x2,x∈R},Q={y|y=x2+1,x∈R},则P∩Q等于()A.P B.QC.D.不知道4. 若P={y|y=x2,x∈R},Q={(x,y)|y=x2,x∈R},则必有()A.P∩Q=B.P Q C.P=QD.P Q5.若集合M={},N={|≤},则MN=()A.B.C.D.6.已知集合A={x|x2+(m+2)x+1=0,x∈R},若A∩R+=,则实数m的取值范围是_________.7.(06高考全国II卷)设,函数若的解集为A,,求实数的取值范围.8.已知集合A=和B=满足A∩B=,A∩B=,I=R,求实数a,b的值.§1.2.常用逻辑用语一、知识导学1.逻辑联结词:“且”、“或”、“非”分别用符号“”“”“”表示.2.命题:能够判断真假的陈述句.3.简单命题:不含逻辑联结词的命题4.复合命题:由简单命题和逻辑联结词构成的命题,复合命题的基本形式:p或q;p且q;非p5.四种命题的构成:原命题:若p则q;逆命题:若q则p;否命题:若p 则q ;逆否命题:若q 则p.6.原命题与逆否命题同真同假,是等价命题,即“若p则q”“若q 则p ”.7.反证法:欲证“若p则q”,从“非q”出发,导出矛盾,从而知“若p则非q”为假,即“若p则q”为真.8.充分条件与必要条件:①pq:p是q的充分条件;q是p的必要条件;②pq:p是q的充要条件.9.常用的全称量词:“对所有的”、“对任意一个”“对一切”“对每一个”“任给”等;并用符号“”表示.含有全称量词的命题叫做全称命题.10.常用的存在量词:“存在一个”、“至少有一个”、“有些”、“有一个”、“有的”、“对某个”;并用符号“”表示.含有存在量词的命题叫做特称命题.二、疑难知识导析1.基本题型及其方法(1)由给定的复合命题指出它的形式及其构成;(2)给定两个简单命题能写出它们构成的复合命题,并能利用真值表判断复合命题的真假;(3)给定命题,能写出它的逆命题、否命题、逆否命题,并能运用四种命题的相互关系,特别是互为逆否命题的等价性判断命题的真假.注意:否命题与命题的否定是不同的. (4)判断两个命题之间的充分、必要、充要关系;方法:利用定义(5)证明的充要条件是;方法:分别证明充分性和必要性(6)反证法证题的方法及步骤:反设、归谬、结论.反证法是通过证明命题的结论的反面不成立而肯定命题的一种数学证明方法,是间接证法之一.注:常见关键词的否定:关键词是都是(全是)()至少有一个至多有一个任意存在否定不是不都是(全是)()一个也没有至少有两个存在任意。
高中数学第一章_集合与常用逻辑用语
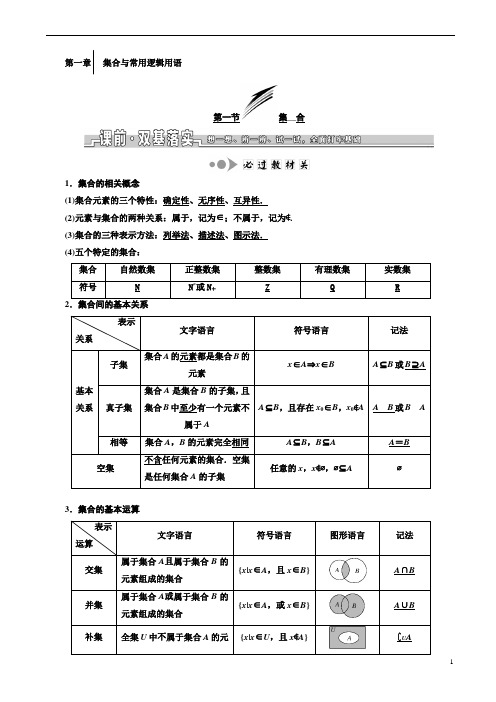
第一章⎪⎪⎪集合与常用逻辑用语第一节集__合1.集合的相关概念(1)集合元素的三个特性:确定性、无序性、互异性. (2)元素与集合的两种关系:属于,记为∈;不属于,记为∉. (3)集合的三种表示方法:列举法、描述法、图示法. (4)五个特定的集合:集合 自然数集正整数集 整数集 有理数集实数集 符号NN *或N +ZQR2.集合间的基本关系表示关系文字语言符号语言 记法基本关系子集集合A 的元素都是集合B 的元素x ∈A ⇒x ∈B A ⊆B 或B ⊇A真子集集合A 是集合B 的子集,且集合B 中至少有一个元素不属于AA ⊆B ,且存在x 0∈B ,x 0∉A A B 或B A相等 集合A ,B 的元素完全相同 A ⊆B ,B ⊆A A =B 空集不含任何元素的集合.空集是任何集合A 的子集任意的x ,x ∉∅,∅⊆A∅3.集合的基本运算表示 运算 文字语言符号语言 图形语言 记法交集属于集合A 且属于集合B 的元素组成的集合{x |x ∈A ,且x ∈B }A ∩B并集属于集合A 或属于集合B 的元素组成的集合{x |x ∈A ,或x ∈B }A ∪B补集全集U 中不属于集合A 的元{x |x ∈U ,且x ∉A }∁U A素组成的集合4.集合问题中的几个基本结论 (1)集合A 是其本身的子集,即A ⊆A ;(2)子集关系的传递性,即A ⊆B ,B ⊆C ⇒A ⊆C ;(3)A ∪A =A ∩A =A ,A ∪∅=A ,A ∩∅=∅,∁U U =∅,∁U ∅=U . (4)A ∩B =A ⇒A ⊆B ,A ∪B =B ⇒A ⊆B . [小题体验]1.已知集合A ={1,2},B ={x |0<x <5,x ∈N },则满足A ⊆C ⊆B 的集合C 的个数为( ) A .1 B .2 C .3 D .4答案:D2.已知集合A ={1,2,3},B ={2,4,5},则集合A ∪B 中元素的个数为________. 答案:53.(2018·江苏高考)已知集合A ={0,1,2,8},B ={-1,1,6,8},那么A ∩B =________. 解析:A ∩B ={0,1,2,8}∩{-1,1,6,8}={1,8}. 答案:{1,8}1.认清集合元素的属性(是点集、数集或其他情形)和化简集合是正确求解集合问题的两个先决条件. 2.解题时注意区分两大关系:一是元素与集合的从属关系;二是集合与集合的包含关系. 3.易忘空集的特殊性,在写集合的子集时不要忘了空集和它本身. 4.运用数轴图示法易忽视端点是实心还是空心.5.在解决含参数的集合问题时,要注意检验集合中元素的互异性,否则很可能会因为不满足“互异性”而导致解题错误.[小题纠偏]1.(2019·浙江名校联考)已知∁R M ={x |ln|x |>1},N =⎩⎨⎧⎭⎬⎫y ⎪⎪y =1x ,x >0,则M ∪N =( ) A .(0,e] B .[-e ,+∞) C .(-∞,-e]∪(0,+∞)D .[-e ,e]解析:选B 由ln|x |>1得|x |>e ,∴M =[-e ,e].N =(0,+∞),∴M ∪N =[-e ,+∞).故选B. 2.若集合A ={x |-2≤x ≤5},B ={x |m +1≤x ≤2m -1},且B ⊆A ,则由m 的可能取值组成的集合为________.解析:当m +1>2m -1,即m <2时,B =∅,满足B ⊆A ;若B ≠∅,且满足B ⊆A ,如图所示,则⎩⎪⎨⎪⎧m +1≤2m -1,m +1≥-2,2m -1≤5,即⎩⎪⎨⎪⎧m ≥2,m ≥-3,m ≤3,所以2≤m ≤3.故m <2或2≤m ≤3,即所求集合为{m |m ≤3}.答案:{m |m ≤3}3.已知集合A ={0, x +1,x 2-5x },若-4∈A ,则实数x 的值为________. 解析:∵-4∈A ,∴x +1=-4或x 2-5x =-4. ∴x =-5或x =1或x =4.若x =1,则A ={0, 2,-4},满足条件; 若x =4,则A ={0, 5,-4},满足条件; 若x =-5,则A ={0,-4,50},满足条件. 所以x =1或x =4或-5. 答案:1或4或-5考点一 集合的基本概念(基础送分型考点——自主练透)[题组练透]1.下列命题正确的有( ) ①很小的实数可以构成集合;②(易错题)集合{}y |y =x 2-1与集合{(x ,y )|y =x 2-1}是同一个集合; ③1,32,64,⎪⎪⎪⎪-12,0.5这些数组成的集合有5个元素; ④集合{(x ,y )|xy ≤0,x ,y ∈R }是指第二和第四象限内的点集. A .0个 B .1个 C .2个D .3个解析:选A 由题意得,①不满足集合的确定性,故错误;②两个集合,一个是数集,一个是点集,故错误;③中⎪⎪⎪⎪-12=0.5,出现了重复,不满足集合的互异性,故错误;④不仅仅表示的是第二、四象限的点,还可表示原点,故错误.综上,没有正确命题,故选A.2.已知a >0,b ∈R ,若⎩⎨⎧⎭⎬⎫a ,4,b a ={a -b,0,a 2},则a 2+b 2的值为( )A .2B .4C .6D .8解析:选B 由已知得a ≠0,则ba =0,所以b =0,于是a 2=4,即a =2或a =-2,因为a >0,所以a =2,故a 2+b 2=22+02=4.3.若集合A ={x ∈R |ax 2-3x +2=0}中只有一个元素,则a 等于( ) A.92 B.98C .0D .0或98解析:选D 若集合A 中只有一个元素,则方程ax 2-3x +2=0只有一个实根或有两个相等实根.当a =0时,x =23,符合题意.当a ≠0时,由Δ=(-3)2-8a =0,得a =98,所以a 的值为0或98.4.(易错题)(2019·江西重点中学协作体联考)设集合A ={1,2,3},B ={2,3,4} ,M ={x |x =ab ,a ∈A ,b ∈B },则M 中的元素个数为________.解析:结合题意列表计算M 中所有可能的值如下:观察可得:M ={2,3,4,6,8,9,12},据此可知M 中的元素个数为7. 答案:7[谨记通法]与集合中的元素有关问题的求解策略(1)确定集合的元素是什么,即集合是数集还是点集. (2)看这些元素满足什么限制条件.(3)根据限制条件列式求参数的值或确定集合中元素的个数,但要注意检验集合是否满足元素的互异性. 考点二 集合间的基本关系(重点保分型考点——师生共研)[典例引领]1.已知集合M ={1,2,3,4},则集合P ={x |x ∈M 且2x ∉M }的子集有( ) A .8个 B .4个 C .3个D .2个解析:选B 由题意,得P ={3,4},所以集合P 的子集有22=4个. 2.已知集合A ={x |x 2+x -2=0},B ={x |ax =1},若B ⊆A ,则a =( ) A .-12或1B .2或-1C .-2或1或0D .-12或1或0解析:选D 集合A ={x |x 2+x -2=0}={-2,1}.当x =-2时,-2a =1,解得a =-12;当x =1时,a =1;又因为B 是空集时也符合题意,这时a =0,故选D.[由题悟法]集合间基本关系的两种判定方法和一个关键[即时应用]1.集合{a ,b ,c ,d ,e }的真子集的个数为( ) A .32 B .31 C .30D .29解析:选B 因为集合有5个元素,所以其子集的个数为25=32个,其真子集的个数为25-1=31个. 2.已知集合A ={x |-1<x <3},B ={x |-m <x <m },若B ⊆A ,则m 的取值范围为________. 解析:当m ≤0时,B =∅,显然B ⊆A . 当m >0时, ∵A ={x |-1<x <3}.当B ⊆A 时,在数轴上标出两集合,如图,∴⎩⎪⎨⎪⎧-m ≥-1,m ≤3,-m <m .∴0<m ≤1.综上所述m 的取值范围为(-∞,1]. 答案:(-∞,1]考点三 集合的基本运算(题点多变型考点——多角探明) [锁定考向]集合运算多与解简单的不等式、函数的定义域、值域相联系,考查对集合的理解及不等式的有关知识;有些集合题为抽象集合题或新定义型集合题,考查学生的灵活处理问题的能力.常见的命题角度有: (1)集合的运算;(2)利用集合运算求参数; (3)新定义集合问题.[题点全练]角度一:集合的运算1.(2018·北京高考)已知集合A ={x ||x |<2},B ={-2,0,1,2},则A ∩B =( ) A .{0,1} B .{-1,0,1} C .{-2,0,1,2}D .{-1,0,1,2}解析:选A ∵A ={x ||x |<2}={x |-2<x <2},B={-2,0,1,2},∴A∩B={0,1}.故选A.2.(2018·全国卷Ⅰ)已知集合A={x|x2-x-2>0},则∁R A=()A.{x|-1<x<2} B.{x|-1≤x≤2}C.{x|x<-1}∪{x|x>2} D.{x|x≤-1}∪{x|x≥2}解析:选B∵x2-x-2>0,∴(x-2)(x+1)>0,∴x>2或x<-1,即A={x|x>2或x<-1}.则∁R A={x|-1≤x≤2}.故选B.角度二:利用集合运算求参数3.(2019·浙江联盟校联考)已知集合P={x|-1<x<1},Q={x|0<x<a},若P∪Q={x|-1<x<2},则实数a的值为()A.1 B.2C.12D.32解析:选B因为P={x|-1<x<1},Q={x|0<x<a},所以当a≤1时,P∪Q={x|-1<x<1},不符合题意;当a>1时,P∪Q={x|-1<x<a},结合P∪Q={x|-1<x<2},可得a=2.角度三:新定义集合问题4.如果集合A,B,同时满足A∪B={1,2,3,4},A∩B={1},A≠{1},B≠{1},就称有序集对(A,B)为“好集对”.这里有序集对(A,B)是指当A≠B时,(A,B)和(B,A)是不同的集对,那么“好集对”一共有()个()A.5个B.6个C.7个D.8个解析:选B因为A∪B={1,2,3,4},A∩B={1},A≠{1},B≠{1},所以当A={1,2}时,B={1,3,4};当A={1,3}时,B={1,2,4};当A={1,4}时,B={1,2,3};当A={1,2,3}时,B={1,4};当A={1,2,4}时,B={1,3};当A={1,3,4}时,B={1,2}.所以满足条件的“好集对”一共有6个,故选B.[通法在握]解集合运算问题4个技巧[演练冲关]1.(2019·浙江十校联盟适考)已知集合A={x|1<x<4},B={x∈Z|x2-6x<0},则(∁R A)∩B=() A.{1,4} B.{4,5}C.{1,4,5} D.{2,3}解析:选C法一:由x2-6x<0可得0<x<6,所以B={1,2,3,4,5},又∁R A={x|x≤1或x≥4},所以(∁R A)∩B={1,4,5}.法二:因为求的是(∁R A)∩B,故排除D,又1,5∈∁R A,1,5∈B,故选C.2.(2019·长沙模拟)已知集合A={1,2,3},B={x|x2-3x+a=0,a∈A},若A∩B≠∅,则a的值为() A.1 B.2C.3 D.1或2解析:选B当a=1时,x2-3x+1=0,无整数解,则A∩B=∅;当a=2时,B={1,2},A∩B={1,2}≠∅;当a=3时,B=∅,A∩B=∅.因此实数a=2.3.(2019·杭州高三四校联考)设集合A={x|(x-3)(x-a)=0,a∈R},B={x|(x-1)(x-4)=0},则A∪B 的子集个数最多为()A.2 B.4C.8 D.16解析:选D由题意可知,要使A∪B的子集个数最多,则需A∪B中的元素个数最多,此时a≠1,a≠3,且a≠4,即集合A={3,a},B={1,4},A∪B={1,3,4,a},故A∪B的子集最多有24=16个.4.如图所示的Venn图中,A,B是非空集合,定义集合A B为阴影部分表示的集合.若x,y∈R,A={x|y=2x-x2},B={y|y=3x,x>0},则A B为()A.{x|0<x<2} B.{x|1<x≤2}C.{x|0≤x≤1或x≥2} D.{x|0≤x≤1或x>2}解析:选D因为A={x|0≤x≤2},B={y|y>1},A∪B={x|x≥0},A∩B={x|1<x≤2},所以A B =∁A∪B(A∩B)={x|0≤x≤1或x>2},故选D.一抓基础,多练小题做到眼疾手快1.(2019·浙江考前热身联考)已知集合M={x|y=2x-x2},N={x|-1<x<1},则M∪N=() A.[0,1)B.(-1,2)C.(-1,2] D.(-∞,0]∪(1,+∞)解析:选C法一:易知M={x|0≤x≤2},又N={x|-1<x<1},所以M∪N=(-1,2].故选C.法二:取x=2,则2∈M,所以2∈M∪N,排除A、B;取x=3,则3∉M,3∉N,所以3∉M∪N,排除D,故选C.2.(2019·浙江三地联考)已知集合P={x|||x<2},Q={x|-1≤x≤3},则P∩Q=()A.[-1,2) B.(-2,2)C.(-2,3] D.[-1,3]解析:选A由|x|<2,可得-2<x<2,所以P={x|-2<x<2},所以P∩Q=[-1,2).3.(2018·嘉兴期末测试)已知集合P={x|x<1},Q={x|x>0},则()A.P⊆Q B.Q⊆PC.P⊆∁R Q D.∁R P⊆Q解析:选D由已知可得∁R P=[1,+∞),所以∁R P⊆Q.故选D.4.(2018·浙江吴越联盟第二次联考)已知集合M={0,1,2,3,4},N={2,4,6},P=M∩N,则P的子集有________个.解析:集合M={0,1,2,3,4},N={2,4,6},P=M∩N={2,4},则P的子集有∅,{2},{4},{2,4},共4个.答案:45.已知集合A={x|x≥3},B={x|x≥m},且A∪B=A,则实数m的取值范围是________.解析:因为集合A={x|x≥3},B={x|x≥m},且A∪B=A,所以B⊆A,如图所示,所以m≥3.答案:[3,+∞)二保高考,全练题型做到高考达标1.(2019·杭州七校联考)已知集合A={x|x2>1},B={x|(x2-1)(x2-4)=0},则集合A∩B中的元素个数为()A.1 B.2C.3 D.4解析:选B A={x|x<-1或x>1},B={-2,-1,1,2},A∩B={-2,2},故选B.2.(2019·浙江六校联考)已知集合U={x|y=3x},A={x|y=log9x},B={y|y=-2x}则A∩(∁U B)=()A.∅B.RC.{x|x>0} D.{0}解析:选C由题意得,U=R,A={x|x>0},因为y=-2x<0,所以B={y|y<0},所以∁U B={x|x≥0},故A∩(∁U B)={x|x>0}.故选C.3.(2019·永康模拟)设集合M={x|x2-2x-3≥0},N={x|-3<x<3},则()A.M⊆N B.N⊆MC.M∪N=R D.M∩N=∅解析:选C由x2-2x-3≥0,解得x≥3或x≤-1,所以M={x|x≤-1或x≥3},所以M∪N=R.4.(2019·宁波六校联考)已知集合A={x|x2-3x<0},B={1,a},且A∩B有4个子集,则实数a的取值范围是()A.(0,3) B.(0,1)∪(1,3)C.(0,1) D.(-∞,1)∪(3,+∞)解析:选B∵A∩B有4个子集,∴A∩B中有2个不同的元素,∴a∈A,∴a2-3a<0,解得0<a <3且a≠1,即实数a的取值范围是(0,1)∪(1,3),故选B.5.(2018·镇海中学期中)若集合M =⎩⎪⎨⎪⎧⎭⎪⎬⎪⎫x ⎪⎪y =lg2-xx ,N ={x |x <1},则M ∪N =( ) A .(0,1) B .(0,2) C .(-∞,2)D .(0,+∞)解析:选C 集合M =⎩⎪⎨⎪⎧⎭⎪⎬⎪⎫x ⎪⎪y =lg2-xx ={x |0<x <2},N ={x |x <1}.M ∪N ={x |x <2}=(-∞,2).故选C.6.设集合A ={x |x 2-x -2≤0},B ={x |x <1,且x ∈Z },则A ∩B =________.解析:依题意得A ={x |(x +1)(x -2)≤0}={x |-1≤x ≤2},因此A ∩B ={x |-1≤x <1,x ∈Z }={-1,0}. 答案:{-1,0}7.(2018·嘉兴二模)已知集合A ={x |-1≤x ≤2},B ={x |x 2-4x ≤0},则A ∪B =________,A ∩(∁R B )=________.解析:因为B ={x |x 2-4x ≤0}={x |0≤x ≤4},所以A ∪B ={x |-1≤x ≤4};因为∁R B ={x |x <0或x >4},所以A ∩(∁R B )={x |-1≤x <0}.答案:{x |-1≤x ≤4} {x |-1≤x <0}8.设集合A ={(x ,y )|y ≥|x -2|,x ≥0},B ={(x ,y )|y ≤-x +b },A ∩B ≠∅. (1)b 的取值范围是________;(2)若(x ,y )∈A ∩B ,且x +2y 的最大值为9,则b 的值是________. 解析:由图可知,当y =-x 往右移动到阴影区域时,才满足条件,所以b ≥2;要使z =x +2y 取得最大值,则过点(0,b ),有0+2b =9⇒b =92.答案:(1)[2,+∞) (2)929.已知集合A ={x |4≤2x ≤16},B =[a ,b ],若A ⊆B ,则实数a -b 的取值范围是________. 解析:集合A ={x |4≤2x ≤16}={x |22≤2x ≤24}={x |2≤x ≤4}=[2,4],因为A ⊆B ,所以a ≤2,b ≥4,所以a -b ≤2-4=-2,即实数a -b 的取值范围是(-∞,-2].答案:(-∞,-2]10.已知集合A ={x |(x +2m )(x -m +4)<0},其中m ∈R ,集合B =⎩⎪⎨⎪⎧⎭⎪⎬⎪⎫x ⎪⎪⎪1-x x +2>0. (1)若B ⊆A ,求实数m 的取值范围; (2)若A ∩B =∅,求实数m 的取值范围. 解:(1)集合B =⎩⎪⎨⎪⎧⎭⎪⎬⎪⎫x ⎪⎪⎪1-x x +2>0={x |-2<x <1}.当A =∅时,m =43,不符合题意.当A ≠∅时,m ≠43.①当-2m <m -4,即m >43时,A ={x |-2m <x <m -4},又因为B ⊆A ,所以⎩⎪⎨⎪⎧ m >43,-2m ≤-2,m -4≥1,即⎩⎪⎨⎪⎧m >43,m ≥1,m ≥5,所以m ≥5.②当-2m >m -4,即m <43时,A ={x |m -4<x <-2m },又因为B ⊆A ,所以⎩⎪⎨⎪⎧m <43,-2m ≥1,m -4≤-2,即⎩⎪⎨⎪⎧m <43,m ≤-12,m ≤2,所以m ≤-12.综上所述,实数m 的取值范围为⎝⎛⎦⎤-∞,-12∪[5,+∞). (2)由(1)知,B ={x |-2<x <1}. 当A =∅时,m =43,符合题意.当A ≠∅时,m ≠43.①当-2m <m -4,即m >43时,A ={x |-2m <x <m -4},又因为A ∩B =∅,所以-2m ≥1或者m -4≤-2, 即m ≤-12或者m ≤2,所以43<m ≤2.②当-2m >m -4,即m <43时,A ={x |m -4<x <-2m },又因为A ∩B =∅,所以m -4≥1或者-2m ≤-2, 即m ≥5或者m ≥1,所以1≤m <43.综上所述,实数m 的取值范围为[1,2]. 三上台阶,自主选做志在冲刺名校1.对于复数a ,b ,c ,d ,若集合S ={a ,b ,c ,d }具有性质“对任意x ,y ∈S ,必有xy ∈S ”,则当⎩⎪⎨⎪⎧a =1,b 2=1,c 2=b 时,b +c +d 等于( )A .1B .-1C .0D .i解析:选B ∵S ={a ,b ,c ,d },由集合中元素的互异性可知当a =1时,b =-1,c 2=-1,∴c =±i ,由“对任意x ,y ∈S ,必有xy ∈S ”知±i ∈S ,∴c =i ,d =-i 或c =-i ,d =i ,∴b +c +d =(-1)+0=-1.2.对于集合M ,N ,定义M -N ={x |x ∈M ,且x ∉N },M ⊕N =(M -N )∪(N -M ),设A =⎩⎨⎧⎭⎬⎫x ⎪⎪x ≥-94,x ∈R ,B ={x |x <0,x ∈R },则A ⊕B =( )A.⎝⎛⎭⎫-94,0B.⎣⎡⎭⎫-94,0 C.⎝⎛⎭⎫-∞,-94∪[0,+∞) D.⎝⎛⎦⎤-∞,-94∪(0,+∞) 解析:选C 依题意得A -B ={x |x ≥0,x ∈R },B -A =⎩⎨⎧x ⎪⎪⎭⎬⎫x <-94,x ∈R ,故A ⊕B =⎝⎛⎭⎫-∞,-94∪[0,+∞).故选C.3.已知函数f (x )=x -3-17-x的定义域为集合A ,且B ={x ∈Z |2<x <10},C ={x ∈R |x <a 或x >a +1}.(1)求:A 和(∁R A )∩B ;(2)若A ∪C =R ,求实数a 的取值范围. 解:(1)要使函数f (x )=x -3-17-x, 应满足x -3≥0,且7-x >0,解得3≤x <7, 则A ={x |3≤x <7}, 得到∁R A ={x |x <3或x ≥7},而B ={x ∈Z |2<x <10}={3,4,5,6,7,8,9}, 所以(∁R A )∩B ={7,8,9}.(2)C ={x ∈R |x <a 或x >a +1},要使A ∪C =R , 则有a ≥3,且a +1<7,解得3≤a <6. 故实数a 的取值范围为[3,6).第二节命题及其关系、充分条件与必要条件1.命题概念 使用语言、符号或者式子表达的,可以判断真假的陈述句特点 (1)能判断真假;(2)陈述句分类真命题、假命题2.四种命题及其相互关系 (1)四种命题间的相互关系:(2)四种命题中真假性的等价关系:原命题等价于逆否命题,原命题的否命题等价于逆命题.在四种形式的命题中真命题的个数只能是0,2,4.3.充要条件若p ⇒q ,则p 是q 的充分条件,q 是p 的必要条件p 成立的对象的集合为A ,q 成立的对象的集合为B p 是q 的充分不必要条件 p ⇒q 且q ⇒/p A 是B 的真子集 集合与充要条件p 是q 的必要不充分条件p ⇒/ q 且q ⇒pB 是A 的真子集p 是q 的充要条件 p ⇔q A =B p 是q 的既不充分也不必要条件 p ⇒/ q 且q ⇒/pA ,B 互不包含[小题体验]1.下列命题是真命题的是( )A .若log 2a >0,则函数f (x )=log a x (a >0,a ≠1)在其定义域上是减函数B .命题“若xy =0,则x =0”的否命题C .“m =3”是“直线(m +3)x +my -2=0与mx -6y +5=0垂直”的充要条件D .命题“若cos x =cos y ,则x =y ”的逆否命题 答案:B2.(2019·温州高考适应性测试)已知α,β∈R ,则“α>β”是“cos α>cos β ”的( ) A .充要条件 B .充分不必要条件 C .必要不充分条件D .既不充分也不必要条件解析:选D α>β ⇒/ cos α>cos β,如α=π3,β=π6,π3>π6,而cos π3<cos π6;cos α>cos β ⇒/ α>β,如α=π6,β=π3,cos π6>cos π3,而π6<π3.故选D.3.设a ,b 是向量,则命题“若a =-b ,则|a |=| b |”的逆否命题为:________. 答案:若|a |≠|b |,则a ≠-b1.易混淆否命题与命题的否定:否命题是既否定条件,又否定结论,而命题的否定是只否定命题的结论.2.易忽视A 是B 的充分不必要条件(A ⇒B 且B ⇒/A )与A 的充分不必要条件是B (B ⇒A 且A ⇒/B )两者的不同.[小题纠偏]1.(2019·杭州模拟)“x<0”是“ln(x+1)<0”的()A.充分不必要条件B.必要不充分条件C.充要条件D.既不充分也不必要条件答案:B2.“在△ABC中,若∠C=90°,则∠A,∠B都是锐角”的否命题为:________________.解析:原命题的条件:在△ABC中,∠C=90°,结论:∠A,∠B都是锐角.否命题是否定条件和结论.即“在△ABC中,若∠C≠90°,则∠A,∠B不都是锐角”.答案:在△ABC中,若∠C≠90°,则∠A,∠B不都是锐角考点一四种命题及其相互关系(基础送分型考点——自主练透)[题组练透]1.命题“若a2>b2,则a>b”的否命题是()A.若a2>b2,则a≤b B.若a2≤b2,则a≤bC.若a≤b,则a2>b2D.若a≤b,则a2≤b2解析:选B根据命题的四种形式可知,命题“若p,则q”的否命题是“若綈p,则綈q”.该题中,p为a2>b2,q为a>b,故綈p为a2≤b2,綈q为a≤b.所以原命题的否命题为:若a2≤b2,则a≤b.2.命题“若x2-3x-4=0,则x=4”的逆否命题及其真假性为()A.“若x=4,则x2-3x-4=0”为真命题B.“若x≠4,则x2-3x-4≠0”为真命题C.“若x≠4,则x2-3x-4≠0”为假命题D.“若x=4,则x2-3x-4=0”为假命题解析:选C根据逆否命题的定义可以排除A,D,因为x2-3x-4=0,所以x=4或-1,故原命题为假命题,即逆否命题为假命题.3.给出以下四个命题:①“若x+y=0,则x,y互为相反数”的逆命题;②(易错题)“全等三角形的面积相等”的否命题;③“若q≤-1,则x2+x+q=0有实根”的逆否命题;④若ab是正整数,则a,b都是正整数.其中真命题是________.(写出所有真命题的序号)解析:①命题“若x+y=0,则x,y互为相反数”的逆命题为“若x,y互为相反数,则x+y=0”,显然①为真命题;②不全等的三角形的面积也可能相等,故②为假命题;③原命题正确,所以它的逆否命题也正确,故③为真命题;④若ab是正整数,但a,b不一定都是正整数,例如a=-1,b=-3,故④为假命题.答案:①③[谨记通法]1.写一个命题的其他三种命题时的2个注意点(1)对于不是“若p,则q”形式的命题,需先改写;(2)若命题有大前提,写其他三种命题时需保留大前提.2.命题真假的2种判断方法(1)联系已有的数学公式、定理、结论进行正面直接判断.(2)利用原命题与逆否命题,逆命题与否命题的等价关系进行判断.考点二充分必要条件的判定(重点保分型考点——师生共研)[典例引领]1.(2019·杭州高三四校联考)“a>-1”是“x2+ax+14>0(x∈R)”的()A.必要不充分条件B.充分不必要条件C.充要条件D.既不充分也不必要条件解析:选A若x2+ax+14>0(x∈R),则a2-1<0,即-1<a<1,所以“a>-1”是“x2+ax+14>0(x∈R)”的必要不充分条件.故选A.2.(2019·杭州高三质检)设数列{a n}的通项公式为a n=kn+2(n∈N*),则“k>2”是“数列{a n}为单调递增数列”的()A.充分不必要条件B.必要不充分条件C.充要条件D.既不充分也不必要条件解析:选A法一:因为a n=kn+2(n∈N*),所以当k>2时,a n+1-a n=k>2,则数列{a n}为单调递增数列.若数列{a n}为单调递增数列,则a n+1-a n=k>0即可,所以“k>2”是“数列{a n}为单调递增数列”的充分不必要条件,故选A.法二:根据一次函数y=kx+b的单调性知,“数列{a n}为单调递增数列”的充要条件是“k>0”,所以“k>2”是“数列{a n}为单调递增数列”的充分不必要条件,故选A.[由题悟法]充要条件的3种判断方法(1)定义法:根据p⇒q,q⇒p进行判断;(2)集合法:根据p,q成立的对象的集合之间的包含关系进行判断;(3)等价转化法:根据一个命题与其逆否命题的等价性,把判断的命题转化为其逆否命题进行判断.这个方法特别适合以否定形式给出的问题,如“xy ≠1”是“x ≠1或y ≠1”的某种条件,即可转化为判断“x =1且y =1”是“xy =1”的某种条件.[即时应用]1.设a >0,b >0,则“a 2+b 2≥1”是“a +b ≥ab +1”成立的( ) A .充分不必要条件 B .必要不充分条件 C .充要条件D .既不充分也不必要条件解析:选B 因为a >0,b >0,所以a +b >0,ab +1>0,故不等式a +b ≥ab +1成立的充要条件是(ab +1)2≤(a +b )2,即a 2+b 2≥a 2b 2+1.显然,若a 2+b 2≥a 2b 2+1,则必有a 2+b 2≥1,反之则不成立,所以a 2+b 2≥1是a 2+b 2≥a 2b 2+1成立的必要不充分条件,即a 2+b 2≥1是a +b ≥ab +1成立的必要不充分条件.2.(2019·浙江期初联考)若a ,b ∈R ,使|a |+|b |>4成立的一个充分不必要条件是( ) A .|a +b |≥4 B .|a |≥4 C .|a |≥2且|b |≥2D .b <-4解析:选D 对选项A ,若a =b =2,则|a |+|b |=2+2≥4,不能推出|a |+|b |>4;对选项B ,若a =4≥4,b =0,此时不能推出|a |+|b |>4;对选项C ,若a =2≥2,b =2≥2,此时不能推出|a |+|b |>4;对选项D ,由b <-4可得|a |+|b |>4,但由|a |+|b |>4得不到b <-4.故选D.3.(2019·宁波模拟)已知四边形ABCD 为梯形,AB ∥CD ,l 为空间一直线,则“l 垂直于两腰AD ,BC ”是“l 垂直于两底AB ,DC ”的( )A .充分不必要条件B .必要不充分条件C .充要条件D .既不充分也不必要条件解析:选A 因为四边形ABCD 是梯形,且AB ∥CD ,所以腰AD ,BC 是交线,由直线与平面垂直的判定定理可知,当l 垂直于两腰AD ,BC 时,l 垂直于ABCD 所在平面,所以l 垂直于两底AB ,CD ,所以是充分条件;当l 垂直于两底AB ,CD ,由于AB ∥CD ,所以l 不一定垂直于ABCD 所在平面,所以l 不一定垂直于两腰AD ,BC ,所以不是必要条件.所以是充分不必要条件.考点三 充分必要条件的应用(重点保分型考点——师生共研)[典例引领]若不等式x -m +1x -2m<0成立的一个充分不必要条件是13<x <12,则实数m 的取值范围是______________.解析:令A =⎩⎪⎨⎪⎧⎭⎪⎬⎪⎫x ⎪⎪⎪x -m +1x -2m <0,B =⎩⎨⎧⎭⎬⎫x ⎪⎪13<x <12. 因为不等式x -m +1x -2m <0成立的充分不必要条件是13<x <12,所以B ⊆A .①当m -1<2m ,即m >-1时,A ={x |m -1<x <2m }.由B ⊆A 得⎩⎪⎨⎪⎧ m -1≤13,2m ≥12,m >-1,解得14≤m ≤43;②当m -1=2m ,即m =-1时,A =∅,不满足B ⊆A ; ③当m -1>2m ,即m <-1时,A ={x |2m <x <m -1}. 由B ⊆A 得⎩⎪⎨⎪⎧2m ≤13,m -1≥12,m <-1,此时m 无解.综上,m 的取值范围为⎣⎡⎦⎤14,43. 答案:⎣⎡⎦⎤14,43[由题悟法]根据充要条件求参数的值或取值范围的关键点(1)先合理转化条件,常通过有关性质、定理、图象将恒成立问题和有解问题转化为最值问题等,得到关于参数的方程或不等式(组),再通过解方程或不等式(组)求出参数的值或取值范围.(2)求解参数的取值范围时,一定要注意区间端点值的检验,尤其是利用两个集合之间的关系求解参数的取值范围时,不等式是否能够取等号决定端点值的取舍,处理不当容易出现漏解或增解的现象.[即时应用]1.(2019·杭州名校大联考)已知条件p :|x +1|>2,条件q :x >a ,且綈p 是綈q 的充分不必要条件,则实数a 的取值范围是( )A .[1,+∞)B .(-∞,1]C .[-3,+∞)D .(-∞,-3]解析:选A 由|x +1|>2,可得x >1或x <-3,所以綈p :-3≤x ≤1;又綈q :x ≤a .因为綈p 是綈q 的充分不必要条件,所以a ≥1.2.已知“命题p :(x -m )2>3(x -m )”是“命题q :x 2+3x -4<0”成立的必要不充分条件,则实数m 的取值范围为________________.解析:命题p :x >m +3或x <m , 命题q :-4<x <1.因为p 是q 成立的必要不充分条件, 所以m +3≤-4或m ≥1, 故m ≤-7或m ≥1.答案:(-∞,-7]∪[1,+∞)一抓基础,多练小题做到眼疾手快 1.“(2x -1)x =0”是“x =0”的( ) A .充分不必要条件 B .必要不充分条件 C .充要条件D .既不充分也不必要条件解析:选B 若(2x -1)x =0,则x =12或x =0,即不一定是x =0;若x =0,则一定能推出(2x -1)x =0.故“(2x -1)x =0”是“x =0”的必要不充分条件.2.设a ,b ∈R ,则“a 3>b 3且ab <0”是“1a >1b ”的( ) A .充分不必要条件 B .必要不充分条件 C .充要条件D .既不充分也不必要条件解析:选A 由a 3>b 3,知a >b ,由ab <0,知a >0>b ,所以此时有1a >1b ,故充分性成立;当1a >1b 时,若a ,b 同号,则a <b ,若a ,b 异号,则a >b ,所以必要性不成立.故选A. 3.设φ∈R ,则“φ=0”是“f (x )=cos(x +φ)(x ∈R )为偶函数”的( ) A .充分不必要条件 B .必要不充分条件 C .充要条件D .既不充分也不必要条件解析:选A 若φ=0,则f (x )=cos x 为偶函数;若f (x )=cos(x +φ)(x ∈R )为偶函数,则φ=k π(k ∈Z ).故“φ=0”是“f (x )=cos(x +φ)(x ∈R )为偶函数”的充分不必要条件.4.命题p :“若x 2<1,则x <1”的逆命题为q ,则p 与q 的真假性为( ) A .p 真q 真 B .p 真q 假 C .p 假q 真D .p 假q 假解析:选B q :若x <1,则x 2<1. ∵p :x 2<1,则-1<x <1.∴p 真,当x <1时,x 2<1不一定成立,∴q 假,故选B.5.若x >5是x >a 的充分条件,则实数a 的取值范围为( ) A .(5,+∞) B .[5,+∞) C .(-∞,5)D .(-∞,5] 解析:选D 由x >5是x >a 的充分条件知,{x |x >5}⊆{x |x >a },∴a ≤5,故选D. 二保高考,全练题型做到高考达标1.命题“若一个数是负数,则它的平方是正数”的逆命题是( ) A .“若一个数是负数,则它的平方不是正数” B .“若一个数的平方是正数,则它是负数” C .“若一个数不是负数,则它的平方不是正数” D .“若一个数的平方不是正数,则它不是负数”解析:选B 依题意得,原命题的逆命题是“若一个数的平方是正数,则它是负数”.2.命题“对任意实数x ∈[1,2],关于x 的不等式x 2-a ≤0恒成立”为真命题的一个必要不充分条件是( )A .a ≥4B .a ≤4C .a ≥3D .a ≤3解析:选C 即由“对任意实数x ∈[1,2],关于x 的不等式x 2-a ≤0恒成立”可推出选项,但由选项推不出“对任意实数x ∈[1,2],关于x 的不等式x 2-a ≤0恒成立”.因为x ∈[1,2],所以x 2∈[1,4],x 2-a ≤0恒成立,即x 2≤a ,因此a ≥4;反之亦然.故选C.3.有下列命题:①“若x +y >0,则x >0且y >0”的否命题; ②“矩形的对角线相等”的否命题;③“若m ≥1,则mx 2-2(m +1)x +m +3>0的解集是R ”的逆命题; ④“若a +7是无理数,则a 是无理数”的逆否命题. 其中正确的是( ) A .①②③ B .②③④ C .①③④D .①④解析:选C ①的逆命题为“若x >0且y >0,则x +y >0”为真,故否命题为真; ②的否命题为“不是矩形的图形对角线不相等”,为假命题; ③的逆命题为,若mx 2-2(m +1)x +m +3>0的解集为R ,则m ≥1. ∵当m =0时,解集不是R ,∴应有⎩⎪⎨⎪⎧m >0,Δ<0, 即m >1.∴③是真命题;④原命题为真,逆否命题也为真.4.(2019·浙江名校联考信息卷)已知直线l 的斜率为k ,倾斜角为θ,则“0<θ≤π4”是“k ≤1”的( )A .充分不必要条件B .必要不充分条件C .充要条件D .既不充分也不必要条件解析:选A 当0<θ≤π4时,0<k ≤1;反之,当k ≤1时,0≤θ≤π4或π2<θ<π.故“0<θ≤π4”是“k ≤1”的充分不必要条件,故选A.5.命题“对任意x ∈[1,2),x 2-a ≤0”为真命题的一个充分不必要条件可以是( ) A .a ≥4 B .a >4 C .a ≥1D .a >1解析:选B 要使“对任意x ∈[1,2),x 2-a ≤0”为真命题,只需要a ≥4,∴a >4是命题为真的充分不必要条件.6.命题“若a >b ,则ac 2>bc 2(a ,b ∈R )”,否命题的真假性为________.解析:命题的否命题为“若a ≤b ,则ac 2≤bc 2”. 若c =0,结论成立.若c ≠0,不等式ac 2≤bc 2也成立. 故否命题为真命题. 答案:真 7.下列命题:①“a >b ”是“a 2>b 2”的必要条件;②“|a |>|b |”是“a 2>b 2”的充要条件;③“a >b ”是“a +c >b +c ”的充要条件.其中是真命题的是________(填序号).解析:①a >b ⇒/ a 2>b 2,且a 2>b 2⇒/ a >b ,故①不正确; ②a 2>b 2⇔|a |>|b |,故②正确;③a >b ⇒a +c >b +c ,且a +c >b +c ⇒a >b ,故③正确. 答案:②③8.已知α,β∈(0,π),则“sin α+sin β<13”是“sin(α+β)<13”的________条件.解析:因为sin(α+β)=sin αcos β+cos αsin β<sin α+sin β,所以若sin α+sin β<13,则有sin(α+β)<13,故充分性成立;当α=β=π2时,有sin(α+β)=sin π=0<13,而sin α+sin β=1+1=2,不满足sin α+sin β<13,故必要性不成立.所以“sin α+sin β<13”是“sin(α+β)<13”的充分不必要条件.答案:充分不必要 9.已知p :实数m 满足m 2+12a 2<7am (a >0),q :方程x 2m -1+y 22-m=1表示焦点在y 轴上的椭圆.若p 是q 的充分不必要条件,则a 的取值范围是________.解析:由a >0,m 2-7am +12a 2<0,得3a <m <4a ,即p :3a <m <4a ,a >0.由方程x 2m -1+y 22-m=1表示焦点在y 轴上的椭圆,可得2-m >m -1>0,解得1<m <32,即q :1<m <32.因为p 是q 的充分不必要条件,所以⎩⎪⎨⎪⎧ 3a >1,4a ≤32或⎩⎪⎨⎪⎧3a ≥1,4a <32,解得13≤a ≤38,所以实数a 的取值范围是⎣⎡⎦⎤13,38. 答案:⎣⎡⎦⎤13,3810.已知集合A =⎩⎨⎧⎭⎬⎫y ⎪⎪y =x 2-32x +1,x ∈⎣⎡⎦⎤34,2,B ={x |x +m 2≥1}.若“x ∈A ”是“x ∈B ”的充分条件,求实数m 的取值范围.解:y =x 2-32x +1=⎝⎛⎭⎫x -342+716,∵x ∈⎣⎡⎦⎤34,2, ∴716≤y ≤2, ∴A =⎩⎨⎧⎭⎬⎫y ⎪⎪716≤y ≤2. 由x +m 2≥1,得x ≥1-m 2, ∴B ={x |x ≥1-m 2}.∵“x ∈A ”是“x ∈B ”的充分条件, ∴A ⊆B ,∴1-m 2≤716, 解得m ≥34或m ≤-34,故实数m 的取值范围是⎝⎛⎦⎤-∞,-34∪⎣⎡⎭⎫34,+∞. 三上台阶,自主选做志在冲刺名校 1.已知p :x ≥k ,q :3x +1<1,如果p 是q 的充分不必要条件,则实数k 的取值范围是( ) A .[2,+∞) B .(2,+∞) C .[1,+∞)D .(-∞,-1]解析:选B 由3x +1<1得,3x +1-1=2-x x +1<0,即(x -2)(x +1)>0,解得x <-1或x >2,由p 是q的充分不必要条件知,k >2,故选B.2.在整数集Z 中,被4除所得余数为k 的所有整数组成一个“类”,记为[k ]={4n +k |n ∈Z },k =0,1,2,3,则下列结论正确的为________(填序号).①2 018∈[2];②-1∈[3];③Z =[0]∪[1]∪[2]∪[3];④命题“整数a ,b 满足a ∈[1],b ∈[2],则a +b ∈[3]”的原命题与逆命题都正确;⑤“整数a ,b 属于同一类”的充要条件是“a -b ∈[0]”.解析:由“类”的定义[k ]={4n +k |n ∈Z },k =0,1,2,3,可知,只要整数m =4n +k ,n ∈Z ,k =0,1,2,3,则m ∈[k ],对于①中,2 018=4×504+2,所以2 018∈[2],所以符合题意;对于②中,-1=4×(-1)+3,所以符合题意;对于③中,所有的整数按被4除所得的余数分为四类,即余数分别为0,1,2,3的整数,即四“类”[0],[1],[2],[3],所以Z =[0]∪[1]∪[2]∪[3],所以符合题意;对于④中,原命题成立,但逆命题不成立,因为若a +b ∈[3],不妨设a =0,b =3,则此时a ∉[1]且b ∉[2],所以逆命题不成立,所以不符合题意;对于⑤中,因为“整数a ,b 属于同一类”,不妨设a =4m +k ,b =4n +k ,m ,n ∈Z ,且k =0,1,2,3,则a -b =4(m -n )+0,所以a -b ∈[0];反之,不妨设a =4m +k 1,b =4n +k 2,m ,n ∈Z ,k 1=0,1,2,3,k 2=0,1,2,3,则a -b =4(m -n )+(k 1-k 2),若a -b ∈[0],则k 1-k 2=0,即k 1=k 2,所以整数a ,b 属于同一类,故“整数a ,b 属于同一类”的充要条件是“a -b ∈[0]”,所以符合题意.答案:①②③⑤3.已知全集U =R ,非空集合A =⎩⎨⎧x ⎪⎪⎪⎭⎬⎫x -2x -(3a +1)<0,B ={x |(x -a )(x -a 2-2)<0,命题p :x ∈A ,命题q :x ∈B .(1)当a =12时,若p 真q 假,求x 的取值范围; (2)若q 是p 的必要条件,求实数a 的取值范围.解:(1)当a =12时,A ={x |2<x <37},B ={x |12<x <146},因为p 真q 假. 所以(∁U B )∩A ={x |2<x ≤12}, 所以x 的取值范围为(2,12].(2)若q 是p 的必要条件,即p ⇒q ,可知A ⊆B . 因为a 2+2>a ,所以B ={x |a <x <a 2+2}. 当3a +1>2,即a >13时,A ={x |2<x <3a +1},应满足条件⎩⎪⎨⎪⎧a ≤2,a 2+2≥3a +1,解得13<a ≤3-52;当3a +1=2,即a =13时,A =∅,不符合题意;当3a +1<2,即a <13时,A ={x |3a +1<x <2},应满足条件⎩⎪⎨⎪⎧a ≤3a +1,a 2+2≥2解得-12≤a <13;综上所述,实数a 的取值范围为⎣⎡⎭⎫-12,13∪⎝ ⎛⎦⎥⎤13,3-52.命题点一 集合及其运算1.(2018·浙江高考)已知全集U ={1,2,3,4,5},A ={1,3},则∁U A =( ) A .∅ B .{1,3} C .{2,4,5}D .{1,2,3,4,5}解析:选C ∵U ={1,2,3,4,5},A ={1,3}, ∴∁U A ={2,4,5}.2.(2018·天津高考)设全集为R ,集合A ={x |0<x <2},B ={x |x ≥1},则A ∩(∁R B )=( ) A .{x |0<x ≤1} B .{x |0<x <1} C .{x |1≤x <2}D .{x |0<x <2}解析:选B ∵全集为R ,B ={x |x ≥1}, ∴∁R B ={x |x <1}. ∵集合A ={x |0<x <2}, ∴A ∩(∁R B )={x |0<x <1}.3.(2017·浙江高考)已知集合P ={x |-1<x <1},Q ={x |0<x <2},那么P ∪Q =( ) A .(-1,2) B .(0,1) C .(-1,0)D .(1,2)解析:选A 根据集合的并集的定义,得P ∪Q =(-1,2).4.(2018·全国卷Ⅲ)已知集合A ={x |x -1≥0},B ={0,1,2},则A ∩B =( ) A .{0} B .{1} C .{1,2}D .{0,1,2}解析:选C ∵A ={x |x -1≥0}={x |x ≥1},B ={0,1,2},∴A ∩B ={1,2}.5.(2018·全国卷Ⅱ)已知集合A ={(x ,y )|x 2+y 2≤3,x ∈Z ,y ∈Z },则A 中元素的个数为( ) A .9 B .8 C .5D .4解析:选A 将满足x 2+y 2≤3的整数x ,y 全部列举出来,即(-1,-1),(-1,0),(-1,1),(0,-1),(0,0),(0,1),(1,-1),(1,0),(1,1),共有9个.故选A.6.(2017·江苏高考)已知集合A ={1,2},B ={a ,a 2+3}.若A ∩B ={1},则实数a 的值为________. 解析:因为a 2+3≥3,所以由A ∩B ={1}得a =1,即实数a 的值为1. 答案:1命题点二 充要条件1.(2016·浙江高考)已知函数f (x )=x 2+bx ,则“b <0”是“f (f (x ))的最小值与f (x )的最小值相等”的( )A .充分不必要条件B .必要不充分条件C .充分必要条件D .既不充分也不必要条件 解析:选A∵f (x )=x 2+bx =⎝⎛⎭⎫x +b 22-b 24,当x =-b 2时,f (x )min =-b 24,又f (f (x ))=(f (x ))2+bf (x )=⎝⎛⎭⎫f (x )+b 22-b 24,当f (x )=-b 2时,f (f (x ))min =-b 24,当-b 2≥-b 24时,f (f (x ))可以取到最小值-b 24,即b 2-2b ≥0,解得b ≤0或b ≥2,故“b <0”是“f (f (x ))的最小值与f (x )的最小值相等”的充分不必要条件.选A.2.(2017·浙江高考)已知等差数列{a n }的公差为d ,前n 项和为S n ,则“d >0”是“S 4+S 6>2S 5”的( ) A .充分不必要条件 B .必要不充分条件 C .充分必要条件D .既不充分也不必要条件解析:选C 因为{a n }为等差数列,所以S 4+S 6=4a 1+6d +6a 1+15d =10a 1+21d,2S 5=10a 1+20d ,S 4+S 6-2S 5=d ,所以d >0⇔S 4+S 6>2S 5.3.(2015·浙江高考)设a ,b 是实数,则“a +b >0”是“ab >0”的( ) A .充分不必要条件B .必要不充分条件C .充分必要条件D .既不充分也不必要条件解析:选D 特值法:当a =10,b =-1时,a +b >0,ab <0,故a +b >0⇒/ ab >0; 当a =-2,b =-1时,ab >0,但a +b <0, 所以ab >0⇒/ a +b >0.故“a +b >0”是“ab >0”的既不充分也不必要条件.4.(2018·天津高考)设x ∈R ,则“⎪⎪⎪⎪x -12<12”是“x 3<1”的( ) A .充分而不必要条件 B .必要而不充分条件 C .充要条件D .既不充分也不必要条件解析:选A 由⎪⎪⎪⎪x -12<12,得0<x <1, 则0<x 3<1,即“⎪⎪⎪⎪x -12<12”⇒“x 3<1”; 由x 3<1,得x <1,当x ≤0时,⎪⎪⎪⎪x -12≥12, 即“x 3<1”⇒ / “⎪⎪⎪⎪x -12<12”. 所以“⎪⎪⎪⎪x -12<12”是“x 3<1”的充分而不必要条件. 5.(2017·天津高考)设θ∈R ,则“⎪⎪⎪⎪θ-π12<π12”是“sin θ<12”的( ) A .充分而不必要条件 B .必要而不充分条件 C .充要条件D .既不充分也不必要条件解析:选A 法一:由⎪⎪⎪⎪θ-π12<π12,得0<θ<π6, 故sin θ<12.由sin θ<12,得-7π6+2k π<θ<π6+2k π,k ∈Z ,推不出“⎪⎪⎪⎪θ-π12<π12”. 故“⎪⎪⎪⎪θ-π12<π12”是“sin θ<12”的充分而不必要条件. 法二:⎪⎪⎪⎪θ-π12<π12⇒0<θ<π6⇒sin θ<12,而当sin θ<12时,取θ=-π6,⎪⎪⎪⎪-π6-π12=π4>π12. 故“⎪⎪⎪⎪θ-π12<π12”是“sin θ<12”的充分而不必要条件. 6.(2018·北京高考)设a ,b 均为单位向量,则“|a -3b |=|3a +b |”是“a ⊥b ”的( ) A .充分而不必要条件 B .必要而不充分条件 C .充分必要条件D .既不充分也不必要条件解析:选C 由|a -3b |=|3a +b |,得(a -3b )2=(3a +b )2, 即a 2+9b 2-6a ·b =9a 2+b 2+6a ·b . 又a ,b 均为单位向量,所以a 2=b 2=1,所以a ·b =0,能推出a ⊥b .由a ⊥b ,得|a -3b |=10,|3a +b |=10, 能推出|a -3b |=|3a +b |,所以“|a -3b |=|3a +b |”是“a ⊥b ”的充分必要条件. 命题点三 四种命题及其关系1.(2015·山东高考)设m ∈R ,命题“若m >0,则方程x 2+x -m =0有实根”的逆否命题是( ) A .若方程x 2+x -m =0有实根,则m >0 B .若方程x 2+x -m =0有实根,则m ≤0 C .若方程x 2+x -m =0没有实根,则m >0 D .若方程x 2+x -m =0没有实根,则m ≤0解析:选D 根据逆否命题的定义,命题“若m >0,则方程x 2+x -m =0有实根”的逆否命题是“若方程x 2+x -m =0没有实根,则m ≤0”.2.(2018·北京高考)能说明“若a >b ,则1a <1b ”为假命题的一组a ,b 的值依次为________. 解析:只要保证a 为正b 为负即可满足要求. 当a >0>b 时,1a >0>1b .答案:1,-1(答案不唯一)3.(2017·北京高考)能够说明“设a ,b ,c 是任意实数.若a >b >c ,则a +b >c ”是假命题的一组整数a ,b ,c 的值依次为________.解析:因为“设a ,b ,c 是任意实数.若a >b >c ,则a +b >c ”是假命题, 则它的否定“设存在实数a ,b ,c .若a >b >c ,则a +b ≤c ”是真命题. 由于a >b >c ,所以a +b >2c ,又a +b ≤c ,所以c <0. 因此a ,b ,c 依次可取整数-1,-2,-3,满足a +b ≤c . 答案:-1,-2,-3(答案不唯一)。
【高中数学必修】第一章 集合与常用逻辑用语(公式、定理、结论图表)

第一章 集合与常用逻辑用语(公式、定理、结论图表)1.集合的有关概念(1)集合元素的三大特性:确定性、无序性、互异性. (2)元素与集合的两种关系:属于,记为∈;不属于,记为∉. (3)集合的三种表示方法:列举法、描述法、图示法. (4)五个特定的集合2.3.集合的基本运算集合的并集 集合的交集集合的补集符号表示A ∪BA ∩B若全集为U ,则集合A 的补集为∁U A图形表示集合表示{x |x ∈A ,或x ∈B }{x |x ∈A ,且x ∈B }{x |x ∈U ,且x ∉A }4.集合的运算性质(1)A ∩A =A ,A ∩∅=∅,A ∩B =B ∩A . (2)A ∪A =A ,A ∪∅=A ,A ∪B =B ∪A .(3)A ∩(∁U A )=∅,A ∪(∁U A )=U ,∁U (∁U A )=A . 5.常用结论(1)空集性质:①空集只有一个子集,即它的本身,∅⊆∅; ②空集是任何集合的子集(即∅⊆A ); 空集是任何非空集合的真子集(若A ≠∅,则∅A ).(2)子集个数:若有限集A 中有n 个元素,则A 的子集有2n 个,真子集有2n -1个,非空真子集有22n -个.典例1:已知集合{}2,4,8A =,{}2,3,4,6B =,则A B ⋂的子集的个数为( ) A .3 B .4 C .7 D .8【答案】B【详解】因为集合{}2,4,8A =,{}2,3,4,6B =,所以{}2,4A B =, 所以A B ⋂的子集的个数为224=个.故选B.典例2:已知集合{}2N230A x x x =∈--≤∣,则集合A 的真子集的个数为( ) A .32 B .31 C .16 D .15【答案】D【详解】由题意得{}{}{}2N230N 130,1,2,3A x x x x x =∈--≤=∈-≤≤=∣∣, 其真子集有42115-=个.故选D.(3)A ∩B =A ⇔A ⊆B ;A ∪B =A ⇔A ⊇B .(4)(∁U A )∩(∁U B )=∁U (A ∪B ),(∁U A )∪(∁U B )=∁U (A ∩B ) . 6.充分条件、必要条件与充要条件的概念若p ⇒q,则p是q的充分条件,q是p的必要条件p是q的充分不必要条件p ⇒q且q ⇏pp是q的必要不充分条件p ⇏q且q ⇒pp是q的充要条件p ⇔qp是q的既不充分也不必要条件p ⇏q且q ⇏p7.充分、必要条件与集合的关系设p,q成立的对象构成的集合分别为A,B.(1)p是q的充分条件⇔A⊆B,p是q的充分不必要条件⇔A B;(2)p是q的必要条件⇔B⊆A,p是q的必要不充分条件⇔B A;(3)p是q的充要条件⇔A=B.8.全称量词和存在量词量词名称常见量词符号表示全称量词所有、一切、任意、全部、每一个等∀存在量词存在一个、至少有一个、有些、某些等∃9.全称命题和特称命题名称全称命题特称命题形式语言表示对M中任意一个x,有p(x)成立M中存在元素x0,使p(x0)成立符号表示∀x∈M,p(x)∃x0∈M,p(x0)10.全称命题与特称命题的否定<知识记忆小口诀>集合平时很常用,数学概念有不同,理解集合并不难,三个要素是关键,元素确定和互译,还有无序要牢记,空集不论空不空,总有子集在其中,集合用图很方便,子交并补很明显.<解题方法与技巧>集合基本运算的方法技巧:(1)当集合是用列举法表示的数集时,可以通过列举集合的元素进行运算,也可借助Venn图运算;(2)当集合是用不等式表示时,可运用数轴求解.对于端点处的取舍,可以单独检验.集合常与不等式,基本函数结合,常见逻辑用语常与立体几何,三角函数,数列,线性规划等结合.充要条件的两种判断方法(1)定义法:根据p⇒q,q⇒p进行判断.(2)集合法:根据使p,q成立的对象的集合之间的包含关系进行判断.充分条件、必要条件的应用,一般表现在参数问题的求解上.解题时需注意:(1)把充分条件、必要条件或充要条件转化为集合之间的关系,然后根据集合之间的关系列出关于参数的不等式(或不等式组)求解.(2)要注意区间端点值的检验.尤其是利用两个集合之间的关系求解参数的取值范围时,不等式是否能够取等号决定端点值的取舍,处理不当容易出现漏解或增解的现象.(3)数学定义都是充要条件.。
高中数学新教材必修第一册第一章 集合与常用逻辑用语基础知识

第一章集合与常用逻辑用语1元素:研究的对象统称为元素,用表示元素三大性质:,,.2集合:一些元素组成的叫做集合,简称集,用表示.3集合相等:两个集合BA,的一样,记作BA=.4元素与集合的关系:属于:a A; 不属于:a A.5常用的数集及其记法:自然数集;正整数集;整数集;有理数集;实数集.6集合的表示方法:①列举法:把集合中的所有元素一一列举出来,并用花括号括起来表示集合的方法;①描述法:把集合中所有具有共同特征)P的元素x所组成的集合表示为(x的方法;①图示法(Venn图):用平面上封闭曲线的内部代表集合的方法.7集合间的基本关系:子集:真子集:8空集:不含任何元素的集合,用表示;空集的性质,空集是任何集合的,是任何的真子集.9集合的基本运算:并集;交集;补集(U为全集,全集是含有所研究问题中涉及的所有元素).运算性质:A∪B=B⇔; A∩B=A⇔; A∪∅=;A∩∅=; C U(C U A)=; C U∅=; C U U=;(C U A)∩(C U B)=; (C U A)∪(C U B)=;10充分条件与必要条件:p⇒,称p是q的充分条一般地,“若p,则q”为真命题,p可以推出q,记作q件,q是p的必要条件;p是q的条件的四种类型:若则p是q的充分不必要条件;若则p是q的必要充分不条件;若则p是q的充要条件;若则p是q的既不充分也不必要条件.11全称量词及全称量词命题:短语,在逻辑中叫做全称量词,并用符号表示,含有全称量词的命题成为全称量词命题.12存在量词及存在量词命题:短语,在逻辑中叫做存在量词,并用符号表示,含有存在量词的命题成为存在量词命题.13全称量词命题与存在量词命题的否定:全称量词命题的否定是;存在量词命题的否定是.库尔勒市第四中学。
常用逻辑用语知识点归纳

高二数学 第1页 共4页简单逻辑用语1、命题:用语言、符号或式子表达的,可以判断真假的陈述句. 真命题:判断为真的语句.假命题:判断为假的语句.2、“若p ,则q ”形式的命题中的p 称为命题的条件,q 称为命题的结论.3、原命题:“若p 则q ” 逆命题: “若q 则p ”否命题:“若﹁p 则﹁q ” 逆否命题:“若﹁q 则﹁p ”4、四种命题的真假性之间的关系:(1)两个命题互为逆否命题,它们有相同的真假性;(2)两个命题为互逆命题或互否命题,它们的真假性没有关系. 5、若p q ⇒,则p 是q 的充分条件,q p ⇐,q 是p 的必要条件.若p q ⇔,则p 是q 的充要条件(充分必要条件). 利用集合间的包含关系: (小推大)例如:若B A ⊆,则A 是B 的充分条件或B 是A 的必要条件;若A=B ,则A 是B 的充要条件; 6、逻辑联结词:⑴且:命题形式p q ∧;⑵或:命题形式p q ∨;⑶非:命题形式p ⌝.7、⑴全称量词——“所有的”、“任意一个”等,用“∀”表示;全称命题p :)(,x p M x ∈∀; 全称命题p 的否定⌝p :)(,x p M x ⌝∈∃。
⑵存在量词——“存在一个”、“至少有一个”等,用“∃”表示;特称命题p :)(,x p M x ∈∃; 特称命题p 的否定⌝p :)(,x p M x ⌝∈∀;1.设命题p ,q 是两个命题,若p q ∨真,p q ∧假,则 ( )A .p,q 中至少有一个为假命题B . p 真q 假C .p,q 中至少有一个为真命题D .p,q 有且只有一个为真命题2.在△ABC 中,sinA sinB =是△ABC 为等腰三角形的( ) A.充分而不必要条件 B.必要而不充分条件 C.充要条件 D.即不充分也不必要条件3.A B >是sinA sinB >的4.命题tan 1p x R x ∃∈=:,使,p ⌝ 为5. a R ∈,3a <成立的一个充分不必要条件是( )A. 3a <B. 2a <C. 29a < D. 02a <<6.已知条件p :220x x +->,条件q :a x >,若q 是p 的充分不必要条件,求a 的取值范围。
高中数学第一章集合与常用逻辑用语知识汇总大全(带答案)
高中数学第一章集合与常用逻辑用语知识汇总大全单选题1、已知集合A={(x,y)||x|+|y|≤2,x∈Z,y∈Z},则A中元素的个数为()A.9B.10C.12D.13答案:D分析:利用列举法列举出集合A中所有的元素,即可得解.由题意可知,集合A中的元素有:(−2,0)、(−1,−1)、(−1,0)、(−1,1)、(0,−2)、(0,−1)、(0,0)、(0,1)、(0,2)、(1,−1)、(1,0)、(1,1)、(2,0),共13个.故选:D.2、已知集合S={s|s=2n+1,n∈Z},T={t|t=4n+1,n∈Z},则S∩T=()A.∅B.S C.T D.Z答案:C分析:分析可得T⊆S,由此可得出结论.任取t∈T,则t=4n+1=2⋅(2n)+1,其中n∈Z,所以,t∈S,故T⊆S,因此,S∩T=T.故选:C.3、设集合A={x|−2<x<4},B={2,3,4,5},则A∩B=()A.{2}B.{2,3}C.{3,4}D.{2,3,4}答案:B分析:利用交集的定义可求A∩B.由题设有A∩B={2,3},故选:B .4、以下五个写法中:①{0}∈{0,1,2};②∅⊆{1,2};③∅∈{0};④{0,1,2}={2,0,1};⑤0∈∅;正确的个数有()A.1个B.2个C.3个D.4个答案:B分析:根据元素与集合以及集合与集合之间的关系表示方法作出判断即可.对于①:是集合与集合的关系,应该是{0}⊆{0,1,2},∴①不对;对于②:空集是任何集合的子集,∅⊆{1,2},∴②对;对于③:∅是一个集合,是集合与集合的关系,∅⊆{0},∴③不对;对于④:根据集合的无序性可知{0,1,2}={2,0,1},∴④对;对于⑤:∅是空集,表示没有任何元素,应该是0∉∅,∴⑤不对;正确的是:②④.故选:B.5、已知集合A={x|-1<x<1},B={x|0≤x≤2},则A∪B=()A.{x|0≤x<1}B.{x|-1<x≤2}C.{x|1<x≤2}D.{x|0<x<1}答案:B分析:由集合并集的定义可得选项.解:由集合并集的定义可得A∪B={x|-1<x≤2},故选:B.6、集合A={x|x<−1或x≥1},B={x|ax+2≤0},若B⊆A,则实数a的取值范围是()A.[−2,2]B.[−2,2)C.(−∞,−2)∪[2,+∞)D.[−2,0)∪(0,2)答案:B分析:分B=∅与B≠∅两种情况讨论,分别求出参数的取值范围,最后取并集即可;解:∵B⊆A,∴①当B=∅时,即ax+2≤0无解,此时a=0,满足题意.②当B≠∅时,即ax+2≤0有解,当a>0时,可得x≤−2a,要使B⊆A,则需要{a>0−2a<−1,解得0<a<2.当a<0时,可得x≥−2a ,要使B⊆A,则需要{a<0−2a≥1,解得−2≤a<0,综上,实数a的取值范围是[−2,2).故选:B.7、在下列命题中,是真命题的是()A.∃x∈R,x2+x+3=0B.∀x∈R,x2+x+2>0C.∀x∈R,x2>|x|D.已知A={a∣a=2n},B={b∣b=3m},则对于任意的n,m∈N∗,都有A∩B=∅答案:B分析:可通过分别判断选项正确和错误,来进行选择/选项A,∃x∈R,x2+x+3=0,即x2+x+3=0有实数解,所以Δ=1−12=−11<0,显然此方程无实数解,故排除;选项B,∀x∈R,x2+x+2>0,x2+x+2=(x+12)2+74≥74>0,故该选项正确;选项C,∀x∈R,x2>|x|,而当x=0时,0>0,不成立,故该选项错误,排除;选项D,A={a∣a=2n},B={b∣b=3m},当n,m∈N∗时,当a、b取得6的正整数倍时,A∩B≠∅,所以,该选项错误,排除.故选:B.8、设集合A={2,a2−a+2,1−a},若4∈A,则a的值为().A.−1,2B.−3C.−1,−3,2D.−3,2答案:D分析:由集合中元素确定性得到:a=−1,a=2或a=−3,通过检验,排除掉a=−1.由集合中元素的确定性知a2−a+2=4或1−a=4.当a2−a+2=4时,a=−1或a=2;当1−a=4时,a=−3.当a=−1时,A={2,4,2}不满足集合中元素的互异性,故a=−1舍去;当a=2时,A={2,4,−1}满足集合中元素的互异性,故a=2满足要求;当a =−3时,A ={2,14,4}满足集合中元素的互异性,故a =−3满足要求.综上,a =2或a =−3.故选:D .多选题9、已知集合A ={x ∣1<x <2},B ={x ∣2a −3<x <a −2},下列命题正确的是A .不存在实数a 使得A =B B .存在实数a 使得A ⊆BC .当a =4时,A ⊆BD .当0⩽a ⩽4时,B ⊆AE .存在实数a 使得B ⊆A答案:AE分析:利用集合相等判断A 选项错误,由A ⊆B 建立不等式组,根据是否有解判断B 选项;a =4时求出B ,判断是否A ⊆B 可得C 错误,分B 为空集,非空集两种情况讨论可判断D 选项,由D 选项判断过程可知E 选项正确.A 选项由相等集合的概念可得{2a −3=1a −2=2解得a =2且a =4,得此方程组无解, 故不存在实数a 使得集合A=B ,因此A 正确;B 选项由A ⊆B ,得{2a −3≤1a −2≥2即{a ≤2a ≥4,此不等式组无解,因此B 错误; C 选项当a =4时,得B ={x ∣5<x <2}为空集,不满足A ⊆B ,因此C 错误;D 选项当2a −3≥a −2,即a ≥1时,B =∅⊆A ,符合B ⊆A ;当a <1时,要使B ⊆A ,需满足{2a −3≥1a −2≤2解得2≤a ≤4,不满足a <1,故这样的实数a 不存在,则当0≤a ≤4时B ⊆A 不正确,因此D 错误; E 选项由D 选项分析可得存在实数a 使得B ⊆A ,因此E 正确.综上AE 选项正确.故选:AE.小提示:本题主要考查了集合相等,子集的概念,考查了推理运算能力,属于中档题.10、已知p 是r 的充分条件而不是必要条件,q 是r 的充分条件,s 是r 的必要条件,q 是s 的必要条件.现有下列命题:①s 是q 的充要条件;②p 是q 的充分条件而不是必要条件;③r 是q 的必要条件而不是充分条件;④¬p 是¬s 的必要条件而不是充分条件;则正确命题序号是 ( )A.①B.②C.③D.④答案:ABD分析:根据题设有p⇒r⇔s⇔q,但r⇏p,即知否定命题的推出关系,判断各项的正误. 由题意,p⇒r⇔s⇔q,但r⇏p,故①②正确,③错误;所以,根据等价关系知:¬s⇔¬q⇔¬r⇒¬p且¬p⇏¬r,故④正确.故选:ABD11、已知x,y,z为非零实数,代数式x|x|+y|y|+z|z|+|xyz|xyz的值所组成的集合是M,则下列判断正确的是()A.0∉M B.2∈M C.−4∈M D.4∈M答案:CD分析:讨论x,y,z的正负数分布情况判断对应代数式的值,即可确定集合M,进而确定正确的选项.当x,y,z均为负数时,x|x|+y|y|+z|z|+|xyz|xyz=−4;当x,y,z两负一正时,x|x|+y|y|+z|z|+|xyz|xyz=0;当x,y,z两正一负时,x|x|+y|y|+z|z|+|xyz|xyz=0;当x,y,z均为正数时,x|x|+y|y|+z|z|+|xyz|xyz=4;∴M={−4,0,4},A、B错误,C、D正确.故选:CD12、已知集合A={y|y=x2+1},集合B={(x,y)|y=x2+1},下列关系正确的是().A.(1,2)∈B B.A=B C.0∉A D.(0,0)∉B答案:ACD分析:根据集合的定义判断,注意集合中代表元形式.由已知集合A={y}y≥1}=[1,+∞),集合B是由抛物线y=x2+1上的点组成的集合,A正确,B错,C正确,D正确,故选:ACD.小提示:本题考查集合的概念,确定集合中的元素是解题关键.13、对任意实数a,b,c,下列命题中真命题是()A.a=b是ac=bc的充要条件B.“a+5是无理数”是“a是无理数”的充要条件C.a>b是a2>b2的充要条件D.a<5是a<3的必要条件答案:BD分析:利用充分条件和必要条件的定义进行判断解:∵“a=b”⇒“ac=bc”为真命题,但当c=0时,“ac=bc”⇒“a=b”为假命题,故“a=b”是“ac=bc”的充分不必要条件,故A为假命题;∵“a+5是无理数”⇒“a是无理数”为真命题,“a是无理数”⇒“a+5是无理数”也为真命题,故“a+5是无理数”是“a是无理数”的充要条件,故B为真命题;∵“a>b”⇒“a2>b2”为假命题,“a2>b2”⇒“a>b”也为假命题,故“a>b”是“a2>b2”的既不充分也不必要条件,故C为假命题;∵{a|a<3}{a|a<5},故“a<5”是“a<3”的必要不充分条件,故D为真命题.故选:BD.填空题14、已知A={x∈R|2a≤x≤a+3},B={x∈R|x<-1或x>4},若A⊆B,则实数a的取值范围是________.答案:a<-4或a>2分析:按集合A为空集和不是空集两种情况去讨论即可求得实数a的取值范围.①当a>3即2a>a+3时,A=∅,满足A⊆B;.②当a≤3即2a≤a+3时,若A⊆B,则有{2a≤a+3a+3〈−1或2a〉4,解得a<-4或2<a≤3综上,实数a的取值范围是a<-4或a>2.所以答案是:a<-4或a>215、命题“∃x∈R,x≥1或x>2”的否定是__________.答案:∀x∈R,x<1根据含有量词的命题的否定,即可得到命题的否定分析:特称命题的否定是全称命题,∴命题“∃x∈R,x≥1或x>2”的等价条件为:“∃x∈R,x≥1”,∴命题的否定是:∀x∈R,x<1.所以答案是:∀x∈R,x<1.16、用符号∈或∉填空:3.1___N,3.1___Z, 3.1____N∗,3.1____Q,3.1___R.答案:∉∉∉∈∈分析:由元素与集合的关系求解即可因为3.1不是自然数,也不是整数,也不是正整数,是有理数,也是实数,所以有:3.1∉N;3.1∉Z;3.1∉N∗;3.1∈Q;3.1∈R.所以答案是:∉,∉,∉,∈,∈.解答题17、已知m>0,p:(x+1)(x−5)≤0,q:1−m≤x≤1+m.(1)若m=5,p∨q为真命题,p∧q为假命题,求实数x的取值范围;(2)若p是q的充分条件,求实数m的取值范围.答案:(1){x|−4≤x<−1或5<x≤6};(2)[4,+∞).分析:(1)由“p∨q”为真命题,“p∧q”为假命题,可得p与q一真一假,然后分p真q假,p假q真,求解即可;(2)由p是q的充分条件,可得[−1,5]⊆[1−m,1+m],则有{m>01−m≤−11+m≥5,从而可求出实数m的取值范围(1)当m=5时,q:−4≤x≤6,因为“p∨q”为真命题,“p∧q”为假命题,故p与q一真一假,若p真q假,则{−1≤x≤5x<−4或x>6,该不等式组无解;若p假q真,则{x<−1或x>5−4≤x≤6,得−4≤x<−1或5<x≤6,综上所述,实数的取值范围为{x|−4≤x<−1或5<x≤6};(2)因为p是q的充分条件,故[−1,5]⊆[1−m,1+m],故{m>01−m≤−11+m≥5,得m≥4,故实数m的取值范围为[4,+∞).18、已知集合A={x|2<x<4},B={x|a<x<3a}.(1)若A∩B={x|3<x<4},求实数a的值;(2)若A∩B=∅,求实数a的取值范围.答案:(1)3(2){a|a≤23或a≥4}分析:(1)根据交集结果直接判断即可.(2)按B=∅,B≠∅讨论,简单计算即可得到结果. (1)因为A∩B={x|3<x<4},所以a=3.(2)因为A∩B=∅,所以可分两种情况讨论:B=∅,B≠∅. 当B=∅时,有a≥3a,解得a≤0;当B≠∅时,有{a>0a≥4或3a≤2,解得a≥4或0<a≤23.综上,实数a的取值范围是{a|a≤23或a≥4}.。
人教版1-1第一章常用逻辑用语小结
,5
3.若命题“对x R, kx2 kx 1 0 ”是真命题,则k 的取值范围是 4,0
4.已知函数
f
x
x
4 x
,
gx
2x
a
,若 x1
1 2
,1,x 2
2,3,
使得 f x1 gx2 ,则实数 a 的取值范围是
,1
课后作业
1.选修 1-1. P28 A 组 4、5、6
2 补充作业
从而有 A B 。
回顾与思考
设 p , q 为含有变量 x 的语句,我们引入如下两个集合
A x p成立 B x q成立
如果 A B ,那么每个使 p 成立的变量 x 也使得 q 成立。也就是说,若 p 成立, 则 q 也成立,即 p q ,从而 p 是 q 成立的充分条件, q 是 p 成立的必要条件。 反过来,如果 p 是 q 的充分条件,那么由 p 成立可以推出 q 成立, 也就是说,若 x A ,则一定有 x B ,从而集合 A B 。
回顾与思考
2.充分条件、必要条件和充要条件与集合之间 的关系
若 p q ,则 p 是 q 的充分条件, q 是 p 的必要条件;
若 p q ,则 p 是 q 的充要条件。
回顾与思考
设 A 、 B 是两个集合,集合 A B 是指: x A x B
(*)
这就是说,“ x A”是“ x B ”的充分条件,“ x B ”是“ x A ”的必要条件。
学习目标
1.了解命题及其逆命题、否命题与逆否命题, 会分析四种命题的相互关系;理解必要条件、 充分条件与充要条件。
2.了解逻辑连接词“或”“且”“非”的含义。 3.理解全称量词与存在量词的意义,能正确地 对含有一个量词的命题进行否定。
高中数学 第1章 常用逻辑用语 1
§1.3简单的逻辑联结词知识点一由简单命题写出复合命题分别写出由下列各组命题构成的“p或q”、“p且q”、“非p”形式的复合命题:(1)p:2是无理数,q:2大于1;(2)p:N⊆Z,q:0∈N;(3)p:x2+1>x-4,q:x2+1<x-4.解(1)p∨q:2是无理数或大于1;p∧q:2是无理数且大于1;綈p:2不是无理数.(2)p∨q:N⊆Z或0∈N;p∧q:N⊆Z且0∈N;綈p:N⃘Z.(3)p∨q:x2+1≠x-4;p∧q:x2+1>x-4且x2+1<x-4;綈p:x2+1≤x-4.知识点二从复合命题中找出简单命题指出下列复合命题的形式及构成它的简单命题.(1)96是48与16的倍数;(2)方程x2-3=0没有有理数解;(3)不等式x2-x-2>0的解集是{x|x<-1或x>2};(4)他是运动员兼教练员.解(1)“p且q”形式,其中p:96是48的倍数,q:96是16的倍数.(2)“非p”形式,其中p:方程x2-3=0有有理数解.(3)“p或q”形式,其中p:不等式x2-x-2>0的解集是{x|x<-1},q:不等式x2-x-2>0的解集是{x|x>2}.(4)“p且q”形式,其中p:他是运动员,q:他是教练员.知识点三判断含有逻辑联结词的命题的真假分别指出由下列各组命题构成的“p或q”“p且q”“非p”形式的命题的真假.(1)p:3>3,q:3=3;(2)p:∅{0},q:0∈∅;(3)p:A⊆A,q:A∩A=A;(4)p:函数y=x2+3x+4的图象与x轴有交点,q:方程x2+3x-4=0没有实根.解(1)因为p假q真,所以“p∨q”为真,“p∧q”为假,“綈p”为真.(2)因为p真q假,所以“p∨q”为真,“p∧q”为假,“綈p”为假.(3)因为p真q真,所以“p∨q”为真,“p∧q”为真,“綈p”为假.(4)因为p假q假,所以“p∨q”为假,“p∧q”为假,“綈p”为真.知识点四非命题与否命题写出下列命题的否定及命题的否命题:(1)菱形的对角线互相垂直;(2)面积相等的三角形是全等三角形.解(1)命题的否定:存在一个菱形,其对角线不互相垂直.否命题:不是菱形的四边形,其对角线不互相垂直.(2)命题的否定:存在面积相等的三角形不是全等三角形.否命题:面积不相等的三角形不是全等三角形.考题赏析1.(广东高考)已知命题p:所有有理数都是实数;命题q:正数的对数都是负数,则下列命题中为真命题的是()A.(綈p)∨q B.p∧qC.(綈p)∧(綈q) D.(綈p)∨(綈q)解析不难判断命题p为真命题,命题q为假命题,从而上述叙述中只有(綈p)∨(綈q)为真命题.答案 D2.(如皋联考)已知命题:p:若实数x,y满足x2+y2=0,则x,y全为0;命题q:若a>b,则1a<1b.给出下列四个复合命题:①p且q;②p或q;③綈p;④綈q.上述命题中为真命题的是________.解析p为真,q为假,故p或q,綈q为真命题.答案②④1.如果命题“非p或非q”是假命题,则在下列各结论中,正确的为()①命题“p且q”是真命题;②命题“p且q”是假命题;③命题“p或q”是真命题;④命题“p或q”是假命题.A.②③B.②④C.①③D.①④答案 C解析因“p且q”的否定为“綈p或綈q”,即綈(p且q)等价于綈p或綈q,所以“綈p或綈q”是假命题等价于“綈(p且q)”是假命题,即p且q为真命题.故选C.2.条件p:x∈A∪B,则綈p是()A.x∉A或x∉B B.x∉A且x∉BC .x ∈A ∩BD .x ∉A 或x ∈B 答案 B解析 因x ∈A ∪B ⇔x ∈A 或x ∈B ,所以綈p 为x ∉A 且x ∉B ,故选B.3.对于命题p 和q ,若p 且q 为真命题,则下列四个命题: ①p 或綈q 是真命题; ②p 或綈q 是假命题; ③綈p 且綈q 是假命题; ④綈p 或q 是假命题, 其中真命题是( )A .①②B .③④C .①③D .②④ 答案 C解析 因为p 且q 为真,所以p 与q 都为真,所以綈p 且綈q 为假.所以只有①③是真命题,所以选C. 4.若命题“p ∧q ”为假,且“綈p ”为假,则( ) A .p ∨q 为假 B .q 假C .q 真D .不能判断q 的真假 答案 B解析 綈p 为假,则p 为真,又p ∧q 为假,所以q 为假.所以选B. 5.“a ≥5且b ≥2”的否定是________. 答案 a <5或b <2解析 本题考查命题的否定,“p 或q ”的否定是“綈p 且綈q ”,“p 且q ”的否定是“綈p 或綈q ”. 6.命题p :{2}∈{2,3},q :{2}⊆{2,3},则下列对复合命题的判断,正确的是________.(填上所有正确的序号)①p 或q 为真;②p 或q 为假;③p 且q 为真;④p 且q 为假;⑤非p 为真;⑥非q 为假. 答案 ①④⑤⑥解析 由题可知p 为假,q 为真,所以p 或q 为真,p 且q 为假,非p 为真,非q 为假.答案为①④⑤⑥.7.已知p :3-x ≤0或3-x >4,q :5x +2<1,求p ∧q .解 由3-x ≤0或3-x >4,解得p :x ≥3或x <-1; 由5x +2-1<0,即3-x x +2<0, 解得q :x <-2或x >3.所以p ∧q :x <-2或x >3.8.已知a >0,a ≠1,设p :函数y =log a (x +1)在x ∈(0,+∞)内单调递减;q :曲线y =x 2+(2a -3)x +1与x 轴交于不同的两点.如果p 与q 有且只有一个正确,求a 的取值范围.解 当0<a <1时,函数y =log a (x +1)在(0,+∞)内单调递减;当a >1时,y =log a (x +1)在(0,+∞)内不是单调递减,曲线y =x 2+(2a -3)x +1与x 轴交于不同的两点等价于(2a -3)2-4>0,即a <12或a >52.若p真q 假,则a ∈(0,1)∩⎩⎨⎧⎭⎬⎫⎣⎡⎭⎫12,1∪⎝⎛⎦⎤1,52=⎣⎡⎭⎫12,1. 若p 假q 真,注意到已知a >0,a ≠1,所以有 a ∈(1,+∞)∩⎩⎨⎧⎭⎬⎫⎝⎛⎭⎫0,12∪⎝⎛⎭⎫52,+∞=⎝⎛⎭⎫52,+∞. 综上可知,a 的取值范围为⎣⎡⎭⎫12,1∪⎝⎛⎭⎫52,+∞.讲练学案部分知识点一 含逻辑联结词的命题的构成将下列命题写成“p ∧q ”“p ∨q ”和“綈p ”的形式: (1)p :菱形的对角线互相垂直,q :菱形的对角线互相平分;(2)p :能被5整除的整数的个位数一定为5,q :能被5整除的整数的个位数一定为0. 解 (1)p ∧q :菱形的对角线互相垂直且平分. p ∨q :菱形的对角线互相垂直或平分. 綈p :菱形的对角线不互相垂直.(2)p ∧q :能被5整除的整数的个位数一定为5且一定为0; p ∨q :能被5整除的整数的个位数一定为5或一定为0;綈p :能被5整除的整数的个位数一定不为5.【反思感悟】 简单命题用联结词“或”、“且”、“非”联结得到的新命题是复合命题,联结后可以综合起来叙述,但综合叙述不能叙述成条件复合的简单命题或叙述成结论复合的简单命题.如(2)中的p ∨q 不能叙述成:能被5整除的整数的个位数一定为5或0,因为p 、q 都是假命题,则p ∨q 也为假命题.判断下列命题是否是复合命题并说明理由.(1)2是4和6的约数;(2)不等式x 2-5x +6>0的解为x >3或x <2.解 (1)是“p 且q ”形式的复合命题,其中p :2是4的约数;q :2是6的约数.(2)是简单命题,而不是用“或”联结的复合命题,因不等式x 2-5x +6>0的解为x >3是假命题,不等式x 2-5x +6>0的解为x <2也是假命题,而命题(2)是真命题,这与p 、q 都假,则p ∨q 一定假矛盾.命题“不等式x 2-5x +6>0的解为x >3或解为x <2”是p ∨q 的形式.知识点二 含逻辑联结词的命题的真假判断分别指出下列命题的形式及构成它的命题,并判断真假:(1)相似三角形周长相等或对应角相等; (2)9的算术平方根不是-3;(3)垂直于弦的直径平分这条弦,并且平分弦所对的两段弧.解 (1)这个命题是p ∨q 的形式,其中p :相似三角形周长相等,q :相似三角形对应角相等,因为p 假q 真,所以p ∨q 为真.(2)这个命题是綈p 的形式,其中p :9的算术平方根是-3,因为p 假,所以綈p 为真.(3)这个命题是p ∧q 的形式,其中p :垂直于弦的直径平分这条弦,q :垂直于弦的直径平分这条弦所对的两段弧,因为p 真q 真,所以p ∧q 为真.【反思感悟】 判断含逻辑联结词的命题的真假,关键是对应p 、q 的真假及“p ∧q ”“p ∨q ”为真时的判定依据,至于“綈p ”的真假,可就p 的真假判断,也可就“綈p ”直接判断.判断下列命题的真假:(1)-1是偶数或奇数;(2)2属于集合Q ,也属于集合R ; (3)A ⃘(A ∪B ).解 (1)此命题为“p ∨q ”的形式,其中p :-1是偶数,q :-1是奇数,因为p 为假命题,q 为真命题,所以“p ∨q ”为真命题,故原命题为真命题.(2)此命题为“p ∧q ”的形式,其中p :2属于Q ,q :2属于R ,因为p 为假命题,q 为真命题,所以“p ∧q ”为假命题,故原命题为假命题.(3)此命题为“綈p ”的形式,其中p :A ⊆(A ∪B ).因为p 为真命题,所以“綈p ”为假命题,故原命题为假命题.知识点三 简单的逻辑联结词的综合应用已知p :函数y =x 2+mx +1在(-1,+∞)上单调递增,q :函数y =4x 2+4(m -2)x +1大于零恒成立.若p 或q 为真,p 且q 为假,求m 的取值范围.解 若函数y =x 2+mx +1在(-1,+∞)上单调递增,则-m2≤-1,∴m ≥2,即p :m ≥2;若函数y =4x 2+4(m -2)x +1恒大于零, 则Δ=16(m -2)2-16<0, 解得1<m <3,即q :1<m <3.因为p 或q 为真,p 且q 为假,所以p 、q 一真一假,当p 真q 假时,由⎩⎨⎧m ≥2m ≥3或m ≤1,得m ≥3,当p 假q 真时,由⎩⎨⎧m <21<m <3,得1<m <2.综上,m 的取值范围是{m |m ≥3或1<m <2}.【反思感悟】 由p 、q 的真假,可以判断“p ∨q ”“p ∧q ”“綈p ”的真假.反之,由“p ∧q ”“p ∨q ”“綈p ”的真假,也能推断p 、q 的真假,如“p ∧q ”为假,则包括“p 真q 假”“p 假q 真”“p 假q 假”三种情况.已知p :方程x 2+mx +1=0有两个不等负根.q :方程4x 2+4(m -2)x +1=0无实根.(1)当m 为何值时,p 或q 为真? (2)当m 为何值时,p 且q 为真?解 由已知可知:p 真时m >2,q 真时1<m <3, (1)若p 或q 为真,只需m ∈{m |m >2}∪{m |1<m <3} ={m |m >1}.(2)若p 且q 为真,只需m ∈{m |m >2}∩{m |1<m <3} ={m |2<m <3}.课堂小结:1. 从集合的角度理解“且”“或”“非”. 设命题p :x ∈A.命题q :x ∈B. 则p ∧qx ∈A 且x ∈Bx ∈A ∩B ;p ∨q x ∈A 或x ∈B x ∈A ∪B ;2.对有逻辑联结词的命题真假性的判断 当p 、q 都为真,p ∧q 才为真;⌝p 与p 的真假性相反且一定有一个为真.当p 、q 有一个为真,p ∨q 即为真; 3.含有逻辑联结词的命题否定(1)“x=0或x=1”的否定是“x ≠0且x ≠1”而不是“x ≠0或x ≠1”; (2)“x 、y 全为0”的否定是“x 、y 不全为0”,而不是“x 、y 全不为0”;(3)“全等三角形一定是相似三角形”的否定是“全等三角形一定不是相似三角形”而不是“全等三角形不一定是相似三角形”.一、选择题1.p :点P 在直线y =2x -3上,q :点P 在抛物线y =-x 2上,则使“p ∧q ”为真命题的一个点P (x ,y )是( )A .(0,-3)B .(1,2)C .(1,-1)D .(-1,1) 答案 C解析 点P (x ,y )满足⎩⎪⎨⎪⎧y =2x -3,y =-x 2.可验证各选项中,只有C 正确.2.如果原命题的结论是“p 且q ”的形式,那么否命题的结论形式为( ) A .綈p 且綈q B .綈p 或綈q C .綈p 或q D .綈q 或p 答案 B解析 注意逻辑联结词的否定,“或”的否定是“且”,“且”的否定为“或”,所以p 且q 的否定为綈p 或綈q .所以选B.3.命题p :函数y =log a (ax +2a )(a >0且a ≠1)的图象必过定点(-1,1);命题q :如果函数y =f (x )的图象关于(3,0)对称,那么函数y =f (x -3)的图象关于原点对称,则有( )A .“p 且q ”为真B .“p 或q ”为假C .p 真q 假D .p 假q 真 答案 C解析 由于将点(-1,1)代入y =log a (ax +2a )成立,故p 真;由y =f (x )的图象关于(3,0)对称,知y =f (x -3)的图象关于(6,0)对称,故q 假.4.若p 、q 是两个简单命题,p 或q 的否定是真命题,则必有( ) A .p 真q 真 B .p 假q 假 C .p 真q 假 D .p 假q 真答案 B解析 因为p 或q 的否定綈p 且綈q 为真命题,所以綈p 与綈q 都是真命题,所以p 与q 都为假命题.所以选B.5.下列命题中既是p ∧q 形式的命题,又是真命题的是( ) A .10或15是5的倍数B .方程x 2-3x -4=0的两根是-4和1C .方程x 2+1=0没有实数根D .有两个角为45°的三角形是等腰直角三角形 答案 D解析 A 中的命题是条件复合的简单命题,B 中的命题是结论复合的简单命题,C 中的命题是綈p 的形式,D 中的命题为p ∧q 型. 二、填空题6.由命题p :6是12的约数,命题q :6是24的约数.构成的“p ∨q ”形式的命题是______________________________,“p ∧q ”形式的命题是______________________________,“綈p ”形式的命题是________________________________.答案 6是12或24的约数 6是12和24的约数 6不是12的约数7.若“x ∈[2,5]或x ∈{x |x <1或x >4}”是假命题,则x 的范围是________. 答案 [1,2)解析 x ∈[2,5]或x ∈(-∞,1)∪(4,+∞), 即x ∈(-∞,1)∪[2,+∞),由于命题是假命题,所以1≤x <2,即x ∈[1,2).8.已知a 、b ∈R ,设p :|a |+|b |>|a +b |,q :函数y =x 2-x +1在(0,+∞)上是增函数,那么命题:p ∨q 、p ∧q 、綈p 中的真命题是________.答案 綈p 解析 对于p 当a >0,b >0时,|a |+|b |=|a +b |,故p 假,綈p 为真;对于q ,抛物线y =x 2-x +1的对称轴为x =12,故q 假,所以p ∨q 假,p ∧q 假.这里綈p 应理解成|a |+|b |>|a +b |不恒成立,而不是|a |+|b |≤|a +b |.三、解答题9.判断下列复合命题的真假:(1)等腰三角形顶角的平分线平分底边并且垂直于底边; (2)x =±1是方程x 2+3x +2=0的根; (3)A ⃘(A ∪B ).解 (1)这个命题是“p 且q ”的形式,其中p :等腰三角形顶角的平分线平分底边,q :等腰三角形顶角的平分线垂直于底边,因为p 真q 真,则“p 且q ”真,所以该命题是真命题.(2)这个命题是“p 或q ”的形式,其中p :1是方程x 2+3x +2=0的根,q :-1是方程x 2+3x +2=0的根,因为p 假q 真,则“p 或q ”真,所以该命题是真命题.(3)这个命题是“非p ”的形式,其中p :A ⊆(A ∪B ),因为p 真,则“非p ”假,所以该命题是假命题. 10.已知p :x 2+4mx +1=0有两个不等的负数根,q :函数f (x )=-(m 2-m +1)x 在(-∞,+∞)上是增函数.若p 或q 为真,p 且q 为假,求实数m 的取值范围.解 p :x 2+4mx +1=0有两个不等的负根⇔⎩⎪⎨⎪⎧Δ=16m 2-4>0-4m <0⇔m >12.q :函数f (x )=-(m 2-m +1)x 在(-∞,+∞)上是增函数 ⇔0<m 2-m +1<1⇔0<m <1.(1)若p 真,q 假,则⎩⎪⎨⎪⎧m >12,m ≤0或m ≥1.⇒m ≥1.(2)若p 假,q 真,则⎩⎪⎨⎪⎧m ≤120<m <1⇒0<m ≤12综上,得m ≥1或0<m ≤12.。
高中数学知识点总结(第一章 集合与常用逻辑用语)
第一章 集合与常用逻辑用语第一节 集 合一、基础知识1.集合的有关概念(1)集合元素的三个特性:确定性、无序性、互异性.元素互异性,即集合中不能出现相同的元素,此性质常用于求解含参数的集合问题中. (2)集合的三种表示方法:列举法、描述法、图示法. (3)元素与集合的两种关系:属于,记为∈;不属于,记为∉. (4)五个特定的集合及其关系图:N *或N +表示正整数集,N 表示自然数集,Z 表示整数集,Q 表示有理数集,R 表示实数集.2.集合间的基本关系(1)子集:一般地,对于两个集合A ,B ,如果集合A 中任意一个元素都是集合B 中的元素,则称A 是B 的子集,记作A ⊆B (或B ⊇A ).(2)真子集:如果集合A 是集合B 的子集,但集合B 中至少有一个元素不属于A ,则称A 是B 的真子集,记作A B 或B A .A B ⇔⎩⎪⎨⎪⎧A ⊆B ,A ≠B .既要说明A 中任何一个元素都属于B ,也要说明B 中存在一个元素不属于A .(3)集合相等:如果A ⊆B ,并且B ⊆A ,则A =B .两集合相等:A =B ⇔⎩⎪⎨⎪⎧A ⊆B ,A ⊇B .A 中任意一个元素都符合B 中元素的特性,B 中任意一个元素也符合A 中元素的特性.(4)空集:不含任何元素的集合.空集是任何集合A 的子集,是任何非空集合B 的真子集.记作∅.∅∈{∅},∅⊆{∅},0∉∅,0∉{∅},0∈{0},∅⊆{0}.3.集合间的基本运算(1)交集:一般地,由属于集合A且属于集合B的所有元素组成的集合,称为A与B的交集,记作A∩B,即A∩B={x|x∈A,且x∈B}.(2)并集:一般地,由所有属于集合A或属于集合B的元素组成的集合,称为A与B的并集,记作A∪B,即A∪B={x|x∈A,或x∈B}.(3)补集:对于一个集合A,由全集U中不属于集合A的所有元素组成的集合称为集合A相对于全集U的补集,简称为集合A的补集,记作∁U A,即∁U A={x|x∈U,且x∉A}.求集合A的补集的前提是“A是全集U的子集”,集合A其实是给定的条件.从全集U中取出集合A的全部元素,剩下的元素构成的集合即为∁U A.二、常用结论(1)子集的性质:A⊆A,∅⊆A,A∩B⊆A,A∩B⊆B.(2)交集的性质:A∩A=A,A∩∅=∅,A∩B=B∩A.(3)并集的性质:A∪B=B∪A,A∪B⊇A,A∪B⊇B,A∪A=A,A∪∅=∅∪A=A.(4)补集的性质:A∪∁U A=U,A∩∁U A=∅,∁U(∁U A)=A,∁A A=∅,∁A∅=A.(5)含有n个元素的集合共有2n个子集,其中有2n-1个真子集,2n-1个非空子集.(6)等价关系:A∩B=A⇔A⊆B;A∪B=A⇔A⊇B.第二节命题及其关系、充分条件与必要条件一、基础知识1.命题的概念用语言、符号或式子表达的,可以判断真假的陈述句叫做命题.其中判断为真的语句叫做真命题,判断为假的语句叫做假命题.一个命题要么是真命题,要么是假命题,不能模棱两可.2.四种命题及其相互关系3.充分条件、必要条件与充要条件(1)如果p⇒q,则p是q的充分条件;①A是B的充分不必要条件是指:A⇒B且B A;②A的充分不必要条件是B是指:B⇒A且A B,在解题中要弄清它们的区别,以免出现错误.(2)如果q⇒p,则p是q的必要条件;(3)如果既有p⇒q,又有q⇒p,记作p⇔q,则p是q的充要条件.充要关系与集合的子集之间的关系设A={x|p(x)},B={x|q(x)},①若A⊆B,则p是q的充分条件,q是p的必要条件.②若A B,则p是q的充分不必要条件,q是p的必要不充分条件.③若A=B,则p是q的充要条件.二、常用结论1.四种命题中的等价关系原命题等价于逆否命题,否命题等价于逆命题,所以在命题不易证明时,往往找等价命题进行证明.2.等价转化法判断充分条件、必要条件p是q的充分不必要条件,等价于非q是非p的充分不必要条件.其他情况以此类推.第三节简单的逻辑联结词、全称量词与存在量词一、基础知识1.简单的逻辑联结词(1)命题中的“且”“或”“非”❶叫做逻辑联结词.①用联结词“且”把命题p和命题q联结起来,得到复合命题“p且q”,记作p∧q;②用联结词“或”把命题p和命题q联结起来,得到复合命题“p或q”,记作p∨q;③对命题p的结论进行否定,得到复合命题“非p”,记作非p.❷❶“且”的数学含义是几个条件同时满足,“且”在集合中的解释为“交集”;“或”的数学含义是至少满足一个条件,“或”在集合中的解释为“并集”;“非”的含义是否定,“非p”只否定p的结论,“非”在集合中的解释为“补集”.❷“命题的否定”与“否命题”的区别(1)命题的否定只是否定命题的结论,而否命题既否定其条件,也否定其结论.(2)命题的否定与原命题的真假总是相对立的,即一真一假,而否命题与原命题的真假无必然联系.(2)命题真值表:命题真假的判断口诀p∨q→见真即真,p∧q→见假即假,p与非p→真假相反.2.全称量词与存在量词3.全称命题与特称命题4.全称命题与特称命题的否定二、常用结论含逻辑联结词命题真假的等价关系(1)p∨q真⇔p,q至少一个真⇔(非p)∧(非q)假.(2)p∨q假⇔p,q均假⇔(非p)∧(非q)真.(3)p∧q真⇔p,q均真⇔(非p)∨(非q)假.(4)p∧q假⇔p,q至少一个假⇔(非p)∨(非q)真.。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
选修2-1知识点小结第一章《常用逻辑用语》(1)命题命题:可以判断真假的语句叫命题;逻辑联结词:“或”“且”“非”这些词就叫做逻辑联结词;简单命题:不含逻辑联结词的命题。
复合命题:由简单命题与逻辑联结词构成的命题。
常用小写的拉丁字母p,q,r,s,……表示命题,故复合命题有三种形式:p或q;p且q;非p。
(2)复合命题的真值“非p”形式复合命题的真假可以用下表表示:“p且q“p且q注:1°像上面表示命题真假的表叫真值表;2°由真值表得:“非p”形式复合命题的真假与p的真假相反;“p且q”形式复合命题当p与q同为真时为真,其他情况为假;“p或q”形式复合命题当p与q同为假时为假,其他情况为真;3°真值表是根据简单命题的真假,判断由这些简单命题构成的复合命题的真假,而不涉及简单命题的具体内容。
(3)四种命题如果第一个命题的条件是第二个命题的结论,且第一个命题的结论是第二个命题的条件,那么这两个命题叫做互为逆命题;如果一个命题的条件和结论分别是原命题的条件和结论的否定,那么这两个命题叫做互否命题,这个命题叫做原命题的否命题;如果一个命题的条件和结论分别是原命题的结论和条件的否定,那么这两个命题叫做互为逆否命题,这个命题叫做原命题的逆否命题。
两个互为逆否命题的真假是相同的,即两个互为逆否命题是等价命题.若判断一个命题的真假较困难时,可转化为判断其逆否命题的真假。
(4)条件一般地,如果已知p⇒q,那么就说:p是q的充分条件;q是p的必要条件。
可分为四类:(1)充分不必要条件,即p⇒q,而q⇒p;(2)必要不充分条件,即p⇒q,而q⇒p;(3)既充分又必要条件,即p⇒q,又有q⇒p;(4)既不充分也不必要条件,即p⇒q,又有q⇒p。
一般地,如果既有p⇒q,又有q⇒p,就记作:p⇔q.“⇔”叫做等价符号。
p⇔q表示p⇒q且q⇒p。
这时p既是q的充分条件,又是q的必要条件,则p是q的充分必要条件,简称充要条件。
(5)全称命题与特称命题这里,短语“所有”在陈述中表示所述事物的全体,逻辑中通常叫做全称量词,并用符号∀表示。
含有全体量词的命题,叫做全称命题。
短语“有一个”或“有些”或“至少有一个”在陈述中表示所述事物的个体或部分,逻辑中通常叫做存在量词,并用符号∃表示,含有存在量词的命题,叫做存在性命题。
注意:1.一个语句是否为命题,关键要看能否判断真假,陈述句、反诘问句都是命题,而祁使句、疑问句、感叹句都不是命题;2.判断命题的真假要以真值表为依据。
原命题与其逆否命题是等价命题,逆命题与其否命题是等价命题,一真俱真,一假俱假,当一个命题的真假不易判断时,可考虑判断其等价命题的真假;3.判断命题充要条件的三种方法:(1)定义法;(2)利用集合间的包含关系判断,若BA⊆,则A 是B的充分条件或B是A的必要条件;若A=B,则A是B的充要条件;(3)等价法:即利用等价关系"ABBA"⇒⇔⇒判断,对于条件或结论是不等关系(或否定式)的命题,一般运用等价法;第二章《圆锥曲线与方程》一.曲线方程步骤含义说明1、“建”:建立坐标系;“设”:设动点坐标。
建立适当的直角坐标系,用(x,y)表示曲线上任意一点M的坐标。
(1)所研究的问题已给出坐标系,即可直接设点。
(2)没有给出坐标系,首先要选取适当的坐标系。
2、现(限):由限制条件,列出几何等式。
写出适合条件P的点M的集合P={M|P(M)}这是求曲线方程的重要一步,应仔细分析题意,使写出的条件简明正确。
3、“代”:代换用坐标法表示条件P(M),列出方程f(x,y)=0常常用到一些公式。
4、“化”:化简化方程f(x,y)=0为最简形式。
要注意同解变形。
5、证明证明化简以后的方程的解为坐标的点都是曲线上的点。
化简的过程若是方程的同解变形,可以不要证明,变形过程中产生不增根或失根,应在所得方程中删去或补上(即要注意方程变量的取值范围)。
(2)求曲线方程的常见方法:直接法:也叫“五步法”,即按照求曲线方程的五个步骤来求解。
这是求曲线方程的基本方法。
转移代入法:这个方法又叫相关点法或坐标代换法。
即利用动点是定曲线上的动点,另一动点依赖于它,那么可寻求它们坐标之间的关系,然后代入定曲线的方程进行求解。
几何法:就是根据图形的几何性质而得到轨迹方程的方法。
参数法:根据题中给定的轨迹条件,用一个参数来分别动点的坐标,间接地把坐标x,y联系起来,得到用参数表示的方程。
如果消去参数,就可以得到轨迹的普通方程。
待定系数法2.圆锥曲线综合问题(1)圆锥曲线中的最值问题、范围问题通常有两类:一类是有关长度和面积的最值问题;一类是圆锥曲线中有关的几何元素的最值问题。
这些问题往往通过定义,结合几何知识,建立目标函数,利用函数的性质或不等式知识,以及观形、设参、转化、替换等途径来解决。
解题时要注意函数思想的运用,要注意观察、分析图形的特征,将形和数结合起来。
圆锥曲线的弦长求法:设圆锥曲线C∶f(x,y)=0与直线l∶y=kx+b相交于A(x1,y1)、B(x2,y2)两点,则弦长|AB|为:若弦AB过圆锥曲线的焦点F,则可用焦半径求弦长,|AB|=|AF|+|BF|.在解析几何中求最值,关键是建立所求量关于自变量的函数关系,再利用代数方法求出相应的最值.注意点是要考虑曲线上点坐标(x,y)的取值范围。
(2)对称、存在性问题,与圆锥曲线有关的证明问题它涉及到线段相等、角相等、直线平行、垂直的证明方法,以及定点、定值问题的判断方法。
(3)实际应用题数学应用题是高考中必考的题型,随着高考改革的深入,同时课本上也出现了许多与圆锥曲线相关的实际应用问题,如桥梁的设计、探照灯反光镜的设计、声音探测,以及行星、人造卫星、彗星运行轨道的计算等。
涉及与圆锥曲线有关的应用问题的解决关键是建立坐标系,合理选择曲线模型,然后转化为相应的数学问题作出定量或定性分析与判断,解题的一般思想是:实际问题模型的解数学模型方程讨论方程的解翻译回去建立坐标系转化成数学问题(4)知识交汇题圆锥曲线经常和数列、三角、平面向量、不等式、推理知识结合到一块出现部分有较强区分度的综合题。
2.直线与圆锥曲线的位置关系1.点M(x0,y0)与圆锥曲线C:f(x,y)=0的位置关系二.直线与圆锥曲线的位置关系(1)直线与圆锥曲线的位置关系,从几何角度可分为三类:无公共点,仅有一个公共点及有两个相异公共点。
(2)直线与圆锥曲线的位置关系的研究方法可通过代数方法即解方程组的办法来研究。
因为方程组解的个数与交点的个数是一样的。
直线与圆锥曲线的位置关系可分为:相交、相切、相离.对于抛物线来说,平行于对称轴的直线与抛物线相交于一点,但并不是相切;对于双曲线来说,平行于渐近线的直线与双曲线只有一个交点,但并不相切.这三种位置关系的判定条件可引导学生归纳为:注意:直线与抛物线、双曲线有一个公共点是直线与抛物线、双曲线相切的必要条件,但不是充分条件. 3.直线与圆锥曲线相交的弦长公式设直线l :y=kx+n ,圆锥曲线:F(x,y)=0,它们的交点为P 1 (x 1,y 1),P 2 (x 2,y 2),且由⎩⎨⎧+==nkx y y x F 0),(,消去y →ax 2+bx+c=0(a ≠0),Δ=b 2-4ac 。
则弦长公式为:d=221221)()(y y x x -+-=2212))(1(x x k -+=22)1(a k Δ+=Δ||)1(2a k +。
焦点弦长:||PF e d=(点P 是圆锥曲线上的任意一点,F 是焦点,d 是P 到相应于焦点F 的准线的距离,e 是离心率)。
三、圆锥曲线方程及性质1.椭圆(1)椭圆概念平面内与两个定点1F 、2F 的距离的和等于常数(大于21||F F )的点的轨迹叫做椭圆。
这两个定点叫做椭圆的焦点,两焦点的距离叫椭圆的焦距。
若M 为椭圆上任意一点,则有21||||2MF MF a +=。
椭圆的标准方程为:22221x y a b +=(0a b >>)(焦点在x 轴上)或12222=+bx a y (0a b >>)(焦点在y 轴上)。
注:①以上方程中,a b 的大小0a b >>,其中222c a b =-;②在22221x y a b +=和22221y x a b+=两个方程中都有0a b >>的条件,要分清焦点的位置,只要看2x 和2y 的分母的大小。
例如椭圆221x y m n+=(0m >,0n >,m n ≠)当m n >时表示焦点在x 轴上的椭圆;当m n <时表示焦点在y 轴上的椭圆。
(2)椭圆的性质①范围:由标准方程22221x y a b+=知||x a ≤,||y b ≤,说明椭圆位于直线x a =±,y b =±所围成的矩形里;②对称性:在曲线方程里,若以y -代替y 方程不变,所以若点(,)x y 在曲线上时,点(,)x y -也在曲线上,所以曲线关于x 轴对称,同理,以x -代替x 方程不变,则曲线关于y 轴对称。
若同时以x -代替x ,y -代替y 方程也不变,则曲线关于原点对称。
所以,椭圆关于x 轴、y 轴和原点对称。
这时,坐标轴是椭圆的对称轴,原点是对称中心,椭圆的对称中心叫椭圆的中心;③顶点:确定曲线在坐标系中的位置,常需要求出曲线与x 轴、y 轴的交点坐标。
在椭圆的标准方程中,令0x =,得y b =±,则1(0,)B b -,2(0,)B b 是椭圆与y 轴的两个交点。
同理令0y =得x a =±,即1(,0)A a -,2(,0)A a 是椭圆与x 轴的两个交点。
所以,椭圆与坐标轴的交点有四个,这四个交点叫做椭圆的顶点。
同时,线段21A A 、21B B 分别叫做椭圆的长轴和短轴,它们的长分别为2a 和2b ,a 和b 分别叫做椭圆的长半轴长和短半轴长。
由椭圆的对称性知:椭圆的短轴端点到焦点的距离为a ;在22Rt OB F ∆中,2||OB b =,2||OF c =,22||B F a =,且2222222||||||OF B F OB =-,即222c a c =-;④离心率:椭圆的焦距与长轴的比ce a=叫椭圆的离心率。
∵0a c >>,∴01e <<,且e 越接近1,c 就越接近a ,从而b 就越小,对应的椭圆越扁;反之,e 越接近于0,c 就越接近于0,从而b 越接近于a ,这时椭圆越接近于圆。
当且仅当a b =时,0c =,两焦点重合,图形变为圆,方程为222x y a +=。
2.双曲线(1)双曲线的概念平面上与两点距离的差的绝对值为非零常数的动点轨迹是双曲线(12||||||2PF PF a -=)。
