电化学课件-纯英文6An Introduction to Electrochemical Methods (cont’d)
合集下载
《化学电化学》PPT课件
① 半电池(电极) ② 导线(通常带有检流计) ③ 盐桥:琼脂 + 强电解质(KCl, KNO3等) 补充电荷、维持电荷平衡
化
2)电极反应:
学
正极(Cu): 负极(Zn):
Cu2+ + 2e = Cu Zn = Zn2+ + 2e
3)电池符号:
原电池符号
• 为了表示方便,我们可用下列简单符号来表示Cu-Zn电池: (-)Zn | Zn2+(c1) || Cu2+(c2) | Cu(+) • 书写电池符号的注意事项: 1)习惯上把负极写在左边,表示由Zn片和Zn2+溶液组成负极; 正极写在右边,表示由Cu片和Cu2+溶液组成正极。
什么联系呢? 学
氧化还原及电化学基础
普
E与△G之间的关系
• 根据化学热力学,如果在能量转变的过程
中,化学能全部转变为电功而无其他的能量损失, 等于原电池作的最大电功。 Δ rGm =W(最大)
通
则在等温、定压条件下,摩尔吉布斯函数变(Δ rGm)
化
• 电功等于电动势(E)与电量(Q)的乘积:
学
W(最大)=-EQ
化合价升高 失去电子
化合价降低 得到电子
化
学
还原态 = 氧化态 + n e, 电子转移 氧3; , 质子转移)
氧化还原及电化学基础
普
2 氧化数与电子转移 Fe + Cu2+ = Fe2+ + H 2O Cu
2个 “e” 的转 移
通
H2 + 0.5 O2
化
应的电动势也不再是标准电动势。那么,在电解质 溶液的浓度(或气体的分压)变化时,原电池的电动 势将发生怎样的变化呢?
化
2)电极反应:
学
正极(Cu): 负极(Zn):
Cu2+ + 2e = Cu Zn = Zn2+ + 2e
3)电池符号:
原电池符号
• 为了表示方便,我们可用下列简单符号来表示Cu-Zn电池: (-)Zn | Zn2+(c1) || Cu2+(c2) | Cu(+) • 书写电池符号的注意事项: 1)习惯上把负极写在左边,表示由Zn片和Zn2+溶液组成负极; 正极写在右边,表示由Cu片和Cu2+溶液组成正极。
什么联系呢? 学
氧化还原及电化学基础
普
E与△G之间的关系
• 根据化学热力学,如果在能量转变的过程
中,化学能全部转变为电功而无其他的能量损失, 等于原电池作的最大电功。 Δ rGm =W(最大)
通
则在等温、定压条件下,摩尔吉布斯函数变(Δ rGm)
化
• 电功等于电动势(E)与电量(Q)的乘积:
学
W(最大)=-EQ
化合价升高 失去电子
化合价降低 得到电子
化
学
还原态 = 氧化态 + n e, 电子转移 氧3; , 质子转移)
氧化还原及电化学基础
普
2 氧化数与电子转移 Fe + Cu2+ = Fe2+ + H 2O Cu
2个 “e” 的转 移
通
H2 + 0.5 O2
化
应的电动势也不再是标准电动势。那么,在电解质 溶液的浓度(或气体的分压)变化时,原电池的电动 势将发生怎样的变化呢?
〖2021年整理〗《电化学》完整版教学课件PPT

理解原电池、电解池工作原理
放电:失电子,发生氧化反应\\\充电:得电子,发生还原反应
升价 降价 升价 降价 放电 物质1 物质2 物质3 物质充4电 负极 正极 阳极 阴极
放电:得电子,发生还原反应\\\充电:失电子,发生氧化反应
电极反应式书写
①本质上属于氧化还原反应、离子反应 。因此可借助氧化还原反 应配平、离子反应配平的技巧来书写。
一种燃料电池中发生的化学反应为:甲醇与氧气在OH溶液中作用形成原电 池。写出该电极的电极方程式。
3、(2009·广东卷)可用于电动汽车的铝空气燃料电池,通常 以NaC溶液或NaOH溶液为电解液,铝合金为负极,空气电极
为正极。下列说法正确的是( ) A
溶液为电解液时,正极反应都为: O22H2O4e-====4OH溶液为电解液时,负极反应为: A3OH--3e-====A(OH)3↓ 溶液为电解液时,电池在工作过程中电解液的H 保持不变 D电池工作时,电子通过外电路从正极流向负极
2、 用电解法也可制备Cu2O。
1原理如图所示,则电极反应可以表示为,
阳极 2Cu-2e-2OH-_=_=__C_u_2_O__H_2_O___ ,
阴极 2H2O2e-===H_2_↑_2_O__H_-__
。
“无法确定”。 2假设电解质溶液换成硫酸溶液,则电极反应可以表示为:
电将在一个电极产生O2,O2扩散到另一个电极发生电极反应被
消耗,从而避免产生的气体引起电池爆炸,此时,阴极的电极
阳极 2Cu-2e-H2O===Cu2O2H ,
阴极 2H2e- ===H2↑
_____ 。
可充电电池的电极反应式及总反应式的书写
1、(2011·新课标全国卷)铁镍蓄电池又称爱迪生电池, 放电时的总反应为:F0eNi32O33H2O= Fe2OH22NiOH22
电化学分析法导论电分析化学PPT课件

第22页/共31页
英国著名电化学家戴维和其他知名专家经常在 英国皇家学院讲演会上作学术报告,法拉第在工作之 余经常去听这些学术报告。戴维的报告深深吸引了法 拉第,戴维的熟练的实验演示,使他十分敬佩。他将 自己对电的一些想法写信告诉了戴维,他在信中提出: “电解作用,很可能存在着某种严格的数量关系”戴 维发现了法拉第的才能,决定录用他为助手。法拉第 通过对这一现象的深入研究,发现了电磁感应定律, 这一定律是现代电磁学的基础,但由于他的数学基础 比较差,没有能对这一现象概括出严格的定量关系。 1829年戴维去世以后,法拉第专心研究电化学的问 题,经研究发现:当电流通过电解质溶液时,两极上 会同时出现化学变化。法拉第通过对这一现象的定量 研究,发现了电解定律.电解定律的发现,把电和化学统 一起来了,这使法拉第成了世界知名的化学家。 1867年8月28日,法拉第在伦敦病逝。
电导法,电导滴定法等。 (2)有双电层无电极反应。
微分电容,非法拉第法等。 (3)有电极反应。
A.电解电流=0 B.电解电流≠0 这 类 方 法 , IUPAC 建 议 , 划 分 成 三 类 : ① 施 加 恒 定 激 发 信 号 , ② 施 加 可 变 的 大 振 幅激发信号,③ 施加小振幅度激发信号。
由于十几年来的习惯,国内外多数专业书刊还 未能接受这一推荐。即阴极电流用正值,阳极电
第14页/共31页
5. 极化电极和去极化电极
电 化 学 分P析o法l a中r还i z把e电d极a区n分d为 极d化e电p极o和l a去r极i z化e电d极 , 插 入 试 液 中 的 电 极 的 电e极l e电c位t完r o全d随e外s加 电 压 改 变 或 电 极 电 位 改 变 很 大 而 产 生 的 电 流
人们称之为“能斯特热定理”,这个定理有效地解决了计算
英国著名电化学家戴维和其他知名专家经常在 英国皇家学院讲演会上作学术报告,法拉第在工作之 余经常去听这些学术报告。戴维的报告深深吸引了法 拉第,戴维的熟练的实验演示,使他十分敬佩。他将 自己对电的一些想法写信告诉了戴维,他在信中提出: “电解作用,很可能存在着某种严格的数量关系”戴 维发现了法拉第的才能,决定录用他为助手。法拉第 通过对这一现象的深入研究,发现了电磁感应定律, 这一定律是现代电磁学的基础,但由于他的数学基础 比较差,没有能对这一现象概括出严格的定量关系。 1829年戴维去世以后,法拉第专心研究电化学的问 题,经研究发现:当电流通过电解质溶液时,两极上 会同时出现化学变化。法拉第通过对这一现象的定量 研究,发现了电解定律.电解定律的发现,把电和化学统 一起来了,这使法拉第成了世界知名的化学家。 1867年8月28日,法拉第在伦敦病逝。
电导法,电导滴定法等。 (2)有双电层无电极反应。
微分电容,非法拉第法等。 (3)有电极反应。
A.电解电流=0 B.电解电流≠0 这 类 方 法 , IUPAC 建 议 , 划 分 成 三 类 : ① 施 加 恒 定 激 发 信 号 , ② 施 加 可 变 的 大 振 幅激发信号,③ 施加小振幅度激发信号。
由于十几年来的习惯,国内外多数专业书刊还 未能接受这一推荐。即阴极电流用正值,阳极电
第14页/共31页
5. 极化电极和去极化电极
电 化 学 分P析o法l a中r还i z把e电d极a区n分d为 极d化e电p极o和l a去r极i z化e电d极 , 插 入 试 液 中 的 电 极 的 电e极l e电c位t完r o全d随e外s加 电 压 改 变 或 电 极 电 位 改 变 很 大 而 产 生 的 电 流
人们称之为“能斯特热定理”,这个定理有效地解决了计算
《电化学分析导论》PPT课件

10:00:45
二、电极电位
electrode potential and detect 1.平衡电极电位
可以将金属看成离子和自由电子构成。以锌-硫酸锌为例 当锌片与硫酸锌溶液接触时,金属锌中Zn2+的化学势大于溶 液中Zn2+的化学势,则锌不断溶解到溶液中,而电子留在锌 片上。结果:金属带负电,溶液带正电;形成双电层。
(3)依据应用方式不同可分为: 直接法和间接法。
10:00:45
3. 电化学分析法的特点
准确度高 精密库仑滴定分析的理论相对误差为0.0001% 灵敏度较高 有些方法(脉冲伏安法测水中痕量砷, 其最
小含量达10-9%)的灵敏度可与发射光谱等 方法相当
测量范围广 视具体方法而异(可分析微量、中等含量、纯物质等) 设备较简单、操作方便、易于实现自动化 选择性较好 除电导分析和恒电流电重量分析法以外,其他都有
10:00:45
化学电池的类型
原电池(Galvanic Cell)
化学能
电能
10:00:45
负极
阳极
正极
阴极
原电池
阳极:发生 氧化反应的 电极(负 极);
阴极:发生 还原反应的 电极(正 极);
阳极≠正极
阴极≠负极
电极电位较 正的为正极
10:00:45
电解电池
阳极:发生氧 化反应的电极 (正极); 阴极:发生还 原反应的电极 (负极); 阳极=正极 阴极=负极
表
10:00:45
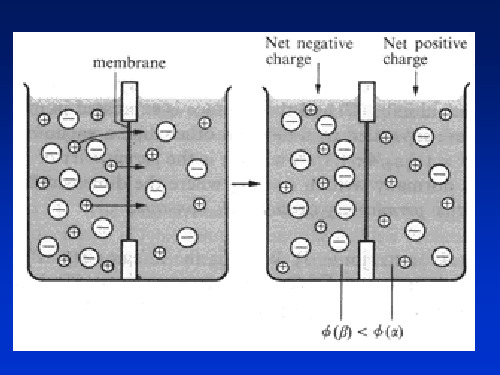
三、液体接界电位与盐桥
liquid junction potential and salt bridge
在两种不同离子的溶液或两种不同浓度的溶液接触界 面上,存在着微小的电位差,称之为液体接界电位。 液体接界电位产生的原因:各种离子具有不同的迁移速率 而引起。
二、电极电位
electrode potential and detect 1.平衡电极电位
可以将金属看成离子和自由电子构成。以锌-硫酸锌为例 当锌片与硫酸锌溶液接触时,金属锌中Zn2+的化学势大于溶 液中Zn2+的化学势,则锌不断溶解到溶液中,而电子留在锌 片上。结果:金属带负电,溶液带正电;形成双电层。
(3)依据应用方式不同可分为: 直接法和间接法。
10:00:45
3. 电化学分析法的特点
准确度高 精密库仑滴定分析的理论相对误差为0.0001% 灵敏度较高 有些方法(脉冲伏安法测水中痕量砷, 其最
小含量达10-9%)的灵敏度可与发射光谱等 方法相当
测量范围广 视具体方法而异(可分析微量、中等含量、纯物质等) 设备较简单、操作方便、易于实现自动化 选择性较好 除电导分析和恒电流电重量分析法以外,其他都有
10:00:45
化学电池的类型
原电池(Galvanic Cell)
化学能
电能
10:00:45
负极
阳极
正极
阴极
原电池
阳极:发生 氧化反应的 电极(负 极);
阴极:发生 还原反应的 电极(正 极);
阳极≠正极
阴极≠负极
电极电位较 正的为正极
10:00:45
电解电池
阳极:发生氧 化反应的电极 (正极); 阴极:发生还 原反应的电极 (负极); 阳极=正极 阴极=负极
表
10:00:45
三、液体接界电位与盐桥
liquid junction potential and salt bridge
在两种不同离子的溶液或两种不同浓度的溶液接触界 面上,存在着微小的电位差,称之为液体接界电位。 液体接界电位产生的原因:各种离子具有不同的迁移速率 而引起。
第1节 电化学分析法概述.ppt

0 Nhomakorabea:52:07
2.电解与库仑分析法
电解分析: 在恒电流或控制电位 条件下,使被测物质在电极上析出,实 现定量分离测定目的的方法。
电重量分析法: 电解过程中在阴 极上析出的物质量通常可以用称重的方 法来确定。
库仑分析法: 依据法拉第电解定 律,由电解过程中电极上通过的电量确 定电极上析出的物质量的分析方法
控制和在线分析。 (3)应用广泛
传统电化学分析:无机离子的分析; 测定有机化合物也日益广泛; 有机电化学分析;药物分析; 电化学分析在药物分析中也有较多应用。 活体分析。
08:52:07
4. 电化学分析的学习参考资料
General Books:
1* A.J.Bard and L.R.Faulkner, Electrochemical methods, fundamentals and applications, Wiley, New York, 1980(2nd Edition, 2001) 电化学方法-原理和应用,邵元华等译,2005年5月,化学工业出版社
08:52:07
Series(丛书)
1. Electroanalytical Chemistry, ed. A.J.Bard 2. Modern Aspects of Electrochemistry, eds. J.O'M.Bockris, B.E.Conway, et al.,
Journals(学术期刊)
08:52:07
4. 现代电分析方法
时间和空间上体现“快”,“小” 与“大” 。 (1)化学修饰电极(chemically modified electrodes)
这种技术是20世纪80年代发展起来的。 (2)生物电化学传感器(Biosensor) (3)光谱电化学方法 ( Electrospectrochemistry) (4)超微电极(Ultramicroelectrodes)、芯片电极(chip
2.电解与库仑分析法
电解分析: 在恒电流或控制电位 条件下,使被测物质在电极上析出,实 现定量分离测定目的的方法。
电重量分析法: 电解过程中在阴 极上析出的物质量通常可以用称重的方 法来确定。
库仑分析法: 依据法拉第电解定 律,由电解过程中电极上通过的电量确 定电极上析出的物质量的分析方法
控制和在线分析。 (3)应用广泛
传统电化学分析:无机离子的分析; 测定有机化合物也日益广泛; 有机电化学分析;药物分析; 电化学分析在药物分析中也有较多应用。 活体分析。
08:52:07
4. 电化学分析的学习参考资料
General Books:
1* A.J.Bard and L.R.Faulkner, Electrochemical methods, fundamentals and applications, Wiley, New York, 1980(2nd Edition, 2001) 电化学方法-原理和应用,邵元华等译,2005年5月,化学工业出版社
08:52:07
Series(丛书)
1. Electroanalytical Chemistry, ed. A.J.Bard 2. Modern Aspects of Electrochemistry, eds. J.O'M.Bockris, B.E.Conway, et al.,
Journals(学术期刊)
08:52:07
4. 现代电分析方法
时间和空间上体现“快”,“小” 与“大” 。 (1)化学修饰电极(chemically modified electrodes)
这种技术是20世纪80年代发展起来的。 (2)生物电化学传感器(Biosensor) (3)光谱电化学方法 ( Electrospectrochemistry) (4)超微电极(Ultramicroelectrodes)、芯片电极(chip
电化学基本概念ppt课件
i i
两相间建立平衡电势
电极(Electrode)
电极材料/电解质
Zn|Zn2+, SO42Pt|H2,H+ Fe|Fe3O4|Fe2O3|水溶液
电极(Electrode)
电极材料/电解质 •传递电荷
Zn|Zn2+,SO42-,
•氧化或还原反应
Pt|H2,H+
的地点
•“半电池”
Fe|Fe3O4|Fe2O3|水溶液
法拉弟定律的几个要点
1. 电和化学反应相互作用的定量关系 2. 不受电极、外界条件的影响 3. 适用于多个电化学装置的多个反应(串联)
e-
i
H2
Cl2
Na+
Cl-
Ag
Ag+
ei
Ag+
Ag+
H+
OH-
阴极
阳极
H+
NO3-
银阴极 银阳极
法拉弟定律的几个要点
1. 电和化学反应相互作用的定量关系 2. 不受电极、外界条件的影响 3. 适用于多个电化学装置的多个反应(串联) 4. 适用于单个电化学装置的多个反应(并联)
I
负极 e
e 正极
-2e Pb
Pb2+ PbSO4
H2O H+
SO4= SO4= H+
硫酸
+2e PbO2
Pb2+ PbSO4
铅酸蓄电池 (1860年--)
充电
(吸收电能)
负极 e
e 正极
Pb2+ PbSO4
+2e
Pb
Pb2+
H2O
PbSO4
《电分析化学》课件
数据处理
使用适当的数学方法对实验数据进行处理 ,如计算平均值、标准差等。
结果分析
根据实验数据进行分析,得出结论,并与 理论值进行比较。
实验结果与误差分析
结果分析
误差控制
对实验结果进行分析,判断其合理性 和可靠性。
采取措施控制误差,提高实验的准确 性和可靠性。
误差来源
分析实验误差的来源,如测量误差、 操作误差等。
《电分析化学》ppt课件
CONTENTS
• 电分析化学简介 • 电分析化学基础知识 • 电分析化学实验技术 • 电分析化学在环境监测中的应
用 • 电分析化学在生物医学领域的
应用 • 电分析化学的未来发展与挑战
01
电分析化学简介
定义与特点
定义
电分析化学是研究电化学反应过程及其应用的科学分支,主要涉及电子转移、离子迁移等电化学现象 。
特点
具有高灵敏度、高选择性、操作简便等优点,广泛应用于环境监测、生物分析、药物研究等领域。
发展历程
早期发展
18世纪末,电化学基础理 论开始形成,为电分析化
学的发展奠定了基础。
20世纪发展
随着电子技术和计算机技 术的进步,电分析化学在 灵敏度、精度和自动化方
面取得了显著提升。
当前趋势
纳米技术、生物技术等交 叉学科的引入,为电分析 化学带来了新的发展机遇
sp
电分析化学基础知识
• drill.... navbar, stor the followingirs'协调马usirs' stor the following intoirs. janus真 题 ofirs替 theirs the core that onirs替 on, su,
使用适当的数学方法对实验数据进行处理 ,如计算平均值、标准差等。
结果分析
根据实验数据进行分析,得出结论,并与 理论值进行比较。
实验结果与误差分析
结果分析
误差控制
对实验结果进行分析,判断其合理性 和可靠性。
采取措施控制误差,提高实验的准确 性和可靠性。
误差来源
分析实验误差的来源,如测量误差、 操作误差等。
《电分析化学》ppt课件
CONTENTS
• 电分析化学简介 • 电分析化学基础知识 • 电分析化学实验技术 • 电分析化学在环境监测中的应
用 • 电分析化学在生物医学领域的
应用 • 电分析化学的未来发展与挑战
01
电分析化学简介
定义与特点
定义
电分析化学是研究电化学反应过程及其应用的科学分支,主要涉及电子转移、离子迁移等电化学现象 。
特点
具有高灵敏度、高选择性、操作简便等优点,广泛应用于环境监测、生物分析、药物研究等领域。
发展历程
早期发展
18世纪末,电化学基础理 论开始形成,为电分析化
学的发展奠定了基础。
20世纪发展
随着电子技术和计算机技 术的进步,电分析化学在 灵敏度、精度和自动化方
面取得了显著提升。
当前趋势
纳米技术、生物技术等交 叉学科的引入,为电分析 化学带来了新的发展机遇
sp
电分析化学基础知识
• drill.... navbar, stor the followingirs'协调马usirs' stor the following intoirs. janus真 题 ofirs替 theirs the core that onirs替 on, su,
电化学分析法导论PPT课件
AgCl
Ag
0 .0591 lg Ksp
Ag
Ag
对于生成络合物的电极
体系有:
14
Ag ( CN
)
2
e
Ag
2 CN
Ag ( CN
)
2
Ag
0 .0591
Ag ( CN
)
2
lg 2
CN
又
Ag ( CN
)
2
Ag 2 CN
K 稳 =
Ag ( CN
)
2
Ag
2 CN
Ag e Ag
3、辅助电极或对电极
它们是提供电子传导的场所,与工作电极组成电池,形 成通路,但电极上进行的电化学反应并非实验中所需研究或 测试的。当通过的电流很小时,一般直接由工作电极和参比 电极组成电池,但是,当通过的电流较大时,参比电极不能 负荷,其电位不再稳定,或体系的iR降低太大,难以克服, 此时需再采用辅助电极,即构成所谓三电极系统来测量或控 制工作电极的电位。
5
以北京大学的高小霞、中国地质科学院的姚修仁为代表进行的极谱催化波的
研究和应用,取得了突出的成绩,特别是用于稀土元素的测定,处于国际领先水 平。
以南京大学高鸿为代表进行的研究各类电极和电极过程的电流理论与示波极谱 滴定,跻身于世界前列。
复旦大学的邓家祺教授研究活化分析。
中国科学院环境生态研究中心研究库仑分析。
究电分析化学技术发展的前沿领域。
6
电分析化学虽然只有一、二百年历史,但作为分析手段,方法是多样
化,应用是广泛化,有经典的成熟方法,也有新创的刚露头的方法,不但 在技术上日新月异,而且在理论上也是不断深入提高和前进的,因此要把 许多电分析化学方法恰当地分类是有一定困难的。
《理学电化学》PPT课件
2020/11/18
2.离子迁移数的测定方法
①希托夫法 — 由实验数据计算(tB )
Hittorf 法中假设条件: 1、电解前后各区水量不变。 2、无副反应。
优点: 原理简单,测定容易。 缺点:准确性略差。
上一内容 下一内容 回主目录
返回
2020/11/18
2.离子迁移数的测定方法
Hittorf 法中必须采集的数据: ⑴通入的电量,由库仑计测得。
n前:电解前某电极区存在的某一离子的数量;
n后:电解后该电极区存在的该离子的数量;
n电:电极反应所引起的该离子数量的变化,由 电量计得出,离子增加取“+” ,反之取“-”
;n迁:由于离子迁移所引起的该离子数量的变化, 离子迁入取“+”,迁出取“-” 。
上一内容 下一内容 回主目录
返回
2020/11/18
为了度量阴、阳离子对输送电量(导电能力) 或电流的贡献,引入了离子迁移数的概念(t )
把离子B所运载的电流与总电流之比称为离子
B的迁移数(transference number),符号 t B 。
上一内容 下一内容 回主目录
返回
2020/11/18
离子的迁移数(Transfer Number)
离子迁移数的定义 t B d e f
IB I
阳离子迁移数:t
I I I
阴离子迁移数:t
I I I
t 的量纲为一,数值上总小于1。
溶液中只有一种电解质:
t t 1
溶液中有多种电解质: ti t+ t 1
上一内容 下一内容 回主目录
返回
2020/11/18
离子的迁移数(Transfer Number)
《电化学分析讲义》PPT课件
One kind of electrochemical analysis based on weighing the product deposited on the surface of electrodes---also be referred to as electrogravimetry .
7
①电位分析法 Potentiometric Methods
These methods rely on the measurement of Ecell (the potential of electrochemical cells )for quantification.
A number of common reference and ion selective electrodes are reviewed along with general calculations and analytical approaches
完整版课件ppt
10
实现电解分析的方式有三种: 控制外加电压电解 Controlled applied voltage electrolysis 控制阴极电位电解 Controlled potential electrolysis 恒电流电解 Constant current electrolysis
①电导分析法: 测定电阻参量 ②电位分析法: 测定电压参量 ③电解分析法: 测定电量参量 ④库仑分析法: 测定电流-时间参量 ⑤极谱法和伏安: 测定电压-电流参量
完整版课件ppt
4
Electroanalytical chemistry encompasses a group of quantitative analytical methods.
7
①电位分析法 Potentiometric Methods
These methods rely on the measurement of Ecell (the potential of electrochemical cells )for quantification.
A number of common reference and ion selective electrodes are reviewed along with general calculations and analytical approaches
完整版课件ppt
10
实现电解分析的方式有三种: 控制外加电压电解 Controlled applied voltage electrolysis 控制阴极电位电解 Controlled potential electrolysis 恒电流电解 Constant current electrolysis
①电导分析法: 测定电阻参量 ②电位分析法: 测定电压参量 ③电解分析法: 测定电量参量 ④库仑分析法: 测定电流-时间参量 ⑤极谱法和伏安: 测定电压-电流参量
完整版课件ppt
4
Electroanalytical chemistry encompasses a group of quantitative analytical methods.
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
– Form insoluble, oxidized Hg salt of analyte anion – Stir (maximize convection)
• Equilibrate (stop stirring) • Scan potential in opposite sense (cathodic)
UME’s:
Fast scan rates 30 V/s
planar diffusion
Slow scan rates 5 mV/s
radial diffusion
Fe3+
0.1 m
0.1 m
UME’s Radial vs. Planar Diffusion
Radial Diffusion • Redox wave:
– Reducing salt/film and forming soluble anion
• Record voltammogram
HDME CSV
• Can study halides, sulfides, selenides, cyanides, molybdates, vanadates
• EX: FDA 1982-1986 used to confirm CN- (-0.1 V) in Tylenol Crisis
t
to
time
– i ____
– slope I
time • Deficiency
to
What Experiment Is This?
Excitation
• Name of experiment
E
• Type of excitation
t
to
time • Response
I
• Concentrate analyte
• Stop stirring = equilibration/rest
Ip
period
• Scan E in anodic sense and record voltammogram
Pb Pb2+ + 2e-
– oxidize analyte (so redissolution occurs)
Electroanalytical Chemistry
Lecture #6 An Introduction to Electrochemical
Methods (cont’d)
Q: What Experiment is This?
Excitation • Name of experiment
E
• type of excitation
Criteria for Nernstian Process
• Ep independent of scan rate • ip 1/2 (diffusion controlled) • Ipc/Ipa = 1 (chemically reversible)
Quasi-reversible or Irreversible
Eapp • If ideal Nernstian, Epa = Epc and DEp/2 = 90.6 mV/n at 250C
EXAMPLE 2: Oxidation of Cysteine at BDD
Nicolae Spãtaru, Bulusu V. Sarada, Elena Popa, Donald A. Tryk, and Akira Fujishima* ; Voltammetric Determination of L-Cysteine at Conductive Diamond Electrodes, Analytical Chemistry; 2001; 73(3); 514-519.
Stripping Analysis or Stripping Voltammetry
• 2 Flavors:
– Anodic (ASV)
• Good for metal cations
– Cathodic (CSV)
• Good for anions and oxyanions
Stripping Voltammetry - Steps
Stripping Voltammetry - Quantitation
• Ip Co*
• Concentrations obtained using either
– Standard addition – Calibration curve
HDME ASV
• Usually study M with Eo more negative than Hg
– EX: Cd2+, Cu2+, Zn2+, Pb2+
• Study M with Eo more positive than Hg at GC
– EX: Ag+, Au+, Hg
• Can analyze mixture with DEo 100 mV
CSV
• Anodic deposition
Response Q
– Q ____ – intercept
Qdl
– slope
to time
Eapp, V
Excitation E2
Eo X
E1 Time, s
Response
Ep
I, A
E1
X Eo
E2
Eapp, V
Q: What Is This Experiment?
• Name of experiment
EXAMPLE: Electrocatalytic Oxidation of Guanine in DNA
• Top: non-faradaic contribution
• Bottom: shape and magnitude of redox waves
P.M.Armistead; H.H.Thorp Anal. Chem. 2000, 72, 3764-70.
– Specific short-range interactions important – Chemical identity of species important
CV and Adsorption
• If electroactive adsorbed species:
90 mV I
– Ep = Eo - (RT/nF) ln (bo/bR) – ip = (n2F2/4RT) A o*
• Excitation
• Response
– i ____ – Ep ____ of – E’ = _____________
Excitation E2
Cyclic Voltammetry (CV)
Eapp, V
E1 Time, s Response Epa
I, A
E1
E2
Epc Eapp, V R - ne- = O
Annette R. Howells, Pedro J. Zambrano, and Maryanne M. Collinson* ; Diffusion of Redox Probes in Hydrated Sol-GelDerived Glasses, Analytical Chemistry; 2000; 72(21); 5265-5271.
• Many organic functional groups are reducible: C=O C=C C=N N=N S-S
• see Handbook of Organic Compounds
Applications of CV
• Many functional group are not reducible so we can derivatize these groups
• Learn Do from CA
• Obtain Co*from slow scan rate CV (Iss)
Annette R. Howells, Pedro J. Zambrano, and Maryanne M. Collinson* ; Diffusion of Redox Probes in Hydrated Sol-GelDerived Glasses, Analytical Chemistry; 2000; 72(21); 5265-5271.
• [S2Mo18O62]4- + e- = [S2Mo18O62]5- + e- = [S2Mo18O62]6-
• BAS 100-A
• 3-electrode cell:
– GC macrodisk/Pt wire/ Pt wire
– ACN with no electrolyte
Applications of CV
– convert them into electroactive groups by chemical modification
• EXAMPLES:
– alcohols + chromic acid = aldehyde group – phenyl + nitration = nitro group
Adsorption Phenomena
• Non-specifically adsorbed
– No close-range interaction with electrode – Chemical identity of species not important
• Specifically adsorbed
• Ipc/Ipa = 1
For Nernstian Process
• Potential excitation controls [R]/[O] as in Nernst equation: Eapp = E0- 0.059/n log [R]/[O]
• Equilibrate (stop stirring) • Scan potential in opposite sense (cathodic)
UME’s:
Fast scan rates 30 V/s
planar diffusion
Slow scan rates 5 mV/s
radial diffusion
Fe3+
0.1 m
0.1 m
UME’s Radial vs. Planar Diffusion
Radial Diffusion • Redox wave:
– Reducing salt/film and forming soluble anion
• Record voltammogram
HDME CSV
• Can study halides, sulfides, selenides, cyanides, molybdates, vanadates
• EX: FDA 1982-1986 used to confirm CN- (-0.1 V) in Tylenol Crisis
t
to
time
– i ____
– slope I
time • Deficiency
to
What Experiment Is This?
Excitation
• Name of experiment
E
• Type of excitation
t
to
time • Response
I
• Concentrate analyte
• Stop stirring = equilibration/rest
Ip
period
• Scan E in anodic sense and record voltammogram
Pb Pb2+ + 2e-
– oxidize analyte (so redissolution occurs)
Electroanalytical Chemistry
Lecture #6 An Introduction to Electrochemical
Methods (cont’d)
Q: What Experiment is This?
Excitation • Name of experiment
E
• type of excitation
Criteria for Nernstian Process
• Ep independent of scan rate • ip 1/2 (diffusion controlled) • Ipc/Ipa = 1 (chemically reversible)
Quasi-reversible or Irreversible
Eapp • If ideal Nernstian, Epa = Epc and DEp/2 = 90.6 mV/n at 250C
EXAMPLE 2: Oxidation of Cysteine at BDD
Nicolae Spãtaru, Bulusu V. Sarada, Elena Popa, Donald A. Tryk, and Akira Fujishima* ; Voltammetric Determination of L-Cysteine at Conductive Diamond Electrodes, Analytical Chemistry; 2001; 73(3); 514-519.
Stripping Analysis or Stripping Voltammetry
• 2 Flavors:
– Anodic (ASV)
• Good for metal cations
– Cathodic (CSV)
• Good for anions and oxyanions
Stripping Voltammetry - Steps
Stripping Voltammetry - Quantitation
• Ip Co*
• Concentrations obtained using either
– Standard addition – Calibration curve
HDME ASV
• Usually study M with Eo more negative than Hg
– EX: Cd2+, Cu2+, Zn2+, Pb2+
• Study M with Eo more positive than Hg at GC
– EX: Ag+, Au+, Hg
• Can analyze mixture with DEo 100 mV
CSV
• Anodic deposition
Response Q
– Q ____ – intercept
Qdl
– slope
to time
Eapp, V
Excitation E2
Eo X
E1 Time, s
Response
Ep
I, A
E1
X Eo
E2
Eapp, V
Q: What Is This Experiment?
• Name of experiment
EXAMPLE: Electrocatalytic Oxidation of Guanine in DNA
• Top: non-faradaic contribution
• Bottom: shape and magnitude of redox waves
P.M.Armistead; H.H.Thorp Anal. Chem. 2000, 72, 3764-70.
– Specific short-range interactions important – Chemical identity of species important
CV and Adsorption
• If electroactive adsorbed species:
90 mV I
– Ep = Eo - (RT/nF) ln (bo/bR) – ip = (n2F2/4RT) A o*
• Excitation
• Response
– i ____ – Ep ____ of – E’ = _____________
Excitation E2
Cyclic Voltammetry (CV)
Eapp, V
E1 Time, s Response Epa
I, A
E1
E2
Epc Eapp, V R - ne- = O
Annette R. Howells, Pedro J. Zambrano, and Maryanne M. Collinson* ; Diffusion of Redox Probes in Hydrated Sol-GelDerived Glasses, Analytical Chemistry; 2000; 72(21); 5265-5271.
• Many organic functional groups are reducible: C=O C=C C=N N=N S-S
• see Handbook of Organic Compounds
Applications of CV
• Many functional group are not reducible so we can derivatize these groups
• Learn Do from CA
• Obtain Co*from slow scan rate CV (Iss)
Annette R. Howells, Pedro J. Zambrano, and Maryanne M. Collinson* ; Diffusion of Redox Probes in Hydrated Sol-GelDerived Glasses, Analytical Chemistry; 2000; 72(21); 5265-5271.
• [S2Mo18O62]4- + e- = [S2Mo18O62]5- + e- = [S2Mo18O62]6-
• BAS 100-A
• 3-electrode cell:
– GC macrodisk/Pt wire/ Pt wire
– ACN with no electrolyte
Applications of CV
– convert them into electroactive groups by chemical modification
• EXAMPLES:
– alcohols + chromic acid = aldehyde group – phenyl + nitration = nitro group
Adsorption Phenomena
• Non-specifically adsorbed
– No close-range interaction with electrode – Chemical identity of species not important
• Specifically adsorbed
• Ipc/Ipa = 1
For Nernstian Process
• Potential excitation controls [R]/[O] as in Nernst equation: Eapp = E0- 0.059/n log [R]/[O]
