实验室制取氧气和二氧化碳的对比表格
实验室制取氧气和二氧化碳

实验室用KMnO4制取氧气原理:2KMnO4====K2MnO4+MnO2+O2↑装置图:实验步骤:1、查:检查装置气密性方法:将导管的一端插入水中,用手握住试管,若导管口有气泡冒出,证明装置气密性良好。
2、装:将药品装入试管试管口放一团棉花的作用:防止高锰酸钾粉末随着氧气流通过试管进入水中,使水变紫色。
试管口为什么要向下倾斜?原因:防止冷凝水回流到热的试管底部,使试管炸裂。
3、定:将试管固定在铁架台上4、点:点燃酒精灯为什么要在试管下方来回移动酒精灯?原因:使试管均匀受热,防止局部过热使试管炸裂。
5、收:收集气体排水法:氧气难溶于水,不跟水发生反应方法向上排空气法:氧气密度比空气大验满方法:将带火星的木条放在集气瓶口,若木条复燃,则已满。
检验气体是否为氧气的方法:将带火星的木条伸入集气瓶里,若木条复燃,则该气体为氧气。
6、移:将导管从水槽中移出7、熄:熄灭酒精灯为什么先将导管从水槽中移出,再熄灭酒精灯?原因:防止水槽中的水倒吸入热的试管中,使试管炸裂。
实验室用过氧化氢制取氧气原理:2H2O2 === 2H2O + O2↑装置图:活塞的作用:可以控制反应速率。
实验室制取二氧化碳原理:CaCO3 + 2HCl==CaCl2 + H2O + CO2↑装置图:实验步骤:1、查:检查装置气密性方法:将导管的一端插入水中,用手握住试管,若导管口有气泡冒出,证明装置气密性良好。
2、装:将药品装入试管3、收:收集气体方法:向上排空气法(二氧化碳密度比空气大)4、满:进行验满将燃着的木条放在集气瓶口,若木条熄灭,则已满。
5、验:检验气体检验气体是否为二氧化碳的方法:将收集到的气体通入澄清石灰水中,若澄清石灰水变浑浊,则该气体为二氧化碳。
实验室也可以用以下装置图制取二氧化碳。
氧气与二氧化碳的性质对比(表格)

氧气和二氧化碳的性质、制法、用途相互比较一览表
①排水法(不易溶于水)
②向上排空气法(氧气的密度是1.429克/升,比空
气的密度(1.293克/升)略大)
向上排空气法(二氧化碳的密度是
升,比空气的密度(1.293克/升)略大)
将带火星的木条伸入集气瓶中,若带火星的木条复燃,证明该瓶气体是氧气。
将澄清的石灰水倒入集气瓶中,振荡,若澄清的石灰水变浑浊,证明该瓶气体是二氧化碳。
将带火星的木条伸入集气瓶口,若带火星的木条复燃,证明该瓶气体已收集满了。
将燃着的木条伸入集气瓶口,若燃着的木条熄灭,证明该瓶气体已收集满了。
氧气、氢气、二氧化碳、一氧化碳的物理性质、化学性质及实验室制法统计表

有H2的验证方法:(先验证混合气体中是否有水份,有则先除掉)将混合气体通入灼热的CuO,再将经过灼热的CuO的混合气体通入盛有无水CuSO4中。现象:黑色CuO变成红色,且无水CuSO4变蓝色。
有CO2的验证方法:将混合气体通入澄清石灰水。现象:澄清石灰水变浑浊。
有CO的验证方法:(先验证混合气体中是否有CO2,有则先除掉)将混合气体通入灼热的CuO,再将经过灼热的CuO的混合气体通入澄清石灰水。现象:黑色CuO变成红色,且澄清石灰水要变浑浊。
H2:<1>用拇指堵住集满氢气的试管口;<2>靠近火焰,移开拇指点火, 若“噗”的一声,氢气已纯;若有尖锐的爆鸣声,则氢气不纯。
CO2:用燃着的木条,平放在集气瓶口,若火焰熄灭,则已满,否则没满。
收集试管放置
正 放
倒 放
正 放
正 放
注 意 事 项
O2:(当用KMnO4制取时以下要注意)ቤተ መጻሕፍቲ ባይዱ:
①检查装置的气密性;②试管口要略向下倾斜(防止凝结在试管口的小水珠倒流入试管底部使试管破裂);③加热时应先使试管均匀受热,再集中在药品部位加热;④排水法收集完氧气后,先撤导管后撤酒精灯(防止水槽中的水倒流,使试管破裂)
Zn+2HCl=ZnCl2+H2↑
Zn+H2SO4=ZnSO4+H2↑
[固+液] 石灰石(大理石)(CaCO3)和稀盐酸(HCl)CaCO3+2HCl=CaCl2+H2O+CO2↑
收 集 方 法
O2:①排水法(不易溶于水) ②瓶口向上排空气法(密度比空气大)
H2:①排水法(难溶于水) ②瓶口向下排空气法(密度比空气小)
实验室制取二氧化碳

由于反应物的状态和反应条件不同,所以所采用 的气体发生装置也不同
三、探究实验室制取二氧化碳的装置
1、二氧化碳和氧气相关性质比较 反应物的 反应条件 气体密度比空 是否与水反应 气大或小 状态
二氧化碳固体和液体 反应
常温
大
能溶于水并能 与水反应
氧气
固体
加热
略大
不能
想一想:实验室制取二氧化碳的装置是否与制取氧 气的装置相同?为什么?
排空气法 密度比空气的小——向下排空气法 排水法(不易溶于水、不与水发生反应)
问题与讨论
1、实验室常用哪两种方法制取氧气?写出化学方程 式,并对比反应物状态、反应条件。
2H2O2
MnO2
2H2O+O2
2KMnO4
分解双 氧水制 取氧气
K2MnO4+MnO2+O2
加热高 锰酸钾 制取氧 气
2、分析制取装置有什么不同,为什么?
分析
结论 实验室制取二氧化碳能不能用稀硫酸代替稀盐酸实验3 :稀盐酸与碳酸钠粉未应现象分析 结论
反应非常剧烈,短时间产生大量气泡
碳酸钠粉未的表面积很大,与盐酸接触面积大, 反应速度很快,不易控制 实验室不能用碳酸钠粉未或大理石粉未等粉未状 物质制取二氧化碳
该反应的化学方程式为:
Na2CO3+2HCl=2NaCl+H2O+CO2
5、下面是实验室制取氧气、氢气、二氧化碳的装置图,
根据装置图回答下列问题:
(1)写出装置标有①—④序号的仪器名称: ①②3④ (2)实验室制取氧气时, 可选用的发生装置是 A 写出用高锰酸钾制取氧气的化学方程式 。 F (3)实验室收集氢气时, 可选用的装置是 D 或 写出用锌和稀硫酸制氢气的化学方程式 。 B 收集装置选用_E (4)实验室制取二氧化碳时, 发生装置可选用__, 写出用大理石和稀盐酸制二氧化碳的化学方程式 (5)实验室常用加热醋酸钠与碱石灰的固体混合物来制取甲烷 (CH4)气体, 甲烷是一种无色、无味、密度比空气小, 极难溶于 水的气体.试回答: 制备和收集甲烷时, 应选用上述仪器装置中 的 A 接 D或 。F
制取氧气和二氧化碳的发生装置比较.doc111

制取氧气和二氧化碳的发生装置比较
用加热高锰酸钾、加热氯酸钾和二氧化锰的混合物的方法制取氧气,用左边的装置;用过氧化氢和二氧化锰制取氧气右边的装置。
实验室制取二氧化碳的装置可采用如图1装置。
实验室里制取二氧化碳的反应药品是大理石和稀盐酸,根据反应物的状态(固体与液体)以及反应的条件(不需要加热),较为简单的发生装置如图2、图3中装置。
在图2装置的基础上,可以增加长颈漏斗,如图4
增加了长颈漏斗,可以随时向锥形瓶中添加反应物稀盐酸。
必须注意的是,长颈漏斗的下端插到液面以下,以防产生的气体从长颈漏斗逸出。
如果将长颈漏斗换成分液漏斗,分液漏斗的下端不必一定要插到液面以下了,如图5
二氧化碳气体可溶于水,二氧化碳的密度比空气大。
所以收集二氧化碳气体一般只能用向上排空气法,如图9 ,如果采用图10中装置来收集,因为二氧化碳的密度比空气大,气体应该从长导管进入。
初三化学精练——O2、H2、CO2的实验室制备比较
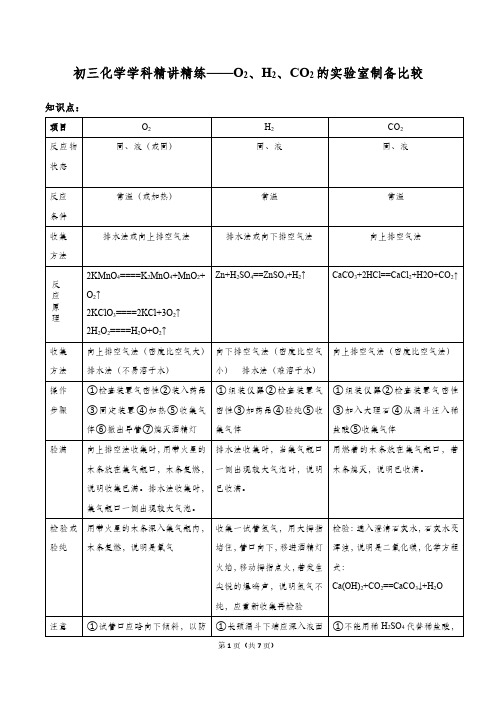
初三化学学科精讲精练——O2、H2、CO2的实验室制备比较知识点:例题:(2017•建邺区一模)请结合如图回答问题:(1)标号a 的仪器名称 。
(2)实验室用氯酸钾和二氧化锰制取氧气的化学方程式为 ,选用A 、D 装置制取O 2,A 装置中试管口略向下倾斜的原因是 ,可用D 装置收集O 2的原因是 。
(3)写出实验室用大理石与稀盐酸反应制取二氧化碳的化学方程式 ,用排空气法收集二氧化碳,可选用的收集装置为 (填字母)。
(4)工业上可用煅烧石灰石制得二氧化碳,若要制取7.7t 二氧化碳,需要含碳酸钙87.5%的石灰石质量是多少?(假设杂质不反应)(在答题纸写出计算过程)【解答】解:(1)集气瓶是常用的反应容器,故答案为:集气瓶;(2)如果用氯酸钾制氧气就需要加热,氯酸钾在二氧化锰做催化剂和加热的条件下生成氯化钾和氧气,配平即可;选用A 、D 装置制取O 2,A 装置中试管口略向下倾斜的原因是:防止水倒流而炸裂试管;氧气的密度比空气的密度大,不易溶于水,因此能用向上排空气法和排水法收集;故答案为:2KClO 32KCl+3O 2↑;防止水倒流而炸裂试管;氧气不易溶于水;(3)实验室制取CO 2,是在常温下,用大理石或石灰石和稀盐酸制取的,碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,因此不需要加热。
二氧化碳能溶于水,密度比空气的密度大,因此只能用向上排空气法收集;故答案为:CaCO3+2HCl=CaCl2+H2O+CO2↑;C;(4)设需要含碳酸钙87.5%的石灰石质量为x,CaCO3CaO+CO2↑100 44x•87.5% 7.7tx=20t;答:需要含碳酸钙87.5%的石灰石质量是20t;故答案为:20t;练习:1.(2017秋•工业园区期中)如图是实验室加热高锰酸钾制取氧气的装置图,下列有关实验操作的分析错误的是()A.连接装置:先检查装置气密性,再加药品;先放酒精灯,再固定试管B.试管口略向下倾斜:防止水倒流入试管底部,导致试管炸裂C.收集:加热前将导管伸入装满水的集气瓶口D.停止加热:先把导管移出水面,再熄灭酒精灯2.(2017•南京二模)根据下列实验装置图,回答有关问题。
(完整版)初中化学知识点总结:氧气、氢气、二氧化碳的比较

初中化学知识点总结:氧气、氢气、二氧化碳的比较表2 氧气、氢气、二氧化碳的比较氧气(O2) 氢气(H2) 二氧化碳(CO2)物理性质通常状况下:无色、无味气体;比空气重;难溶于水;熔、沸点很低。
通常状况下:无色、无味的气体;比空气轻;难溶于水;熔、沸点很低。
通常状况下:无色、无味的气体;比空气重;能溶于水;加压、冷却易变成无色液体和雪状固体——干冰。
干冰可直接气化。
化学性质化学性质活泼, 能跟非金属、金属等多种物质发生氧化反应, 具有氧化性。
常温下化学性质稳定, 在点燃或加热条件下可跟许多物质发生反应, 具有可燃性和还原性。
一般情况下:不支持燃烧, 不能燃烧, 且不助呼吸;跟水反应;跟碱液反应。
制法工业制法:分离液态空气法。
(物理变化)电解水;分离水煤气;天然气等在催化剂作用下受热分解。
高温煅烧石灰石。
实验室制法原理∆===42KMnO↑++2242OMnOMnOK232MnOKClO∆===↑+232OKCl活泼金属和稀酸反应:↑+=+222HZnClHClZn42SOHZn+(稀)↑+=24HZnSO大理石(或石灰石)和稀盐酸反应。
232CaClHClCaCO=+OHCO22+↑+装置固体+固体气体块状固体+液体→气体启普发生器块状固体+液体→气体启普发生器收集排水法或向上排空气法排水法或向下排空气法向上排空气法检验使带火星的木条复燃点燃, 火焰呈淡蓝色, 不纯时有爆鸣声。
使澄清石灰水变浑浊用途供给呼吸;气割气焊;炼钢;液氧炸药等。
充灌探空气球;作高能燃料;生产盐酸;冶炼金属等。
灭火剂;致冷剂;人工降雨;化工原料等。
二氧化碳与氧气的对比(“气体”相关文档)共9张
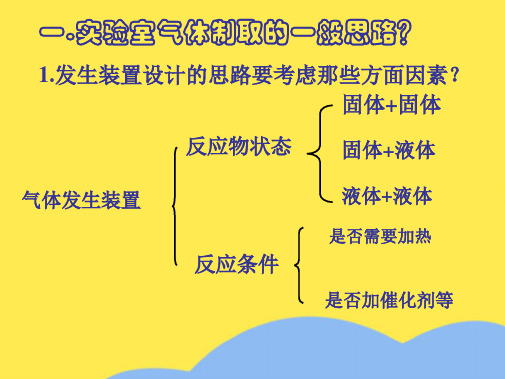
1.发生装置设计的思路要考虑那些方面因素? 固体+固体
反应物状态 固体+液体
气体发生装置
反应条件
液体+液体
是否需要加热
是否加催化剂等
2.收集装置设计一般要考虑那些方面因素? 气体的的密度、水溶性。
气体收集 方法
排空气法
气体密度比空气大:
向上排空气法
气体密度比空气小:
向下排空气法
不易溶于水或难溶于水
排水法
不与水反应
实验室气体制取的一般思路? 发生装置设计的思路要考虑那些方面因素? 探究:实验室制取H2的方法 氧气和二氧化碳的实验室制取及对比 发生装置设计的思路要考虑那些方面因素? 气体的的密度、水溶性。 实验室气体制取的一般思路? 探究:实验室制取H2的方法
2 H2O2 === 2H2O2 + O2 ↑ 实验室气体制取的一般思路? 实验室气体制取的一般思路? 气体的的密度、水溶性。
氧气和二氧化碳的实验室制取及对比
气体的密度
在水中的溶解性
是否比空气大
不易溶于水
否
D或E
CO2
比空气大 易溶于水
是
E
C
D
E
探究:实验室制取H2的方法
反应原料
H2 锌粒和稀硫酸
反应原理 反应物状态
Zn + HCl==== ZnCl2 + H2
固液型
反应条件
不加热
气体发生装置
B
密度
MnO2
2 H2O2 === 2H2O2 + O2 ↑
CaCO3 + 2HCl == CaCl2 + H2O + CO2 ↑
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
ⅠⅡ
(1和2用装置Ⅰ,3用装置Ⅱ)
收集方法
1.排水法2.向上排空气法
向上排空气法
检验
用点火星的木条检验氧气
用澄清石灰水检验二氧化碳
验满
带火星的木条放在集气瓶口,木条复燃,则氧气已收集满
燃着的木条放在集气瓶口,木条熄灭,则二氧化碳已收集满
注意事项
装置图Ⅱ中长颈漏斗下端插入页面以下
长颈漏斗下端插入页面以下
工业制法
分离液态空气法
高温煅烧石灰石
装置Ⅰ气密性检查方法:连接好装置后,用酒精灯加热试管,若伸入水槽中导管口有气泡产生,则装置的气密性良好。
装置Ⅱ气密性检查方法:用弹簧夹夹紧皮管,往长颈漏斗中加入一定量的水形成液封后,若长颈漏斗内液面高度不变,则装置气密性良好。
实验室制取氧气、二氧化碳对比
氧气
钾(MnO2作催化剂)
3.过氧化氢溶液(MnO2作催化剂)
稀盐酸和大理石(或石灰石)
反应原理
1.2KMnO4 K2MnO4+MnO2+O2
2.2KClO32KCl+3O2↑
3.2H2O22H2O+ O2↑
CaCO3+2HCl = CaCl2+H2O+CO2↑
