硅及其化合物知识点总结--雪山
硅与化合物总结

物理性质 熔、沸点低, 微溶于水 熔点高,硬度大,不溶于水
与水反应 CO2+H2O=H2
不反应
化 与NaOH反 CCOO32+2NaOH=Na2C SiO2+2NaOH=Na2SiO
学 性 质
应与CaO反应 OCO3+2+HC2OaO=CaC
S3+iOH22+OCaO 高温
与酸反应 O不3反应 与氢氟酸反应:CaSiO3
硅或硅酸盐中的硅氧化学键非常 牢固,硅氧键一旦形成就很难被破 坏,所以,自然界中硅都是以二氧化 硅或硅酸盐的形式存在,没有游离 态的硅.
五、硅
<1>只有化合态,无游离态;
1、存在和状态:<2>晶体硅和无定型硅.
2、物理性质:
灰黑色,有金属光泽、硬而脆的固体,熔沸点较高.
3、化学性质:不活泼 <1>常温下:①
二、硅酸〔H2SiO3>
思考与交流:CO2+H2O=H2CO3,我们知道
SiO2不能直接和水化合成H2SiO3,那怎样制备
H〔21制Si取O3〔呢实?验4-1
原理
Na2SiO3+2HCl=2NaCl+H2S强iO酸3↓制弱酸
现象 经色逐渐消失,且有白色胶状沉淀生成
结论
难溶于水的弱酸
方程式 Na2SiO3+2HCl=2NaCl+H2SiO3↓
现象
燃烧
无明火,不燃烧
Na2结S论iO3溶Na液2Si〔O3水不易玻燃璃烧—,可作防火剂
木材防火、黏胶剂等
四、硅酸盐工业
1、玻璃: 原料:纯碱、石灰石和石英 Na2CO3+SiO2=Na2SiO3+CO2↑
高一硅及硅的化合物知识点

高一硅及硅的化合物知识点硅(Si)是元素周期表中的第14号元素,属于非金属元素。
硅及其化合物在日常生活和工业生产中具有重要的应用价值。
本文将介绍关于硅及其化合物的知识点。
一、硅的基本性质硅是一种无色、硬度较高、脆性较大的固体物质。
它具有较高的熔点和沸点,不溶于水和大多数常见的溶剂,但能溶于热的氢氟酸和碱性溶液。
硅是一种良好的导热材料,同时具有半导体特性,因此在电子行业中有广泛应用。
二、硅的化合物及应用1. 硅石(SiO2):也称为二氧化硅,是硅最常见的氧化物。
硅石在自然界中广泛存在,常见于石英、石英砂等形式。
它是制备硅金属的重要原料,也用于制备玻璃、陶瓷等材料。
2. 硅酸盐:是一类以硅酸根离子(SiO4^4-)为主的化合物。
硅酸盐在岩石、矿石和土壤中普遍存在,如长石、石英等。
它们具有重要的地质作用,也用于制备建筑材料、陶瓷等。
3. 二氧化硅凝胶:是一种由硅酸盐制备得到的多孔固体材料,具有很高的比表面积和孔隙度。
它被广泛应用于催化剂、吸附剂、保温材料等领域。
4. 硅油:是一种由聚硅氧烷链构成的有机硅化合物,具有良好的润滑性、绝缘性和耐热性。
硅油常用于机械设备的润滑、电子元器件的封装等。
5. 硅树脂:是一类由有机硅聚合物构成的高分子材料,常用于制备塑料、胶黏剂等。
硅树脂具有良好的耐高温性能和化学稳定性,广泛应用于航空航天、电子、汽车等领域。
6. 硅橡胶:是一种由聚硅氧烷和填充剂组成的弹性材料,具有优异的耐高温、耐候性和绝缘性。
硅橡胶常用于制备密封件、隔振垫等。
7. 硅材料在半导体工业中的应用:由于硅具有半导体特性,因此在半导体工业中,硅被广泛应用于制备集成电路、太阳能电池等。
三、硅及其化合物的重要性硅及其化合物在现代工业和科技领域具有重要的地位和应用价值。
硅材料的独特性能使其成为电子行业中不可或缺的材料,半导体工业的发展离不开硅材料。
此外,硅化合物在建筑材料、化工原料、橡胶和塑料等领域也起着重要作用。
第10讲 硅及其化合物-高考化学一轮复习名师讲义

第四单元非金属及其化合物第10讲硅及其化合物【复习目标】1.了解Si 和SiO 2的主要性质,了解CO 2和SiO 2物理性质差异的主要原因。
2.了解硅酸及常见硅酸盐的性质。
3.了解硅酸盐工业及新型无机非金属材料的性质与应用。
【知识梳理】考点一硅和二氧化硅1.硅(1)自然界存在形式:硅在地壳中的含量仅次于氧,全部以化合态存在。
主要单质有:晶体硅和无定性硅两大类。
(2)物理性质:晶体硅为原子晶体,灰黑色、有金属光泽、硬度大而脆、熔沸点高。
导电性介于导体和绝缘体之间,是常用的半导体材料。
(3)化学性质:常温下化学性质不活泼,只能跟F 2、HF 和NaOH 溶液反应,在高温条件下,单质硅能与O 2和Cl 2等非金属单质反应。
Si +O 2SiO 2 (4)用途:太阳能电池、计算机芯片、半导体材料、制作特种钢及合金等。
(5)制备:自然界中无游离态的硅,工业上,用C 在高温下还原SiO 2可制得粗硅,有关反应的化学方程式: SiO 2+2CSi(粗)+2CO ↑,Si(粗)+2Cl 2SiCl 4,SiCl 4+2H 2Si(纯)+4HCl2.二氧化硅(SiO 2)(1)SiO 2的空间结构:SiO 2晶体是立体网状结构。
在SiO 2晶体里,每个Si 周围结合四个O ,同时每个O 与两个Si 相结合,在SiO 2晶体中原子个数比为1∶2,因此用“SiO 2”这个式子 高温 高温 高温表示二氧化硅晶体的组成。
SiO 2直接由原子构成不存在单个SiO 2分子。
(2)物理性质:熔点高,硬度大,不溶于水。
(3)化学性质:SiO 2常温下化学性质很不活泼,不与水、酸反应(氢氟酸除外),能与强碱溶液、氢氟酸反应,高温条件下可以与碱性氧化物反应。
化学反应化学方程式 相关应用 与强碱反应 SiO 2+2NaOH =Na 2SiO 3+H 2O SiO 2能与强碱溶液生成的硅酸钠具有粘性,所以不能用带磨口玻璃塞试剂瓶存放碱性溶液,避免Na 2SiO 3将瓶塞和试剂瓶粘住,打不开,碱性溶液存放应用橡皮塞与氢氟酸反应 SiO 2+4HF =SiF 4↑+2H 2O 利用此反应,氢氟酸能刻蚀玻璃;氢氟酸不能用玻璃试剂瓶存放,应用塑料瓶与碱性氧化物反应SiO 2+CaO CaSiO 与某些盐类反应 SiO 2+CaCO 3CaSiO 3+CO 2↑ SiO 2+Na 2CO 3Na 2SiO 3+CO 2↑之所以能够如此反应,原因是高温条件下,产物CO 2容易从反应体系中逃逸,使反应向正方面进行 (4)用途:石英可用于制作石英表和石英玻璃;石英砂常用作制薄玻璃和建筑材料;水晶常用来制造电子部件、光学仪器、工艺品和眼镜片等;玛瑙用于制造精密仪器轴承、耐磨器皿和装饰品;SiO 2被用于制造高性能的现代通讯材料——光导纤维。
高中化学必修一第四章非金属及其化合物 知识点总结
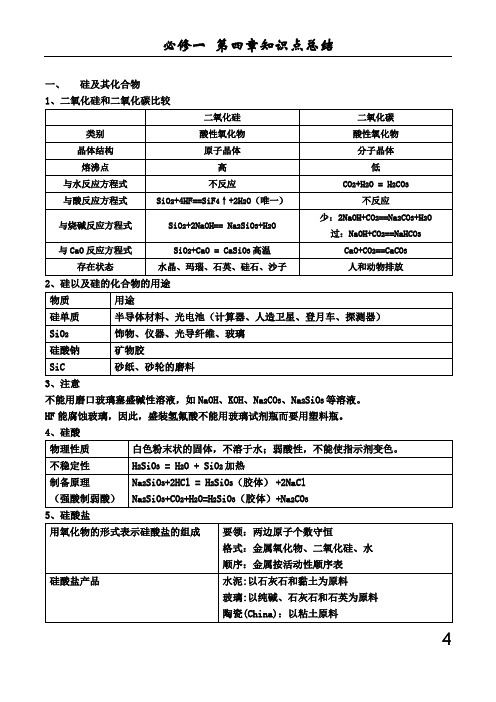
一、硅及其化合物1、二氧化硅和二氧化碳比较2、硅以及硅的化合物的用途3、注意不能用磨口玻璃塞盛碱性溶液,如NaOH、KOH、Na2CO3、Na2SiO3等溶液。
HF能腐蚀玻璃,因此,盛装氢氟酸不能用玻璃试剂瓶而要用塑料瓶。
4、硅酸5、硅酸盐4物理性质灰黑色,有金属光泽,硬而脆的固体;熔、沸点高、硬度大;晶体硅是良好的半导体化学性质与氟气反应Si+2F2==SiF4与氢氟酸反应Si+4HF==SiF4↑+2H2↑与强碱溶液反应Si+2NaOH+H2O==Na2SiO3+2H2↑与氯气反应Si+2Cl2==SiCl4加热与氧气反应Si + O2 == SiO2加热硅的制法SiO2+2C == 2CO +Si(粗)高温Si(粗) + 2Cl2 == SiCl4高温SiCl4+ 2H2== 4HCl + Si(纯)高温液氯新制氯水久置氯水分类纯净物混合物混合物颜色黄绿色黄绿色无色成分Cl2Cl2、H2O、HClO、H+、Cl―、ClO―、极少量的OH―H+、Cl―、H2O、极少量的OH―(稀盐酸)性质氧化性氧化性、酸性、漂白性酸性物理性质黄绿色、有刺激性气味的气体、密度比空气大、易液化、有毒化学性质与金属钠反应方程式 <白烟> 2Na+Cl22NaCl与金属铁反应方程式 <棕褐色的烟> 2Fe+3Cl22FeCl3与金属铜反应方程式 <棕黄色的烟> Cu+Cl2 CuCl2与氢气反应方程式H2+Cl2 2HCl与水反应方程式H2O+Cl2==HCl+HClO制漂白液反应方程式Cl2+2NaOH==NaCl+NaClO+H2O制漂白粉反应方程式2Cl2+2Ca(OH)2==CaCl2+Ca(ClO)2+2H2O 实验室制法MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O 氯离子的检验试剂以及反应方程式AgNO3溶液;Ag++Cl―==AgCl↓次氯酸受热易分解:2HClO==O2↑+2HCl光照漂白粉的主要成分:CaCl2与Ca(ClO)2 漂白粉的有效成分:Ca(ClO)24、氯气的制备①反应原理:MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O②C装置的作用是除去氯气中的氯化氢气体;D装置的作用是干燥氯气;F装置的作用是吸收多余的氯气,防止污染环境。
人教必修一化学----硅及其化合物基础知识

1硅及其化合物主干知识梳理 一、 硅1、 物理性质: 晶体硅是灰黑色、有金属光泽、硬而脆的固体。
熔沸点很高,硬度也很大。
是良好的半导体材料。
2、 化学性质: 与氟气反应: Si+2F 2=SiF 4与氢氟酸反应: Si+4HF=SiF 4↑+2H 2O与强碱溶液反应: Si+2NaOH+H 2O=Na 2SiO 3+2H 2↑与氯气反应加热_: Si+2Cl 2△SiCl 4 与氧气反应加热: Si+O 2△SiO 2 2 、 制 法:高温 SiO 2+2C===Si+2CO ↑ (含杂质的粗硅)高温 Si+2Cl 2==SiCl 4高温 SiCl 4 +2H 2==Si+4HCl ↑ 这样就可得到纯度较高的多晶硅。
二、二氧化硅 1物理性质:熔点高,硬度大,不溶于水。
纯净的SiO 2晶体无色透明的固体。
2化学性质:①酸性氧化物a 、在常温下与强碱反应,生成盐和水。
例如:SiO 2+2NaOH=Na 2SiO 3+H 2Ob 、在高温下与碱性氧化物反应生成盐。
例如:SiO 2+CaO 高温CaSiO 3 ②弱氧化性:高温下被焦炭还原SiO 2+2C △Si+2CO ↑SiO 2+3C △SiC+2CO ↑(焦炭过量)③特殊反应:a 、与HF 反应 :4HF+ SiO 2= SiF 4↑+2H 2O 氢氟酸是唯一可以与的SiO 2反应的酸。
b 、与Na 2CO 3 和CaCO 3反应:Na 2CO 3+SiO 高温Na 2SiO 3+CO 2↑CaCO 3+SiO 高温CaSiO 3+CO 2↑与CO 的比较2SiO 2是由Si 原子和O 原子以原子个数比为2∶1组成的空间立体网状晶体。
SiO 2晶体与金刚石结构相似,具有高硬度、高熔沸点特征。
(说明:SiO 2晶体结构:不存在单个的SiO 2分子,是由Si 原子和O 原子以2:1组成的空间立体网状晶体。
每个Si 原子与4个O 原子相连,每个O 原子与两个Si 原子相连。
硅及其化合物知识点

硅及其化合物知识点硅的基本概念硅是一种化学元素,化学符号为Si,原子序数为14。
它是地壳中含量第二多的元素,仅次于氧。
硅是一种非金属元素,具有半导体性质,广泛应用于电子工业。
硅的原子结构类似于碳,具有四个价电子,因此它可以形成四个共价键。
硅与氧结合形成二氧化硅(化学式SiO2),是一种常见的无机化合物,也是地壳中最主要的成分之一。
硅的化合物通常由硅原子与其他元素的化合物组成,如硅酸盐、硅烷等。
硅化合物在材料科学、电子工业、化学工业等领域具有重要的应用价值。
硅的性质和用途硅的物理性质:•硅是一种银白色晶体,具有金属光泽。
•硅是一种半导体材料,其导电性介于导体和绝缘体之间。
•硅具有较高的熔点和沸点,熔点约为1414℃,沸点约为3265℃。
硅的化学性质:•硅在常温下与大多数酸和碱不发生反应。
•硅可以与氧反应形成二氧化硅,与氟反应形成氟化硅等。
硅的应用:•电子工业:硅是半导体材料的主要成分,广泛用于制造集成电路、太阳能电池等。
•材料科学:硅的高熔点和耐高温性能使其在高温合金、陶瓷材料等方面有广泛应用。
•化学工业:硅化合物被广泛用于制造硅胶、硅橡胶、硅油等化学产品。
•建筑工业:硅酸盐是建筑材料中常见的成分,如水泥、玻璃等。
硅的化合物1. 二氧化硅(SiO2)二氧化硅是最常见的硅化合物,也是硅的主要氧化物。
它存在于自然界中的石英、石英砂、石英石等矿物中。
二氧化硅具有高熔点、高硬度和良好的绝缘性能,因此被广泛用于制造玻璃、陶瓷、光纤等。
2. 硅酸盐硅酸盐是一类含有硅酸根离子(SiO4)的化合物。
常见的硅酸盐包括长石、石英、云母等。
硅酸盐在建筑材料、陶瓷等方面有广泛应用。
3. 硅烷(SiH4)硅烷是一种由硅和氢组成的化合物,化学式为SiH4。
它是一种无色、有毒的气体,在常温下不稳定,容易分解。
硅烷被广泛用于制造光纤、半导体材料等。
4. 硅酸(H4SiO4)硅酸是一种无机酸,化学式为H4SiO4。
它是一种无色、无味的液体,具有较强的腐蚀性。
硅及其化合物知识点总结

硅及其化合物知识点总结硅是一种非金属元素,化学符号为Si,原子序数为14。
它是地壳中含量第二多的元素,占地壳质量的27.7%。
硅具有许多重要的物理和化学性质,广泛应用于电子、光学、化工等领域。
硅化合物是由硅和其他元素形成的化合物,具有多样的结构和性质。
硅具有明显的半导体特性,被广泛应用于电子行业。
由于硅原子的外层电子结构为2s22p6,其中有4个价电子,因此硅的价带和导带之间的能隙较小。
这使得硅在适当的条件下能够导电。
硅通过掺杂来调节其导电性能,常见的掺杂元素有磷、硼等。
掺杂后的硅可以用来制造半导体器件,如晶体管、二极管、太阳能电池等。
硅还具有良好的光学特性,能够在可见光和红外光范围内透明。
它的折射率高,适用于光学器件的制造。
硅也是光纤的重要材料之一,能够传输光信号,并广泛应用于通信领域。
除了在电子和光学领域的应用,硅还被广泛用于化工工业。
硅化合物是由硅和其他元素形成的化合物,具有多样的结构和性质。
其中,最常见的硅化合物是二氧化硅(SiO2)。
二氧化硅是一种无机化合物,具有良好的热稳定性、耐腐蚀性和绝缘性。
它被用作玻璃、陶瓷、水泥等材料的主要成分。
此外,二氧化硅还可用于制备硅胶、硅藻土等吸附材料。
硅还可以形成与氧、氢、氮等元素的化合物。
硅氧烷是由硅和氧形成的化合物,具有类似于有机化合物的结构和性质。
硅氧烷可以用作涂料、密封剂、防水剂等材料的添加剂,提供物理和化学性能的改善。
硅氧烷还可以用作生物医学领域的材料,如人工关节、牙科材料等。
硅还可以形成与碳形成的化合物,即有机硅化合物。
有机硅化合物具有碳硅键,具有独特的化学性质和应用价值。
其中,硅烷是最简单的有机硅化合物,由硅和氢形成。
硅烷具有良好的稳定性和低毒性,被广泛应用于涂料、粘合剂、密封剂等行业。
有机硅化合物还包括硅烷类、硅醇类、硅氧烷类等,具有广泛的应用领域。
硅及其化合物具有广泛的应用领域。
硅作为半导体材料,在电子行业具有重要地位;硅化合物在光学、化工等领域发挥着重要作用。
高考化学一轮复习:硅元素及其化合物知识点总结

高考化学一轮复习:硅元素及其化合物知识点总结1、硅在自然界的存在:地壳中含量仅次于氧,居第二位;无游离态,化合态主要存在形式是硅酸盐和二氧化硅。
2、硅单质:晶体硅是灰黑色有金属光泽,硬而脆的固体;导电性介于导体和绝缘体之间,是良好的半导体材料。
(1)常温下:与氢氟酸和强碱溶液反应Si + 4HF == SiF4↑ + 2H2↑ Si + 2NaOH + H2O == Na2SiO3 + 2H2↑高温下:Si + O2SiO2Si + 2Cl2 SiCl4(2)硅的用途:①用于制造硅芯片、集成电路、晶体管、硅整流器等半导体器件;①制造太阳能;①制造合金等。
(3)工业生产硅:制粗硅:SiO2 + 2C Si + 2CO↑ 制纯硅:Si + 2Cl2 SiCl4SiCl4 + 2H2 Si + 4HCl3、二氧化硅(1)SiO2在自然界中有较纯的水晶、含有少量杂质的石英和普遍存在的沙。
自然界的二氧化硅又称硅石。
(2)SiO2物理性质:硬度大,熔点高,难溶于溶剂(水)的固体。
(3)SiO2化学性质:常温下,性质稳定,只与单质氟、氢氟酸和强碱溶液反应。
SiO2 + 4HF == SiF4↑ + 2H2O(雕刻玻璃的反应——实验室氢氟酸应保存在塑料瓶中)SiO2 + 2NaOH == Na2SiO3 + H2O(实验室装碱试剂瓶不能用玻璃塞的原因)SiO2 + 2C Si + 2CO↑ SiO2 + Na2CO3Na2SiO3 + CO2↑SiO2 + CaCO3CaSiO3 + CO2↑ SiO2 + CaO CaSiO3(4)SiO2的用途:制石英玻璃,是光导纤维的主要原料;制钟表部件;可制耐磨材料;用于玻璃的生产等。
4、硅酸钠(Na2SiO3):易溶于水,水溶液俗称“水玻璃”,是建筑行业的黏合剂,也用于木材的防腐和防火。
(1)硅酸钠溶液呈碱性,通入CO2有白色胶状沉淀:Na2SiO3 + CO2 + H2O == Na2CO3 + H2SiO3↓(硅酸)SiO32− + CO2 + H2O == CO32− + H2SiO3↓(2)硅酸钠溶液中滴加稀盐酸产生白色沉淀:Na2SiO3 + 2HCl == 2NaCl + H2SiO3↓ SiO32− + 2H+ == H2SiO3↓5、硅酸(1)硅酸是难溶于水的弱酸,酸性比H2CO3弱(2)硅酸受热分解:H2SiO3H2O + SiO2(3)硅酸和氢氧化钠反应:H2SiO3 + 2NaOH == Na2SiO3 + 2H2O H2SiO3 + 2OH− == SiO32− + 2H2O6、硅酸盐产品(传统无机非金属材料)制玻璃的主要反应:Na2CO3 + SiO2Na2SiO3 + CO2↑ CaCO3 + SiO2CaSiO3 + CO2↑。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
廊坊一中编制人:雪山
硅
1 单质硅有晶体和无定形两种
2 晶体硅的结构与金刚石相似
3 带有金属光泽的灰黑色固体,熔点高,硬度大,有脆性,常温下化学性质稳定
4 良好的半导体材料
5 计算机芯片的主要材料
6 硅在地壳中的含量排第二位
7 硅是将太阳能转化为电能的常用材料
8 硅是构成矿物和岩石的基本元素,单质不溶于水
9 硅元素的最高价态为+4价
10 硅是亲氧元素,自然界没有单质,以二氧化硅和硅酸盐的形式存在
二氧化硅
1 在自然界存在结晶型和无定形两种,都统称为硅石
2 结晶的二氧化硅俗称为石英
3 无色透明的晶体称为水晶
4 具有彩色环带状或层状的成为玛瑙
5 二氧化硅具有空间立体网状结构,类似于金刚石结构
6 光导纤维的基本材料
7 可制成石英钟,水晶玻璃等
8 难溶于水,常温下化学性质稳定
9 硅酸的酸酐-----SiO2
硅酸盐
1 由硅、氧和金属组成的化合物的总称
2 大多数不溶于水
3 硅酸钠俗称水玻璃,可溶于水
4 硅酸钠是制备硅胶和木材防火剂的材料
5 硅酸钠可作黏合剂、耐酸水泥掺料
6 硅酸盐种类繁多,结构复杂,通常用二氧化硅和金属氧化物的组合形式表示其组成
7 三大传统无机非金属材料---陶瓷玻璃水泥
8 陶瓷的原料:黏土
9 玻璃的原料:纯碱石灰石二氧化硅在玻璃窑烧制
10 水泥的原料:黏土石灰石在水泥回转窑制
11 碳化硅(SiC)俗称金刚砂,具有金刚石结构
1。
