高一化学电解质及酸碱中和图像练习题(附答案)
化学易错题专题训练一电解质溶液图像含解析

电解质溶液图像【错题纠正】例题1、以酚酞为指示剂,用0.1000 mol·L−1的NaOH溶液滴定20。
00 mL未知浓度的二元酸H2A溶液。
溶液中,pH、分布系数δ随滴加NaOH溶液体积V NaOH的变化关系如图所示。
[比如A2−的分布系数:δ(A2-)=c(A2-)]c(H2A)+c(HA-)+c(A2-)下列叙述正确的是A.曲线①代表δ(H2A),曲线②代表δ(HA-)B.H2A溶液的浓度为0.2000 mol·L−1C.HA−的电离常数K a=1。
0×10−2D.滴定终点时,溶液中c(Na+)<2c(A2-)+c(HA-)【解析】根据图像,曲线①代表的粒子的分布系数随着NaOH的滴入逐渐减小,曲线②代表的粒子的分布系数随着NaOH的滴入逐渐增大,粒子的分布系数只有1个交点;当加入40mLNaOH溶液时,溶液的pH在中性发生突变,且曲线②代表的粒子达到最大值接近1;没有加入NaOH时,pH约为1,说明H2A第一步完全电离,第二步部分电离,曲线①代表δ(HA-),曲线②代表δ(A 2—),根据反应2NaOH+H 2A=Na 2A+2H 2O ,c (H 2A)=0.1000mol/L ×40mL 2×20.00mL =0。
1000mol/L,据此分析作答。
A .根据分析,曲线①代表δ(HA —),曲线②代表δ(A 2-),A 错误;B .当加入40。
00mLNaOH 溶液时,溶液的pH 发生突变,说明恰好完全反应,结合分析,根据反应2NaOH+H 2A=Na 2A+2H 2O,c (H 2A)=0.1000mol/L ×40mL 2×20.00mL =0.1000mol/L ,B 错误;C .根据曲线当δ(HA -)=δ(A 2—)时溶液的pH=2,则HA —的电离平衡常数K a =c(A 2-)⋅c (H +)c (HA -)=c (H +)=1×10—2,C 正确;D .用酚酞作指示剂,酚酞变色的pH 范围为8.2~10,终点时溶液呈碱性,c (OH —)>c (H +),溶液中的电荷守恒为c (Na +)+c (H +)=2c (A 2-)+c (HA —)+c (OH -),则c (Na +)>2c (A 2—)+c (HA -),D 错误;答案选C 。
高一化学上学期电解质离子方程式综合练习题(附答案)

高一化学上学期电解质离子方程式综合练习题(附答案)-CAL-FENGHAI-(2020YEAR-YICAI)_JINGBIAN高一化学上学期电解质离子方程式综合练习题学校:___________注意事项: 2、请将答案正确填写在答题卡上第1卷一、单选题( )A .熔融的NaOHB .铜C .KOH 溶液D .液氨 2.下列说法正确的是( )A. 铜、石墨均导电,所以它们均是电解质B. NH 3、CO 2的水溶液均导电,所以NH 3、CO 2均是电解质C. 液态HCl 、固体NaCl 均不导电,所以HCl 、NaCl 均是非电解质D.蔗糖、酒精在水溶液和熔融状态下均不导电,所以它们均是非电解质 3.下列离子方程式表达不正确的是( )A.向3FeCl 溶液中滴加HI 溶液:223++2I =2Fe Fe =2I -++B.向223Na S O 溶液中滴加盐酸:222+322H ==S O S SO H O -++↓↑+ C.向2NaA1O 溶液中通入过量2CO 制()3A1OH :()-33222A12O==A1OH O O C H H O C -+↓++D.向()442NH A1SO 溶液中滴加少量()2Ba OH 溶液:+2--442+4322NH SO 2OH BaBaS =O H =O 2N H ↓++⋅++ 4.常温下,相同物质的量浓度的下列溶液,导电能力最强的是(?? ) A.盐酸???????B.氨水???????C.醋酸???????D.碳酸钠5.某100mL 溶液中含H 2SO 4 ,加入下列物质,溶液导电性增强的是( ) A . Ba(OH)2B .100mL 水C .酒精D . Na 2SO 4固体6.如图点滴板上四种溶液间的反应对应的离子方程式书写正确的是( )反应:+-2H OH H O +== 反应:22+3+l 2l Fe C Fe C -+==+反应:2+422-+-4SO H O Ba BaSO H O H +=↓+++=反应:()3++3243A13NH H O A1OH 3NH =↓+=+⋅7.下列各项的两组物质在溶液中的反应,可用同一离子方程式表示的是( ) A .氢氧化钠与盐酸;氢氧化钠与碳酸B .BaCl 2溶液与Na 2SO 4溶液;Ba(OH)2溶液与H 2SO 4溶液C .Na 2CO 3溶液与硝酸溶液;CaCO 3溶液与硝酸溶液D .石灰石与硝酸反应;石灰石与盐酸 8.下列解释事实的方程式不正确的是( )A.用食醋清洗水垢:233CO 2CH COOH -+3222CH COO H O CO -++↑消毒液与洁厕灵混用产生有毒气体:ClO Cl 2H --+++ 22Cl H O ↑+C.用氢氧化铝治疗胃酸过多:()3Al OH 3H ++ 32Al 3H O ++ D.用硫化钠除去废水中的汞离子:22Hg +S +-HgS ↓9.能用离子方程式H ++OH -=H 2O 表示的反应是(?? ) A.?稀醋酸和稀氨水反应 B.?稀硫酸和烧碱溶液反应 C.?稀盐酸和氢氧化铜反应 D.?稀硫酸和氢氧化钡溶液反应10.下列离子方程式的书写及评价,均合理的是( )11.能发生离子反应,但是不会产生沉淀的是( )A .澄清石灰水中通入CO 2B .NaHCO 3溶液中滴加NaOH 溶液C .Na 2CO 3溶液中滴加NaOH 溶液D .氯化钠溶液中滴加硝酸银溶液 12.下列化学反应的离子方程式正确的是(?? )A.氯化铝溶液与过量的氨水反应:Al 3++4NH 3·H 2O=-2AlO +4+4NH +2H 2OB.小苏打溶液中加入过量的澄清石灰水:Ca 2++2OH -+2-3HCO =CaCO 3↓+ 2-3CO +H 2O C.纯碱溶液中滴加少量盐酸: 2-3CO +H +=-3HCO D.用FeCl3溶液腐蚀铜电路板:Fe 3++Cu?= Fe 2++ Cu 2+13.下列按电解质、非电解质、酸性氧化物、碱性氧化物的组合,正确的是( ) A.?切开的金属Na 暴露在空气中,光亮表面逐渐变暗:2Na +O 2=Na 2O 2 B.?金属钠比通金属铜活泼,金属钠放入CuSO 4溶液:CuSO 4+2Na=Cu +Na 2SO 4 C.?Na 2O 2在潮湿的空气中放置一段时间,变成白色粘稠物:2Na 2O 2+2CO 2=2Na 2CO 3+O 2 D.?将Na 块放入水中,产生气体:2Na +2H 2O=2NaOH +H 2↑ 15.关于反应过程中的先后顺序,下列评价正确的是( )A .向浓度都为L 的FeCl 3和CuCl 2的混合溶液中加入铁粉,溶质CuCl 2首先与铁粉反应B .向过量的Ba(OH)2溶液中滴加少量的KAl(SO 4)2溶液,开始没有白色沉淀生成C .向浓度都为L 的Na 2CO 3和NaOH 的混合溶液通入CO 2气体,NaOH 首先反应D .向浓度为L 的FeCl 3溶液中,加入质量相同、颗粒大小相同的铁和铜,铜单质首先参加反应 16.下列反应属于离子反应的是( ) A .氢气还原氧化铜生成水和铜B .石灰石高温分解生成氧化钙和二氧化碳C .盐酸滴加到石灰石固体上D .实验室加热高锰酸钾制氧气二、填空题(1)按要求写出方程式:①HNO 3(电离方程式) 。
专题22 电解质溶液中的图像问题(学生版)(新高考地区专用)

1.(2021·湖北真题)常温下,已知H 3PO 3溶液中含磷物种的浓度之和为0.1mol·L -1,溶液中各含磷物种的pc—pOH 关系如图所示。
图中pc 表示各含磷物种的浓度负对数(pc=-lgc),pOH 表示OH -的浓度负对数[pOH=-lgc(OH -)];x 、y 、z 三点的坐标:x(7.3,1.3),y(10.0,3.6),z(12.6,1.3)。
下列说法正确的是A .曲线①表示pc(H 3PO 3)随pOH 的变化B .H 3PO 3的结构简式为C .pH=4的溶液中:c (H 2PO 3-)<0.1mol·L -1-2c (HPO 23-)D .H 3PO 3+HPO 23-2H 2PO 3-的平衡常数K >1.0×1052.(2021·福建真题)如图为某实验测得-130.1mol L NaHCO ⋅溶液在升温过程中(不考虑水挥发)的pH 变化曲线。
下列说法正确的是专题22 电解质溶液中的图像问题A .a 点溶液的()-c OH 比c 点溶液的小B .a 点时,()()w a123a223K <K H CO K H CO ⋅C .b 点溶液中,()()()+2-33c Na=c HCO +2c CO -D .ab 段,pH 减小说明升温抑制了-3HCO 的水解3.(2021·海南真题)25℃时,向-110.00mL 0.1000mol L ⋅的3NaHCO 溶液中滴加-10.1000mol L ⋅的盐酸,溶液的pH 随加入的盐酸的体积V 变化如图所示。
下列有关说法正确的是A .a 点,溶液pH>7是由于-3HCO 水解程度大于电离程度B .b 点,()()()()+-2--33Na =HCO +2CO +Cl c c c cC .c 点,溶液中的+H 主要来自-3HCO 的电离D .d 点,()()+--1Na =Cl =0.1000mol L c c ⋅4.(2021·辽宁真题)用-10.1000mol L ⋅盐酸滴定220.00mL Na A 溶液,溶液中2H A 、-HA 、2-A 的分布分数δ随pH 变化曲线及滴定曲线如图。
04电解质溶液的图像分析——酸碱中和滴定曲线

电解质溶液的图像分析——酸碱中和滴定曲线【研析真题•明方向】1.(2018·浙江卷)常温下,分别取浓度不同、体积均为20.00mL的3种HCl溶液,分别滴入浓度为1.000mol·L-1,0.1000mol·L-1和0.01000mol·L-1的NaOH溶液,测得3个反应体系的pH随V(NaOH)的变化的曲线如图,在V(NaOH)=20.00mL前后出现突跃。
下列说法不正确...的是()A.3种HCl溶液的c(HCl):最大的是最小的100倍B.曲线a、b、c对应的c(NaOH):a>b>cC.当V(NaOH)=20.00mL时,3个体系中均满足:c(Na+)=c(Cl-)D.当V(NaOH)相同时,pH突跃最大的体系中的c(H+)最大2.(2016·全国卷Ⅰ)298 K时,在20.0 mL 0.10 mol·L-1氨水中滴入0.10 mol·L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示。
已知0.10 mol·L-1氨水的电离度为1.32%,下列有关叙述正确的是()A.该滴定过程应该选择酚酞作为指示剂B.M点对应的盐酸体积为20.0 mLC.M点处的溶液中c(NH+4)=c(Cl-)=c(H+)=c(OH-) D.N点处的溶液中pH<123.(2016·天津卷)室温下,用相同浓度的NaOH溶液,分别滴定浓度均为0.1 mol·L-1的三种酸(HA、HB和HD)溶液,滴定曲线如图所示,下列判断错误的是()A.三种酸的电离常数关系:K HA>K HB>K HDB.滴定至P点时,溶液中:c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-)C.pH=7时,三种溶液中:c(A-)=c(B-)=c(D-)D.当中和百分数达100%时,将三种溶液混合后:c(HA)+c(HB)+c(HD)=c(OH-)-c(H+)4.(2015·山东卷)室温下向10 mL 0.1 mol·L-1NaOH溶液中加入0.1 mol·L-1的一元酸HA,溶液pH的变化曲线如图所示。
高一化学电解质试题答案及解析

高一化学电解质试题答案及解析1.下列电离方程式中,正确的是A.H2SO4=H2++SO42-B.Ba(OH)2=Ba2++OH-C.NaNO3=Na++NO3-D.HClO=H++Cl-+O2-【答案】C【解析】A、硫酸是强酸,在水溶液中完全电离,产生2H+,而不是H2+,错误;B、Ba(OH)2是强碱,完全电离产生2OH-,错误;C、NaNO3是易溶易电离的盐,完全电离,正确;D、次氯酸是弱酸,不完全电离产生H+和ClO-,错误,答案选C。
【考点】考查电解质的电离方程式的书写2.下表是生活生产中常见的物质,表中列出了它们的一种主要成分(其它成分未列出)(1)请你对表中①~⑦的主要成分进行分类(填编号)属于盐的是______________________,属于电解质的是_______________________,属于非电解质的是__________________________。
(2)写出过量盐酸与③反应的离子方程式为_______________________________________【答案】(1)①③;①②③⑦;④⑥(2)CO32-+2H=CO2↑+H2O【解析】能电离出金属阳离子(或铵根离子)和酸根离子的化合物属于盐,在水溶液或熔融状态下能导电的化合物叫电解质,在水溶液和熔融状态下均不能导电的化合物叫非电解质。
①③是能电离出金属阳离子和酸根离子的化合物,属于盐类,①②③⑦是在水溶液状态下均能导电的化合物,属于电解质,④⑥是在水溶液和熔融状态下均不能导电的化合物,属于非电解质(2)过量盐酸与Na2CO3反应生成二氧化碳和水,离子方程式CO32-+2H=CO2↑+H2O。
【考点】酸、碱、盐、氧化物的概念及其相互联系;电解质与非电解质3.“探险队员”——盐酸,不小心走进了化学迷宫,不知怎样走出来,因为迷宫有许多“吃人的野兽”(即能与盐酸反应的物质),盐酸必须避开它们,否则就无法通过。
最新-《高考化学复习专题》酸碱中和滴定图像题 精品

(3)NH4+ + OH- → NH3· H2 O;
将0.1mol/L氢氧化钠滴入等体积、浓度均为0.1mol/L的盐酸和醋酸 中,能正确反映溶液pH变化曲线的是(实线表示盐酸,虚线表示 醋酸))
√
√
7.25℃,向一定体积0.1mol/L的醋酸溶液中逐滴加入等浓度 的NaOH溶液,溶液中c(H+)与c(OH—)的变化关系如图所示,则 A.M点所示溶液的导电能力强于Q点 B.N点所示溶液中c(CH3COO―)>c(Na+) C.Q点消耗NaOH溶液的体积等于醋酸溶液的体积 D.M点和N点所示溶液中H2O的电离程度相同
滴定过程中可能出现:
A.C(CH3COOH)>C(CH3COO-)>C(H+)>C(Na+)>C(OH-) B.点①所示溶液中:C(CH3COO-)+C(OH-)=C(CH3COOH)+C(H+) C.点②所示溶液中:C(Na+)= C(CH3COOH)+ C(CH3COO-) D.点③所示溶液中:
√ √
√ √
2.在25mL0.1mol/LNaOH溶液中逐滴加入0.2mol/L醋酸溶液, 曲线如下图所示,有关粒子浓度关系的比较正确的是( )。 A.在A、B间任一点,溶液中一定都有: c(Na+) > c(CH3COO-) > c(OH-) > c(H+) B.在B点,a>12.5,且有: c(Na+) = c(CH3COO-) > c(OH-) = c(H+) C.在C点:c(CH3COO-) > c(Na+) > c(H+) > c(OH-) D.在D点:c(CH3COO-) + c(CH3COOH) = c(Na+)
2021年高考化学易错题专题训练一电解质溶液图像含解析
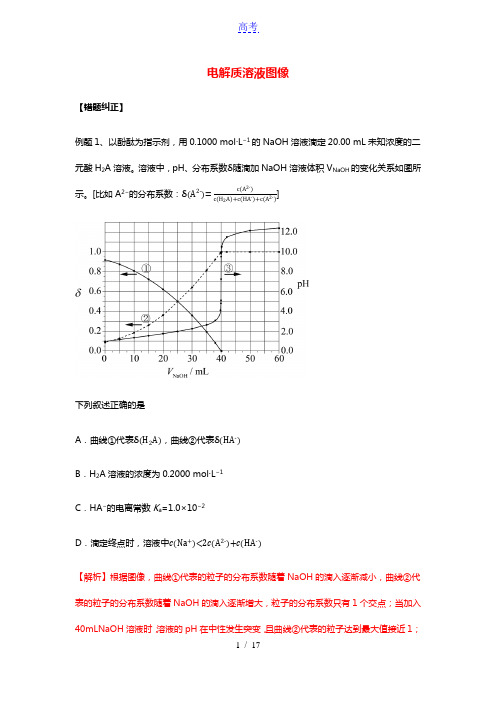
电解质溶液图像【错题纠正】例题1、以酚酞为指示剂,用0.1000 mol·L−1的NaOH溶液滴定20.00 mL未知浓度的二元酸H2A溶液。
溶液中,pH、分布系数δ随滴加NaOH溶液体积V NaOH的变化关系如图所示。
[比如A2−的分布系数:δ(A2-)=c(A2-)]c(H2A)+c(HA-)+c(A2-)下列叙述正确的是A.曲线①代表δ(H2A),曲线②代表δ(HA-)B.H2A溶液的浓度为0.2000 mol·L−1C.HA−的电离常数K a=1.0×10−2D.滴定终点时,溶液中c(Na+)<2c(A2-)+c(HA-)【解析】根据图像,曲线①代表的粒子的分布系数随着NaOH的滴入逐渐减小,曲线②代表的粒子的分布系数随着NaOH的滴入逐渐增大,粒子的分布系数只有1个交点;当加入40mLNaOH溶液时,溶液的pH在中性发生突变,且曲线②代表的粒子达到最大值接近1;没有加入NaOH 时,pH 约为1,说明H 2A 第一步完全电离,第二步部分电离,曲线①代表δ(HA -),曲线②代表δ(A 2-),根据反应2NaOH+H 2A=Na 2A+2H 2O ,c (H 2A)=0.1000mol/L ×40mL2×20.00mL =0.1000mol/L ,据此分析作答。
A .根据分析,曲线①代表δ(HA -),曲线②代表δ(A 2-),A 错误;B .当加入40.00mLNaOH 溶液时,溶液的pH 发生突变,说明恰好完全反应,结合分析,根据反应2NaOH+H 2A=Na 2A+2H 2O ,c (H 2A)= 0.1000mol/L×40mL 2×20.00mL =0.1000mol/L ,B 错误;C .根据曲线当δ(HA -)=δ(A 2-)时溶液的pH=2,则HA -的电离平衡常数K a =c(A 2-)⋅c(H +)c(HA -)=c (H +)=1×10-2,C 正确;D .用酚酞作指示剂,酚酞变色的pHX 围为8.2~10,终点时溶液呈碱性,c (OH -)>c (H +),溶液中的电荷守恒为c (Na +)+c (H +)=2c (A 2-)+c (HA -)+c (OH -),则c (Na +)>2c (A 2-)+c (HA -),D 错误;答案选C 。
2022届高三化学大一轮复习化学反应原理练20酸碱中和滴定图像分析Word版含答案

2022届高三化学大一轮复习化学反应原理专题练_20酸碱中和滴定图像分析一、单选题(本大题共16小题,共48分)1.常温下,用0.1mol·L−1NaOH溶液滴定10mL0.1mol·L−1HA溶液的滴定曲线如图所示,下列说法不正确的是()A. a≈3,说明HA属于弱酸B. 水的电离程度:d点>e点C. c点溶液中:c(Na+)=c(A−)+c(HA)D. b点溶液中粒子浓度大小:c(A−)>c(Na+)>c(H+)>c(OH−)2.室温下,用0.10mol/L KOH溶液滴定10.00mL0.10mol/L H2C2O4溶液,滴定曲线如图(混合溶液体积可看成混合前两种溶液的体积之和)。
下列说法不正确的是()A. K a2(H2C2O4)数量级为10−5B. 点a溶液中,2c(H+)−2c(OH−)=c(HC2O4−)+3c(C2O42−)−c(H2C2O4)C. 点b溶液中,c(K+)>c(HC2O4−)>c(C2O42−)>c(H+)>c(OH−)D. 点a、b、c、d溶液中,均存在:c(K+)+c(H+)=c(HC2O4−)+2c(C2O42−)+c(OH−)3.已知M(OH)2为二元有机弱碱,室温下,在水中存在电离平衡:M(OH)2M(OH)++OH−、M(OH)+M2++OH−。
用0.1mol/LHNO3溶液滴定20mL0.1mol/L某可溶性有机二元弱碱M(OH)2溶液,滴定过程中溶液的pH变化曲线如图所示。
下列说法中正确的是A. 图中a、b、c、d、e五个点中,c点时水的电离程度最大B. b点时:c(M2+)>c[M(OH)2]C. d点时:2c(NO3−)=c(M2+)+c[M(OH)2]+c[M(OH)+]D. c点时:c(M2+)+c[M(OH)+]=c(NO3−)4.25℃时,用一定浓度NaOH溶液滴定HA溶液,溶液pH和导电能力的变化分别如图所示(溶液混合时体积变化忽略不计)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高一化学电解质及酸碱中和图像练习题一、单选题1.唐代著名诗人杜牧在《泊秦淮》中写道:“烟笼寒水月笼纱,夜泊秦淮近酒家”,据此内容判断下列说法正确的是( )HeA.月球上含有大量的氦-3,可以用来作核能原料,可表示为3B.文中的"烟"能产生丁达尔现象C.相同质量的"寒水"所含的能量比冰少D."酒"属于弱电解质,酒香主要是因为有酯生成2.向CH3COOH溶液中滴入稀氨水,溶液的导电能力发生变化,其电流(I)随加入氨水的体积(V)的变化曲线是( )A. B.C. D.3.四甲基氢氧化铵[(CH3)4NOH]是强碱,常温下甲胺(CH3NH2• H2O)的电离常数为K b,且p K b = -lg K b=3.38。
常温下,在体积均为20 mL、浓度均为0.1 mol • L-1的四甲基氢氧化铵溶液和甲胺溶液中,分别滴加浓度为0.1 mol • L-1的盐酸,溶液的导电率与盐酸体积的关系如图所示。
下列说法正确的是( )A.曲线1代表四甲基氢氧化铵溶液B.常温下,CH3NH3Cl水解常数的数量级为10-11C.在b、c、e三点中,水的电离程度最大的点是eD.b 点溶液中存在c(H+) =c(OH-) +c(CH3NH2•H2O)4.下列图示与对应的叙述相符的是( )A. 图Ⅰ表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化B. 图Ⅱ表示常温下,0.l000mol·L-1NaOH溶液滴定20.00mL0.1000mol·L-1CH3COOH溶液所得到的滴定曲线C. 图Ⅲ表示一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化曲线,图中a、b、c三点醋酸的电离程度:a<b<cD. 图Ⅳ表示犮应4CO(g)+2NO2(g)N2(g)+4CO2(g)△H<0,在其他条件不变的情况下改变起始物 CO的物质的量,平衡时N2的体积分数变化情况,由图可知N02的转化率b>a>c5.下列判断合理的是()①蔗糖、硝酸和氨水分别属于非电解质、强电解质和弱电解质②硫酸、烧碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物③Na2O、Fe2O3、Al2O3属于碱性氧化物④根据分散系是否具有丁达尔效应,将分散系分为溶液、胶体和浊液⑤根据反应中是否有电子的转移,将化学反应分为氧化还原反应和非氧化还原反应⑥CO2、SO2、NO2都能和碱溶液发生反应,因此它们都属于酸性氧化物A.②④⑥B.①⑤C.①③⑤D.②⑤6.下列法正确的是( )A.碱都是强电解质,酸都是弱电解质B.NH3的水溶液能导电,所以NH3比为电解质C.强电解质溶液的导电能力很强D.CaCO3在水中的溶解度小,但溶解的部分完全电离,故CaCO3是强电解质7.下列说法不正确...的是( )A.Na与H2O的反应是熵增的放热反应,该反应能自发进行B.饱和Na2SO4溶液或浓硝酸均可使蛋白质溶液产生沉淀,但原理不同C.FeCl3和MnO2均可加快H2O2分解,同等条件下二者对H2O2分解速率的改变相同D.Mg(OH)2固体在溶液中存在平衡:Mg(OH)2(s)Mg2+(aq)+2OH—(aq),该固体可溶于NH4Cl溶液8.下列关于电解质、非电解质的说法正确的是( )A.氯气溶于水得氯水,该溶液能导电,因此氯气是电解质B.CaCO 3饱和溶液导电能力很弱,故CaCO 3是弱电解质C.导电能力弱的溶液肯定是弱电解质的溶液D.HF 的水溶液中既有H +、F -,又有大量的HF 分子,因此HF 是弱电解质9.一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示,下列说法正确的是( )A .a 、b 、c 三点溶液的pH :c<a<bB .a 、b 、c 三点醋酸的电离程度:c < a <bC .用湿润的pH 试纸测量a 处溶液的pH ,测量结果偏小D .a 、b 、c 三点溶液用1mol/L 氢氧化钠溶液中和,消耗氢氧化钠溶液体积:c<a<b10.NaOH 溶液滴定邻苯二甲酸氢钾(邻苯二甲酸氢钾2H A 的131.110a K -=⨯,263.910a K -=⨯)溶液,混合溶液的相对导电能力变化曲线如图所示,其中b 点为反应终点。
下列叙述错误的是( )A.混合溶液的导电能力与离子浓度和种类有关B.Na +与2A -的导电能力之和大于HA -的C.b 点的混合溶液pH=7D.c 点的混合溶液中,(Na )(K )(OH )c c c ++->>二、多选题11.下列说法正确的是( )A .水是弱电解质,电离方程式为H 2O+H 2OH 3O ++OH - B .常温下,向水中加入H 2SO 4溶液,H + 浓度增大,K W 增大C .将纯水加热到100℃,pH ≈6,显酸性D .常温下,将0.1mol·L -1的 NaOH 溶液体积稀释到原来的10倍,则pH =1212、属于离子化合物的电解质(如NaCl)发生电离的条件是A.水溶液中B.熔融状态C.通直流电D.通交流电三、不定项选择题13、 化合物A 、B 、C 、D 各由两种元素组成,甲、乙、丙是前两周期元素的三种单质。
这些常见的化合物与单质之间存在如下关系(已知化合物C 是一种有机物), 以下结论不正确的是[] A.上图所示的五个转化关系中,有三个是化合反应B.上述转化关系所涉及的化合物中有一种是电解质C四、填空题14.在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I 随加入水的体积V 变化的曲线如图所示。
请回答:1.“O”点处冰醋酸导电能力为0的理由是__________。
2.a 、b 、c 三点处,溶液的c(H +)由小到大的顺序为__________。
3.a 、b 、c 三点处,电离程度最大的是__________。
4.若将c 点溶液中c(CH 3COO -)增大,溶液c(H +)减小,可采取的措施是①__________;②__________;③__________。
15.写出下列物质的电离方程式(在水溶液中):1.H 2SO 4:__________2.H 2CO 3:__________3.NaHSO 4:__________4.NaHCO 3:__________5.Cu(OH)2:__________16.乙酸是重要的化工原料,在生活、生产中被广泛应用。
1.写出乙酸在水溶液中的电离方程式_______________。
若某温度下, ()3CH COOH aq 与()NaOH aq 反应的焓变()146.8,H kJ mol HCl aq -∆=-⋅与()NaOH aq 反应的焓变155.6H kJ mol -∆=-⋅,则3CH COOH 在水中电离的焓变H ∆=_______1mol kJ -⋅。
2.已知常温下3CH COOH 的电离常数51.610K -=⨯,该温度下,1 13mol L CH COONa -⨯溶液pH 约为__________(已知20.3lg =)。
向2pH =的3CH COOH 溶液中加入2pH =的稀硫酸溶液,保持溶液温度不变,溶液的pH 将__________(填“变大”或“变小”或“不变”)。
3.常温下,向10 mL 0.1 1mol L -⋅的3CH COOH 溶液中逐滴滴入0.1 1mol L -⋅的ROH 溶液,所得溶液pH 及导电性变化如图。
下列分析正确的是( )A. b 点导电能力最强,说明ROH 为强碱B. b 点溶液5pH =,此时酸碱恰好中和C. c 点溶液存在()()3c R c CH COO +-> 、()()c OH c H -+>D. b c ~任意点溶液均有()()141.010W c H c OH K +--⋅==⨯4.近年来用乙烯和乙酸为原料、杂多酸作催化剂合成乙酸乙酯的新工艺,具有明显经济优势。
其合成的基本反应如下: 223()()CH CH g CH COOH l =+325()CH COOC H l①在恒温恒容容器中投入一定量的乙烯和足量的乙酸,下列分析正确的是__________。
A.当乙烯断开1mol 碳碳双键的同时乙酸恰好消耗1mol,说明反应已达到化学平衡B.当体系中乙烯的百分含量保持不变,说明反应已达到化学平衡C.达到化学平衡后再通入少量乙烯,再次达到化学平衡时,乙烯的浓度与原平衡相等D.该反应的平衡常数表达式为()()()323322c CH OOC H K c CH COOH c CH CH =⋅= ②乙烯与乙酸等物质的量投料条件下,某研究小组在不同压强下进行了在相同时间点乙酸乙酯的产率随温度的变化的测定实验,实验结果如图所示。
回答下列问题:温度在60~80℃范围内,乙烯与乙酸反应速率由大到小的顺序是__________[用()()()123,,v P v P v P 分别表示不同压强下的反应速率]。
在压强为1PMPa 、温度超过80℃时,乙酸乙酯产率下降的原因可能是__________。
根据测定实验结果分析,较适宜的生产条件是__________(填出合适的压强和温度)。
为提高乙酸乙酯的合成速率和产率,可以采取的措施有__________(任写出一条)。
五、实验题17.氰化钠是一种剧毒物质,工业上常用硫代硫酸钠溶液处理废水中的氰化钠。
硫代硫酸钠的工业制备原理为:2Na 2S+Na 2CO 3+4SO 2===3Na 2S 2O 3+CO 2 。
某化学兴趣小组拟用该原理在实验室制备硫代硫酸钠,并检测氰化钠废水处理排放情况。
I.实验室通过如图所示装置制备Na 2S 2O 3II.氰化钠废水处理(1)实验中要控制SO 2生成速率,可采取的措施有_______________(写出一条)。
(2)b 装置的作用是_______________________。
(3)反应开始后,c 中先有淡黄色浑浊产生,后又变为澄清,此浑浊物为__________(填化学式)。
(4)实验结束后,在e 处最好连接盛__________(填“NaOH 溶液”、“水”、“CCl 4”中的一种) 的注射器,接下来的操作为__________________________,最后拆除装置。
(5)已知: a.废水中氰化钠的最高排放标准为0.50mg/L ;b.Ag ++2CN -=[Ag(CN)2]-,Ag ++I -=AgI↓,AgI 呈黄色,且CN -优先与Ag +反应。
实验如下: 取20.00mL 处理后的氰化钠废水于锥形瓶中,并滴加几滴KI 溶液作指示剂,用1.00×10-4mol/L 的标准AgNO 3溶液滴定,消耗AgNO 3溶液的体积为1.50mL 。
