第17章 碳硅硼 习题解答
碳和硅的习题
碳和硅的习题唐荣德1.苏打和小苏打有着广泛应用。
试从反应物的消耗量角度说明在下列用途中选用苏打还是小苏打?为什么?(1) 做面条时防止面粉较长时间储存变酸味,常加入适量的面碱,选用__________,因为________________________________________________________________。
(2) 作为泡沫灭火器中的药品,选用_____________,因为_________________________ _________________________________________________。
(3) 用于洗涤餐具及实验室的玻璃仪器等,选用______________,因为_______________ _____________________________________________________________________。
2.两位同学设计下述两个方案,并都认为如果观察到的现象和自已所设计的方案一致,即可确证无色气体中一定含有SO2和CO2气体。
方案甲:无色气体溴水溴水澄清石灰水褪色不褪色变浑浊方案乙:无色气体品红溶液品红溶液澄清石灰水褪色不褪色变浑浊请你评价上述两个方案是否严密,并说明理由。
方案甲:_________________________________________________________________;方案乙:_________________________________________________________________。
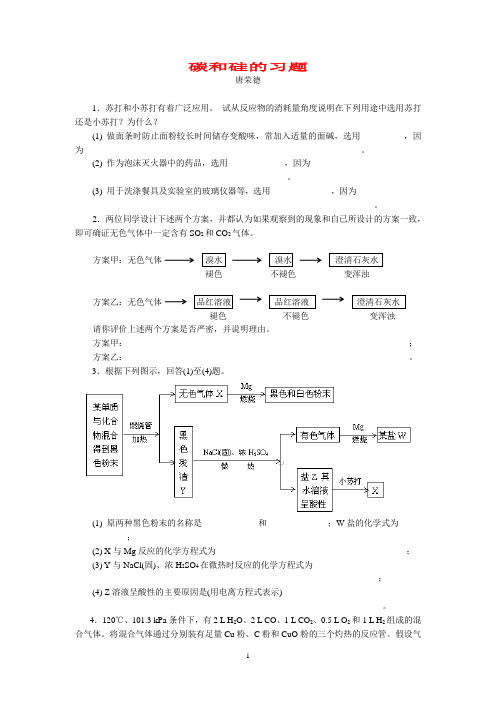
3.根据下列图示,回答(1)至(4)题。
(1) 原两种黑色粉末的名称是_____________和______________;W盐的化学式为___________;(2) X与Mg反应的化学方程式为____________________________________________;(3) Y与NaCl(固)、浓H2SO4在微热时反应的化学方程式为______________________________________________________________________;(4) Z溶液呈酸性的主要原因是(用电离方程式表示)_______________________________________________________________________。
无机化学练习题(含答案)第16章 碳硅硼

第16章 碳硅硼16-1: 对比等电子体CO 与N 2 的分子结构及主要物理﹑化学性质。
解:CO 与N 2是等电子体,结构相似,分子中也有三重键,即一个键,和两个πσ但和N 2不同的是:其中一个π键是配键,其电子来自氧原子。
16-2: 某实验室备有 CCl 4 干冰和泡沫灭火器[内为Al 2(SO 4)3 和NaHCO 3 ],还有水源和砂。
若有下列失火情况,各宜用哪种方法灭火并说明理由: (1)金属镁着火;(2)金属钠着火; (3)黄磷着火;(4)油着火;(5)木器着火 解:(1)砂 (2)砂(3)CCl 4 ,干冰和泡沫灭火器,砂均可以。
(4)干冰和泡沫灭火器,砂 (5)以上方法均可16-3: 标准状况时,CO 2 的溶解度为 160mL/100g 水: (1)计算在此条件下,溶液中H 2CO 3 的实际浓度;(2)假定溶解的CO 2全部转变为H 2CO 3,在此条件下,溶液的PH 是多少?解:(1)100g 水中,H 2CO 3的物质的量为160⨯10-3/22.4=0.00759mol;所以H 2CO 3的实际浓度为0.00759mol/L ;(2)由公式c K H ⨯=+][=L mol /1071.500759.0103.457--⨯=⨯⨯ 所以p H=4.2416-4: 将含有Na 2CO 3 和NaHCO 3 的固体混合物60.0g 溶于少量水后稀释到2.00L ,测得该溶液的PH 为10.6 ,试计算原来的混合物中含Na 2CO 3 及NaHCO 3 各有多少克?解:设碳酸钠为xg ;则NaHCO 3 为(60-x )g ; 由公式323][CO Na NaHCO a C C K H ⨯=+=5.61⨯10-11⨯106/84/)60(x x -=10-10。
6代入公式得x=44.29g;则NaHCO 3为16.71g16-5: 试分别计算0.1mol.L -1NaHCO 3 和 0.1mol.L -1 (NH 4)2CO 3溶液的PH 。
第17章习题解答

第17章习题解答17-1 对比等电体CO 与N 2的分子结构及主要物理、化学性质。
解: CO [KK(σ2s )2(σ*2s )2(π2p )4(σ2p )2] 1个σ键,2个π键(其中1个是由O 提供电子对的配键)N 2 [KK(σ2s )2(σ*2s )2(π2p )4(σ2p )2] 1个σ键,2个π键。
CO 的物理性质:无色、无味气体,密度1.250g/L ,溶解度0.02体积/1体积水。
N 2的物理性质:无色、无味气体,密度1.250g/L ,溶解度0.02体积/1体积水。
临界温度126K ,熔点63K ,沸点77K 。
CO 的化学性质:(1) 还原性;(2) 配位性;(3) 与非金属作用。
N 2的化学性质:键能大,不活泼,在高温下才与金属和非金属反应。
17-2 概述CO 的实验室制法及收集方法。
写出CO 与下列物质起反应的方程式并注明反应条件:(1)Ni ;(2)CuCl ;(3)NaOH ;(4)H 2;(5)PdCl 2。
解:将浓硫酸滴到HCOOH 上即可得到CO 气体;或用草酸晶体与浓硫酸一起加热可得到CO 和CO 2混合气体,将此混合气体通过固体NaOH 吸收CO 2,即可得到纯的CO 。
CO 可用排水集气法,因CO 难溶于水。
(1) 4CO + Ni 50℃ Ni(CO)4(2) CO + CuCl + H 2O HCl 溶液 Cu(CO)Cl·2H 2O(3) CO + NaOH 433K 加压 HCOONa(4) CO + 3H 2 CH 4 + H 2O CO + 2H 2 CH 3OH(5) CO + PdCl 2 + H 2O === CO 2(g) + Pd + 2HCl17-3 某实验室备有CCl 4、干冰和泡沫灭火器[内为Al 2(SO 4)3和NaHCO 3],还有水源和砂。
若有下列失火情况,各宜用哪种方法灭火并说明理由:(1)金属镁着火; (2)金属钠着火; (3)黄磷着火;(4)油着火; (5)木器着火解:金属镁,钠,黄磷着火应用干沙灭火,以起到隔绝空气的作用。
高一化学碳硅及其化合物试题答案及解析

高一化学碳硅及其化合物试题答案及解析1.下列物质中不能通过化合反应制得的是()A.SiO2B.NaHCO3C.H2SiO3D.SiF4【答案】C【解析】 A项,Si+O2SiO2;B项,Na2CO3+CO2+H2O====2NaHCO3;D项,Si+2F2====SiF4。
C项,SiO2难溶于水,不能与水化合生成H2SiO3。
【考点】含硅矿物与信息材料2.玻璃工业中有一重要反应:CaCO3+SiO2CaSiO3+CO2↑,若把100 g的CaCO3和30 g的SiO2混合高温充分反应后,收集到的气体的体积是(设气体为标准状况下) A.11.2 L B.22.4 L C.33.6 L D.无法计算【答案】B【解析】根据“元素守恒”,CO2中的C来自于CaCO3,所以n(CO2)=n(CaCO3)="1" mol,V(CO2)=22.4 L。
【考点】含硅矿物与信息材料3.下列试剂中,不能贮存在玻璃瓶中的是A.浓硫酸B.氢氟酸C.浓氢氧化钠溶液D.硝酸银溶液【答案】BC【解析】玻璃瓶的主要成分是二氧化硅,而二氧化硅可以与氢氟酸,氢氧化钠溶液反应,因此答案选BC【考点】考查二氧化硅性质的相关知识点4.赏心悦目的雕花玻璃可用下列物质中的一种对玻璃进行刻蚀而制成,这种物质是()A.盐酸B.氢氟酸C.烧碱D.纯碱【答案】B【解析】玻璃的主要成分是SiO2, 能够对玻璃进行刻蚀而制成赏心悦目的雕花玻璃的物质是氢氟酸,因此选项是B。
【考点】考查HF的用途的知识。
5.绝大多数原子核是由质子和中子构成的,如果质子或中子为某些特定数值,原子核就异常稳定,科学家将这些数值称为“幻数”,科学家在人造硅同位素1442Si中发现新的物理学“幻数”,下列有关说法正确的是()A.1442Si原子核内含有42个中子B.硅用于制造光导纤维C.二氧化硅用于半导体材料D.SiO2可以与弱酸HF反应【答案】D【解析】A、1442Si原子核内应含有(42-14)=28个中子,错误;B、用于制造光导纤维的是SiO2,错误;C、用于半导体材料的是Si,错误;D、SiO2一般不与酸反应,但可以与弱酸HF反应,常用于雕刻玻璃,正确,答案选D。
高三化学一轮复习碳、硅练习含答案

碳、硅一、选择题1.等物质的量的Na和Al两种金属加入足量的水中,生成26.88L(标准状况下)的气体,则下列描述错误的是()A.金属Al无剩余B.c (Na+)=c (AlO2-)C.所得溶液呈碱性D.Na的物质的量是0.6mol2.对金属制品进行抗腐蚀处理,可延长其使用寿命。
以下为铝材表面处理的一种方法:碱洗的目的是除去铝材表面的自然氧化膜,为将碱洗槽液中的铝以沉淀形式回收,最好向槽液中加入下列试剂中的()A.NH3B.CO2 C.NaOH D.HNO33.用除去表面氧化膜的细铝条紧紧缠绕在温度计上,将少许硝酸汞溶液滴到铝条表面,置于空气中,很快铝条表面产生“白毛”,且温度明显上升.下列分析错误的是()A.Al和O2化合放出热量B.硝酸汞是催化剂C.涉及了:2Al+3Hg2+→2Al3++3HgD.“白毛”是氧化铝4.硅在自然界最主要的存在形式是()①硅②二氧化硅③硅酸盐①② B. ①③ C. ②③ D. ①②③5将过量CO2分别通入下列物质的溶液中:①BaCl2;②Na2SiO3;③Ca(OH)2;④饱和Na2CO3溶液;⑤NaAlO2,最终有白色沉淀析出的是()A.①②③④⑤B.②④⑤C.①②③D.②③⑤6半导体工业中,有一句行话:“从沙滩到用户”,即由SiO2制取Si。
制取过程中不涉及的化学反应是()A.2C+SiO2Si+2CO↑B.SiO2+2NaOH Na2SiO3+H2OC.Si+2Cl2SiCl4 D.SiCl4+2H2Si+4HCl7.硅作为一种新型能源被广泛开发利用,关于其有利因素的下列说法中,你认为不正确的是()A.硅燃烧产物对环境产生的污染容易得到有效控制B.从Si(s)+O2(g)SiO2(s)ΔH=-858.6 kJ·mol-1可知,硅燃烧放出的热量多C.自然界中硅的储量丰富,可以从自然界直接获得单质硅D.硅便于运输、贮存,从安全角度考虑,硅是最佳的燃料之一8下列说法正确的是()A.高温下,可在试管内完成焦炭和石英砂(SiO2)制取硅的反应B.CO2和钠在一定条件下反应可以得到金刚石和碳酸钠,反应中氧化剂和还原剂的物质的量之比是3∶4C.现代海战通过喷放液体SiCl4(极易水解)和液氨可产生烟幕,其主要成分是NH4Cl D.从燃煤烟道灰中(含GeO2)提取半导体材料单质锗(Ge),没有发生氧化还原反应9.下列事实中能证明碳的非金属性比硅强的是①往Na2SiO3溶液中通入CO2产生白色沉淀②石墨是导体,晶体硅是半导体③制玻璃过程中发生反应:Na2CO3+SiO2=====高温Na2SiO3+CO2↑④CH4比SiH4稳定A.①④B.②③C.③④D.①②10下列物质间的转化不能通过一步反应完成的是()A. SiO2SiB. CO2 CC. SiO2H2SiO3D. Si Na2SiO311已知甲、乙、丙和X是四种中学化学中常见的物质,其转化关系如图所示,则甲和X不可能是()A.C、O2B.SO2、NaOH溶液C.Cl2、FeD.Al、NaOH溶液12如何解决好碳排放问题是关系到人类可持续发展的重大课题之一。
碳族和硼族元素练习

碳族和硼族元素练习一、选择题( 共17题34分)1. (7643)与Na2CO3溶液作用全部都生成碱式盐沉淀的一组离子是……………………()(A) Mg2+,Al3+,Co2+,Zn2+ (B) Fe3+,Co2+,Ni2+,Cu2+(C) Mg2+,Mn2+,Ba2+,Zn2+ (D) Mg2+,Mn2+,Co2+,Ni2+2. (7462)下列说法不正确的是……………………………………………………………()(A) SiCl4在与潮湿的空气接触时会冒“白烟”(B) NF3因会水解,不能与水接触(C) SF6在水中是稳定的(D) PCl5不完全水解生成POCl33. (3718) 铅蓄电池在充电时,阳极反应是……………………………………………()(A) PbSO4 + H2O = PbO2 + 4H+ + SO-24+ 2e (B) Pb + SO-24= PbSO4 + 2e(C) PbSO4 + 2e = Pb + SO-24(D) PbO2 + 4H+ + SO-24+ 2e = PbSO4 + 2H2O4. (0545) 已知在一定温度下SnO2(s) + 2H2(g)Sn(s) + 2H2O(g) K c=CO(g) + H2O(g)CO2(g) + H2(g) K c=因此下列反应SnO2(s) + 2CO(g)Sn(s) + 2CO2(g) 的K c值………………………()(A) (B) (C) (D)5. (7476)分离SnS和PbS,应加的试剂为…………………………………………………()(A) 氨水(B) 硫化钠(C) 硫酸钠(D) 多硫化铵6. (7475)鉴别Sn4+和Sn2+离子,应加的试剂为……………………………………………()(A) 盐酸(B) 硝酸(C) 硫酸钠(D) 硫化钠(过量)7. (7466)下列分子中,C与O之间键长最短的是…………………………………………()(A) CO (B) Ni(CO)4(C) CO2(D) CH3COOH8. (7363)将过量SiF4通入NaOH溶液中,主要产物是……………………………………()(A) H4SiO4,NaF (B) Na2SiO3,NaF (C) Na2SiO3,Na2SiF6(D) SiO2,HF9. (4370)下列说法不正确的是…………………………………………………………()(A)HCO3-可通过氢键形成双聚离子(B) NaHCO3的热稳定性不如NaCO3高(C) BeCO3在热水中就可发生分解(D) 所有碱金属碳酸盐都是易溶于水的10. (4308) CO32-的几何构型是………………………………………………………()(A) 平面三角形(B) 三角锥形(C) T形(D) 直线形11. (1460) 下列硫化物,能溶于Na2S溶液生成硫代酸盐的是…………………………()(A) SnS (B) SnS2(C) PbS (D) Bi2S312. (1456) 试判断Ge、Sn、Pb 分别与浓HNO3作用时,正确的说法是………………()(A) 三元素都被氧化成+2价(B) 三元素都被氧化成+4价(C) Ge和Sn被氧化成+4价,但Pb却被氧化成+2价(D) Ge被氧化成+4价,但Sn和Pb只却被氧化成+2价13. (1451) IVA族元素从Ge到Pb;下列性质随原子序数的增大而增加的是…………()(A) +2氧化态的稳定性(B) 二氧化物的酸性(C) 单质的熔点(D) 氢化物的稳定性14. (7354)从分子轨道理论出发,可以认为在B2分子中存在的化学键是………………()(A) 三中心二电子键(B) 一个键(C) 二个单电子键(D) 一个键和一个键15. (4403) BF 3通入过量的Na 2CO 3溶液,得到的产物是……………………………( ) (A) HF 和H 3BO 3 (B) HBF 4和B(OH)3 (C) NaBF 4和NaB(OH)4 (D) HF 和B 4O 316. (4333) 下列含氧酸中属于三元酸的是…………………………………………… ( ) (A) H 3BO 3 (B) H 3PO 2 (C) H 3PO 3 (D) H 3AsO 417. (1478) 铝在空气中燃烧时,生成……………………………………………………( ) (A) 单一化合物Al 2O 3 (B) Al 2O 3和Al 2N 3 (C) 单一化合物Al 2N 3 (D) Al 2O 3和AlN二、填空题 ( 共18题 36分 )18. (1509)将适量的SnCl 2溶液加入HgCl 2溶液中,有____________产生,其化学反应方程式为:__________________________________________________________。
大学无机化学第17章 硼族元素习题解答
第17章硼族元素习题解答1.下图为硼元素部分不同存在形态物质之间的转化图,请写出具体的反应方程式。
答案见教材各章节。
2.下图为铝元素部分不同存在形态物质之间的转化图,请写出具体的反应方程式。
答案见教材各章节。
3.什么是缺电子原子,什么是缺电子分子?缺电子分子为什么可以稳定存在?答由价电子数少于价层轨道的缺电子原子形成的化合物叫做缺电子化合物。
例如硼族元素,价轨道数是4个,一个s轨道、3个p轨道,但价电子数确只有3个。
在分子结构中含有多中心缺电子键的分子或者是指中心原子价层电子数少于8的分子称为缺电子分子。
缺电子分子通常用两种方式来使自身稳定:第一种是形成多中心键,例如三氯化铝经常以双聚体或多聚体存在,甲硼烷极不稳定易双聚成乙硼烷。
第二种是将电子反馈给配体。
例如三氟化硼中氟的π轨道电子离域到硼的p轨道内,形成离域π46键。
4.硼酸为何具有酸性?是几元酸?通常如何增强它的酸性?答一元酸。
硼酸为缺电子化合物,O-H键不解离,而是接受水分子中的OH-,释放出H+:H3BO3 + H2O = [B(OH)4]- + H+因而为一元酸。
加入多元醇可以增强硼酸的酸性。
5.什么是“三中心两电子”键,它与通常的共价键有什么不同?答“三中心两电子”键是两个电子连接3个原子所形成的一种特殊的离域共价键,它是缺电子原子的一种成键特征。
它与通常的共价键的区别,在于它是一种缺电子的桥键,而一般的共价键是由两个原子共用两个电子所形成的。
6.铝在什么情况下生成致密的钝化膜,其应用如何?钝化膜又在什么情况下容易被破坏?答铝在空气中由于表面会生成致密的氧化膜而阻止进一步的反应,不易受到腐蚀,常被用来制造化学反应器、医疗器械、冷冻装置、石油精炼装置、石油和天然气管道等。
铝但遇到冷的浓硝酸或浓硫酸时,由于在金属表面生成薄而极其致密的氧化物薄膜,而发生钝化。
食盐可腐蚀铝表面的氧化膜,因此铝制器皿不宜长期存放咸的菜品等。
铝置于水中会生成紧密而很难溶解的氢氧化铝层。
第十三章 p区元素(一)参考答案

第十七章碳、硅、硼一、是非题:1 、钻石所以那么坚硬是因为碳原子间都是共价键结合起来的,但它的稳定性在热力学上石墨要差一些。
2、在B2H6分子中有两类硼氢键,一类是通常的硼氢σ键,另一类是三中心键, 硼与硼之间是不直接成键的。
3、非金属单质不生成金属键的结构,所以熔点比较低,硬度比较小,都是绝缘体。
4、非金属单质与碱作用都是歧化反应。
二、选择题:1、硼的独特性质表现在:A 、能生成正氧化态化合物如BN,其它非金属则不能B 、能生成负氧化态化合物,其它非金属则不能C、能生成大分子D、在简单的二元化合物中总是缺电子的2 、二氧化硅:A 、与NaOH共熔反应生成硅酸钠B、是不溶于水的碱性氧化物C 、单质是分子晶体,与CO2晶体相似D 、属AB2型的化合物,晶体结构属CaF2型3 、下列四种非金属元素中,哪一种不生成象POCl3之类的氯氧分子化合物?A 、B B 、C C 、ND 、S4、C、Si、B都有自相结合成键的能力,但C的自链能力最强,原因是:A 、C原子外层4个电子易得或易失形成C4-或C4+B、C形成的最大共价数为2C、C单质的化学活性较Si,B活泼D、C原子半径小,自链成键不受孤对电子键弱化效应的影响5 、CO与金属形成配合物的能力比N2强的原因是:A、C原子电负性小易给出孤对电子 B 、C原子外层有空d轨道易形成反馈键C、CO的活化能比N2低D 、在CO中由于C-←O+配键的形成,使C原子负电荷偏多,加强了CO 与金属的配位能力6 、下列无机酸中能溶解酸性氧化物SiO2的是:A、HCl B 、H2SO4(浓) C、HF D、HNO3(浓)7 、下列元素性质最相似的是:A、B和Al B 、B和SiB、B和Mg D 、B和C8、关于BF3的下列描述中,说法正确的是:A、BF3水解得到HF(aq)和H3BO3B、BF3接受电子对的倾向比BCl3强C、BF3是离子化合物,分子是极性的D、在室温下B与F2反应得到BF3三、填空题:1、等电子原理是指( )。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第17章碳硅硼17-1解:CO和N2是等电体(14e),分子轨道能级图相似,分子中都有三重键:键能相近。
一般条件下,两种物质都是气体,很少溶于水;熔、沸点,临界力,临界温度等一些物理性质也相似。
但CO和N2分子中三重键特点并不完全相同,N2分子中负电荷分布是对称的,而CO却是不对称的。
C原子略带负电荷,再加上C的电负性比N小,因此CO比σπN2较易给出电子对向过渡金属原子(离子)配位,除形成-配键外,还有-反馈键形成,故生成的配合物较稳定。
而N2的配位能力远不如CO,分子氮配合物远不如羰基化合物稳定。
所以CO的键能虽比N2略大,但化学性质却比N2要活泼,不象N2那样“惰性”。
17—2解:实验室制备CO的方法有①将CO2还原CO2(g)+C(s)====2CO(g)②将H2C2O4或和HCOOH加热分解H2C2O4(s)=====CO(g)+CO2(g)+H2O(l)HCOOH(l)====CO(g)+H2O(l)或用HCOONa(s)+H2SO4(l)====(l)+NaHSO4(s)HCOOH进一步分解得CO CO仅微溶于水,可用排水集气法收集。
因为有毒,制备及收集过程应在通风橱内进行。
工业上用焦炭在有限的空气中燃烧或在灼热的焦炭中通入水蒸气都可以得到CO的混合气体。
CO能与许多物质进行加成反应和还原反应:(1)Ni+4CO====Ni(CO)4条件:1atm,25℃(2)CuCl(氨水或盐酸溶液)+CO+2H2O====CuC l·C O·2H2O(3)CO+NaOH====HCOONa条件:6~10atm,473K(4)2H2+CO=====CH3OH条件:Cr2O3·ZnO,623~673K(5)CO+PdCl2+H2O====CO2+P d↓+2HCl17-3答:(1)金属镁着火----砂子(2)金属钠着火-----砂子(3)黄磷着火-------水、泡沫灭火器、干冰(4)油着火----泡沫灭火器、干冰、砂子、(5)木器着火----以上都可以17—4解:T=273K P=105Pa(1)100g水中,H2CO3的物质的量为170 10-3/22.4=0.00759(mol)所以H2CO3的实际浓度为0.0759mol/L;17-5解:解法1设该混合物中含Na 2CO 3x mol,NaHCO 3y molNaHCO 3和Na 2CO 3组成一个缓冲体系gg mol NaHCO y gg mol CO Na x y x x y CO HCO HCO pKa pH 8.15)(84188.0)(188.0)(2.44)(106417.0)(417.0)(0.60841066.10lg 25.10][][lg )(3322333=⨯===⨯===+=-=-=---解法2:设该混合物中Na 2CO 3为x 克,则NaHCO 3为(60-x )克g x x xCO HCO HCO pKa pH 2.446.10210628460lg 25.10][][lg )(2333=⇒⇒⇒=⨯⨯--=-=---即Na 2CO 3为44.2g ,NaHCO 3为15.8g.17-7解:(1)Ca 2+等浓度等体积Na 2CO 3[Ca 2+]=[CO 32-]=0.2molQ=[Ca 2+][CO 32-]=0.04>K SP (CaCO 3)=8.7*10-8所以通入有CaCO 3沉淀生成(2)Cu 2+中通入Na 2CO 3溶液产物为Cu 2(OH)2CO 3(3)Al 3+中通入Na 2CO 3溶液产物为Al(OH)3Al 3++CO 32-=Al 2(CO 3)3Al 2(CO 3)3+H 2O=Al(OH)3+H 2CO 3H 2CO 3=H 2O+CO 217—6解:(1)0.1mo l·L -1NaHCO 3溶液,HCO 3-是两性物质31.8)1091.4lg(]lg[1091.41061.5103.4][101061.51.01061.599117211412112=⨯-=-=⨯=⨯⨯⨯=∙=⨯=⨯⨯=∙-+---+---H pH K K H c K a a a θθθ 17—8解:热稳定性(1)Na 2CO 3>BeCO 3(2)NaHCO 3<Na 2CO 3(3)MgCO 3<BaCO 3(4)PbCO 3<CaCO 317—9解:(1)先做硼砂珠实验,鉴定出Na 2B 4O 7.10H 2O ;然后用Al 2(SO 4)3鉴定出Na 2CO 3,现象有沉淀和气泡产生。
或者加入HCl ,先鉴定出Na 2CO 3(2)在酒精灯上加热,有气体产生的是NaHCO 3(3)利用SiH 4在碱的催化下,剧烈水解有白色沉淀产生,而CH 4无此现象17-10答:(1)将含有少量CO 2、O 2、H 2O 等杂质的CO 的气体通人热的铜网(除O 2),然后通入石灰水(除CO 2),最后通过浓硫酸(除H 2O )。
或者依次通过炽热的碳粉,红热的铜网,以及碱石灰。
(2)充分摇荡(除H 2S,SO 2);用Al 2O 3纤维物作载体,Pt 作催化剂(除O 2,CO );通过浓硫酸(除H 2O );液化或者在氧气中充分燃烧后,通过溴水,再依次通过灼热的铜网,浓硫酸,再与镁条充分燃烧后,通入氧气中再燃烧充分。
17—14解:(1)CH 4分子中,中心原子C 上没有孤电子对,也没有空轨道接受外界电子。
所以它既没有酸性,也没有碱性。
(2)Si 的电负性小于C ,而半径Si 大于C ,因此Si 4-失去电子的能力大于C 4-,即硅烷与烷烃相比较,硅烷的稳定性没有烷烃强,还原性硅烷强于烷烃,容易被氧化剂氧化。
(3)硅的卤化物比氢化物易形成链,一般认为可能是卤化硅中存在着d-pπ配键(由卤原子充满电子的pπ轨道与Si 原子的3d 空轨道形成),使Si—X 键得到加强。
(4)BH 3和BX 3都是缺电子化合物,都有形成二聚体的倾向。
BH 3由于形成双聚体的倾向特别大而只能以二聚体B 2H 6形式存在,解决了缺电子问题。
BX 3中存在键缓解了其缺电子问题;同时,B 半径小,X 半径大,在B 的周围容64∏纳4个X 原子显得拥挤而使BX 3不能形成双聚体。
17-15答:(1)将石英砂,硫酸钠和煤粉混合后在反射炉内进行反应,温度为1373-1623K ,一小时后,将产物冷却,即将玻璃块状物,然后用水蒸气处理使得溶解成粘稠液体;这就制成“泡化碱”,化学组成为Na 2O.nSiO 2用途主要是:建筑工业及造纸工业作粘合剂。
(2)将硅酸凝胶充分洗涤以除去可溶性盐,干燥脱水后即成为多孔硅固体,这样就制成了硅胶,它是很好的干燥剂,吸附剂及催化剂载体对H 2O,BCl 3,PCl 5等极性物质都有较强的吸附作用。
(3)人工分子筛是用水玻璃,偏铝酸钠和氢氧化钠为原料,按一定的配比并控制适当的温度使其充分反应而制得,由于原料配比及制备条件的不同,所得的分子筛的结构、孔径也不同;它的用途主要是用于吸附。
同时用于物质的分离,提纯,作催化剂载体。
17—16解:B 2H 6是硼烷中最简单的烷烃,它的形成不能用氢键来解释,因为B 是缺电子原子,电负性小,不可能提供孤对电子,满足不了氢键形成的条件(B 2H 6的结构见课本P 588)。
B 2H 6分子中除了正常的共价键外,还有3c —2e 的氢桥键,即三个原子共用两个电子,而一般的共价键是两个原子共用两个电子。
17—21解:(1)3Si+4HNO 3+18HF=3H 2SiF 6+4NO ↑+8H 2O(2)Na 2B 4O 7+2HCl+5H 2O=4H 3BO 3↓+2NaCl(3)8BF 3+3Na 2CO 3+3H 2O=2H 3BO 3↓+6Na[BF 4]+3CO 2↑(4)Ca 2Si +4HCl=2CaCl 2+SiH 4↑(5)H 3BO 3+NaOH=Na[BOH]4(6)Be 2C+4H 2O=2Be(OH)2↓+CH 4↑(7)SiO 2+2C+2Cl 2=SiCl 4+2CO ↑(8)B 2H 6+6Cl 2=2BCl 3+6HCl(9)H 3BO 3+3C 2H 5OH B(OCH 2CH 3)3+3H 2O−−→−浓硫酸(10)Si 2H 6+8H 2O=2H 2SiO 4↓+9H 2↑(11)3B 2H 6+6NH 3=2B 3N 3H 6+12H 2(12)B 2H 6+2LiH=2LiBH 4(13)2Na 2SO 4+C+2SiO 2=2Na 2SiO 3+CO ↑+2SO 2↑(副反应还产生CO 2等)17-22解:(1)将 1.5克H 3BO 3溶于100ml 水中,H 3BO 3溶液的浓度C=(1.5/61.8)mol/10-1C=0.24mol/l.[H +=1.2*10-5pH=-lg[H +]=-lg1.2×10-5=4.92(2)2Ca 2B 6O 115H 2O --------------------------------3Na 2B 4O 710H 2O410.86×2381.24×375×85%X解得:X=8.9×103kg17-23解:P=v =P=所以M=mv nRTP *m p nRT PRTp(1)化学式为BH 3气体的分子量==280.629*8314.3*29053978设BH 3的分子式为B n H 3n则11n +3n=28n=2所以化学式为BH 3分子式为B 2H 6(2)化学式为BH 3气体的分子量==540.1553*8314.3*2926916设BH 3的分子式为B 2n H 5n 则22n +5n=54n=2所以化学式为BH 3分子式为B 4H 1017-25解:解法一:设CO,CO 2和H 2含量分别为x ml,y ml,z ml混合气体中O 2的反应为:2CO+O 2=2CO 22H 2+O 2===2H 2O(l)2x 122y 12x+y+z=50(1)(混合物总体积为50)x+y+5=37(2)(反应后剩余气体=反应后剩余O 2+CO 反应生成的CO 2+先有的CO 2)x/2+y/2=(25-5)(3)(反应的O 2的量)解得:x=22ml y=10ml z=18mlCO 气体占的百分量为=×100%=44%5022CO 2气体占的百分量为=×100%=20%1050H 2气体占的百分量为=×100%=36%1850解法二:2CO +O 2===2CO 22H 2+O 2===2H 2O(l)212212从上式看到,每提供一体积的O 2,均消耗2体积的CO 或者2体积的H 2。
