人教版高中化学必修一第一章练习题及答案
高一化学必修一第一章单元测试题(含答案及解析)

高一化学必修一第一章单元测试题(含答案及解析)一、高一化学必修一第一章单元测试题一、选择题(每题2分,共40分)1. 下列关于化学科学的叙述中,正确的是()A. 化学是研究物质的组成、结构、性质以及变化规律的基础科学B. 化学只研究纯净物的性质和变化C. 化学是研究物质的性质、组成和用途的科学D. 化学是研究原子内部结构的科学2. 下列各组物质中,属于纯净物的是()A. 空气B. 氯化钠溶液C. 蒸馏水D. 铜锌合金3. 下列关于原子的叙述中,正确的是()A. 原子是构成物质的最小微粒B. 原子是不可分割的C. 原子是化学变化中的最小微粒D. 原子是构成分子的基本单元4. 下列关于分子的叙述中,正确的是()A. 分子是构成物质的最小微粒B. 分子是不可分割的C. 分子是化学变化中的最小微粒D. 分子是保持物质化学性质的最小粒子5. 下列关于离子化合物和共价化合物的叙述中,正确的是()A. 离子化合物中一定含有离子键,共价化合物中一定含有共价键B. 离子化合物中可能含有共价键,共价化合物中一定含有离子键C. 离子化合物和共价化合物中均含有离子键和共价键D. 离子化合物和共价化合物中均不含离子键和共价键6. 下列关于氧化还原反应的叙述中,正确的是()A. 氧化还原反应中,氧化剂和还原剂必定同时存在B. 氧化还原反应中,氧化剂和还原剂必定不同时存在C. 氧化还原反应中,氧化剂和还原剂可以同时存在,也可以不同时存在D. 氧化还原反应中,氧化剂和还原剂必定是同一种物质7. 下列关于化学方程式的叙述中,正确的是()A. 化学方程式只能表示化学反应B. 化学方程式可以表示化学反应的速率C. 化学方程式可以表示反应物和生成物的质量比D. 化学方程式可以表示反应物和生成物的体积比8. 下列关于质量守恒定律的叙述中,正确的是()A. 质量守恒定律只适用于化学变化B. 质量守恒定律只适用于物理变化C. 质量守恒定律适用于化学变化和物理变化D. 质量守恒定律适用于所有自然现象9. 下列关于化学反应类型的叙述中,正确的是()A. 分解反应一定是氧化还原反应B. 合成反应一定是氧化还原反应C. 置换反应一定是氧化还原反应D. 复分解反应一定是氧化还原反应10. 下列关于催化剂的叙述中,正确的是()A. 催化剂能改变反应的平衡常数B. 催化剂能改变反应的热力学性质C. 催化剂能加快反应速率D. 催化剂在反应前后质量和化学性质不变二、填空题(每题10分,共50分)1. 填写下列物质的化学式:(1)氢氧化钠()(2)硫酸铜()(3)氯化钾()(4)二氧化碳()2. 根据下列化学方程式,填写反应类型:(1)2H2 + O2 → 2H2O ()(2)CaCO3 → CaO + CO2↑ ()(3)Zn + CuSO4 → ZnSO4 + Cu ()(4)AgNO3 + NaCl → AgCl↓ + NaNO3 ()3. 下列关于氧化还原反应的叙述中,正确的是()(1)氧化剂在反应中得电子,化合价降低()(2)还原剂在反应中失电子,化合价升高()(3)氧化剂和还原剂必定同时存在()(4)氧化剂和还原剂可以同时存在,也可以不同时存在()4. 下列关于化学平衡的叙述中,正确的是()(1)化学平衡是动态平衡()(2)化学平衡时,反应物和生成物的浓度不再发生变化()(3)化学平衡时,正反应和逆反应的速率相等()(4)化学平衡时,反应物和生成物的质量比不变()5. 下列关于化学反应速率的叙述中,正确的是()(1)化学反应速率与反应物的浓度成正比()(2)化学反应速率与反应温度成正比()(3)化学反应速率与催化剂有关()(4)化学反应速率与反应物的性质有关()三、解答题(共30分)1. (15分)根据以下实验现象,写出相应的化学方程式,并注明反应类型:(1)将氢氧化钠溶液滴入硫酸铜溶液中,产生蓝色沉淀。
人教版高中化学必修一第一章练习题及答案

必修1第一章《从实验学化学》测试题一、单项选择题(共10小题,每小题3分,共30分。
)1.下列实验基本操作(或实验注意事项)中,主要是出于实验安全考虑的是A.实验剩余的药品不能放回原试剂瓶C.气体实验装置在实验前进行气密性检查B.可燃性气体的验纯D.滴管不能交叉使用2.实验向容量瓶转移液体操作中用玻璃棒,其用玻璃棒的作用是A.搅拌 B.引流 C.加速反应 D.加快热量散失3.标准状况下的1mol H e 的体积为A.11.2LB.22.4LC.33.6LD.44.8L4.下列关于阿伏加德罗常数的说法正确的是A.阿伏加德罗常数是一个纯数,没有单位B.阿伏加德罗常数就是×1023C.阿伏加德罗常数是指1mol的任何粒子的粒子数 D.阿伏加德罗常数的近似值为:×1023mol-15. 16g某元素含有×10个原子,则该元素原子的相对原子质量为A.1B. 126.关于2molO2的叙述中,正确的是A.体积为44.8L B.质量为32g C.分子数为×10 D.含有4mol 原子7.在1mol H 2SO 4中,正确的是A.含有1mol H B.含有×10个氢原子C.含有×10个分子 D.含有×10个氧原子8.下列溶液中,溶质的物质的量浓度为L 的是A.1L 溶液中含有4g NaOH B.1L 水中溶解4gNaOH C.0.5L 溶液中含有 H 2SO 4 D.9.8g H 2SO 4溶于1L 水配成溶液9.1mol/L H2SO4的含义是()A、1L 水中含有1mol H2SO4B、1L 溶液中含有1mol H+C、将98gH2SO4溶于1L 水中配成的溶液D、该溶液c(H+)=2mol/L-232323232310.下列溶液中,Cl 的物质的量浓度与50mL 3mol/LNaCl 溶液中Cl-物质的量浓度相等是A.150mL 3mol/LKCl 溶液 B.150m L 1mol/LAlCl3溶液C.50mL3mol/LMgCl2溶液 D.75mL LMgCl2溶液11.下列溶液中,跟100mL L NaCl 溶液所含的Cl-物质的量浓度相同的是()A.100mL L MgCl 2溶液 B.200mL LCaCl 2溶液C.50ml 1mol/L NaCl 溶液 D.25ml LHCl 溶液12.配制一定物质的量浓度的NaOH 溶液时,造成实验结果偏低的是()A.定容时观察液面仰视 B.定容时观察液面俯视 C.有少量NaOH 溶液残留在烧杯中 D.容量瓶中原来有少量蒸馏水113.8g 无水硫酸铜配成L 的水溶液,下列说法正确的是()A.溶于500mL 水中 B.溶于1L 水中C.溶解后溶液的总体积为500mL D.溶解后溶液的总体积为1L 14、0.5L1mol/LFeCl 3溶液与0.2L1mol/L KCl 溶液中n(Cl—)之比为()A、1﹕1B、3﹕1C、15﹕2D、5﹕215、在1L 溶有和 MgCl 2的溶液中,c(Cl—)为()A、LB、LC、LD、L二、多项选择题(共6小题,每小题5分,共30分。
人教版高中化学必修一第1章综合检测及答案

第一章综合检测(时间:90分钟;满分:100分)一、选择题(本题包括15小题,每小题3分,共45分)1.要从硝酸钾和食盐(少量)的混合物中,分离出较纯净的硝酸钾,应把它们( ) A.溶解、过滤B.制成饱和溶液,降温后再过滤C.加热、冷却后结晶D.溶解、过滤后结晶2.下列实验中,①pH试纸的使用②过滤③蒸发④配制一定物质的量浓度溶液,均用到的仪器是( )A.蒸发皿B.玻璃棒C.试管 D.分液漏斗3.同温、同压下等质量的SO2气体和CO2气体,下列有关比较的叙述中,正确的是( )①密度比为16∶11②密度比为11∶16③体积比为16∶11④体积比为11∶16A.①③ B.①④C.②③ D.②④4.某非金属单质A和氧气发生化合反应生成B,B为气体,其体积是反应掉氧气体积的两倍(同温同压)。
以下对B分子组成的推测一定正确的是( )A.有1个氧原子 B.有2个氧原子C.有1个A原子 D.有2个A原子5.(2008年高考全国卷)取浓度相等的NaOH和HCl溶液,以3∶2体积比相混和,所得溶液中的c(OH-)=0.01 mol/L,则原溶液的浓度为( )A.0.01 mol/L B.0.017 mol/LC.0.05 mol/L D.0.50 mol/L6.设N A表示阿伏加德罗常数,下列说法正确的是( )A.1 mol氦气中有2N A个氦原子B.14 g氮气中含N A个氮原子(氮的相对原子质量为14)C.2 L 0.3 mol·L-1Na2SO4溶液中含0.6N A个Na+D.18 g水中所含的电子数为8N A7.已知气体的密度与它的摩尔质量成正比。
一只气球若放在空气(空气的平均摩尔质量是29 g·mol-1)中可静止不动,那么在相同条件下该气球放在下列气体中会下沉的是( ) A.O2 B.Cl2C.CO2 D.CH48.铅笔芯的主要成分是石墨和黏土,这些物质按照不同的比例加以混合、压制,就可以制成铅笔芯。
人教版高中高一化学必修一--第一单元 1.1 化学实验基本方法 练习题(含答案)
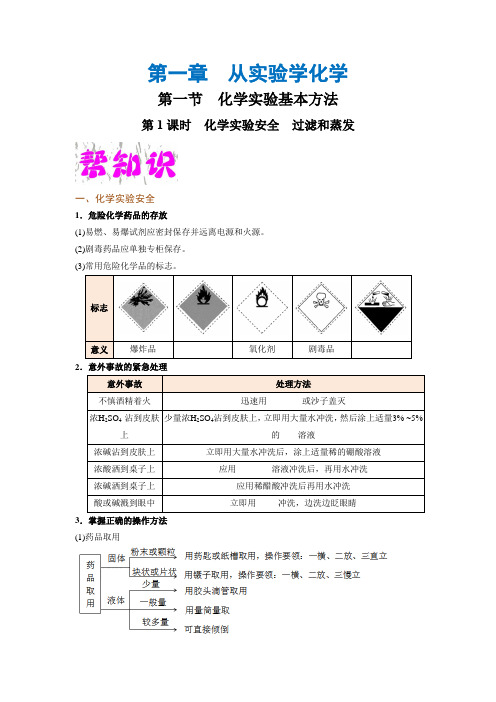
第一章 从实验学化学第一节 化学实验基本方法第1课时 化学实验安全 过滤和蒸发一、化学实验安全1.危险化学药品的存放(1)易燃、易爆试剂应密封保存并远离电源和火源。
(2)剧毒药品应单独专柜保存。
(3)常用危险化学品的标志。
2.意外事故的紧急处理3.掌握正确的操作方法 (1)药品取用(2)物质加热(3)收集气体的方法:排水法和排空气法(包括向上和向下)。
4.重视并逐步熟悉污染物和废弃物的处理方法(1)实验用剩的试剂一般不放回原试剂瓶,以防止污染试剂,应放到指定的容器中。
(2)实验后的废液用废液缸收集,集中处理。
二、过滤和蒸发三、粗盐的提纯1.不溶性杂质的除去粗盐中含有泥沙、氯化钙、氯化镁、硫酸盐等杂质,要通过________、________、________进行提纯。
以上操作都要用到玻璃棒,它们的作用依次是:(1)________溶解。
(2)引流。
(3)________________________。
注:若所得液体如仍浑浊则需再过滤一次。
2.可溶性杂质的除去3.加试剂的先后顺序为使杂质离子完全除去,要加入过量的试剂。
后续试剂要能够将前面所加过量的试剂除去,由此可知Na2CO3 溶液要在BaCl2溶液之后加入,通常加入试剂的几种顺序为:①BaCl2溶液→NaOH溶液→Na2CO3溶液→盐酸;②NaOH溶液→BaCl2溶液→Na2CO3溶液→盐酸;③BaCl2溶液→Na2CO3溶液→NaOH溶液→盐酸。
四、盐中2SO-的检验方法4【答案】一、1.易燃品腐蚀品2.湿布NaHCO3Na2CO3水二、固体液体可溶性固体三、1.溶解过滤蒸发(1)加速(3)搅拌、防止液体溅出2.BaCl2BaSO4↓ +2NaCl NaOH Mg(OH)2↓+2NaCl Na2CO3CaCO3↓+2NaCl四、稀盐酸BaCl2溶液无明显现象白色沉淀一、化学实验安全1.判断化学实验是否存在安全隐患,可以从以下六个方面考虑。
高中化学(必修一)第一章 燃烧热练习题(含答案解析)

高中化学(必修一)第一章 燃烧热 练习题(含答案解析)学校:___________姓名:___________班级:___________考号:___________一、单选题1.已知2H 2(g)+O 2(g)=2H 2O(l) ΔH=-571.6 kJ·mol -1,则下列关于方程式2H 2O(l)=2H 2(g)+O 2(g)的ΔH 的说法中正确的是A .方程式中的化学计量数表示分子数B .该反应ΔH 大于零C .该反应ΔH=-571.6 kJ·mol -1D .该反应可表示36 g 水分解时的热效应 2.环氧乙烷()可用作生产一次性口罩的灭菌剂。
工业上常用乙烯氧化法生产环氧乙烷,其原理是:2CH 2=CH 2(g)+O 2(g)2(g) ∆H 。
已知下列两个反应,则ΔH 为①122222l CH =CH (g)+3O (g)2CO (g)+2H O(g)ΔH =1323kJ mol --⋅①122225+O (g)2CO (g)+2H O(g)ΔH =1218kJ mol 2--⋅A .1210kJ mol -+⋅B .1210kJ mol --⋅C .1175kJ mol --⋅D .1105kJ mol --⋅3.已知丙烷的燃烧热12215kJ mol H -∆=-⋅,()()22H O l H O g = 144.0kJ mol H -∆=+⋅,若一定量的丙烷完全燃烧后生成18g 水蒸气,则放出的热量为 A .2039kJB .509.75kJC .553.75kJD .597.75kJ4.甲烷燃烧的热化学方程式,可用下列两种方程式表示:()()()()42221CH g 2O g CO g 2H O g Q kJ +=++,()()()()422222CH g 4O g 2CO g 4H O l Q kJ +=++,1Q 与2Q 的关系为A .12Q =QB .12Q >QC .122Q <QD .122Q >Q5.下列说法正确的是A .将NaOH 溶液分多次缓慢注入盐酸中,或一次性快速注入盐酸中,都不影响中和热的测定B .已知中和热为ΔH =-57.3kJ·mol -1,则稀H 2SO 4与稀Ba(OH)2溶液反应的反应热ΔH =-2×57.3kJ·mol -1C .燃烧热是指在101kPa 时1mol 可燃物完全燃烧时所放出的热量,故S(s)+32O 2(g)=SO 3(g) ΔH =-315kJ·mol -1即为硫的燃烧热D .已知冰的熔化热为6.0kJ·mol -1,冰中氢键键能为20.0kJ·mol -1,假设1mol 冰中有2mol 氢键,且熔化热完全用于破坏冰中的氢键,则最多只能破坏1mol冰中15%的氢键6.已知CH4气体的燃烧热为802 kJ∙mol-1,1mol CH4不完全燃烧生成CO和H2O(l)时放出的热量为519 kJ。
人教版高中化学必修一化学第一章练习卷子

化学第一章练习卷子一、选择题(本题包括16小题,每小题3分,共48分)1.化学是一门以实验为基础的学科,化学实验是化学学习的重要内容。
根据你掌握的知识判断,下列实验操作的描述中,正确的是( )A .从试剂瓶中取出的任何药品,若有剩余不能再放回原试剂瓶B .用稀盐酸洗涤盛放过石灰水的试剂瓶C .酒精灯不慎碰倒起火时可用水扑灭D .各放一张质量相同的滤纸于天平的两托盘上,将NaOH 固体放在左盘纸上称量 2.下列的分离方法不.正确的是( ) A .用过滤的方法除去食盐水中的泥沙 B .用蒸馏的方法将自来水制成蒸馏水 C .用酒精萃取碘水中的碘D .用分液的方法分离食盐水和汽油的混合物3.如果你家里的食用花生油不小心混入了部分水,利用你所学的知识,采用最简便的分离方法是()4.下列有关气体摩尔体积的说法中正确的是( ) A .在标准状况下,0.5 mol 任何气体的体积都必定是11.2 L B .在标准状况下,1 mol 任何物质的体积都约是22.4 L C .常温常压下,1 mol 任何气体的体积都约是22.4 L D .在标准状况下,0.5 mol CO 2所占有的体积约是11.2 L 5.用N A 表示阿伏加德罗常数,下列有关说法正确的是( ) A .在常温常压下,11.2 L O 2含有的分子数为0.5N A B .在常温常压下,1 mol 氦气含有的原子数为2N A C .71 g Cl 2所含原子数为2N AD .标准状况下,1 mol H 2O 和1 mol H 2的体积都约为22.4 L6.常温常压下,用等质量的CH 4、CO 2、O 2、SO 2四种气体分别吹出四个气球,其中气体为CH 4的是()7.下列说法中,正确的是( )A .1 mol O 2和1 mol N 2所占的体积都约为22.4 LB .H 2的气体摩尔体积约为22.4 LC .在标准状况下,1 mol H 2和1 mol H 2O 所占的体积都约为22.4 LD .在标准状况下,22.4 L 由N 2、N 2O 组成的混合气体中所含有的N 的物质的量为2 mol 8.下列关于容量瓶的使用操作中正确的是( ) A .使用容量瓶前应先检查它是否漏水 B .容量瓶先用蒸馏水洗净,再用待配液润洗C .配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加入蒸馏水到液面距刻度线1~2 cm 处,再改用胶头滴管滴加蒸馏水至刻度线D .浓硫酸稀释后马上转移到容量瓶中9.下列各组数据中,前者刚好是后者两倍的是( ) A .2 mol 水的摩尔质量和1 mol 水的摩尔质量B .200 mL 1 mol/L 氯化钙溶液中c (Cl -)和100 mL 2 mol/L 氯化钾溶液中c (Cl -) C .64 g 二氧化硫中氧原子数和标准状况下22.4 L 一氧化碳中氧原子数D .20%NaOH 溶液中NaOH 的物质的量浓度和10%NaOH 溶液中NaOH 的物质的量浓度10.除去某溶液里溶解的少量杂质,下列做法中不.正确的是(括号内的物质为杂质)( ) A .NaCl 溶液(BaCl 2):加过量Na 2CO 3溶液,过滤,再加适量盐酸并加热 B .KNO 3溶液(AgNO 3):加过量KCl 溶液,过滤 C .NaCl 溶液(Br 2):加CCl 4,分液D .KNO 3溶液(NaCl):加热蒸发得浓溶液后,降温11.某氯化镁溶液的密度为1.18 g/cm ,其中镁离子的质量分数为5.1%。
人教版高中化学必修一第一章测试题
人教版高中化学必修一第一章测试题
一、单选;
1. 分子结构最丰富的物质是:
A. 元素
B. 化合物
C. 有机物
D. 混合物
答案:B. 化合物
2. 下列物质的中子的数目不相同的是:
A. 氢原子
B. 氦原子
C. 氧原子
D. 氢氧分子
答案:D. 氢氧分子
3. 气体A和气体B相混合,若其密度变小,则:
A. 气体A分子数量增多
B. 气体B分子数量增多
C. 两者分子数量都不变
D. 两者分子数量都增多
答案:C. 两者分子数量都不变
二、多选;
下列物质能够发生化学反应的有:
A. 元素
B. 化合物
C. 有机物
D. 混合物
答案:A. 元素 B. 化合物 C. 有机物
三、判断;
1. 不同的化合物能够混合的说法是正确的。
答案:正确
2. 同一元素的不同核素是可以混合的。
答案:正确。
人教版初中高中化学必修一第一章《物质及其变化》经典练习卷(含答案解析)
一、选择题1.磷元素的最高价为+5价,次磷酸(H3PO2)是一元中强酸,具有较强还原性,下列有关次磷酸及其盐的说法正确的是H POA.次磷酸的电离方程式为H3PO2=H++-22B.NaH2PO2是次磷酸的酸式盐C.利用(H3PO2)进行化学制银反应中,1个H3PO2分子最多还原4个Ag+离子D.白磷与氢氧化钠溶液反应可得次磷酸盐,反应的化学方程式为P4+9NaOH=3Na3PO2+PH3↑+3H2O2.高铁酸钾的生产流程如图所示,其中②是歧化反应,磁铁矿的主要成分是Fe3O4,下列有关说法错误的是A.高铁酸钾作净水剂的原因之一是其还原产物Fe3+与水作用生成的Fe(OH)3胶体具有吸附性B.步骤②中反应每消耗1个Cl2分子,转移1个电子NO=9Fe3++NO2↑+13H2OC.步骤③中反应的离子方程式为3Fe3O4+26H++-3D.由图知,氧化性:KClO>K2FeO43.下列叙述正确的是A.液态氯化氢不能导电,但氯化氢是电解质B.Cu和Cl2的水溶液都能导电,所以说Cu和Cl2都是电解质C.某化合物的水溶液可以导电,该化合物一定是电解质D.BaSO4难溶于水,所以BaSO4不是电解质4.化学与生活密切相关。
下列分析不正确的是A.“方家以磁石磨针锋,则能指南”中涉及物理变化B.食品添加剂可以改善食品品质及延长食品保存期,对其用量不必严格控制C.丝绸和头发的主要成分是蛋白质D.“浮梁巧烧瓷,颜色比琼玖”的“瓷”是硅酸盐产品5.常温下,在溶液中可发生以下反应:①2KBr+Cl2=2KCl+Br2;②2KI+Cl2=2KCl+I2;③2KI+Br2=2KBr+I2由此判断下列说法正确的是()A.溴元素在①和③中均被氧化B .氧化性强弱顺序为:I 2>Br 2>Cl 2C .还原性强弱顺序为:KI >KBr >KClD .常温下也能进行如下反应:2KCl+Br 2=2KBr+Cl 2 6.下列关于胶体的说法错误的是 A .利用丁达尔效应可鉴别胶体和溶液 B .利用胶体聚沉的原理可制作豆腐 C .利用渗析可除去胶体中的杂质离子D .胶体中所有微粒的直径均介于1~100 nm 之间 7.下列说法正确的是:A .铜、石墨均能导电,所以它们均是电解质B .NH 3、CO 2的水溶液均能导电,所以NH 3、CO 2均是电解质C .液态HCl 、固体NaCl 均不能导电,所以HCl 、NaCl 均是非电解质D .蔗糖、酒精在水溶液或熔融状态下均不能导电,所以它们均是非电解质 8.下列有关离子方程式一定不正确的是A .氯气被足量的纯碱溶液完全吸收:2-3223---2CO +Cl +H O=2HCO +Cl +ClO B .向一定量的NaOH 溶液中通入一定量的CO 2:-2-3=OH +CO HCOC .向3FeCl 溶液中加入过量的Na 2S 溶液:3+22+2Fe +S =2Fe +S ↓﹣D .向NH 4Al(SO 4)2溶液中滴加Ba(OH)2溶液至2-4SO 恰好完全沉淀:+3+2--2+44NH +Al +2SO +2Ba +4OH =43322BaSO +Al(OH)+NH H O ↓↓⋅9.在一定条件下,2PbO 与3Cr +反应,产物是227Cr O -和2Pb +,则生成2271molCr O -所需2PbO 的物质的量为()A .3.0molB .1.5molC .1.0molD .0.75mol10.某工业废水中存在大量的Na +、Cl -、Cu 2+、SO 24-,欲除去其中的Cu 2+、SO 24-(为使离子完全沉淀,沉淀剂需要过量),设计工艺流程如图所示:下列说法不正确...的是 工业废水NaOH −−−→试剂a 试剂b操作x−−−→−−−→ 溶液试剂c−−−→ Na + Cl - A .NaOH 的作用是除去Cu 2+ B .试剂a 为Na 2CO 3,试剂b 为BaCl 2 C .流程图中,操作x 为过滤D .试剂c 为盐酸二、填空题11.写出下列反应的热化学方程式:(1)N 2(g)和H 2(g)反应生成1mol NH 3(g),放出46.1kJ 热量_____。
高一化学必修一第一章练习题附解析
高中化学必修一第一章练习题附答案1.下列有关化学实验安全问题的叙述正确的是()A.制备H2时,为防止H2逸出,待刚刚出现气泡时就在气体发生器出气口点燃B.取用化学药品时,应特别注意药品包装容器上的安全警示标志C.凡是给玻璃仪器加热,都要垫石棉网,以防仪器炸裂D.为更清楚地闻到化学药品的气味可使鼻子凑近药品2..实验时万一碰倒了酒精灯,洒出的酒精在桌上燃烧起来,这时最简单、最好的扑灭方法是()A.用泡沫灭火器灭火B.用书本扑打C.用水冲灭D.用湿抹布扑灭3..掌握化学实验中常用仪器的特征和用途,有利于开展化学学习和研究。
请从下列常见仪器中,选择恰当的字母序号填空:(1)可以直接在酒精灯火焰上加热的玻璃仪器是。
(2)镁条燃烧时,用来夹持镁条的仪器是。
(3)用酒精灯加热时需要垫上石棉网的仪器是。
(4)取用粉末状固体药品用到的仪器是。
(5)吸取和滴加少量液体试剂的仪器是。
(6)排空气法收集气体用到的玻璃仪器是。
4..欲除去CuSO4·5H2O中的沙子,必要的实验操作为()A.溶解过滤蒸发结晶B.加热溶解过滤C.溶解过滤蒸馏D.溶解过滤分液5.提纯含有少量硝酸钡杂质的硝酸钾溶液,设计实验方案为溶液KNO3溶液则X试剂为()A.Na2CO3B.K2CO3C.Na2SO4D.K2SO46.要除去下列四种物质中的少量杂质(括号内物质为杂质)。
甲:CaCO3(NaHCO3)乙:NaOH(Na2CO3)丙:KCl(KHCO3)丁:炭粉(氧化铜)可选用的试剂及操作方法有:①加适量盐酸,搅拌,过滤②加适量水,搅拌,过滤③加适量盐酸,蒸发④溶解,加适量石灰水,过滤,蒸发下列组合正确的是()A.甲—②,乙—④B.乙—③,丙—③C.丙—①,丁—②D.丙—③,丁—④7.下列实验操作中一定要用到玻璃棒的是()①过滤②蒸发③溶解④取液体试剂⑤取固体试剂A.①②③B.④⑤C.①④D.①③⑤8..可以用水、烧杯、玻璃棒、过滤器等在常温或加热下分离的物质是()A.CaO、CaCO3B.BaSO4、NaClC.Fe、AgClD.NH4NO3、K2SO49..氯碱厂的原料工业食盐因含CaCl2、MgCl2等杂质,使用前必须精制,回答下列有关问题:(1)精制过程中发生反应的化学方程式为。
人教版高中化学 必修一 第一章达标检测(解析版)
第一章达标检测一、选择1.体操运动员比赛时为了防滑,常在手掌上涂抹碳酸镁粉末。
碳酸镁属于( ) A.酸B.碱C.盐D.氧化物2.化学概念在逻辑上存在如下关系:对下列概念间的关系说法正确的是( )A.纯净物与混合物属于包含关系B.单质与化合物属于交叉关系C.氧化还原反应与化合反应属于并列关系D.化合物与氧化物属于包含关系3.实验室里有4个药品橱,已经存放以下物品:实验室新购进一些碘,应该将这些碘放在( )A.甲橱B.乙橱C.丙橱D.丁橱4.化合反应、分解反应、置换反应和复分解反应是四种基本化学反应类型。
下列变化属于氧化还原反应,但不属于四种基本反应类型的是( )A.CO+CuO Cu+CO₂B.2Al+Fe₂O₃Al₂O₃+2FeC.2O₃3O₂ D.Cl₂+2FeCl₂=2FeCl₃5.某胶体遇盐卤( MgCl₂.6H₂O)或石膏(CaSO₄.2H₂O)易发生聚沉,而与食盐水或Na₂SO₄溶液相遇聚沉的效果就差一些。
下列有关说法不正确的是( )A.该胶体中胶体粒子直径的大小约为10¯⁹~ 10¯⁷ mB.该胶体粒子带正电荷C.Na⁺使此胶体聚沉的效果不如Ca²、Mg²⁺D.该胶体遇BaCl₂溶液或Fe(OH)₃胶体可发生聚沉6.下列反应既是离子反应,又是氧化还原反应的是( )A.氯化钠溶液中滴入硝酸银溶液B.金属钠在氯气中燃烧C.铁片置于硫酸铜溶液中D.氢氧化钠溶液与稀硫酸反应7.下列离子方程式书写正确的是( )A.氢氧化钡与稀硫酸反应:Ba²⁺+OH¯+H⁺+SO-24=BaSO₄O₃+H₂OB.Al₂O₃溶于盐酸中:O²¯+2H⁺=H₂OC.铜和硝酸银溶液反应:Cu+Ag⁺= Cu²⁺+AgD.Cu(OH)₂中加入硝酸:Cu(OH)₂+2H⁺=Cu²⁺+2H₂O8.下列各组物质相互混合后,不会发生离子反应的是( )A.Na₂SO₄溶液和MgCl₂溶液B.Na₂CO₄溶液和稀硫酸C.NaOH溶液和Fe₂(SO₄)₃溶液D.Ca(OH)₂和盐酸9.甲、乙、丙、丁四种易溶于水的物质,分别由NH+4、Ba²⁺、Mg²⁺、H⁺、OH¯、Cl¯、SO-24、HCO-3中的不同阳离子和阴离子各一种构成,将甲溶液分别与其他三种物质的溶液混合,均有白色沉淀生成,则甲为( )A.Ba(HCO₃)₂B.Ba(OH)₂C.Mg(HCO₃)₂D.MgSO₄10.离子方程式BaCO₃+2H⁺= CO₂↑+H₂O+Ba²⁺中的H⁺不能代表的物质是( )①HCl ②H₂SO₄③HNO₃④NaHSO₄⑤CH₃COOHA.①③B.①④⑤C.②④⑤D.①⑤11.下列各组离子能在呈酸性的无色溶液中大量共存的是( )A.Ba²⁺、Na⁺、NO-3、MnO-4B.Mg²⁺、Cl¯、Al3+、SO-24C.K⁺、OH¯、HCO-3、NO-3D.Ca²⁺、Na⁺、Fe³⁺、SO-2412.甲、乙、丙、丁四位同学分别进行实验,测定四份不同澄清溶液的成分,记录如下:其中记录合理的是( )A.甲B.乙C.丙D.丁13.下列反应中,盐酸既表现出酸性,又表现出还原性的是( )A.Zn+2HCl=ZnCl₂+H₂↑B.MnO₂+4HCl(浓)MnCl₂+Cl₂↑+2H₂OC.CuO+2HCl=CuCl₂+H₂OD.AgNO₃+HCl=AgC↓+HNO₃14.某同学在做实验时引发了镁失火,他立即拿起二氧化碳灭火器欲把火扑灭,却被实验老师及时制止。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
必修1第一章《从实验学化学》测试题一、单项选择题(共10小题,每小题3分,共30分。
)1.下列实验基本操作(或实验注意事项)中,主要是出于实验安全考虑的是A.实验剩余的药品不能放回原试剂瓶B.可燃性气体的验纯C.气体实验装置在实验前进行气密性检查D.滴管不能交叉使用2.实验向容量瓶转移液体操作中用玻璃棒,其用玻璃棒的作用是A.搅拌 B.引流 C.加速反应 D.加快热量散失3.标准状况下的1mol H e的体积为A.11.2L B.22.4L C.33.6L D.44.8L4.下列关于阿伏加德罗常数的说法正确的是A. 阿伏加德罗常数是一个纯数,没有单位B. 阿伏加德罗常数就是×1023C.阿伏加德罗常数是指1mol的任何粒子的粒子数 D.阿伏加德罗常数的近似值为:×1023mol-1 5. 16g某元素含有×1023个原子,则该元素原子的相对原子质量为A.1 B. 126.关于2molO2的叙述中,正确的是A.体积为44.8L B.质量为32gC.分子数为×1023 D.含有4mol原子7.在1mol H2SO4中,正确的是A.含有1mol H B.含有×1023个氢原子C.含有×1023个分子 D.含有×1023个氧原子8.下列溶液中,溶质的物质的量浓度为L的是A.1L溶液中含有4g NaOH B.1L水中溶解4gNaOHC.0.5L溶液中含有 H2SO4 D.9.8g H2SO4溶于1L水配成溶液9.1mol/L H2SO4的含义是()A、1L水中含有1mol H2SO4B、1L溶液中含有1mol H+C、将98gH2SO4溶于1L水中配成的溶液D、该溶液c(H+)=2mol/L10. 下列溶液中,Cl-的物质的量浓度与50mL 3mol/LNaCl溶液中Cl-物质的量浓度相等是A.150mL 3mol/LKCl溶液 B.150m L 1mol/LAlCl3溶液C.50mL3mol/LMgCl2溶液 D.75mL LMgCl2溶液11.下列溶液中,跟100mL L NaCl溶液所含的Cl-物质的量浓度相同的是() A.100mL L MgCl2溶液 B.200mL L CaCl2溶液C.50ml 1mol/L NaCl溶液 D.25ml L HCl溶液12.配制一定物质的量浓度的NaOH溶液时,造成实验结果偏低的是()A.定容时观察液面仰视 B.定容时观察液面俯视C.有少量NaOH溶液残留在烧杯中 D.容量瓶中原来有少量蒸馏水13.8g无水硫酸铜配成L的水溶液,下列说法正确的是()A.溶于500mL水中 B.溶于1L水中C.溶解后溶液的总体积为500mL D.溶解后溶液的总体积为1L14、0.5L1mol/LFeCl3溶液与0.2L1mol/L KCl溶液中n(Cl—)之比为()A、1﹕1B、3﹕1C、15﹕2D、5﹕215、在1L溶有和 MgCl2的溶液中,c(Cl—)为()A、LB、LC、LD、L二、多项选择题(共6小题,每小题5分,共30分。
每小题至少有2个选项正确,少选且正确得2分,错选、未选不得分)11.下列说法正确的是A.摩尔是七个基本单位之一,符号为mol B.1 mol 任何物质都含有×1023个分子C.标准状况下,任何气体的摩尔体积为22.4 L/molD.摩尔质量在数值上等于该物质的相对分子质量或相对相对原子质量13.下列叙述正确的是A.相同条件下,相同体积的气体,其气体分子物质的量也相等B.相同条件下,等物质的量的甲烷和一氧化碳所含的分子数一定相等C.相同条件下,若物质的量相同的物质,则它们所含的体积也相同D.相同条件下的一氧化碳气体和氮气,若体积相等,则质量也相等14.下列实验操作中叙述正确的是A.萃取操作实验试经常用的仪器是:分液漏斗B.分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出C.容量瓶用蒸馏水洗涤后不烘干就使用D.为了便于操作,浓溶液稀释或固体溶解可直接在容量瓶中进行15.下列说法正确的是(N A表示阿伏加德罗常数的值)A.1mol H2中含有的电子数为2N A B.标准状态下,1mol水所含的氧原子数为1N AC.常温常压下,28g氮气所含的原子数为2N A D.2g氢气所含的氢原子数为N A16.下列溶液中,Cl-的物质的量浓度与50mL 1mol/LAlCl3溶液中Cl-物质的量浓度相等是A.150mL 3mol/LKCl溶液 B.75mL LMgCl2溶液C.50mL1mol/LNaCl溶液 D.50m L 2mol/LAlCl3溶液三、填空题(共40分)实验室里将粗盐制成精盐的过程中,在溶解、过滤、蒸发三个步骤的操作中都要用到玻璃棒,分别说明在这三种情况下使用玻璃棒的目的;溶解时:。
过滤时: 。
蒸发时: 。
简要计算题:(1) H 2O 中,含有氢原子的物质的量为多少它有多少个分子(2) H 2SO 4含有多少摩尔氧原子含有多少g 硫原子若完全电离,可电离出多少个H +人教版必修1第二章《化学物质及其变化》测试题(B 卷)一、单项选择题(共10小题,每小题3分,共30分。
)1.下列物质属于电解质的是A .CuB .N 2C .KNO 3D .乙醇2.下列生产、生活中的事例不属于...氧化还原反应的是 A .金属冶炼 B .石灰水粉刷墙壁 C .食物腐败 D .燃放鞭炮3.现榨的苹果汁在空气中会由淡绿色变为棕黄色,其原因可能是( )。
A .苹果汁中的Fe2+变成Fe3+B .苹果汁含有Cu2+C .苹果汁含有OH −D .苹果汁含有Na+5.下列反应的离子方程式不.正确的是 A .锌与硫酸铜溶液反应: Zn + Cu 2+ = Zn 2+ + Cu B .氢氧化钠与盐酸反应: OH - + H + = H 2OC .铁与稀盐酸反应:2Fe + 6H + = 2Fe 3+ + 3H 2↑ D.氯化钡与硫酸反应: Ba 2+ +SO 42- = BaSO 4↓6.下列反应中必须加入还原剂才能进行的是A .Zn → Zn 2+B .H 2 → H 2OC .CaO → Ca(OH)2D .CuO → Cu10.在甲、乙两烧杯溶液中,含有大量的Cu 2+、Na +、H +、SO 42-、CO 32-、OH- 6种离子。
已知甲烧杯的溶液呈蓝色,则乙烧杯的溶液中大量存在的离子的是A .Cu 2+、H +、SO 42-B .Na +、OH -、CO 32-C .CO 32-、OH -、SO 42-D .Na +、H +、SO 42-二、多项选择题(共6小题,每小题5分,共30分。
每小题至少有2个选项正确)11.氢气还原氧化铜:CuO + H 2 △ Cu + H 2O ,在该反应中A .CuO 做还原剂B .CuO 做氧化剂C .铜元素化合价降低D .铜元素化合价升高14.下列反应中,盐酸既表现出酸性又表现出氧化性的是( )。
A .MnO2 + 4HCl (浓) ═══ MnCl2 + Cl2↑+ 2H2OB .HCl + AgNO3 ═══ AgCl ↓ + HNO3C .Zn + 2HCl ═══ ZnCl2 + H2↑D .2HCl ═══ H2↑ + Cl2↑ 15.在下列三个反应中:①SO2 + 2NaOH ══Na2SO3 + H2O ,②SO2 + 2H2S ══3S ↓+ 2H2O , ③SO2 + Cl2 + 2H2O══ H2SO4 + 2HCl ,二氧化硫所起的作用( )。
△通电Z X Y A 、相同 B 、不同 C 、是氧化剂的作用 D 、是还原剂的作用16.图表示的一些物质或概念间的从属关系中正确的是三、填空题(共40分)18.(6分)从氧化还原反应的角度看,在制备下列三种气体时,盐酸起什么作用:(填序号)制备H 2 Zn + 2HCl = ZnCl 2 + H 2 ↑ 盐酸起 作用制备Cl 2 MnO 2 + 4HCl = MnCl 2 + 2H 2O + Cl 2↑ 盐酸起 作用制备CO 2 CaCO 3 + 2HCl = CaCl 2 + H 2O + CO 2↑ 盐酸起 作用A .氧化剂B .还原剂C .既是氧化剂又是还原剂D .既不是氧化剂也不是还原剂19.我国古代四大发明之一的黑火药是由硫黄粉、硝酸钾和木炭粉按一定比例混合而成的,爆炸时的反应为:S+2KNO3+3C=K2S+N2↑+3CO2↑。
该反应中还原剂是________,氧化剂是________。
20.(1)请用双线桥画出得失电子的情况,并指明该反应的氧化剂、氧化产物、以及被氧化的物质①C+H 2O CO+H 2 ②2Na+2H 2O=2NaOH+H 2↑ 人教版必修1第三章《金属及其化合物》测试题一、单项选择题(共10小题,每小题3分,共30分。
)1.下列物质中,属于合金的是A .青铜B .明矾C .水银D .刚玉2.下列金属在一定条件下能够与水反应,且生成金属氧化物的是A .KB .MgC .FeD .Cu3.下列氧化物投入稀盐酸中,能形成无色透明溶液的是A .MgOB .CuOC .Fe 2O 3D .FeO4.下列关于金属铝及其化合物的叙述正确的是A .铝在常温下不能与氧气反应B .铝在化学反应中容易失去电子,是氧化剂C .铝与盐酸或强碱溶液反应都能放出氢气D .氧化铝只能与酸反应,不能与碱反应5.下列关于钠的化合物的叙述错误..的是 A .过氧化钠可用于呼吸面具中作为氧气的来源 B .过氧化钠与水反应放出氢气C .碳酸钠进行焰色反应,火焰呈黄色D .碳酸钠溶液中滴入酚酞溶液,溶液显红色X Y Z A .酸 含氧酸 纯净物 B .电解质 盐 化合物 C .胶体 分散系 物质 D . 碱性氧化物 氧化物 化合物6.钠与水反应时产生的各种现象如下:①钠浮在水面上;②钠沉在水底;③钠熔化成小球;④小球迅速游动逐渐减小,最后消失;⑤发出嘶嘶的声音;⑥滴入酚酞后溶液显红色。
其中正确的一组是A.①②③⑥ B.①②③④⑤ C.①③④⑤⑥ D.全部7.下列反应的离子方程式正确的是A.稀盐酸滴在石灰石上: CO32-+2H+= CO2↑+H2OB.氯化铝溶液加入过量氨水: Al3++3OH-= Al(OH)3↓C.铜与硝酸银溶液反应: Cu +Ag+= Ag + Cu2+D.碳酸氢钠溶液中加入稀硝酸: HCO3-+H+= CO2↑+H2O8.金属钠投入足量水中,反应后生成气体的质量为A.0.025g B.0.05g C.0.25g D.0.5g9.镁铝合金与盐酸完全反应后,加入过量的氢氧化钠溶液,最后的结果是A.没有沉淀物生成 B.只有氢氧化铝沉淀生成C.只有氢氧化镁沉淀生成 D.有氢氧化铝和氢氧化镁沉淀生成10.把少量废铁屑溶于过量的稀硫酸,过滤,除去杂质,在滤液中加入适量硝酸,再加入过量的氨水,有红褐色沉淀生成。
