人教版高中化学必修1:氨
2020届人教版高中化学必修1 最基础考点系列: 考点14 氨的性质含答案

考点14 氨的性质【考点定位】本考点考查氨的性质,涉及氨的结构与物理性质、氨气的还原性及氨水的弱碱性,掌握氨水喷泉实验的操作要点及常见氨气的制备原理与实验装置。
【精确解读】1.氨的物理性质:①氨是无色、有刺激性气味的气体,比空气轻;②氨易液化.在常压下冷却或常温下加压,气态氨转化为无色的液态氨,同时放出大量热.液态氨气化时要吸收大量的热,使周围的温度急剧下降;③氨气极易溶于水.在常温、常压下,1体积水中能溶解约700体积的氨气(因此,氨气可进行喷泉实验);④氨对人的眼、鼻、喉等粘膜有刺激作用.若不慎接触过多的氨而出现病症,要及时吸入新鲜空气和水蒸气,并用大量水冲洗眼睛.2.氨分子的结构:NH3的电子式为,结构式为,氨分子的结构为三角锥形,N原子位于锥顶,三个H原子位于锥底,键角107°18′,是极性分子.3.氨的化学性质:①跟水反应.氨气溶于水时(氨气的水溶液叫氨水),大部分的NH3分子与H2O分子结合成NH3•H2O(叫一水合氨).NH3•H2O为弱电解质,只能部分电离成NH4+和OH-:NH3+H2O⇌NH3•H2O⇌NH4++OH-a.氨水的性质:氨水具有弱碱性,使无色酚酞试液变为浅红色,使红色石蕊试液变为蓝色.氨水的浓度越大,密度反而越小(是一种特殊情况).NH3•H2O不稳定,故加热氨水时有氨气逸出:NH4++OH-=NH3↑+H2Ob.氨水的组成:氨水是混合物(液氨是纯净物),其中含有3种分子(NH3、NH3•H2O、H2O)和3种离子(NH4+和OH-、极少量的H+).c.氨水的保存方法:氨水对许多金属有腐蚀作用,所以不能用金属容器盛装氨水.通常把氨水盛装在玻璃容器、橡皮袋、陶瓷坛或内涂沥青的铁桶里.d.有关氨水浓度的计算:氨水虽然大部分以NH3•H2O形式存在,但计算时仍以NH3作溶质.②跟氯化氢气体的反应:NH3+HCl=NH4C1说明:a.当蘸有浓氨水的玻璃棒与蘸有浓盐酸的玻璃棒靠近时,产生大量白烟.这种白烟是氨水中挥发出来的NH3与盐酸挥发出来的HCl化合生成的NH4C1晶体小颗粒.b.氨气与挥发性酸(浓盐酸、浓硝酸等)相遇,因反应生成微小的铵盐晶体而冒白烟,这是检验氨气的方法之-.c .氨气与不挥发性酸(如H 2SO 4、H 3PO 4等)反应时,无白烟生成.③跟氧气反应:4NH 3+5O 2催化剂 △4NO+6H 2O 说明:这一反应叫做氨的催化氧化(或叫接触氧化),是工业上制硝酸的反应原理之一.4.氨气的用途:①是氮肥工业及制造硝酸、铵盐、纯碱的原料;②是有机合成工业如合成纤维、塑料、染料、尿素等的常用原料;③用作冰机中的致冷剂【精细剖析】1.喷泉实验的原理中学教材中喷泉实验装置如右图所示。
人教高中化学必修1全册课件:第四节《氨硝酸硫酸》第一课时

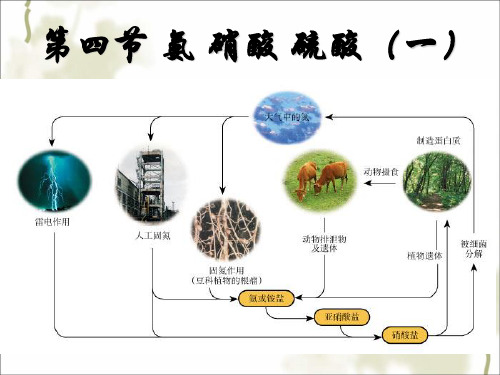
一、氨 阅读材料:
2004年4月20日上午10时,杭州市一 制冷车间发生液氨泄漏事件,整个厂区 是白茫茫的一片,方圆数百米,空气中 弥漫着一股浓烈的刺激性气味。厂区内 寒气逼人。
思考:氨气有哪些物理性质?
[实 验4—8] 氨的性质,注意观察现象。
现象:烧杯中的水由玻璃导管进入 烧瓶形成红色的喷泉。
NH4Cl △= NH3 ↑ + HCl ↑ NH4HCO3 △= NH3 ↑ + H2O ↑ + CO2 ↑ (NH4)2CO3 △= 2NH3 ↑ + H2O ↑ + CO2 ↑
由上面的反应可以看出, NH4Cl 、 NH4HCO3、 (NH4)2CO3 受热都能分解,都有NH3产生,但不是所有的铵盐受热分 解都能产生NH3的,例如NH4NO3的分解:
2NH4Cl+Ca(OH)2=△=2NH3↑+2H2O+CaCl2
(3)制取装置:
固固加热装置
棉花的作用: 防止空气对流,保证 氨气纯度
④集气方法:向下排空气法
⑤验满方法: ①将湿润的红色石蕊试纸置于试管口(试纸变蓝) ②将蘸有浓盐酸的玻璃棒靠近试管口(白烟)
⑥干燥方法: 碱石灰(CaO和NaOH混合物)等碱性干燥剂 注意:无水CaCl2不能用来干燥NH3(形成CaCl2.8NH3)
小结:浓硫酸的脱水性是指浓硫酸能把有机物中 的氢氧原子按2∶1(H2O)的个数比脱去。
吸水性、脱水性的比较
性质
吸水性
脱水性
吸收物质中的游 吸收对 离水、水蒸气、 将有机物中的氢、氧
象 结晶水,直接与 元素按水的比例脱去 水分子结合
本
质
与水发生水合作 用,放出热量
高中化学人教版氨的教案

高中化学人教版氨的教案
一、教学目标
1. 知识目标:了解氮气的性质及用途,掌握氨的物理性质和化学性质;
2. 能力目标:能够分析氨的合成反应,勾画氨的制备工艺流程,运用氨的化学性质解决实际问题;
3. 情感目标:培养学生对环境保护和能源利用的意识,培养学生勤奋学习、积极探究的品质。
二、教学重点和难点
1. 了解氨的制备方法和应用;
2. 掌握氨的物理性质和化学性质。
三、教学过程
1. 导入新课:介绍氨的性质,引发学生对氨的好奇和探究欲望。
2. 学习氨的物理性质和化学性质,进行实验验证,巩固学生对氨的认识。
3. 结合实际案例,讨论氨的应用领域和环保意义。
4. 学习氨的制备方法和化学合成反应,引导学生分析氨的合成原理。
5. 分组讨论,设计氨的制备工艺流程,展示学生的创造力和解决问题的能力。
6. 总结本节课的知识点,激励学生对化学学科的探索和研究。
四、教学评价
1. 课堂表现:听课认真、思维活跃、能积极回答问题、能有效运用所学知识解决问题;
2. 作业表现:书写规范、内容详实、用词准确、理解透彻;
3. 实验操作:注意安全、操作规范、数据准确、结论明确。
五、教学反思
通过本节课的教学,学生对氨的性质和应用有了更深入的理解,同时也加深了对氨制备方法和化学反应的认识。
在未来的教学中,可以增加更多案例引导学生探究氨在环保和生产中的重要性,激发学生的学习兴趣,提高学生的学习效果。
高中化学教案氨

教学目标:1. 理解氨的物理性质和化学性质。
2. 掌握氨的制备方法和用途。
3. 能够解决相关氨化学问题。
教学重点和难点:重点:氨的性质和用途。
难点:氨的化学性质和其与其他物质的反应。
教学准备:实验器材:氨水、盐酸、氢氧化钠等。
课本:有关氨的知识点。
图表:相关实验原理和结果图表。
教学过程:一、导入:通过有趣的实例引入氨的概念和作用,激发学生对氨的兴趣。
二、讲解氨的性质:1. 介绍氨的物理性质(无色、刺激性气味、易挥发等)和化学性质(碱性、与酸等物质发生反应)。
2. 展示实验现象,让学生亲自操作观察和体会氨的性质。
三、探讨氨的制备方法:1. 介绍氨的制备方法(氨水和氢氧化铵的反应、氨气与氢氮气的合成等)。
2. 分析不同制备方法的优缺点,并让学生进行讨论。
四、探讨氨的用途:1. 介绍氨在工业生产、医药、化肥等方面的广泛应用。
2. 分析氨的用途对人类生活和环境的影响,让学生思考如何合理利用和管理氨资源。
1. 安排相关实验,让学生进行氨的制备和性质实验。
2. 引导学生观察、记录实验现象并进行分析。
六、总结回顾:对本节课学习内容进行总结,强调氨的重要性和用途,激发学生对化学的兴趣和探究欲望。
板书设计:氨的性质:物理性质、化学性质氨的制备方法:氨水和氢氧化铵的反应、氨气与氢氮气的合成氨的用途:工业生产、医药、化肥等作业布置:1. 思考并写出氨在不同领域的应用情况。
2. 撰写氨的化学性质及与其他物质的反应实验报告。
教学反思:本节课注重通过实验操作,引导学生深入理解氨的性质和用途,培养学生独立思考和解决问题的能力。
同时,激发学生对化学知识的兴趣和探究欲望,使得化学教学更生动有趣。
人教版高中化学必修一第四章第四节氨硝酸硫酸

(3)若V L烧瓶充满标况下的氨气,喷泉实验后溶液充满
整个烧瓶,所得溶液的物质的量浓度是
1 22.4
。mol/L
2、氨气的化学性质 (1)氨与水反应
NH3+H2O
NH3 H2O
NH4++OH-
关于氨水——氨的水溶液
① 氨水中含有的主要微粒有:
分子:H2O、NH3、NH3•H2O 离子:NH4+、OH注意:计算氨水的质量分数时,以NH3为溶质。 ② 氨水密度小于水(氨水浓度越大,密度越小)
③ NH3•H2O不稳定
△
NH3•H2O == NH3+ H2O
氨水是一种不稳定、易挥发的一元弱碱
讨论1:在1L 1mol/L的氨水中( D ) A、含有1mol NH3 B、含NH3和NH4+的物质的量之和为1mol C、含1mol NH3• H2O D、含NH3、 NH3• H2O和NH4+的物质的量之和为1mol
注意:NH4Cl受热分解,产生的气体冷却又生成NH4Cl,
NH4HCO3 NH3↑+H2O+CO2↑
都产生NH3,
△
非氧化还原反应
(NH4)2CO3 = 2NH3 ↑ + H2O + CO2 ↑
2NH4NO3△= 4H2O + 2N2 ↑ +O2 ↑ 无NH3产生,是氧化还原反应 注意:不是所有的铵盐受热分解都生成氨气。
保存:硝酸盛放于棕色瓶中,置于冷暗处
2、强氧化性
浓氨水 CaO
讨论2:通常情况下能大量共存,并且都能用浓硫酸和碱石灰
干燥的是( B )
A、NH3、NO、HCl C、H2S、SO2、O2
B、N2、H2、O2 D、NO、NO2、O2
高中化学 氨课件 新人教必修1

(3)作致冷剂。
●典例精析
【例1】 某无色混合气体可能有CO、CO2、 NH3、HCl、H2、水蒸气中的一种或几种,当 依次通过澄清石灰水(无浑浊现象),氢氧化 钡溶液(有浑浊现象),浓硫酸、灼热的氧化 铜(变红)和无水硫酸铜(变蓝)时,则可断定该 混合气体中一定有
NH3+H2O NH3·H2O NH+ 4 +OH- 弱 (2)白烟 NH3+HCl===NH4Cl 4NH3+5O2催==化△==剂= 4NO+6H2O
(3)易 易 碱 NH4Cl==△===NH3↑+HCl↑, NH4HCO3==△===NH3↑+H2O+CO2↑; NH4NO3+NaOH==△===NaNO3+H2O+NH3↑
温馨提示:①NH+ 4 的检验:在含有 NH+ 4 的溶液中加 入强碱并加热,用湿润的红色石蕊试纸检验,若试纸变蓝, 则证明原溶液中含有 NH+ 4 。②铵盐受热都易分解,但不 一定都放出氨气。如,2NH4NO3==△===2N2↑+O2↑+4H2O。 ③铵盐与强碱的反应可用来检验 NH+ 4 的存在。其离子方 程式:浓溶液或加热时写为
【氨与氯化氢反应的实验探究】
实验步骤:用两根玻璃棒分别在浓氨水和浓 盐酸里蘸一下,然后使这两根玻璃棒接近(不 要接触),观察发生的现象(如图)。
实验现象:可以看到,当两根玻璃棒接近时, 产生大量白烟。
实验结论:这种白烟是氨水挥发出的NH3与 盐酸挥发出的HCl化合生成微小的NH4Cl晶体。
2.氨的性质:
(1)氨气的物理性质:
_______________________________________。 氨气的水溶液叫氨水,写出氨气与水反应以 及电离的方程式 _______________________________________ ___,氨气有________(填“强”或“弱”)碱 性。
人教版高中化学精品系列 必修一 氨气 课件
△
2NH3+H2SO4 ==(NH4)2SO4
催化剂
2 NO + O2 === 2NO2 3NO2 + H2O === 2HNO3 + NO
催化剂
△
制硝酸
2NH3+CO2 ==== CO(NH2)2+ H2O
NH3(g)
放热 吸热
制尿素
NH3(l) 制冷剂
NH3 水
酚酞
【实验现象】 : 烧杯中的水进入烧 瓶中,形成红色的 喷泉。 ——“ 喷 泉 实 验 ”
①烧瓶里为什么会形成喷泉? ②胶头滴管的作用是什么? ③烧瓶中的溶液为什么变成红色?
①烧瓶内外产生压强差。
②引发“喷泉”实验 ③水溶液呈碱性,有OH-离子存在。
一、氨(NH3): 1.氨的物理性质: 颜色: 无色 气味: 有刺激性气味 状态: 气体 密度: 比空气的密度小 水溶性:极易溶于水(1:700)
氨易液化.
2.氨气的化学性质: ⑴氨与水反应: NH3+H2O NH3· H2O 一水合氨
氨的溶解更主要的是化学反应。 氨溶于水时,大部分氨与水结合, 形成一水合氨(NH3· H2O)。
NH3· H2O可以部分电离形成NH4 和OH ,所以氨水显弱碱性。
NH3· H2O
NH3+H2O
+
NH4
NH3· H2O
++OH-
NH4++OH-
【小结】:氨水的成分 分子:NH3、H2O、NH3· H2 O 离子:NH4+、OH-等
【探究实验】:
将氨的酚酞溶液倒入栓有小气球的试管 中,加热。
高中化学必修1 第四章 第四节 氨 硝酸 硫酸

(2)强氧化性: 浓硝酸和稀硝酸都能与铜发生反应: • 4HNO3(浓)+ Cu ═ Cu(NO3)2 + 2NO2 ↑ + 2H2O
H2SO4 ═
Zn H2SO4 +
Cu(OH)2 CuO BaCl2
2H+ + SO42变红
ZnSO4 + H2↑
CuSO4 + 2H2O CuSO4 + H2O BaSO4 +
@皮皮课件
紫色石蕊试液
2HCl
17
第二章 硫酸和硝酸的氧化性
2.2 硫酸 A.浓硫酸的特性:
① 吸水性:
向蔗糖中加入浓硫酸时,蔗糖变黑,体积 膨胀,变成疏松多孔的海绵状炭,并放出 刺激性气味。
@皮皮课件
20
第二章 硫酸和硝酸的氧化性
2.2 硫酸
小贴士
有些气体可以用浓硫酸干燥,有些气体却不能用浓硫酸干燥:
能用浓硫酸干燥的气体: H2、O2、N2、CO、CO2、CH4、SO2、HCl、Cl2
不能用浓硫酸干燥的气体:
① 碱性气体(NH3) ② 还原性气体(H2S、HI、HBr)
@皮皮课件 21
• 氧化非金属单质:
加热盛有浓硫酸和木炭的试管,碳就被氧化成二 氧化碳,而硫酸被还原为二氧化硫。
C + 2H2SO4(浓)
==
CO2↑ +
2SO2↑ + 2H2O
@皮皮课件
24
第二章 硫酸和硝酸的氧化性
2.4 硫酸的用途
@皮皮课件
25
第二章 硫酸和硝酸的氧化性
2.5 硝酸
(1)不稳定性(易分解): 4HNO3 ═ 4NO2 + 2H2O + O2↑
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1900年法国化学家勒夏特利是最先研究氢
气和氮气在高压下直接合成氨的反应。很 可惜,由于他所用的氢气和氮气的混合物 中混进了空气,在实验过程中发生了爆炸。 在没有查明发生事故的原因的情况下,就 放弃了这项实验。德国化学家能斯特,对 于研究具有重大工艺价值的气体反应有兴 趣,研究了氮、氢、氨的气体反应体系, 但是由于他在计算时,用了一个错误的热 力学据,以致得出不正确的理论,因而认 为研究这一反应没有什么前途,把研究停 止了。
1.原理:2NH4Cl+Ca(OH)2=CaCl2+2NH3 +2H2O 2.记忆规律: NH4Cl,熟石灰,加热反应制HNO3
制取装置同O2,收集方法下排气 干燥要用碱石灰,检验要湿红纸石蕊 3.注意:不能用CaCl2,P2O5,浓H2SO4干燥NH3 CaCl2+8NH3=CaCl2. 8NH3 2NH3+H2SO4=(NH4)2SO4 棉花团作用:防止空气对流,制取较 纯NH3
N2+3H2=2NH3(高温高压催化剂)
• NH3是一种无色的有刺激性气味的有
1
毒气体,相对分子质量为17,密度 比空气小。
2 • NH3极易溶于水,V水:VNH3=1:700
3 • NH3极易液化,常用作制冷剂。
N原子采取 杂化sp3 NH3为三角锥形
与水反应 NH3溶于水得到氨水 NH3+H2O=NH4OH=NH4++OH-(可逆)
2NH3+3Cl2=N2+6HCl 8NH3+3Cl2=N2+6NH4Cl 5NH3+3Cl2=N2+3NH4Cl+3HCl NH3+3Cl2=NCl3+3HCl(催化剂) 2NH3+3CuO=N2+3Cu+3H2O(加热) 4NH3+6NO=5N2+6H2O(催化剂) 8NH3+6NO2=7N2+12H2O(催化剂) NO2+NO+2NH3=2N2+3H2O(催化剂)
氨
目录
一. 氨的存在与发现 二. 氨的物理性质 三. 氨的结构 四. 氨的化学性质 五. 氨的实验室制法 六. 氨的用途
重难点
※ 氨的化学性质 ※ 氨的实验室制法
1727年英国的牧师、化学家哈尔斯,用氯化铵 与石灰的混合物在以水封闭的曲颈瓶中加热, 只见水被吸入瓶中而不见气体放出。1774年化 学家普利斯德里重作这个实验,采用汞代替水 来密闭曲颈瓶,制得了碱空气(氨)。他还研 究了氨的性质,发现它易溶于水、可以燃烧, 还发现在氨气中通以电火花时,其容积增加很 多,而且分解为两种气体;一种是可燃的氢气; 另一种是不能助燃的氮气。从而证实了氨是氮 和氢的化合物。其后戴维等化学家家继续研究, 进一步证实了2容积的氨通过火花放电之后, 分解为1容积的氮气和3容积的氢气。
4.NH3的检验方法:
a.将红色湿润的石蕊试纸放在试管口,若试 纸变蓝,则证明生成的气体是NH3.
b.用玻璃棒蘸取浓盐酸放在试管口,若产生 白烟,则证明生成的气体是NH3.
5.快速制取少量氨气: 将浓氨水滴加到生石灰或氢氧化钠固体或
碱石灰中。
♣农业上用于制造氮肥,植物 固氮合成自身所需物质。 ♣化学上用于制造硝酸,铵盐 的原料。 ♣工业上用于做制冷剂。
氨水中含 3分子:NH4OH、NH3、H2O
3离子:NH4+、OH-、H+(少)
NH4OH不稳定,受热易分解 NH4OH=NH3↑+H2HCl=NH4Cl(会有白烟生成) NH3+HNO3=NH4NO3(会有白烟生成) 2NH3+H2SO4=(NH4)2SO4
氧化反应
4NH3+5O2=4NO+6H2O(催化剂、加热) 4NH3+3O2=2N2+6H2O(加热)
虽然在合成氨的研究中化学家遇到的困难不少, 但是,德国的物理学家、化工专家哈伯和他的学 生勒罗塞格诺尔仍然坚持系统的研究。起初他们 想在常温下使氨和氢反应,但没有氨气产生。又 在氮、氢混合气中通以电火花,只生成了极少量 的氨气,而且耗电量很大。后来才把注意力集中 在高压这个问题上,他们认为高压是最有可能实 现合成反应的。根据理论计算,表明让氢气和氮 气在600℃和200个大气压下进行反应,大约可能 生成8%的氨气。
