《物理化学第4版》第四章4-3 拉乌尔定律和亨利定律ppt课件
合集下载
物理化学:第4章_多组分系统热力学_
Vm*,B Vm*,C Vm*,B xC
真实混合物:实曲线
Vm xBVB xCVC VB (VC VB)xC
当混合物组成改变时,两组 分偏摩尔体积随之改变,且二者 变化相互关联。
组成接近某纯组分,其偏摩 尔体积也接近该纯组分摩尔体积。
5. 吉布斯 − 杜亥姆方程
对广度量 X (T , p, nB, nC , nD ,) 求全微分:
dX
X T
p,nB
dT
X p
T ,nB
dp
B
X nB
dnB T , p,nC
恒温、恒压
另一方面,由加和公式
,恒温恒压下求导:
比较两式,得
或
或
吉布斯-杜亥姆方程--在一定温度压力下,当混合物
组成变化时,各组分偏摩尔量变化的相互依赖关系。
➢ 系统中各组分的偏摩尔量并非完全独立,而是相 互依存的。
➢ 例:固体溶解、过饱和溶液析出、…
组分B在α、β两相中迁移达平衡的条件:该组分
在两相中的化学势相等。
➢ 物质总是从其化学势高的相向化学势低的相迁移, 直至物质迁移达平衡时为止,此时系统中每个组分在 其所处的相中的化学势相等。
化学势 判据
② 化学平衡
<0:自发不可逆; =0:平衡、可逆
任一化学反应,假定系统已处于相平衡,
任一组分B在每个相中的化学势都相等: Bα B
B
B
整个系统中B组分物质的量的变化量: dnBα dnB
α
BdnB
B
化学平衡时
平衡条件:与化学反应达到平衡的方式无关。
§4.3 气体组分的化学势
1、纯理想气体的化学势 2、理想气体混合物中任一组分的化学势 3、纯真实气体的化学势 4、真实气体混合物中任一组分的化学势
真实混合物:实曲线
Vm xBVB xCVC VB (VC VB)xC
当混合物组成改变时,两组 分偏摩尔体积随之改变,且二者 变化相互关联。
组成接近某纯组分,其偏摩 尔体积也接近该纯组分摩尔体积。
5. 吉布斯 − 杜亥姆方程
对广度量 X (T , p, nB, nC , nD ,) 求全微分:
dX
X T
p,nB
dT
X p
T ,nB
dp
B
X nB
dnB T , p,nC
恒温、恒压
另一方面,由加和公式
,恒温恒压下求导:
比较两式,得
或
或
吉布斯-杜亥姆方程--在一定温度压力下,当混合物
组成变化时,各组分偏摩尔量变化的相互依赖关系。
➢ 系统中各组分的偏摩尔量并非完全独立,而是相 互依存的。
➢ 例:固体溶解、过饱和溶液析出、…
组分B在α、β两相中迁移达平衡的条件:该组分
在两相中的化学势相等。
➢ 物质总是从其化学势高的相向化学势低的相迁移, 直至物质迁移达平衡时为止,此时系统中每个组分在 其所处的相中的化学势相等。
化学势 判据
② 化学平衡
<0:自发不可逆; =0:平衡、可逆
任一化学反应,假定系统已处于相平衡,
任一组分B在每个相中的化学势都相等: Bα B
B
B
整个系统中B组分物质的量的变化量: dnBα dnB
α
BdnB
B
化学平衡时
平衡条件:与化学反应达到平衡的方式无关。
§4.3 气体组分的化学势
1、纯理想气体的化学势 2、理想气体混合物中任一组分的化学势 3、纯真实气体的化学势 4、真实气体混合物中任一组分的化学势
《物理化学第4版》第四章4-4 理想液态混合物和理想稀溶液组分的化学势ppt课件

xB μΒ(l) B( g,T,p)
17
由相平衡条件,得 μΒ (l) = μΒ ( g) ①
设蒸气为理想气体
μΒ( g) = μΒ( g ,T) + RTln(pB /p ) ② 理想稀溶液,溶质 B 遵守亨利定律 pB = kx,B xB ( xB0 严格成立) ③
② ③代入①,得
18
B(l) B(g,T) RT ln(kx,B / p) RT ln xB
(2)无混合热效应,即
mixH = 0 ;
(3)混合过程为熵增大的过程,
即 mixS =-RnBlnxB> 0 ;
(4)混合过程可自发进行,是吉布斯函数减少的
过程,即 mixG =RTnBlnxB < 0。
14
三、理想稀溶液中组分的化学势
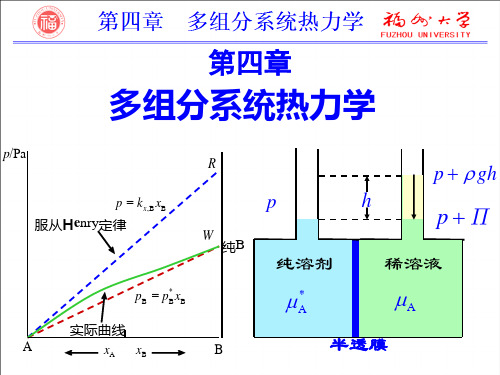
理想稀溶液的定义:溶剂 A 遵守拉乌 尔定律,溶质 B 遵守亨利定律的稀薄 溶液称为理想稀溶液。
分的分子间作用力相同,可表示为:
fAA=fBB=fAB (2)理想液态混合物中各组分的分
子体积大小几乎相同,可表示为:
VA=VB
6
2 、用拉乌尔定律定义理想液态混合物:
任一组分B在全部组成范围内 (xB=0xB=1)都严格遵守拉乌尔定律, 即pB=pB*xB的混合物称为理想液态混合 物。
7
3、 任一组分B的化学势:
当p p 时, 忽略积分项
B* (l,T , p) B(l,T , p) B(l,T )
所以
B
(l)
B
(l,T
)
RT
ln
xB
11
写为
B
(l)
B
(l)
RT
ln
xB
(0< xB<1)
17
由相平衡条件,得 μΒ (l) = μΒ ( g) ①
设蒸气为理想气体
μΒ( g) = μΒ( g ,T) + RTln(pB /p ) ② 理想稀溶液,溶质 B 遵守亨利定律 pB = kx,B xB ( xB0 严格成立) ③
② ③代入①,得
18
B(l) B(g,T) RT ln(kx,B / p) RT ln xB
(2)无混合热效应,即
mixH = 0 ;
(3)混合过程为熵增大的过程,
即 mixS =-RnBlnxB> 0 ;
(4)混合过程可自发进行,是吉布斯函数减少的
过程,即 mixG =RTnBlnxB < 0。
14
三、理想稀溶液中组分的化学势
理想稀溶液的定义:溶剂 A 遵守拉乌 尔定律,溶质 B 遵守亨利定律的稀薄 溶液称为理想稀溶液。
分的分子间作用力相同,可表示为:
fAA=fBB=fAB (2)理想液态混合物中各组分的分
子体积大小几乎相同,可表示为:
VA=VB
6
2 、用拉乌尔定律定义理想液态混合物:
任一组分B在全部组成范围内 (xB=0xB=1)都严格遵守拉乌尔定律, 即pB=pB*xB的混合物称为理想液态混合 物。
7
3、 任一组分B的化学势:
当p p 时, 忽略积分项
B* (l,T , p) B(l,T , p) B(l,T )
所以
B
(l)
B
(l,T
)
RT
ln
xB
11
写为
B
(l)
B
(l)
RT
ln
xB
(0< xB<1)
物理化学课件拉氏亨氏定律

pA (l ) pA ( s ) μ A ( g ) RTln μ A ( g ) RTln p p pA (l ) pA ( s)
o
a
Tf Tf
T
10
•稀溶液的凝固
Tf kf mB
R(Tf* ) 2 kf MA fus H m,A
Tf Tf* Tf
H2 O - NaCl(s)
252 K 218 K 262.5 K
H2O - CaCl2 (s) H 2 O - KCl(s) H2 O - NH4 Cl(s)
257.8 K 在冬天,为防止路面结冰,撒上盐,实际用的就 是冰点下降原理。融雪盐NaCl+CaCl2或NaCl+MgCl2
12
沸点上升(溶质不挥发)
2
亨利定律
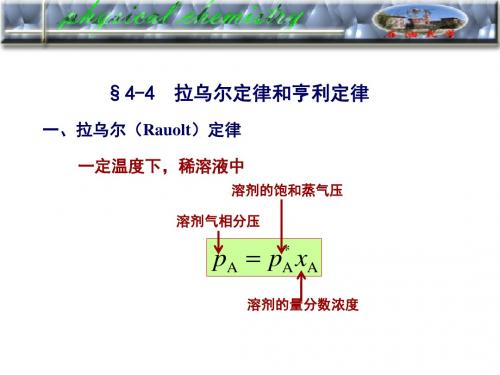
亨利定律:一定温度下, 稀溶液中挥发性溶质B在平衡 气相中的分压力pB与该溶质B在平衡液相中的摩尔分数 xB成正比.
pB = kx, BxB
kx, B 亨利常数, 与 T及溶剂, 溶质的性质
有关
• 开启易拉罐后, 压力减小, CO2气体的溶解度随之减 小, 从液体中释放出来.
• 热玻棒插入碳酸饮料中, 亨利常数随之增大, CO2 气体从液体中释放出来. 3
9
凝固点降低
凝固点降低: 在溶质B和溶剂A不生成固溶体的条件下, 当A 中溶有少量B后, 则从溶液中析出固态纯溶剂的温度, 就会 低于纯溶剂在同样外压下的凝固点.
A(l ) A * ( s )
pA
p(外)=常
数
A(g) A(l) A*(s)
μA (l ) μA ( s) 由相平衡条件
6
理想稀溶液
大学物理化学--第四章

由两种或两种以上物质以分子,原子或离子为 基本单元相互均匀混合而成的均匀系统。
混合物(mixture):对系统中的各组分采用同样 的标准态和研究方法,系统中的各组分是平等的。
溶液(solution): 各组分区分为溶剂(solvent) 和溶质(solute ),并对二者采用不同的标准态和研 究方法;系统中的各组分是不平等的。
偏摩尔量
XB
(
X nB
)T
,
p
,
,下标必须是
nC
T
,
p。, nC
只有广度量才有偏摩尔量(质量除外)。
偏摩尔量是强度量。
偏摩尔量随温度、压力、组成(浓度)变化而变, 与系统的总量无关。
上一内容 下一内容 回主目录
返回
2020/8/23
§4.1 偏摩尔量
偏摩尔量的加和公式
X nB X B
B
它的含义是:在一定温度、压力下,一定组成混合
物理化学电子教案—第四章
多组分系统热力学
上一内容 下一内容 回主目录
返回
2020/8/23
第四章 多组分系统热力学
目录
§4.1 偏摩尔量 §4.2 化学势 §4.3 气体组分的化学势 §4.4 逸度及逸度因子 §4.5 拉乌尔定律和亨利定律 §4.6 理想液态混合物 §4.7 理想稀溶液
§4.8 活度及活度因子 §4.9 稀溶液的依数性
标准态 kb,B ( p p )
实际溶液 pB - bB 关系曲线
pB
O
b
上一内容 下一内容 回主目录
bB
返回
2020/8/23
4.7 理想稀溶液
理想稀溶液中溶质的化学势
B(溶 质)
0 B(溶 质)
混合物(mixture):对系统中的各组分采用同样 的标准态和研究方法,系统中的各组分是平等的。
溶液(solution): 各组分区分为溶剂(solvent) 和溶质(solute ),并对二者采用不同的标准态和研 究方法;系统中的各组分是不平等的。
偏摩尔量
XB
(
X nB
)T
,
p
,
,下标必须是
nC
T
,
p。, nC
只有广度量才有偏摩尔量(质量除外)。
偏摩尔量是强度量。
偏摩尔量随温度、压力、组成(浓度)变化而变, 与系统的总量无关。
上一内容 下一内容 回主目录
返回
2020/8/23
§4.1 偏摩尔量
偏摩尔量的加和公式
X nB X B
B
它的含义是:在一定温度、压力下,一定组成混合
物理化学电子教案—第四章
多组分系统热力学
上一内容 下一内容 回主目录
返回
2020/8/23
第四章 多组分系统热力学
目录
§4.1 偏摩尔量 §4.2 化学势 §4.3 气体组分的化学势 §4.4 逸度及逸度因子 §4.5 拉乌尔定律和亨利定律 §4.6 理想液态混合物 §4.7 理想稀溶液
§4.8 活度及活度因子 §4.9 稀溶液的依数性
标准态 kb,B ( p p )
实际溶液 pB - bB 关系曲线
pB
O
b
上一内容 下一内容 回主目录
bB
返回
2020/8/23
4.7 理想稀溶液
理想稀溶液中溶质的化学势
B(溶 质)
0 B(溶 质)
多组分4-3讲课
pB kx,B xB
A xB
pA kx,A xA
B
pCS2 kx,CS2 xCS2
kx,A
稀 溶 液 区
若组分A在某浓度区间 符合拉乌尔定律,则在该
kx,B
稀 溶 液 区
区间内,组分B必遵从亨利
定律。
如丙酮与二硫化
pB *
pB p x
* B B
pA *
pA p x
* A A
碳体系:
xC3H4O 0.7 ~ 1.0
* pC3H4O pC x 3H 4O C3H 4O
A A A A A A A A A A A A A A
A
B B A A B A A B A B A B A
A
若A中加入大量B,
AB相互作用不可忽略,
上式不适用;
若B与A分子大小、性质很接近,使其相互作用 力近似相等: f AA f AB f BB 则在全部浓度范围内符合Raoult定律-理想溶液。
100 3 18.015 101325P a 91.3103 P a 100 3 3 18.015 46.069 3 46.069 kx 3 100 3 46.069 18.015
k x 930kPa
稀溶液浓度为
` x乙 0.02
p
` H 2O
p
* H2O
(1 x ) 89.5kPa
极稀溶液中
k x,B
kb,B MA
A
MA
kc,B
A
③
应用时注意
a. 溶质在气相和液相中的分子状态应相同
如HCl (g)溶于水中,电离出 H+、Cl-, 不适用;但溶于有机溶剂如苯、氯仿中是适 用的。 b. 对于混合气体(总压不大时),每种气体应分别 应用Henry定律。
亨利定律与拉乌尔定律的区别和联系

亨利定律与拉乌尔定律的区别和联系
亨利定律和拉乌尔定律都是物理化学的基本定律,二者区别和联系如下:
区别:
适用范围:亨利定律适用于气体在溶液中的溶解度,而拉乌尔定律适用于难挥发非电解质稀溶液的蒸气压。
定律形式:亨利定律形式为p=kX(A),其中p为气体分压,k为亨利常数,X(A)为气体A在溶液中的摩尔分数。
拉乌尔定律形式为p(B)=p X(B)=p(1-X(A)),其中p为溶剂饱和蒸气压,X(B)为溶剂在溶液中的摩尔分数,X(A)为溶质在溶液中的摩尔分数。
应用领域:亨利定律主要用于气体在液体中的溶解度计算,而拉乌尔定律主要用于蒸馏和吸收等过程的计算。
联系:
亨利定律和拉乌尔定律都是溶液热力学的基本定律,对相平衡和溶液热力学函数的研究起指导作用。
在一定温度下,气体在溶液中的溶解度与该气体溶在溶液内的摩尔浓度成正比,这是亨利定律的核心内容,也是拉乌尔定律的一个重要应用。
总之,亨利定律和拉乌尔定律虽然有不同的适用范围和形式,但都是溶液热力学的基本定律,对相平衡和溶液热力学函数的研究起指导作用。
物理化学电子教案—第四章.ppt

3. B的浓度 cB (又称为 B的物质的量浓度)
cB def
nB V
即B的物质的量与混合物体积V的比值
cB 单位是 mol m3
但常用单位是 mol dm3
cB [B]
2020-11-9
谢谢观赏
11
§4.2 多组分系统的组成表示法
4. B的摩尔分数 xB
xB def
nB nA
A
即指B的物质的量与混合物总的物质的量之比
(2) V 1 mol Vm*,B 1 mol Vm*,C
2020-11-9
谢谢观赏
形成了混合物 形成了溶液
18
多组分系统的热力学特征
但对于多组分均相系统, 仅规定 T 和 p系统的 状态并不能确定.下表给出100kPa、20℃时不同浓 度的100g乙醇水溶液体积的实验结果:
2020-11-9
谢谢观赏
7
§4.2 多组分系统的组成表示法
在均相的混合物中,任一组分B的浓度表示 法主要有如下几种:
1.B的质量浓度 2. B的质量分数 3. B的浓度 4. B的摩尔分数
2020-11-9
谢谢观赏
8
§4.2 多组分系统的组成表示法
1.B的质量浓度 B
B def m(B) /V
17
§4.3 偏摩尔量
多组分系统与单组分系统的差别 单组分系统的广度性质具有加和性
若1 mol单组分B物质的体积为
V* m,B
则2 mol单组分B物质的体积为
2
V* m,B
而1 mol单组分B物质和1 mol单组分C物质混合,
得到的混合体积可能有两种情况:
(1)
V
1
mol
V* m,B
物理化学第四章PPT

C
B K (C RT / P )
二、平衡常数的各种表示法 (2)用摩尔分数表示的平衡常数 K y
PB PyB K
( PyB / P )
B
B
B B (P / P ) yB
B
令 K y yB
B
B
K
B K y (P / P )
' g ' h (P / P ) ( P / P ) G H JP ' ( PA / P )a ( PB' / P )b
r Gm RT ln J P RT ln K
范特霍夫等温方程
一、 理想气体反应的标准平衡常数
r Gm
JP RT ln K
K Jp
$ p
r Gm 0 r Gm 0
CaCO3 (s) CaO(s) CO2 ( g )
三、有纯态凝聚相参加的理想气体反应的 K
r Gm B B 0
B
r Gm CO2 CaO CaCO3 0
B B RT ln( PB / P )
RT ln( P / P )
反应向右自发进行 反应向左自发进行 反应达平衡
K$ p Jp
K Jp
$ p
r Gm 0
一、 理想气体反应的标准平衡常数
例题 有理想气体反应 2H2(g)+O2(g)=2H2O(g),在2000K 时,已知 K=1.55×107。
(1)计算H2和O2分压各为1.00 ×104 Pa,水蒸气分压为1.00 ×105 Pa的混合气中,计算上述反应的△rGm,并判断反应自发 进行的方向; (2)当H2和O2的分压仍然分别为1.00 ×104 Pa时,欲使反应不 能正向自发进行,水蒸气的分压最少需要多大?
B K (C RT / P )
二、平衡常数的各种表示法 (2)用摩尔分数表示的平衡常数 K y
PB PyB K
( PyB / P )
B
B
B B (P / P ) yB
B
令 K y yB
B
B
K
B K y (P / P )
' g ' h (P / P ) ( P / P ) G H JP ' ( PA / P )a ( PB' / P )b
r Gm RT ln J P RT ln K
范特霍夫等温方程
一、 理想气体反应的标准平衡常数
r Gm
JP RT ln K
K Jp
$ p
r Gm 0 r Gm 0
CaCO3 (s) CaO(s) CO2 ( g )
三、有纯态凝聚相参加的理想气体反应的 K
r Gm B B 0
B
r Gm CO2 CaO CaCO3 0
B B RT ln( PB / P )
RT ln( P / P )
反应向右自发进行 反应向左自发进行 反应达平衡
K$ p Jp
K Jp
$ p
r Gm 0
一、 理想气体反应的标准平衡常数
例题 有理想气体反应 2H2(g)+O2(g)=2H2O(g),在2000K 时,已知 K=1.55×107。
(1)计算H2和O2分压各为1.00 ×104 Pa,水蒸气分压为1.00 ×105 Pa的混合气中,计算上述反应的△rGm,并判断反应自发 进行的方向; (2)当H2和O2的分压仍然分别为1.00 ×104 Pa时,欲使反应不 能正向自发进行,水蒸气的分压最少需要多大?
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
12
亨利定律只适用于平衡系统; 对于公式中的 k[%],B 冶金系统广泛应用, 我们称之为百分之一亨利系数。但是,冶 金行业仍称之为亨利系数。
13
三、 拉乌尔定律和亨利定律的应用 1、应用拉乌尔定律测定溶剂的相对蒸 气压下降 2、利用亨利定律求难溶气体的溶解度
3、计算挥发性溶质在平衡气相的组成
14
1、文字叙述:定温下,稀溶液中溶剂的蒸 气压pA等于纯溶剂的蒸气压pA*乘以溶液中 溶剂的摩尔分数xA。 2、数学表达式:
pA pA* xA
2
(1)式中的各量均指平衡状态下的性 质; (2)适用于稀溶液中的溶剂,xA1时 严格适用;一般而言,溶液愈稀愈接近 实际(分压)。
3
(3)对于双组分系统, xA =1 -xB, 则 pA= pA* xA= pA*(1-xB)
1、文字叙述:一定温度 下,微溶气体B在溶液中 的平衡组成xB与该气体在 气相中的平衡分压pB成正 比。即亨利定律。
pB g xB l
7
2、数学表达式:
pB=kx,BxB
式中, xB是挥发性溶质(即所溶解的气 体B) 在溶液中的摩尔分数. pB是平衡时液面上该气体的分压. kx,B 溶质组成用摩尔分数表示时的 亨利系数. 是一个常数,其数值与T、p 及溶剂、溶质的性质有关.
§4-3 拉乌尔定律和亨利定律
研究溶液中组分的热力学, 如化学 势,采用的基本方法仍然是研究与液相 组分呈平衡的气体的化学势. 因此,必须 知道液相组成与平衡气相分压有何关 系?这一关系由两个经验定律来描述.
1
一、拉乌尔定律
(法国化学家F.M.Raoult)
在溶剂中加入非挥发性溶质后,溶剂的 蒸气压降低, 1887年发表了定量关系.
bB (40
C)
pB kb,B (40
C)
2.026105 Pa 4.5106 Pa mol-1
kg
0.045 mol kg-1
19
在20℃,与该质量摩尔浓度的CO2水溶液 平衡的CO2气体压力为
pB (20 C) kb,B (20 C) bB (40 C) 2.6106 Pa mol-1 kg 0.045 mol kg-1 1.2105 Pa
16
对于xB = 0.015的未知溶液 : p = pA*xA + k x,B xB = 91294 Pa 0.985 + 9.3 105 Pa0.015 = 1.03 105 Pa
又因 pB = k x,B xB = pyB 所以 yB = k x,B xB / p = 9.3 105 Pa 0.015 / (1.03 105 Pa) = 0.14
17
[ 例] 在20℃和40℃,压力为常压的CO2在 1 kg水中分别可溶解1.7 g和1.0 g。如果用
最大可承受2.026105 Pa的瓶子保存该饮
料,问在20℃封装该饮料时所用CO2的压 力应低于多少才能确保这种瓶装饮料在
40℃下也不爆裂?
解:
kb,B (20
C)
pB (20 C) bB (20 C)
[ 例] 质量分数 wB = 0.03 的乙醇水溶液在 外压为 101325Pa时的沸点为370.3 K, 该温
度下 p水* = 91294 Pa , 求(1) xB = 0.015 的
乙醇水溶液在 370.3 K的蒸气压 ; (2) 与
上述溶液平衡的蒸气的组成 yB .
解: 取 100g溶液作为计算基准
xB
pA* pA pA*
p pA*
表明:溶剂蒸气压的下降值与纯溶剂蒸
气压之比等于溶液中溶质的摩尔分数。
4
(4)若溶质不止一种,则 xB= p /pA*
(5)上述公式中,组分 A、B 的组成只 能用摩尔分数; (6)计算 xA 的 A 在平衡气相和平衡液相 必须有相同的分子结构。
5
对拉乌尔定律的微观理解: 以溶质不挥发的稀溶液为例,
因溶质含量很少,溶质分子的存 在引起分子间力的改变可忽略, 每个溶剂分子进入气相的概率与 纯溶剂相同 ; 但由于溶质占据了 部分溶剂分子位置,减少了单位 时间内可能离开液相表面而进入 气相的溶剂分子数目, 导致蒸气压 按比例( xA )下降。
溶剂分子 溶质分子
图 对拉乌尔定律的 微观理解
6
二.亨利定律(Henrys Law;1803年)
0
xB
1
图 亨利常数所在的假想态
10
当溶质的组成用 bB ( 或[%B] )表示时, 亨利定律可表示成:
pB = k[%],B [%B] pB = kb,B bB
11
亨利定律的应用对象是稀溶液中的溶 质,当xB时严格适用;
溶质在两相中的分子形态必须相同; 对于同一个溶液,pB只有一个,但是 组成可以有不同的表示, 因而亨利系数 也不同。
xB
3.0g 12
18.0g.mol 1
xA = 1- 0.012= 0.988
15
对于已知溶液: p pA* xA kx,BxB
所以 k x,B = ( p- pA*xA ) / xB
= ( 101325 - 91294 0.988 )Pa/ 0.012 = 9.3 105 Pa
1.01325105 Pa (1.7g kg-1)/44g mol-1
2.6106 Pa mol-1 kg 18
kb,B (40
C)
pB (40 C) bB (40 C)
1.01325105 Pa (1.0g kg-1)/44g mol-1
4.5106 Pa mol-1 kg
在40℃,与压力为2.026105 Pa的CO2气体 平衡的CO2水溶液的质量摩尔浓度
20
A
pA*
为 溶
剂
pB
的 稀
kx,A 溶
液 区
图解比较
T 一定
0
A
xB
图 4-1 A-B双组分的 p - x图
B 为 溶 剂
A
的 pB*
稀 溶 液 区
kx,B
1.0 B
21
8
比较可见,亨利定律在形式上与拉 乌尔定律相似, 但比例系数kx的物理意
义与拉乌尔定律中的pA* 不同.
kx反映的是溶质分子受到溶剂分子 的引力作用,而不是溶剂与溶剂,也不是 溶质与溶质相互作用. 因此,其数值与T、 p及溶剂、溶质的性质有关.
9
pB 亨利定律
kx,B
pB=kx,BxB
pB*
实验压力
亨利定律只适用于平衡系统; 对于公式中的 k[%],B 冶金系统广泛应用, 我们称之为百分之一亨利系数。但是,冶 金行业仍称之为亨利系数。
13
三、 拉乌尔定律和亨利定律的应用 1、应用拉乌尔定律测定溶剂的相对蒸 气压下降 2、利用亨利定律求难溶气体的溶解度
3、计算挥发性溶质在平衡气相的组成
14
1、文字叙述:定温下,稀溶液中溶剂的蒸 气压pA等于纯溶剂的蒸气压pA*乘以溶液中 溶剂的摩尔分数xA。 2、数学表达式:
pA pA* xA
2
(1)式中的各量均指平衡状态下的性 质; (2)适用于稀溶液中的溶剂,xA1时 严格适用;一般而言,溶液愈稀愈接近 实际(分压)。
3
(3)对于双组分系统, xA =1 -xB, 则 pA= pA* xA= pA*(1-xB)
1、文字叙述:一定温度 下,微溶气体B在溶液中 的平衡组成xB与该气体在 气相中的平衡分压pB成正 比。即亨利定律。
pB g xB l
7
2、数学表达式:
pB=kx,BxB
式中, xB是挥发性溶质(即所溶解的气 体B) 在溶液中的摩尔分数. pB是平衡时液面上该气体的分压. kx,B 溶质组成用摩尔分数表示时的 亨利系数. 是一个常数,其数值与T、p 及溶剂、溶质的性质有关.
§4-3 拉乌尔定律和亨利定律
研究溶液中组分的热力学, 如化学 势,采用的基本方法仍然是研究与液相 组分呈平衡的气体的化学势. 因此,必须 知道液相组成与平衡气相分压有何关 系?这一关系由两个经验定律来描述.
1
一、拉乌尔定律
(法国化学家F.M.Raoult)
在溶剂中加入非挥发性溶质后,溶剂的 蒸气压降低, 1887年发表了定量关系.
bB (40
C)
pB kb,B (40
C)
2.026105 Pa 4.5106 Pa mol-1
kg
0.045 mol kg-1
19
在20℃,与该质量摩尔浓度的CO2水溶液 平衡的CO2气体压力为
pB (20 C) kb,B (20 C) bB (40 C) 2.6106 Pa mol-1 kg 0.045 mol kg-1 1.2105 Pa
16
对于xB = 0.015的未知溶液 : p = pA*xA + k x,B xB = 91294 Pa 0.985 + 9.3 105 Pa0.015 = 1.03 105 Pa
又因 pB = k x,B xB = pyB 所以 yB = k x,B xB / p = 9.3 105 Pa 0.015 / (1.03 105 Pa) = 0.14
17
[ 例] 在20℃和40℃,压力为常压的CO2在 1 kg水中分别可溶解1.7 g和1.0 g。如果用
最大可承受2.026105 Pa的瓶子保存该饮
料,问在20℃封装该饮料时所用CO2的压 力应低于多少才能确保这种瓶装饮料在
40℃下也不爆裂?
解:
kb,B (20
C)
pB (20 C) bB (20 C)
[ 例] 质量分数 wB = 0.03 的乙醇水溶液在 外压为 101325Pa时的沸点为370.3 K, 该温
度下 p水* = 91294 Pa , 求(1) xB = 0.015 的
乙醇水溶液在 370.3 K的蒸气压 ; (2) 与
上述溶液平衡的蒸气的组成 yB .
解: 取 100g溶液作为计算基准
xB
pA* pA pA*
p pA*
表明:溶剂蒸气压的下降值与纯溶剂蒸
气压之比等于溶液中溶质的摩尔分数。
4
(4)若溶质不止一种,则 xB= p /pA*
(5)上述公式中,组分 A、B 的组成只 能用摩尔分数; (6)计算 xA 的 A 在平衡气相和平衡液相 必须有相同的分子结构。
5
对拉乌尔定律的微观理解: 以溶质不挥发的稀溶液为例,
因溶质含量很少,溶质分子的存 在引起分子间力的改变可忽略, 每个溶剂分子进入气相的概率与 纯溶剂相同 ; 但由于溶质占据了 部分溶剂分子位置,减少了单位 时间内可能离开液相表面而进入 气相的溶剂分子数目, 导致蒸气压 按比例( xA )下降。
溶剂分子 溶质分子
图 对拉乌尔定律的 微观理解
6
二.亨利定律(Henrys Law;1803年)
0
xB
1
图 亨利常数所在的假想态
10
当溶质的组成用 bB ( 或[%B] )表示时, 亨利定律可表示成:
pB = k[%],B [%B] pB = kb,B bB
11
亨利定律的应用对象是稀溶液中的溶 质,当xB时严格适用;
溶质在两相中的分子形态必须相同; 对于同一个溶液,pB只有一个,但是 组成可以有不同的表示, 因而亨利系数 也不同。
xB
3.0g 12
18.0g.mol 1
xA = 1- 0.012= 0.988
15
对于已知溶液: p pA* xA kx,BxB
所以 k x,B = ( p- pA*xA ) / xB
= ( 101325 - 91294 0.988 )Pa/ 0.012 = 9.3 105 Pa
1.01325105 Pa (1.7g kg-1)/44g mol-1
2.6106 Pa mol-1 kg 18
kb,B (40
C)
pB (40 C) bB (40 C)
1.01325105 Pa (1.0g kg-1)/44g mol-1
4.5106 Pa mol-1 kg
在40℃,与压力为2.026105 Pa的CO2气体 平衡的CO2水溶液的质量摩尔浓度
20
A
pA*
为 溶
剂
pB
的 稀
kx,A 溶
液 区
图解比较
T 一定
0
A
xB
图 4-1 A-B双组分的 p - x图
B 为 溶 剂
A
的 pB*
稀 溶 液 区
kx,B
1.0 B
21
8
比较可见,亨利定律在形式上与拉 乌尔定律相似, 但比例系数kx的物理意
义与拉乌尔定律中的pA* 不同.
kx反映的是溶质分子受到溶剂分子 的引力作用,而不是溶剂与溶剂,也不是 溶质与溶质相互作用. 因此,其数值与T、 p及溶剂、溶质的性质有关.
9
pB 亨利定律
kx,B
pB=kx,BxB
pB*
实验压力
