分离植物内生真菌操作流程
植物内生菌分离处理方法汇总

d植物内生菌分离处理方法刘明志。
南方红豆杉产紫杉醇内生真菌的分离。
热带亚热带植物学报,2011,19(4):360~364剥取红豆杉的老树皮,截成2~3 cm长的小段,去除树皮层,先用75%酒精中浸泡30 s,无菌水冲洗3次,再用0.1%升汞溶液浸泡8 min,无菌水冲洗3~5次。
用无菌滤纸吸干表面水分,用无菌解剖刀将小段切成0.5 cm左右长的小块,接种于加有100 mg L-1青霉素和链霉素的PDA固体培养基表面。
每皿放置10块,依次编号,置于25℃恒温培养箱中培养。
幼茎内生菌的分离方法同上,将幼茎切成1 cm长的小段,以伤口断面垂直接种于PDA固体培养基上培养。
红豆杉叶片内生菌的分离采用两种方法,第一种方法与树皮内生菌的分离方法类似,分离时将叶片切成2至3段,接种于PDA固体培养基上;第二种方法是将叶片消毒后用无菌研钵研磨成匀浆液,然后将研磨液倾倒于PDA固体培养基上,置于25℃恒温培养箱中培养。
1刘金花。
黄花蒿内生菌的分离与初步鉴定。
2011,33(4):27~30黄花蒿的根,茎,叶,叶切成1cm2,茎和叶切成1cm左右小段(两端皆有切口),将根,茎,叶一次用75%酒精浸1min,再用1%的次氯酸钙溶液浸,置于含双抗的VA培养基平板培养泡1min,用无菌水冲洗5次。
待切口处长出菌落后转至PDA培养基进行内生真菌的分离。
2宋培勇,珙桐内生细菌的分离鉴定及系统发育分析,2011, 38(1): 8?13将采集的新鲜珙桐的茎、叶和叶柄分别用流水冲洗, 风干表面水分, 剪成小块或小段,无菌水漂洗 2 次, 75%酒精浸泡 1 min, 再用 2%NaClO 溶液中浸泡 3 min, 转入 75%酒精中浸泡 30 s,接着用无菌水漂洗 3 次, 平放于 NA 平板上, 28 °C培养 2?3 d。
取最后一次漂洗液涂布 NA 平板作为对照。
内生菌分离和纯化。
将 NA 平板上组织块下或周缘长出的菌落或菌苔划线稀释分离 1-2 次直到获得纯培养3孙传伯。
植物病原菌分离方法

病原菌分离方法一、实验原理:植物患病组织内的真丝菌丝体,如果给予适宜的环境条件,除了个别种类外,一般都能恢复生长和繁殖。
植物病原菌的分离就是指通过人工培养,重染病植物组织中将病原真菌与其他杂菌相分开并从寄主植物中分离出来,再将分离得到的病原菌于适宜环境内纯化,这个过程总称植物病原的分离培养。
二、实验用具:酒精灯、手术剪、镊子、75%酒精、3%~5%次氯酸钠、灭菌水、培养皿、封口膜、乳酸等三、实验前的准备工作:1、煮培养基(PDA):马铃薯200g,葡萄糖20g,琼脂粉(AGAR)20g(10:1:1)水1000ml(1)将去皮称量好的马铃薯切片后加水煮沸15~20min(水可以适量多加200ml 左右,因为在煮的过程中会蒸发一些),待土豆煮软即可。
(2)三层纱布滤去马铃薯后将过滤的水倒入洗净的锅中,加琼脂粉搅拌充分后再加热煮沸,小火使其充分融化。
(3)加入葡萄糖并不断搅拌,待其完全融化后双层纱布过滤,定容到1000ml,分装到500ml的玻璃瓶内,每个玻璃瓶最多装300ml,121℃湿热灭菌30min。
2、培养皿干热灭菌170℃1h;蒸馏水、枪头等湿热灭菌121℃30min。
四、实验步骤:1、用75%酒精擦拭超净工作台,所有器具用紫外灯灭菌30min,分离室要保持清洁。
2、取样,病斑大小约20个(含病缘线)3、分装培养基:(1)融PDA,松盖在微波炉中加热约3min(看量多少而定)(2)待冷却至50℃后在超净工作台指示灯显绿灯时分装(3) 分装时滴入一管乳酸约20滴(每10ml培养基中加3滴乳酸)(4)左手拿培养皿并将皿盖在火焰附近打开一缝,迅速倒入培养基约15m1(300ml一瓶的培养基倒20多个平板),加盖后轻轻摇动培养皿,使培养基均匀分布在培养皿底部,然后平置于桌面上,待凝后即为平板。
4、表面消毒:(1)75%的酒精3ml~4ml没过样表面10s,快速吸掉酒精(2)3%~5%次氯酸钠(现配现用、避光)10ml消毒2~3min(3)无菌水冲洗2~3次5、转样:(1)器具经酒精灯消毒后无菌水水洗(2)培养皿上写明名称、分离时间后,在酒精灯旁转五点于培养基上。
6实验六内生菌的分离

表面消毒效果的常用检验方法:有两种。
(1) 漂洗液检验法,即把最后一次漂洗灭菌材料的漂洗液吸取0.2~0.3ml涂布 于固体平板上。每个处理重复3次,培养48h,观察有无菌落产生。 (2) 组织印迹法,即把经灭菌、无菌水漂洗过的材料置于固体平板上保留几分 钟,然后移去样品。于28℃培养48小时,检查表面消毒是否彻底。据此验证此 消毒方法是否能全部杀死供试材料。表面消毒检验方法的评价标准为表面消毒 检验培养皿中菌落数量越多菌落出现的时间越早说明该表面消毒检验方法的灵 敏度越高 c.分离培养。组织块培养法表面消毒后的植物组织根或茎在无菌条件下用手术 刀纵 向或横向切割将切口紧贴于分离培养基上。研磨液法表面消毒后的植物组织部 位无菌条件下用PBS 缓冲液研磨研磨液8 层无菌纱布过滤取200 L 直接涂布于 各分离培养基28 下培养36 天。 酵母液处理取0.5mL 研磨液和2mL 含6 酵母粉和0.05 SDS 的PBS 缓冲液混和 160rpm 40 振荡20min 同时将该液稀释10 倍和100 倍后分别取三个梯度的研 磨处理液200 L 涂布于各分离培养基28 下培养36 天。
2.分离方法: ⑴内生细菌 表面灭菌: 将块茎用自来水冲洗干净,在无菌操作台上,依次用 75%的乙醇和次氯酸钠(有效cl-10%)分别进行表面消毒五分钟, 再用无菌水漂洗块茎三次。为了检验表面灭菌的效果,用灭菌过的 镊子夹住块茎,使其表面与固体平板接触3~5 min,然后将培养皿 放在22℃~25℃的温箱中培养3~5d。若发现皿中无菌落出现,证 明该块茎表明灭菌彻底,否则,该分离结果不能使用。 ⑵取样: 用打孔器(d=10 mm)从茎基部插入薯块,取出样品, 用灭菌的手术刀切取10 mm(包括维管束环),置于研钵中(De Boer,1974)。 ⑶样品处理: 研磨样品,加无菌水定容至10ml,静置30 min后,梯 度稀释到浓度为10-1~10-4,取0.2ml涂布于BPA平板上,每浓度 涂平皿一个,重复三次,置于22℃~25℃温箱中培养。 ⑷纯化和保存: 培养3~5d后,挑取不同形态的菌落重新于固体平 板上划线纯化,然后,真空冷冻干燥保存,备用。
植物内生菌分离处理方法

刘明志。
南方红豆杉产紫杉醇内生真菌的分离。
热带亚热带植物学报,2011,19(4):360~364剥取红豆杉的老树皮,截成2~3 cm长的小段,去除树皮层,先用75%酒精中浸泡30 s,无菌水冲洗3次,再用0.1%升汞溶液浸泡8 min,无菌水冲洗3~5次。
用无菌滤纸吸干表面水分,用无菌解剖刀将小段切成0.5 cm左右长的小块,接种于加有100 mg L-1青霉素和链霉素的PDA固体培养基表面。
每皿放置10块,依次编号,置于25℃恒温培养箱中培养。
幼茎内生菌的分离方法同上,将幼茎切成1 cm长的小段,以伤口断面垂直接种于PDA 固体培养基上培养。
红豆杉叶片内生菌的分离采用两种方法,第一种方法与树皮内生菌的分离方法类似,分离时将叶片切成2至3段,接种于PDA固体培养基上;第二种方法是将叶片消毒后用无菌研钵研磨成匀浆液,然后将研磨液倾倒于PDA固体培养基上,置于25℃恒温培养箱中培养。
1刘金花。
黄花蒿内生菌的分离与初步鉴定。
2011,33(4):27~30黄花蒿的根,茎,叶,叶切成1cm2,茎和叶切成1cm左右小段(两端皆有切口),将根,茎,叶一次用75%酒精浸1min,再用1%的次氯酸钙溶液浸,置于含双抗的V A培养基平板培养泡1min,用无菌水冲洗5次。
待切口处长出菌落后转至PDA培养基进行内生真菌的分离。
2宋培勇,珙桐内生细菌的分离鉴定及系统发育分析,2011, 38(1): 8−13将采集的新鲜珙桐的茎、叶和叶柄分别用流水冲洗, 风干表面水分, 剪成小块或小段,无菌水漂洗2 次, 75%酒精浸泡 1 min, 再用2%NaClO 溶液中浸泡 3 min, 转入75%酒精中浸泡30 s,接着用无菌水漂洗3 次, 平放于NA 平板上, 28 °C培养2−3 d。
取最后一次漂洗液涂布NA 平板作为对照。
内生菌分离和纯化。
将NA 平板上组织块下或周缘长出的菌落或菌苔划线稀释分离1-2 次直到获得纯培养3孙传伯。
植物病原菌分离方法

植物病原菌分离方法第四章植物病原菌分离与纯化植物病原菌一、植物病原菌分离流程二、分离的准备分离的准备工作无菌室操作前保持清洁无菌接种工作准备培养基的准备分离材料选择以收获的材料从病健交界处采样果实腐烂从开始腐烂处分离根腐和枯萎层可能从离土较远处分离有些枯萎如野火病被固定在局部,从病斑边缘分不到等有些材料污染严重时可先接种再分离:即将病组织接种到健康材料等发病后分离组织表面消毒⑴升汞:1‰◆升汞1g HCl(浓)25ml 水1000ml◆升汞先溶于盐酸中,加水后稀释,也可用NaCl 5g/L 代替盐酸,但易沉淀◆作用:盐酸,NaCl增加溶解度,HCl能增强杀菌能力。
◆处理时间:30’S-30min不等,常3-5min;所需时间因材料不同而异,消毒后灭菌水3-5次附在组织表皮的气泡,含使消毒剂不能与寄生表面直接通气影响消毒效果,除气泡抽气、70%酒精浸2-3秒⑵漂白粉◆常用表面消毒剂适用于病组织表面消毒,也可处理种子◆成分:漂白粉10g,水140ml,过滤后使用。
◆最好现配现用,放久失效,有效成分CaClO次氯酸钙◆好的消毒液易使有色纸褪色,且产生氯气有强烈臭味。
◆一般3-5min,时间长短因材料不同而不同。
处理种子5-10min,长的可达20-30min。
优点:杀菌能力强,具有挥发性,不会遗留在组织上影响分离结果,其杀菌能力小于升汞。
(3)酒精:70%,浸很短时间(几秒到1min)灭菌水洗。
◆较大的材料在酒精中浸或棉花擦,然后在火焰烧去。
◆幼嫩的病组织,表面用药剂消毒时可能会同时杀死其中的病原真菌,消毒时间应尽量缩短。
比较安全的方法是不用药剂消毒,而以灭菌水换洗八九次。
培养基的准备●分离失败的原因,有时是由于培养基不适宜。
寄生性细菌对培养基的要求要比腐生性细菌严格。
一种适宜于纯培养的培养基不一定适宜于分离(杂菌太多)●有时分离失败的原因不是培养基的成分不适宜,而是由于培养基的酸度不适当或存放的时间太长。
【精品】植物病原真菌的分离培养

【精品】植物病原真菌的分离培养植物病原真菌的分离培养是植物病害学研究中的常规技术,它是诊断病原微生物的重要手段。
通过环境、罹病组织或病株上的真菌分离,可以准确地确定病原物种,病害发生的原因和病害防治的策略。
本文将介绍植物病原真菌的分离培养方法及其注意事项。
一、实验材料1. 植物体、果实或病株。
2. 无菌匀质培养基:具备营养丰富,pH约为7.0,含有适量的蔗糖、氨基酸、维生素和矿物质元素。
3. 无菌器具:试管、培养皿、匀质棒、无菌酒精灯、注射器等。
二、分离方法1. 选材:选择患病植物或病株,减少环境污染的干扰,以便于真菌分离和培养。
2. 分离:在实验室中进行无菌操作,将病株或罹病组织的表皮割去,注意不要带皮层或子叶,然后用30%的酒精或75%的酒精消毒5-10秒,沥干后放入无菌盘中。
3. 培养:将培养基煮沸,冷却后加入抗生素,避免杂菌污染,用培养皿接种盘,置于26℃左右的恒温箱中孵育。
初次孵育检查时间视病原真菌的生长速度而定,通常在1-2周内可见初生菌丝和菌落。
如果没有生长或生长极为缓慢,可能需要增加孵育时间或重新分离。
4. 子培养:将孵育的菌落通过匀质棒挑选到其他含有抗生素的培养基中,进行子培养,以保证分离出的真菌种属的准确性。
如培养子菌落中有杂菌或真菌菌落与初步分离的不一致,应重新分离。
5. 稳定培养:对于经过检查并确认是病原真菌的菌株,应进行深层冻存或贮存,以免失掉纯度,同时要做好鉴定记录。
三、注意事项1. 操作要无菌,防止环境污染,避免误诊。
2. 病株样品与周围环境隔离,减少环境干扰。
3. 选用适当的培养基,保证真菌菌落的生长和营养。
4. 操作时注意安全,避免接触真菌孢子、毒素等对人体有害的物质。
5. 菌落的检查应在暗的环境下进行,以免光照影响观察结果。
四、结语植物病原真菌的分离培养是诊断和定位植物病害的一个重要工具。
通过正确的操作方法和注意事项,可以准确地分离出病原菌,并对其性质和特征进行鉴定和确认。
(整理)植物内生菌分离处理方法
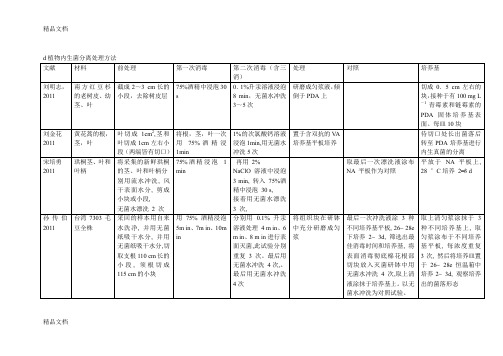
d植物内生菌分离处理方法文献材料前处理第一次消毒第二次消毒(含三消)处理对照培养基刘明志,2011 南方红豆杉的老树皮、幼茎、叶截成2~3 cm长的小段,去除树皮层75%酒精中浸泡30s0.1%升汞溶液浸泡8 min,无菌水冲洗3~5次研磨成匀浆液,倾倒于PDA上切成0.5 cm左右的块,接种于有100 mg L-1青霉素和链霉素的PDA固体培养基表面。
每皿10块刘金花2011 黄花蒿的根,茎,叶叶切成1cm2,茎和叶切成1cm左右小段(两端皆有切口)将根,茎,叶一次用75%酒精浸1min1%的次氯酸钙溶液浸泡1min,用无菌水冲洗5次置于含双抗的V A培养基平板培养待切口处长出菌落后转至PDA培养基进行内生真菌的分离宋培勇2011 珙桐茎、叶和叶柄将采集的新鲜珙桐的茎、叶和叶柄分别用流水冲洗, 风干表面水分, 剪成小块或小段,无菌水漂洗2 次75%酒精浸泡 1min再用2%NaClO 溶液中浸泡3 min, 转入75%酒精中浸泡30 s,接着用无菌水漂洗3 次,取最后一次漂洗液涂布NA 平板作为对照平放于NA 平板上,28 °C培养2−3 d孙传伯2011 台湾7303毛豆全株采回的样本用自来水洗净, 并用无菌纸吸干水分, 并用无菌纸吸干水分,切取支根110 cm长的小段, 须根切成115 cm的小块用75% 酒精浸泡5m in、7m in、10min分别用0.1% 升汞溶液处理4 m in、6m in、8 m in进行表面灭菌,此试验分别重复3次。
最后用无菌水冲洗4次,。
最后用无菌水冲洗4次将组织块在研钵中充分研磨成匀浆最后一次冲洗液涂3种不同培养基平板, 26~ 28e下培养2~ 3d, 筛选出最佳消毒时间和培养基, 将表面消毒彻底棉花根部切块放入灭菌研钵中用无菌水冲洗4次,取上清液涂抹于培养基上。
以无菌水冲洗为对照试验。
取上清匀浆涂抹于3种不同培养基上, 取匀浆涂布于不同培养基平板, 每浓度重复3次, 然后将培养皿置于26~ 28e 恒温箱中培养2~ 3d, 观察培养出的菌落形态精品文档张鑫2011 植物圣罗勒的健康叶子将叶子用流水冲洗10 min1% 的次氯酸钠中浸泡10min0.02 mol / L、pH7.0 的无菌磷酸钾缓冲液( PB) 漂洗4 次加无菌水将材料研磨涂布培养李铭, 2011 石耳目地衣为了诱导产孢,黑化菌株在光照/黑暗( 12 h∶12h) 条件下,于2%的PDA培养基上,18℃下培养 3 个月刘杰凤2011 健康的小白菜,染病的小白菜根,茎,叶流水冲洗干净,剪成小段75%酒精中浸泡3min10%次氯酸钠浸泡茎为8 min,根和叶由于气孔较茎大,浸泡5 min即可,然后用无菌水浸泡多次,每次3 min无菌条件下用适量的PBS缓冲液捣碎以最后一次的漂洗液作对照,30 ℃下培养一个星期搅拌后静置3 min,取上清液0.5 mL分别涂布于分离培养基平板上,每种材料做3次平行精品文档朱士茂2011 新采集的银杏枝条,叶子和根在自来水中冲洗干净,然后将枝条和根截成 3 -4cm长,将叶子和叶柄分开,分别将根,枝,叶放在不同的灭菌后的广口瓶中(一),根的表面灭菌: 0. 1%的土温20 消毒1min,无菌蒸馏水冲洗 2次。
分离植物内生真菌操作流程

分离植物内生真菌操作流程1.材料准备:植物样本、剪刀、镊子、70%乙醇、3%次氯酸钠(本实验用4%84)、酒精灯、计时器、平板、锥形瓶,无菌水,离心管(带盖,灭菌)、打开无菌操作台灭菌30min。
(1)植物样本的采集:选取生长状态良好,不要有病斑或者枯枝烂叶,每种植物采取三株标本,要带有叶子、叶柄和枝条及其他部位,将样本名字写在小纸条上放在装标本的袋子里,采下来的标本与写有名字的纸条一同拍照,样本上有脏东西时,请用纸轻轻擦掉,若不清楚植物名字,请将整棵植物拍照留用于鉴定,并做好相关记录。
(2)制作PDA固体培养基,在无菌操作台中倒平板,每瓶250ml的培养基大概倒15个板,待其凝固后用于接种。
2.清洗:认真用清水将标本洗净,洗去标本表面的灰尘,去除枯叶,备用。
3.取样:(1)在叶片的左上、右上、左下,右下和正中五个部位进行取样,剪取5mm*5mm的叶片,如果是叶柄或枝干,则剪取5~10mm,若是比较粗的枝干或圆圆的果实之类的,总之比较大的,则将它切开,再剪取样本,样本不要剪的太大或太小。
(2)每种植物的叶子,叶柄,枝干等其他部位,每种部位接种两块板,大板每个要接种五个样本即左上、右上、左下,右下和正中,小板每个接种四个样本即左上、右上、左下,右下,计算好所要剪的样本数,尽量多剪几个,以免后面的表面灭菌中冲洗时被冲掉。
(3)若植物标本有剩余,且是没有洗过的,重新装好,放到冰箱里,备用,洗过的扔掉。
(4)每种植物标本所剪的样本放在一个50ml的离心管中,放在试管架上,并且每个离心管上要标好所对应的植物标本。
4.表面灭菌:在无菌操作台中进行(1)先向各离心管内倒入适量(10~20ml)70%乙醇,拧紧盖子,用计时器开始计时1min,每10秒钟晃动离心管几次,使其充分灭菌。
(2)1min后,拧松盖子,将乙醇倒入事先准备的锥形瓶中,注意不要将管中样本倒出,倒出的样本不要再放入其中,也不要用手碰到样本,样本不可以接触到除了离心管以外的东西。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
分离植物内生真菌操作流程
1.材料准备:植物样本、剪刀、镊子、70%乙醇、3%次氯酸钠(本实验用4%84)、
酒精灯、计时器、平板、锥形瓶,无菌水,离心管(带盖,灭菌)、打开无菌操作台灭菌30min。
(1)植物样本的采集:选取生长状态良好,不要有病斑或者枯枝烂叶,每种植物采取三株标本,要带有叶子、叶柄和枝条及其他部位,将样本名字写在
小纸条上放在装标本的袋子里,采下来的标本与写有名字的纸条一同拍照,样本上有脏东西时,请用纸轻轻擦掉,若不清楚植物名字,请将整棵植物
拍照留用于鉴定,并做好相关记录。
(2)制作PDA固体培养基,在无菌操作台中倒平板,每瓶250ml的培养基大概倒15个板,待其凝固后用于接种。
2.清洗:认真用清水将标本洗净,洗去标本表面的灰尘,去除枯叶,备用。
3.取样:
(1)在叶片的左上、右上、左下,右下和正中五个部位进行取样,剪取5mm*5mm的叶片,如果是叶柄或枝干,则剪取5~10mm,若是比较
粗的枝干或圆圆的果实之类的,总之比较大的,则将它切开,再剪取
样本,样本不要剪的太大或太小。
(2)每种植物的叶子,叶柄,枝干等其他部位,每种部位接种两块板,大板每个要接种五个样本即左上、右上、左下,右下和正中,小板每个
接种四个样本即左上、右上、左下,右下,计算好所要剪的样本数,
尽量多剪几个,以免后面的表面灭菌中冲洗时被冲掉。
(3)若植物标本有剩余,且是没有洗过的,重新装好,放到冰箱里,备用,洗过的扔掉。
(4)每种植物标本所剪的样本放在一个50ml的离心管中,放在试管架上,并且每个离心管上要标好所对应的植物标本。
4.表面灭菌:在无菌操作台中进行
(1)先向各离心管内倒入适量(10~20ml)70%乙醇,拧紧盖子,用计时器开始计时1min,每10秒钟晃动离心管几次,使其充分灭菌。
(2)1min后,拧松盖子,将乙醇倒入事先准备的锥形瓶中,注意不要将管
中样本倒出,倒出的样本不要再放入其中,也不要用手碰到样本,样
本不可以接触到除了离心管以外的东西。
(3)然后,再向各离心管中加入40ml的3%次氯酸钠,拧紧盖子,用计时器开始计时10min,每隔1min晃动几次离心管,时间到后,拧松盖子,
将次氯酸钠倒入事先准备的锥形瓶中,注意不要将管中样本倒出,倒
出的样本不要再放入其中,也不要用手碰到样本,样本不可以接触到
除了离心管以外的东西。
(4)最后,用无菌水冲洗三遍,操作步骤同上面(3)。
(5)冲洗完后,将样本放在盖子里,备用。
(6)表面灭菌是整个实验中的关键步骤,务必认真进行表面灭菌,各项操作严格进行。
5.平板接种:
(1)将已经凝固的平板标好相应的植物标本名字,时间和自己的名字,每种标本的平板再用A、B、C、D等来区分,如桂花A,桂花B,桂花C,
桂花D等,桂花A和桂花B用来接种桂花的叶子,C和D用来接种叶
柄,以此类推。
(2)在无菌操作台中,打开酒精灯,平板的盖子四周在酒精灯处灭菌,将镊子在火焰上灭菌后,夹取样本,在酒精灯附近打开平板的一边,放
入样本,大板每个要接种五个样本即左上、右上、左下,右下和正中,
小板每个接种四个样本即左上、右上、左下,右下,样本在平板上整
齐排列,尽量一次性放到位,不要在平板上到处移,掉在操作台上的
样本不可以再用,夹取每种植物标本前一定要在火焰上灭菌。
(3)放入样本后,立刻合上平板,并且再在酒精灯处灭菌,此过程要注意严格无菌操作。
6.室温培养:接种好的平板放在室温下培养3~7天,每日观察。
7.挑取菌种:待样本附近长出菌后,还可以分出不同菌种前,立即进行挑菌。
(1)用记号笔在平板底部划出要挑的菌种,并且每块板上标好1,2,3等,标完后,数好需要挑的真菌总数,取相应数量灭过菌的1.5ml小管,做
好相应的标记。
(2)在无菌操作台中,挑取相应菌种放入1.5ml小管中,注意尽量挑取相同颜色的菌块,这样挑菌种比较纯,此过程也要注意无菌操作。
(3)记录好每块板上挑取的真菌数及种类,待其长满后,同样的则不需要再记录。
8.纯化菌种:
(1)数好需要纯化的菌种,倒好相应数量的平板,待其凝固后,在无菌操作台中,将小管中的真菌块挑到平板正中央,此过程也要注意无菌操
作。
(2)种好菌的平板放在室温下培养,每日观察,若染上细菌,则重新挑到新板中再长,若分离出其他菌种,则拿新的板再分离。
9.菌种保藏:
(1)准备:已灭菌的液体石蜡和菌种保藏管,每种菌放两个小管,其中一个小管放1ml液体石蜡。
(2)拍照:待内生真菌长满平板后,在无菌操作台里打开平板盖子,拍下照片,并且也拍好与之相对应的菌种名称。
(3)保藏:小管做好标记后放在无菌操作台里,打开酒精灯,取一个平板和与之相对应的两个小管,打开小管盖子,盖子口朝上放在操作台上,
小管放在酒精灯附近,将平板在酒精灯火焰处灭菌,针在火焰上灭菌
后,打开平板盖子,在平板一边划一块培养基,分成若干小块,每个
小管放五小块。
合上平板盖子,在火焰处灭下菌,针在挑下一个菌种
前务必灭菌。
(4)保藏菌种的小管放到冰箱里。
10.菌种发酵:
(1)制作PDA液体培养基,与50ml锥形瓶,50ml量筒一起灭菌。
(2)灭菌后,在无菌操作台中将PDA液体培养基分装到50ml锥形瓶中,各个瓶30ml,在瓶壁上写上相应的所需发酵的菌种。
(3)从各个平板中取两小块带菌种的培养基放入瓶中,发酵20天。
(4)注意无菌操作。
11.过滤发酵液体:
(1)准备:滤纸,漏斗,锥形瓶,针筒,细菌滤器(已灭菌的),50ml离心管(已灭菌的),移液器,ph试纸,1.5ml小管(已灭菌的),96孔
板,蒸馏水。
(2)过滤:将放好滤纸的漏斗先用少量蒸馏水润湿,然后倒掉锥形瓶里的蒸馏水,将发酵瓶中的液体倒入漏斗,注意不要将菌块倒入,也不要
倒太满,待其漏下后再倒。
(3)测ph:用移液器吸取一点的发酵液,滴在ph试纸上测,并做好记录。
(4)待发酵液过滤完后,用洗干净的针筒吸取里面的液体,吸完后,在针筒头上套上已灭菌的细菌滤器,缓缓打入相应50ml离心管中,并在
1.5ml相应小管中放入1ml发酵液,用移液器分别吸取200微升发酵液
放入编号为1#和2# 的96孔板的相同位置,作好记录,并且记录50ml
离心管中最后所得发酵液的体积。
(5)50ml离心管、1.5ml小管、96孔板分别装好放入冰箱保存,备用。
(6)倒出发酵液的锥形瓶先放着,不洗掉,用过的细菌滤器扔掉里面的滤纸,洗净,重放滤纸,用报纸包好灭菌。
12.菌丝形态拍照:
(1)准备:载玻片和盖玻片,生理盐水,移液器,枪头,显微镜。
(2)在干净的载玻片中央滴20微升生理盐水,用枪头挑一丝菌丝,轻轻在水中拍散,盖上盖玻片,在显微镜下,分别拍下菌丝形态,产孢子结
构,孢子以及其他特殊形态。
