回缩自毁式一次性使用无菌注射器
一次性无菌溶药器说明书

一次性使用无菌溶药注射器说明书
[主要结构、性能] :本产品由外套、芯杆、橡胶活塞及一次性使用侧孔针或斜面针组成。
其物理、化学、生物性能符合xxxxxxxxxx标准的规定。
[适用范围] :供抽吸液体、溶解药液用。
产品规格有:20mL 、30mL 、50mL;
配针规格1.2mm、1.6mm。
注册号:X食药监械(准)字xxxx第xxxxx号
生产许可证号:
[禁忌症、注意事项、警示及提示说明] :
1、本品经环氧乙烷灭菌,无菌、无热原。
打开小包装应立即使用。
2、使用时,应检查小包装是否完整;如包装破损,禁止使用。
3、本品仅供一次性使用,用后销毁(用毁型器销毁)。
4、超过失效日期(失效日期见小包装封口处)禁止使用。
5、本品禁止抽取血液及人体注射用。
xxxxx医疗器械有限责任公司
(注册、生产)地址:xxxxxxxxxxxxxxxx
售后服务单位:xxxxxxxxxxxxxxxxxxxxxxxxxxxx
电话:xxxxxxxxxxxxx x
传真:xxxxxxxxxxxx 邮编:xxxxxxxxxxxx。
一次性使用无菌溶药注射器产品技术要求威高
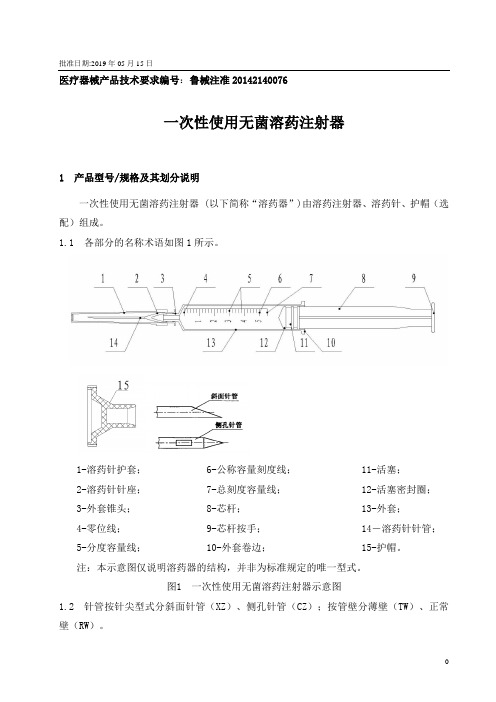
医疗器械产品技术要求编号:鲁械注准20142140076一次性使用无菌溶药注射器1 产品型号/规格及其划分说明一次性使用无菌溶药注射器 (以下简称“溶药器”)由溶药注射器、溶药针、护帽(选配)组成。
1.1 各部分的名称术语如图1所示。
1-溶药针护套; 6-公称容量刻度线; 11-活塞;2-溶药针针座; 7-总刻度容量线; 12-活塞密封圈;3-外套锥头; 8-芯杆; 13-外套;4-零位线; 9-芯杆按手; 14-溶药针针管;5-分度容量线; 10-外套卷边; 15-护帽。
注:本示意图仅说明溶药器的结构,并非为标准规定的唯一型式。
图1 一次性使用无菌溶药注射器示意图1.2 针管按针尖型式分斜面针管(XZ)、侧孔针管(CZ);按管壁分薄壁(TW)、正常壁(RW)。
1.3 产品标记:溶药器的标记以公称容量、针管公称外径、针管标称长度、针管管壁类型和针尖型式表示。
标记示例:20mL 1.2×33 TW CZ溶药针针尖型式:侧孔溶药针溶药针管壁类型:薄壁溶药针标称长度:33mm溶药针公称外径:1.2mm溶药器公称容量:20mL1.4 型式溶药器的型式分为中头式和偏头式。
1.5 规格1.5.1 溶药器溶药器规格按公称容量分为10 mL、20mL、30mL、50mL、100mL。
1.5.2 溶药针溶药针按照针尖型式,分为侧孔溶药针和斜面溶药针。
溶药针的规格按公称外径分为1.2mm、1.4mm、1.6mm、1.8mm、2.1mm、2.4mm。
1.6 溶药器应选用符合医用要求的润滑剂。
1.7 材料溶药注射器和溶药针采用的主要材料见表a。
表a 一次性使用无菌溶药注射器材料表。
一次性使用无菌注射器等25种医疗器械生产环节风险清单和检查要点说明

食药监械监〔2016〕37号附件一次性使用无菌注射器等25种医疗器械生产环节风险清单和检查要点目录一、一次性使用无菌注射器生产环节风险清单和检查要点 (1)二、一次性使用输液器生产环节风险清单和检查要点 (7)三、一次性使用静脉留置针生产环节风险清单和检查要点 (13)四、一次性使用真空采血系统-采血管生产环节风险清单和检查要点(1) (17)一次性使用真空采血系统-静脉采血针生产环节风险清单和检查要点(2) (20)五、骨接合植入物(金属接骨板、金属接骨螺钉)生产环节风险清单和检查要点 (23)六、脊柱固定金属植入物生产环节风险清单和检查要点 (27)七、人工关节风险清单和检查要点 (31)八、人工晶状体生产环节风险清单和检查要点 (36)九、血管支架生产环节风险清单和检查要点 (38)十、乳房植入体生产环节风险清单和检查要点 (40)十一、医用透明质酸钠凝胶(鸡冠提取法)生产环节风险清单和检查要点 (43)十二、同种异体骨植入物生产环节风险清单和检查要点 (46)十三、天然胶乳橡胶避孕套生产环节风险清单和检查要点 (52)十四、血液净化用设备生产环节风险清单和检查要点 (57)十五、血液净化用器具(接触血液的管路)生产环节风险清单和检查要点 (59)十六、血液净化用器具(过滤/透析/吸附器械)生产环节风险清单和检查要点 (63)十七、透析粉、透析浓缩液生产环节风险清单和检查要点 (66)十八、中心静脉导管生产环节风险清单和检查要点 (69)十九、封堵器系统产品生产环节风险清单和检查要点 (73)二十、角膜接触镜生产环节风险清单和检查要点 (76)二十一、麻醉系统生产环节风险清单和检查要点 (80)二十二、医用防护服生产环节风险清单及检查要点 (83)二十三、医用防护口罩生产环节风险清单及检查要点 (89)二十四、一次性使用非电驱动式输注泵生产环节风险清单和检查要点 (94)二十五、定制式义齿生产环节风险清单和检查要点 (96)一、一次性使用无菌注射器生产环节风险清单和检查要点二、一次性使用输液器生产环节风险清单和检查要点三、一次性使用静脉留置针生产环节风险清单和检查要点四、一次性使用真空采血系统——采血管生产环节风险清单和检查要点(1)一次性使用真空采血系统——静脉采血针生产环节风险清单和检查要点(2)五、骨接合植入物(金属接骨板、金属接骨螺钉)生产环节风险清单和检查要点六、脊柱固定金属植入物生产环节风险清单和检查要点七、人工关节风险清单和检查要点八、人工晶状体生产环节风险清单和检查要点九、血管支架生产环节风险清单和检查要点十、乳房植入体生产环节风险清单和检查要点十一、医用透明质酸钠凝胶(鸡冠提取法)生产环节风险清单和检查要点十二、同种异体骨植入物生产环节风险清单和检查要点。
一次性使用自毁式安全注射器(带针) 使 用 说 明 书

一次性使用自毁式安全注射器(带针)使用说明书产品名称:一次性使用自毁式安全注射器(带针)结构与规格:其结构由外套、活塞、推筒、针座、针头、防液圈、回缩装置、顶塞、护套组成。
产品规格:1ml、3ml、5ml、10ml注射针规格:0.3mm、0.33mm、0.4mm 、0.45mm、0.55mm、0.5mm、0.6mm、0.7mm、0.8mm、0.9mm性能与特点:1. 产品经环氧乙烷灭菌,无菌,无热原。
2. 单手操作,使用方法与普通注射器一样简便。
3. 注射针自动回缩后,针头不外露。
4. 对接受注射者无害。
5. 对卫生保健人员不构成任何危险。
6. 注射后产生的废弃物不对社会构成危害。
7. 注射器针尖穿刺瓶塞三次,不影响针头锋利度。
(见图8)用途与范围:本产品适应于临床肌肉、皮下、皮内、静脉等注射和静脉抽血的住院、门诊病人。
使用说明:临床医务人员使用安全注射器前,请先阅读使用说明书或经过培训,以便正确使用该产品。
使用步骤如下:1. 打开小包装,取下护套。
(见图1)2. 将注射针插入药液瓶内,抽吸药液至筒身内。
(见图2)3. 排除筒内空气,即可注射。
(见图3)4. 注射药液时,必须把活塞基准线推进与外套的零位线吻合,针头会自动回缩。
注意事项:1. 使用前请阅读“使用说明书”。
2. 本产品已经灭菌,仅供一次性使用。
3. 使用该产品时在抽液体后注入药瓶时,推力不得过猛(见图4)。
4. 如发现小包装破损或护套脱落,切勿使用。
5. 本产品使用前,不得将推筒推到超过警戒线(见图5)。
6. 注射药液时,必须把活塞基准线推进与外套的零位线吻合,把药液注射完全后,针头才能自动回缩达到自毁(见图6)。
(当药液尚未注射干净,针头是不会自动回缩的。
)7. 如药液已彻底注射干净,确认针头无法自动回缩,请拉回注射器的推筒,使针头在注射器内,对接受注射者无害(见图7)。
8. 本产品在使用前,先检查推筒前端是否带卡钩,若无带卡钩,请勿使用。
国家卫计委安全注射专项工作指导方案

《阻断院感注射传播,让注射更安全(2015-2018年)》专项工作指导方案注射是医院感染传播的重要途径。
安全注射是阻断医院感染传播,保障患者安全和医务人员职业安全的基本路径和有效措施。
长期以来,全球范围内因不安全注射导致的医疗保健相关感染问题一直存在。
采取有效措施改善安全注射状况,通过实施安全的注射来保障注射安全目标的实现已经成为全球医疗服务领域在思想上、行动上的共识。
就加强医院感染与医疗保健相关感染防范的角度而言,阻断感染经注射途径传播是保障注射安全的首要目标和核心任务。
它不仅包括阻断接受注射患者可能获得的感染,也包括阻断注射操作者或参与者因职业暴露而可能获得的感染,还包括阻断因接触处理不当的注射用具而可能获得的感染。
为有效阻断卫生保健服务中经注射途径传播感染发生。
在全国范围内广泛推行安全注射理念和实践,推动《血源性病原体职业接触防护导则》、《静脉治疗护理技术操作规范》、《医疗废物管理条例》的有效落实,致力于减少因非必要注射、非安全注射导致的医疗保健相关感染和医务人员相关职业暴露事件的发生,保障患者安全和医务人员职业安全,遵循世界卫生组织(WHO)关于安全注射的规范,结合国情实际,从医院感染防控角度出发,特实施本专项工作指导方案.本方案中所指的安全注射,特指注射操作的安全性以及注射产生废物的管理(相关名词释义见附件1)。
一、工作主题阻断院感注射传播,让注射更安全。
二、工作目标(一)总体目标推动安全注射理念建立与规范执行,实现安全注射持续改进,推动和促进我国医院感染管理整体能力和水平的提升.(二)具体目标1.开展基线调查,掌握医疗卫生机构安全注射基本情况;2。
加强安全注射知识宣传教育与技能培训,提升医务人员安全注射的意识、知识和技能;面向患者普及安全注射常识,鼓励患者积极参与,提倡对出院后居家注射操作的患者或家属进行安全注射教育;倡导医疗卫生机构加强多部门合作,优化安全注射环境;3。
建立、完善安全注射制度、操作规范及规程,并着力推进安全注射操作规范及规程的落实;强化不安全注射风险识别、评估与干预,防范因非安全注射导致的医院感染以及医务人员职业伤害事件的发生;4。
验证方案(加速老化实验)

华普医疗科技加速老化试验版本/修改状态:生效日期:文件编号:发放号:控制状态:拟制:审核:批准:加速老化实验计划一、使用围本公司生产的一次性使用无菌注射器,一次性使用无菌自毁式注射器,一次性使用无菌胰岛素注射器及其外包装。
二、过程要求1、微生物屏障2、无毒性3、物理特性的符合性4、化学特性的符合性5、生物特性的符合性三、预计完成时间:老化实验前全能性实验: 2008年5月20日前包装验证实验: 2008年5月22日前阻菌实验: 2008年5月24日前老化实验时间: 2008年5月26日前加速第一年验证无菌实验: 2008年6月18日前全能性实验: 2008年6月25日前包装验证实验: 2008年6月25日前阻菌实验: 2008年6月27日前加速第二年验证无菌实验: 2008年7月1日前全能性实验: 2008年7月8日前包装验证实验: 2008年7月8日前阻菌实验: 2008年7月10日前加速第三年验证无菌实验: 2008年7月15日前全能性实验: 2008年7月22日前包装验证实验: 2008年7月22日前阻菌实验: 2008年7月24日前加速第四年验证无菌实验: 2008年7月29日前全能性实验: 2008年8月6日前包装验证实验: 2008年8月6日前阻菌实验: 2008年8月8日前加速第五年验证无菌实验: 2008年8月13日前全能性实验: 2008年8月20日前包装验证实验: 2008年8月20日前阻菌实验: 2008年8月22日前目的:在有效期三年和三年有效期外,通过对我公司产品检验实验,来验证我们的产品规定为三年的有效期是有科学依据的,可靠有效的。
加速老化试验(一)老化试验1.目的:通过老化试验以后对产品的外观、无菌、热原试验等全性能试验来证明本公司生产的产品规定为三年的有效期是有科学依据,可靠有效的。
2.围:本公司生产的一次性使用无菌注射器带针,一次性使用无菌安全自毁式注射器,一次性使用无菌胰岛素注射器3.测试依据:按ISO11137-95和ISO11607-2003方法4.样品来源:成品留样产品(二)试验准备1.本次试验所需样品465只,从中随机抽取20只用于试验前的产品的全能性检验,抽取20 只做包装材料渗漏性试验,抽取10只做真空泄露性试验,抽取20只做爆破和蠕动性试验抽取10只做阻菌性试验(琼脂接触攻击性试验)。
注射器自毁性专业测试仪器

注射器自毁性专业测试仪器注射疗法是临床治疗的重要手段和方法,注射器是国内注射治疗消耗较大医用耗材器械。
一般注射器在临床使用中存在一系列问题,如重复使用、针头简单误刺医务人员、使用后恢复不便利等。
目前在欧美等发达国家已广泛使用一次性自毁注射器代替一般注射器。
随着科学技术的进步,我国自毁注射器的质量越来越受到临床的重视,并且通过一系列注射器自毁式测试仪器以及防止重复使用回推想试仪,达到质量检验。
自毁特性当输送完预定的固定使用剂量时,自毁特性进行自动开头生效。
自毁功能生效后:在正常使用条件下,注射器和针头不应重复使用;自毁特性不应失效,即以100mm/min的速度在芯杆上施加100N的力,或在针上施加100kPa/min至最高300kPa/min的背压,疫苗注射器不应再次使用,疫苗注射器不应重复使用。
自毁特性自锁力测试仪主要用于测定自毁型固定剂量疫苗注射器的物理特性,是鉴定医自毁型固定剂量疫苗注射器的重要手段之一。
ZS0573-C自毁特性自锁力测试仪技术参数:操作界面:简体中文/英文测试标准:YY/T 0573.3-2023 一次性使用无菌注射器第3部分:自毁型固定剂量疫苗注射器测试范围:0.1N~150N 误差不大于0.1N;测试速率:100mm/min 误差范围:1mm/min;(测试速度可软件设定)公称容量:0.1ml~200 ml、全部规格任意输入。
产品净重:15kg形状尺寸:430×290×400(mm)电源:AC90V-240V/50Hz(自适应宽电压)整机功率:70W可编程掌握器:PLC/ARM触摸屏:7英寸K600+内核/点阵式65色800*480辨别率传感器:高精度力值传感器测力机构:内置打印机:机载针式打印机自毁特性压力测试仪主要用于测定自毁型固定剂量疫苗注射器的物理特性,是鉴定医自毁型固定剂量疫苗注射器的重要手段之一。
YL0573-C自毁特性压力测试仪技术参数:操作界面:简体中文/英文测试标准:YY/T 0573.3 一次性使用无菌注射器第3部分:自毁型固定剂量疫苗注射器压力输出范围:高于当地大气压,0kPa~350kPa,可任意设定压力输出值,检定误差不大于读数的1%。
一次性使用无菌注射器国家标准编制说明

《一次性使用无菌注射器》国家标准编制说明一、任务来源本标准是根据国家标准化管理委员会下达的2006年第一批制修订国家标准项目计划通知(国标委计划[2006]48号)而修订的。
计划项目编号是20065424-Q-464。
本标准由全国医用注射器(针)标准化技术委员会归口管理,由上海康德莱企业发展集团股份有限公司、成都市新津事丰医疗器械有限公司、山东威高集团医用高分子制品股份有限公司、江西洪达医疗器械集团有限公司、上海市医疗器械检测所负责起草。
二、修定标准的目的及意义一次性使用无菌注射器是目前应用最广泛的无菌医疗器械之一。
其产品标准在国内应用已近三十年,最近一版距今已有十六年。
随着科学技术的发展和对临床安全不断提高,原国家标准已经不适应这种需求。
ISO国际标准化组织已于2017年修订了ISO 7886-1:2017《一次性使用无菌皮下注射器第1部分:手动注射器》的发行稿。
该标准对原ISO标准进行了较大修订。
它更多考虑的是在设计上充分保证产品的安全性要求。
为适应这种变化,相对应的国家标准有必要进行修订。
三、产品适用范围本标准规定了一次性使用无菌注射器(以下简称注射器)的分类与命名、要求、试验方法、包装、标识等。
本标准适用于供抽吸液体或抽吸液体后立即注射用的手动注射器。
本标准不适用于胰岛素注射器、玻璃注射器、永久带针注射器、带有动力驱动注射泵的注射器、自毁型固定剂量疫苗注射器、带防止再次使用特性的注射器、由制造厂预装药液的注射器以及与药液配套的注射器等。
本标准规定的不带针注射器应与符合GB 15811要求的一次性使用无菌注射针配套使用。
四、关于技术指标的说明本标准修改采用ISO 7886-1:2017《一次性使用无菌皮下注射器第1部分:手动注射器》本标准与GB15810-2001相比主要技术差异如下:1.修改了适用范围。
修定原因:与ISO 7886-1:2017标准保持一致。
一次性使用无菌注射器作为一个单器械,必须联合一次性使用无菌注射针组成组合器械应用于临床。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
回缩自毁式一次性使用无菌注射器
市场分析报告
为了消除注射器重复使用和外露针尖对医务人员的伤害,随着我国经济的高速发展,人们的自我保护意识日益增长,国家大力推广安全型、自毁型的注射器,欧美等部分发达国家已强制使用安全型、自毁型的注射器,这是大势所趋,民心所向。
中国有13.7亿人口,北京市1961.24万人;天津市1293.82万人河北省7185.42万人;山西省3571.21万人;内蒙古自治区2470.63万人;辽宁省4374.63万人;吉林省2746.23万人;黑龙江省3831.22万人;上海市2301.91万人;江苏省7865.99万人;浙江省5442.69万人;安徽省5950.05万人;福建省3689.42万人;江西省4456.75万人;山东省9579.31万人;河南省9402.36万人;湖北省5723.77万人;湖南省6568.37万人;广东省10430.31万人;广西壮族自治区4602.66万人;海南省867.15万人;重庆市2884.62万人;四川省8041.82万人;贵州省3474.65万人;云南省4596.62万人;西藏自治区300.22万人;陕西省3732.74万人;甘肃省2557.53万人;青海省562.67万人;宁夏回族自治区630.14万人;新疆维吾尔自治区2181.33万人。
这是一个非常巨大的市场,对市场前景我们充满信心。
目前有弹簧的回缩自毁式一次性使用无菌注射器,国内有两家浙江华凯和甘肃白银,进口两家美国和台湾。
由于受种种原因的限制,目前销售都不理想,销量非常有限。
营销策略采取代理商模式,公司配备一支执行力超强的招商队伍,权利、责任和目标明确,落实到每一个人每一件事。
每个省、市、自治区下辖的地级市,地级市下辖的县,县下辖的每一个乡镇,只要有医疗机构(包括疾控系统)的地方,就要有我们的回缩自毁式一次性使用无菌注射器。
愿望是美好的,但还要看实际行动,我相信只要脚踏实地、一步一个脚印,兢兢业业,一定会成功的。
但同时困难也是非常大的,受收费项目和招标采购等等的限制,使其成为社会各方普遍接受的产品,还需有关方面的共同努力。
磨难是成功的必修课,一帆风顺必定是到不了岸的,只有经历过困难和挫折,拿到的成果才是实实在在的。
