高考化学 第14讲 原子结构 化学键
2024高考化学三轮复习人教版选择性必修2第二章

【复习与提高】
●H2O2分子结构示意图(两个氢原子犹如在半展开的书的两面上)
●解释与水分子结构相似的OF2极性小的原因? ①从电负性上看,氧和氢的电负性差大于氟与氧的电负性差 ②OF2中的O有两个孤电子对,抵消了F—O中共用电子对偏向F而 产生的极性
【第三节 分子结构与物质的性质】
熟记沸点变化趋势图
【第三节 分子结构与物质的性质】
●溶解性(氢键、相似相溶) ●碘在水和四氯化碳中的溶解性 ●有手性异构体的分子叫做手性分子
【复习与提高】
● 氢氰酸(化学式为HCN),结构 ● H3O+与H2O的H—O—H键角大小比较? ● 看杂化方式,键角:sp>sp2>sp3 ● 看电子对间的斥力 ● (1)电子对排斥力大小顺序:LP-LP>LP-BP>BP-BP ● (2)三键、双键、单键之间的排斥力大小顺序:三键—极性和分子的极性,对于多原子分子来说,只含非极性键的分子 一般为非极性分子(除O3);空间结构对称(无孤电子对)的分子一 般为非极性分子
●臭氧是极性分子,O3在水中的溶解度比O2的大(相似相溶),O3在四 氯化碳中的溶解度高于在水中的溶解度(极性微弱)
●表面活性剂(亲水基,有极性;疏水基,几乎无极性),细胞膜(头 基是极性基团而尾基是非极性基团)
高三三轮复习 第14讲
选择性必修2第二章 教材回归
【第一节 共价键】
●共价键的分类(按照电子云重叠方式) ●σ 键与π 键的成键特点、强度大小等 ●用原子轨道表示分子形成过程 ●键参数 ●键能是指气态分子中1 mol 化学键解离成气态原子所吸收的能量 ●键长和键角的数值可通过晶体的X射线衍射实验获得
高考化学化学键知识点总结

高考化学化学键知识点总结一、化学键的定义和分类在化学世界中,化学键就像是将原子们紧紧“黏合”在一起的神秘力量。
它是相邻原子之间强烈的相互作用。
化学键主要分为离子键、共价键和金属键三大类。
离子键,通常发生在活泼金属与活泼非金属之间。
比如说,氯化钠(NaCl)的形成就是典型的离子键的例子。
钠原子容易失去一个电子,形成带正电的钠离子(Na⁺);氯原子则容易获得一个电子,变成带负电的氯离子(Cl⁻)。
钠离子和氯离子之间由于静电作用相互吸引,就形成了离子键。
共价键则是原子间通过共用电子对形成的化学键。
比如氢气(H₂)分子中,两个氢原子各自提供一个电子,形成共用电子对,从而将两个氢原子紧紧“拉住”。
共价键又分为极性共价键和非极性共价键。
当共用电子对不偏向任何一方原子时,形成的就是非极性共价键,像氧气(O₂)分子中的共价键。
而当共用电子对偏向某一方原子时,就形成了极性共价键,例如氯化氢(HCl)分子中的共价键。
金属键存在于金属单质或合金中。
金属原子失去部分或全部外层电子,形成金属离子和自由电子。
金属离子与自由电子之间存在强烈的相互作用,从而使金属具有良好的导电性、导热性和延展性。
二、离子键的特点离子键具有以下几个显著特点:1、没有方向性离子键的形成与离子的电荷分布有关,而离子的电荷分布通常是球形对称的,所以离子键在空间的各个方向上的作用强度是相同的,没有特定的方向限制。
2、没有饱和性只要离子周围空间允许,它可以尽可能多地吸引带相反电荷的离子,并不存在饱和的问题。
离子键的强度通常用晶格能来衡量。
晶格能越大,离子键越强,离子化合物的熔点和沸点也就越高。
三、共价键的特点与离子键不同,共价键具有方向性和饱和性。
1、方向性这是因为形成共价键的原子轨道在空间具有一定的方向性,只有沿着特定的方向进行重叠,才能最大程度地形成稳定的共价键。
2、饱和性每个原子所能形成的共价键数目是有限的,取决于该原子所能提供的未成对电子数目。
共价键的键参数也是我们需要重点关注的内容,包括键长、键能和键角。
第14讲 卤族元素 溴、碘单质的提取-2024年高考化学一轮复习课件

八.卤素的微观结构
物质 熔点/℃ 沸点/℃
氯气 -101 -34.6 溴单质 -7.2 58.78 碘单质 113.5 184.4
分子晶体熔化、汽化时一般只破坏范德华 力、氢键,不破坏化学键。范德华力、氢 键相对化学键较弱。
九.卤素在有机反应中的应用
• 甲烷与氯气反应条件?生成的氯代物状态? • 乙烯与氯气发生反应的反应类型? • 丙烯与溴蒸气发生反应的反应类型(非加成)? • 卤代烃能发生哪些典型的反应类型? • 甲苯与溴气反应条件?产物? • 甲苯与液溴反应条件?产物? • 苯酚能与溴水反应的原理? • 溴水可否氧化醛基?
终结性评价
1.(2015·全国卷Ⅱ,12)海水开发利用的部分过程如下图所示。下列说法错误的是
A.向苦卤中通入Cl2是为了提取溴 B.粗盐可采用除杂和重结晶等过程提纯
√C.工业生产中常选用NaOH作为沉淀剂
D.富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收
2.[2021·全国甲卷,26(1)]碘(紫黑色固体,微溶于水)及其化合物广泛用于医药、染 料等方面。回答下列问题:I2的一种制备方法如图所示:
溴
反应逐渐变缓慢
碘
X2 + H2O
HX+ HXO
元素 名称
现象
反应条件
气态氢化物 稳定性
化学方程式
氟 氯 与H2反应 溴
一定
条件
H2+X2 → 2HX
碘
• 在HX中,HF的熔、沸点最高,氢氟酸是弱酸,能腐蚀玻璃。 • 同浓度卤化氢水溶液酸性递变性?
元素 名称
氟 氯 与碱反应
溴
碘
化学方程式 X2+ 2NaOH === NaX+ NaXO+H2O (F除外)
高考化学常见物质化学键键角

高考化学常见物质化学键键角化学是一门关于物质变化的科学,它研究物质的成分、性质以及变化过程。
在化学中,物质的化学键和键角是非常重要的概念。
本文将介绍一些高考化学中常见的物质的化学键和键角。
首先,我们先来了解一下化学键的概念。
化学键是由两个或多个原子通过共用电子对而形成的,用以保持原子间的连接。
根据共用电子对的数目不同,化学键可以分为共价键、离子键和金属键。
共价键是由两个或多个非金属原子通过共用电子对而形成的,其中电子对是由两个原子上的成对电子共同占据的。
共价键强度较弱,一般在常规温度下不会断裂。
举个例子,氧气分子(O2)中的两个氧原子通过共用两对电子形成了一个双键。
离子键是由一个或多个阳离子和一个或多个阴离子之间通过电荷吸引力而形成的。
相比较共价键,离子键的强度更大。
例如,氯化钠(NaCl)是一个由一个钠阳离子和一个氯阴离子通过离子键连接而成的化合物。
金属键是金属原子之间的一种特殊键,其中金属原子通过共享电子云形成一个电子气体模型。
金属键具有较高的导电性和热传导性。
例如,铁(Fe)是由多个铁原子通过金属键连接而成的金属。
除了了解化学键的类型,我们还需要学习化学键角的概念。
化学键角是指由形成化学键的原子围绕共享电子对之间的夹角。
化学键角的大小影响着物质的空间结构和性质。
常见的化学键角包括线性键角、三角形键角和四面体键角。
线性键角是指共享电子对之间的夹角为180度的化学键角。
举个例子,一氧化碳(CO)中的碳氧之间就是一个线性键角。
三角形键角是指共享电子对之间的夹角为大约120度的化学键角。
例如,水分子(H2O)中的氢氧之间就是一个三角形键角。
四面体键角是指共享电子对之间的夹角为109.5度的化学键角。
举个例子,甲烷(CH4)分子中的碳和氢之间就是四面体键角。
了解了化学键和键角的概念后,我们就可以更好地理解和解释物质的性质和反应过程。
通过学习化学键和键角,我们可以预测物质的三维结构、分子极性和化学反应的机理等。
高考化学一轮复习规范练14原子结构化学键(含解析)新人教版

原子结构 化学键(时间:45分钟 满分:100分)一、选择题(本题共10小题,每小题5分,共50分。
每小题只有一个选项符合题目要求) 1.下列叙述中,正确的是( )。
A.14C 中含有14个中子 B.1H 、2H 、3H 是同一种核素2O 与D 2O(重水)互称同位素60、C 70、金刚石、石墨均为碳的同素异形体14C 中含有的中子数=146=8,A 错误;1H 、2H 、3H 是质子数相同,中子数不同的氢元素的不同种核素,B 错误;H 2O 与D 2O 是化合物,不是原子,不能互称同位素,C 错误;C 60、C 70、金刚石、石墨都是碳元素形成的不同单质,均为碳的同素异形体,D 正确。
2.下列有关说法中正确的是( )。
A.12C 、13C 、14C 是碳的三种同素异形体2S 的电子式可表示为H+[··S ······]2H +C.HCl 、HBr 、HI 的稳定性逐渐减弱,而熔点和沸点逐渐升高4在熔融状态下不仅破坏了离子键,还破坏了共价键12C 、13C 、14C 是碳的三种核素,同素异形体的研究对象是同种元素形成的不同单质,A 错误。
H 2S是共价化合物,其电子式为H ··S ······H,B 错误。
氯、溴、碘的非金属性依次减弱,所以HCl 、HBr 、HI 的稳定性逐渐减弱;HCl 、HBr 、HI 的相对分子质量逐渐增大,分子间作用力逐渐增强,所以熔点和沸点逐渐升高,C 正确。
NaHSO 4在熔融状态下只破坏了离子键,D 错误。
3.下列描述正确的是( )。
A.氯水试剂瓶的标签上应标注:4的电子式:C l ··C··Cl ··Cl··ClC.质子数为116,中子数为177的钅立(Lv)原子:116293LvD.10B 3+的结构示意图:项氯水不是剧毒物,故A 项错误;B 项CCl 4电子式中Cl 原子周围应为8个电子,故B 项错误;D 项是硼原子的结构示意图,故D 项错误。
高考化学物质结构与性质
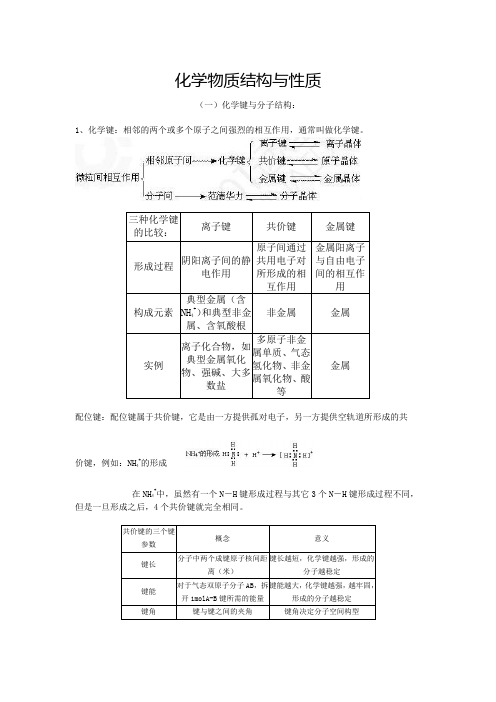
化学物质结构与性质(一)化学键与分子结构:1、化学键:相邻的两个或多个原子之间强烈的相互作用,通常叫做化学键。
配位键:配位键属于共价键,它是由一方提供孤对电子,另一方提供空轨道所形成的共价键,例如:NH 4+的形成在NH 4+中,虽然有一个N -H 键形成过程与其它3个N -H 键形成过程不同,但是一旦形成之后,4个共价键就完全相同。
键长、键能决定共价键的强弱和分子的稳定性:原子半径越小,键长越短,键能越大,分子越稳定。
共价键按成键形式可分为σ键和π键两种,σ键主要存在于单键中,π键主要存在于双键、叁键以及环状化合物中。
σ键较稳定,而π键一般较不稳定。
共价键具有饱和性和方向性两大特征。
2、分子结构:价层电子对互斥理论:把分子分成两大类:一类是中心原子上的价电子都用于形成共价键。
如CO2、CH2O、CH4等分子中的C原子。
它们的立体结构可用中心原子周围的原子数来预测,概括如下:另一类是中心原子上有孤对电子(未用于形成共价键的电子对)的分子。
如H2O和NH3中心原子上的孤对电子也要占据中心原子周围的空间,并参与互相排斥。
因而H2O分子呈V型,NH3分子呈三角锥型。
杂化轨道理论:在形成多原子分子的过程中,中心原子的若干能量相近的原子轨道重新组合,形成一组新的轨道,这个过程叫做轨道的杂化,产生的新轨道叫杂化轨道。
据参与杂化的s轨道与p轨道的数目,存在sp3、sp2、sp三种杂化。
杂化轨道理论分析多原子分子(离子)的立体结构价层电子对互斥模型判断简单分子或离子的空间构型说明:(1)等电子原理是指原子总数相同,价电子总数相同的分子或离子,对于主族元素而言,价电子就是其最外层电子数,即为最外层电子总数相等。
这一类分子或离子具有相似的化学键特征、分子结构以及部分物理性质相似,但一般情况下,化学性质并不相似。
同样,化学键相似,并不是指键角等一定相同。
利用等电子原理可判断一些简单分子或离子的主体构型,如:CO2、CNS-、NO2+、N3-的原子总数均为3,价电子总数均为16,因此,它们的空间构型均为直线型。
第14讲原子结构核外电子排布-2024-2025学年高考化学一轮复习课件

题组二 “三素”“两同”概念辨析 4.(2022 浙江 1 月选考)下列说法不正确的是( D ) A.32S 和 34S 互为同位素 B.C70 和纳米碳管互为同素异形体 C.CH2ClCH2Cl 和 CH3CHCl2 互为同分异构体 D.C3H6 和 C4H8 一定互为同系物
[解析] 32S 和 34S 是质子数相同、中子数不同的原子,互为同位素,故 A 正确;C70 和纳米碳管是由碳元素组成的不同单质,互为同素异形体,故 B 正确;CH2ClCH2Cl 和 CH3CHCl2 的分子式相同、结构不同,互为同分异构体,故 C 正确;C3H6 和 C4H8 可能为 烯烃或环烷烃,所以不一定是同系物,故 D 错误。
3.(2023 郑州模拟)现有下列几组粒子:①N2、CO、C2H2;②NH+4 、H3O+、OH -;③C22-、O22+、CN-;④PO34-、SO24-、ClO-4 。对上述四组粒子归类正确的是( D )
A.质子数相等、电子数和原子数不相等:① B.质子数和电子数相等、原子数不相等:② C.电子数相等、质子数和原子数不相等:③ D.原子数和电子数相等、质子数不相等:④ [解析] ①N2、CO、C2H2 的质子数和电子数都等于 14,原子数不相等;②NH+4 、 H3O+、OH-的原子数和质子数不相等,电子数都为 10;③C22-、O22+、CN-的原子数和 电子数都相等,质子数不相等;④P、S、Cl 所含的电子数分别为 15、16、17,酸根离 子中所含氧原子数均相等,所带负电荷数依次为 3、2、1,三种酸根离子所含的总电子 数相等(18+32)、原子数都为 5,但三种酸根离子的质子数不相等。
(2)原子轨道:量子力学把电子在原子核外的一个 空间运动状态 称为一个原子轨
道。
能级符号
高考化学键

[2014· 重庆卷] Na在氧气中完全燃烧所得产物 的电子式为__ [2014· 山东卷]COCl2电子式
考点1
离子键与共价键、离子化合物与共价化合物的比较
特别提醒:离子键一般由活泼的金属元素和活泼的非金属元素 组成,或者由铵根离子和活泼的非金属元素组成;共价键一般由 非金属元素组成(少数由金属原子与非金属原子组成,如AlCl3 中含有共价键)。 2.极性共价键和非极性共价键的区别
四个结论
物质中的化学键 (1)离子化合物中一定有离子键,可能含有共价键。简单 离子组成的离子化合物中只有离子键,如MgO、NaCl等 ,复杂离子(原子团)组成的离子化合物中既有离子键,又
有共价键,如(NH4)2SO4、NH4NO3、NaOH、Na2O2等。
(2)共价化合物中只有共价键,一定没有离子键。
Mg
Na
2、离子的电子式: ①阴离子的电子式
简单阴离子: 一般用
R
注意
n-
表示
Cl O
H
O
2
Hale Waihona Puke 2-H复杂的阴离子
使每一个原子铺开,并都达 到稳定结构
简单的阳离子: ②阳离子的电子式 如Mg
即离子符号
Na
复杂的阳离子: 要注明最外层电子数 及电荷数 H + H 如NH4+: H N . H
3、离子化合物: 由阳离子的电子式和阴离子的电 子式组合而成.
+ - + -
(3)由两种共价化合物结合生成的化合物不一定是共价 化合物。如NH3+HCl===NH4Cl。
考点3
1.四种
常化学用语
元素符号:Al3+ S 2- + 2- S SO4 [AgNH32] 离子符号:Al 符号 12 13 同位素符号: C 6 6C +3 -2 化合价符号:A l S
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(5)分类 (6)存在
课件ppt
题组一 原子的组成、结构与性质
1.一定量的锎
(
2 9
5 8
C2 f)是非常有用的中子源,1
mg
2 9
C85 2 f
每秒约放出8.34×109
个中子,在医学上常用作治疗恶性肿瘤的中子源。下列有关锎的说法错误
的是 ( )
A.
2 9
5 8
2 Cf
原子中,中子数为154
课件ppt
a.最外层电子数 满8个 (He为2个)形成稳定结构,该结构是稀有气体 元素原子结构,不易得失电子,因此化学性质稳定,一般条件下不发生反 应。 b.最外层电子数较少的(1、2、3个)有失电子达到稳定结构的倾向,表现出
金属性 。 c.最外层电子数较多的(4、5、6、7个)有得电子或形成共用电子对达到稳 定结构的倾向,表现出 非金属性 。
答案 A 同位素是质子数相同而中子数不同的同一元素的不同原子之 间的互称,它们的质量数不同,最外层电子数相同,化学性质相同;一种核素 就是一种原子;同分异构体指分子式相同而结构不同的物质。137CsOH为强 碱,常温时,0.1 mol·L-1的137CsOH溶液,pH=13。
课件ppt
题组三 化学键 6.判断下列说法是否正确。 (1)任何物质中都含有化学键。 ( ) (2)由活泼金属元素和活泼非金属元素形成的化学键一定是离子键。 (
正 价,失去几个电子就显正几价。 (3)非金属元素原子最外层一般 大于 或 等于 4个电子,较易
得到 电子,显 负 价,得到几个电子就显负几价。
课件ppt
题组二 元素、核素、同位素 1.元素:具有相同① 核电荷数(即质子数) 的同一类原子的总称。 2.核素 具有一定数目的② 质子 和一定数目的③ 中子 的一种原子叫做核 素。 核素与元素的关系:有的元素有多种核素,如碳元素、氧元素;有的元素只 有一种④ 核素 ,如钠元素。 3.同位素 ⑤ 质子数 相同而⑥ 中子数 不同的同一元素的不同⑦ 原子 互 称为同位素。
题组二 元素、核素、同位素 3.《物质构成的奥秘》告诉我们:元素的种类、化学性质分别与下列粒子 数密切相关,它们是 ( ) A.质子数、中子数 B.质子数、最外层电子数 C.中子数、最外层电子数 D.最外层电子数、质子数
答案 B 元素的种类由质子数决定,元素的化学性质与最外层电子数密 切相关。
课件ppt
课标版 化学
第14讲 原子结构 化学键
课件ppt
教材研读
题组一 原子的组成、结构与性质 1.原子的结构 (1)原子的组成
原子
课件ppt
(2)组成原子的各种微粒及相互关系 a.质子数(Z)=④ 核电荷数 =⑤ 原子核外电子数 b.质量数(A)=⑥ 质子数 +⑦ 中子数 c.阳离子的核外电子数=质子数-所带电荷数 d.阴离子的核外电子数=质子数+所带电荷数 2.原子核外电子排布的规律 (1)每个电子层最多能容纳⑧ 2n2 个电子。 (2)最外层电子数最多不超过⑨ 8 个(K层是最外层时,最多不超过2个)。
B.
2 9
5 8
2 Cf
原子中,质子数为98
C.
2 9
5 8
2 Cf
原子中,电子数为98
D.锎元素的相对原子质量为252
答案 D 2 5 C2 f 的质量数为252。要理解元素的相对原子质量和核素的相 98
对原子质量这两个不同的概念。
课件ppt
2.下列有关化学用语表示正确的是 ( ) A.丙烯的结构简式为:CH3CHCH2
) (3)凡含有共价键的化合物一定属于共价化合物。 ( ) (4)凡含有离子键的化合物一定是离子化合物。 ( ) (5)有化学键形成的变化一定是化学变化。 ( ) (6)由同种非金属元素形成的双原子分子中一定存在非极性共价键。 ( )
课件ppt
题组三 化学键 1.化学键 (1)定义:使离子或原子相结合的作用力。 (2)分类:
化学键
2.离子键 (1)定义:阴、阳离子之间的相互作用。 (2)成键微粒:⑤ 阴 、⑥ 阳 离子。 (3)成键实质:⑦ 静电 作用(离子间的静电吸引与电子和电子之间、核
课件ppt
与核之间的静电排斥达到平衡)。 (4)形成条件:活泼金属与活泼非金属化合时,一般形成离子键。 (5)存在:所有离子化合物中都有离子键。 3.共价键 (1)定义:原子间通过⑧ 共用电子对 所形成的相互作用。 (2)成键微粒:⑨ 原子 。 (3)成键实质:原子间形成共用电子对,共用电子对对核的静电吸引与核 间、电子间的静电排斥达到平衡。 (4)形成条件:⑩ 同种或不同种 非金属原子相结合时,一般形成共价 键。
课ቤተ መጻሕፍቲ ባይዱppt
d.电子的 得失或偏移 产生了氧化还原反应,形成了元素的化合价。 (3)次外层电子数最多不超过 18 个。 3.原子结构与元素性质的关系 (1)稀有气体元素原子最外层电子数一般为 8 (氦最外层只有2个电 子),性质不 活泼 ,既不易 失去 电子,又不易 得到 电子。 常见化合价为 0 。 (2)金属元素原子最外层一般少于 4 个电子,较易 失去 电子,显
B.S2-的结构示意图:
C.质子数为53,中子数为78的碘原子
:
1 5
3
3
1
I
D.H2SO4的摩尔质量是98 g
答案 C A项,丙烯的结构简式为CH3CH CH2;B项, 为硫
原子的结构示意图;C项
,
1 5
3
3
1I表示质子数为53,中子数为78的碘原子;D项,摩
尔质量的单位是g/mol。
课件ppt
4.医学界通过14C标记的C60发现了一种羧酸衍生物,在特定条件下,它可以通 过断裂DNA抑制艾滋病病毒的繁殖。下列有关叙述中,正确的是 ( ) A.14C与12C的性质完全不同 B.14C与14N含有的中子数相同 C.14C60与12C60是碳元素的同素异形体 D.14C与12C、13C互为同位素
答案 D 质子数相同而中子数不同的同一元素的不同原子互称为同位 素;同位素的化学性质相同,物理性质不同。
课件ppt
5.日本地震导致核电站泄漏出大量的人工放射性核素,如131I(碘)、137Cs(铯) 等。下列说法正确的是 ( ) A.127I与131I为不同的核素,但具有相同的化学性质 B.127I是碘元素稳定的同位素,与131I互为同分异构体 C.127I与131I的质量数不同,核外电子排布方式也不同 D.铯为ⅠA族元素,常温时,0.1 mol·L-1的137CsOH溶液,pH<13
