极性键的定义
键的极性与分子极性
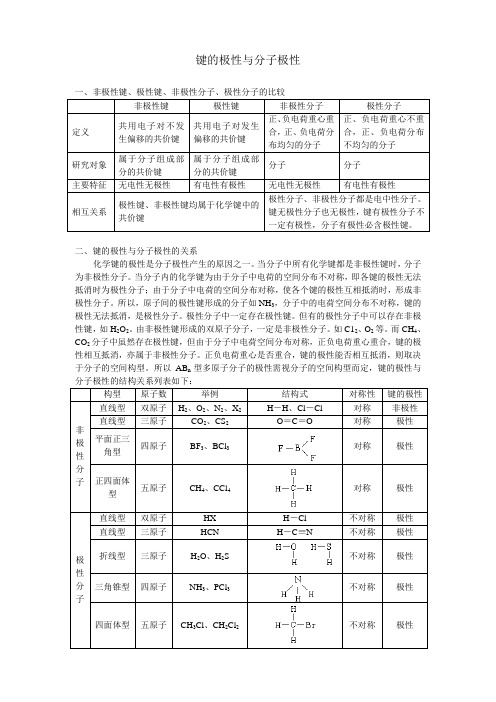
键的极性与分子极性一、非极性键、极性键、非极性分子、极性分子的比较非极性键极性键非极性分子极性分子定义共用电子对不发生偏移的共价键共用电子对发生偏移的共价键正、负电荷重心重合,正、负电荷分布均匀的分子正、负电荷重心不重合,正、负电荷分布不均匀的分子研究对象属于分子组成部分的共价键属于分子组成部分的共价键分子分子主要特征无电性无极性有电性有极性无电性无极性有电性有极性相互关系极性键、非极性键均属于化学键中的共价键极性分子、非极性分子都是电中性分子。
键无极性分子也无极性,键有极性分子不一定有极性,分子有极性必含极性键。
二、键的极性与分子极性的关系化学键的极性是分子极性产生的原因之一。
当分子中所有化学键都是非极性键时,分子为非极性分子。
当分子内的化学键为由于分子中电荷的空间分布不对称,即各键的极性无法抵消时为极性分子;由于分子中电荷的空间分布对称,使各个键的极性互相抵消时,形成非极性分子。
所以,原子间的极性键形成的分子如NH3,分子中的电荷空间分布不对称,键的极性无法抵消,是极性分子。
极性分子中一定存在极性键。
但有的极性分子中可以存在非极性键,如H2O2。
由非极性键形成的双原子分子,一定是非极性分子。
如C12、O2等。
而CH4、CO2分子中虽然存在极性键,但由于分子中电荷空间分布对称,正负电荷重心重合,键的极性相互抵消,亦属于非极性分子。
正负电荷重心是否重合,键的极性能否相互抵消,则取决于分子的空间构型。
所以AB n型多原子分子的极性需视分子的空间构型而定,键的极性与构型原子数举例结构式对称性键的极性非极性分子直线型双原子H2、O2、N2、X2 H-H、Cl-Cl 对称非极性直线型三原子CO2、CS2 O=C=O 对称极性平面正三角型四原子BF3、BCl3 对称极性正四面体型五原子CH4、CCl4 对称极性极性分子直线型双原子HX H-Cl 不对称极性直线型三原子HCN H-C≡N 不对称极性折线型三原子H2O、H2S 不对称极性三角锥型四原子NH3、PCl3 不对称极性四面体型五原子CH3Cl、CH2Cl2 不对称极性对于上述AB n型分子极性的判断也可用以下规律:⑴若中心原子(A)的化合价的绝对值等于该元素的主族序数,则为非极性分子;若不相等,则为极性分子。
课件11:2.3.1 键的极性、分子极性、范德华力

当堂检测
1.下列分子中,属于含有极性键的非极性 分子的是 ( D ) A.H2O B.Cl2 C.NH3 D.CH4
2.科学家最近研制出可望成为高效火箭推进剂N(NO2)3(如 图所示)。
已知该分子中N—N—N键角都是108.1°,下列有关N(NO2)3的 说法正确的是( ) A.分子中N、O间形成的共价键是非极性键 B.分子中四个氮原子共平面 C.该物质既有氧化性又有还原性 D.15.2 g该物质含有6.02×1022个原子
不显电性
H2、O2、Cl2
2.分子极性的判断方法 分子的极性由共价键的极性和分子的空间构型两方面共同 决定。 (1)只含非极性键的分子:都是非极性分子。 单质分子即属此类,如H2、O2、P4、C60等。 (2)以极性键结合而形成的异核双原子分子:都是极性分子。 即A—B型分子,如HCl、CO等均为极性分子。 (3)以极性键结合而形成的多原子分子。 空间构型为中心对称的分子,是非极性分子。 空间构型为非中心对称的分子,是极性分子。
(6)以极性键相结合,而且分子极性最大的是___H_F____。
本节内容结束
更多精彩内容请登录:
【解析】B项,Na2O2中虽有非极性键,但却是 离子化合物。
1.下列说法正确的是( C ) A.含有非极性键的分子一定是非极性分子 B.非极性分子中一定含有非极性键 C.由极性键形成的双原子分子一定是极性分子 D.分子的极性与键的极性无关
【解析】含有非极性键的分子不一定是非极性分子,如 H2O2;非极性分子中不一定含有非极性键,如CH4、CO2 中均是非极性分子,却仅有极性键;分子的极性除与键的 极性有关外,还与分子空间构型有关。
【解析】由于N、O为不同原子,其电负性不同,所 以N、O间形成极性键,A错,如题图四个氮原子形 成三角锥形结构,所以B错。15.2 g该物质含有 6.02×1023个原子,D错。
极性分子的名词解释

极性分子的名词解释引言:极性分子是化学中一个重要的概念,它在许多化学和生物学的领域中具有重要的应用。
本文将对极性分子进行详细的解释,并探讨其在不同领域中的作用。
一、极性分子的定义极性分子是指分子中存在极性键,使得分子具有正负电荷分布不均匀的性质。
在化学中,极性键是指由原子间电负性差异较大的元素形成的共价键,如氧气和氢气之间的偶极键。
二、极性分子的特征1. 偶极矩:极性分子在外电场中会产生瞬时的正负电荷分布,从而形成偶极矩。
偶极矩的大小与键的极性以及原子间的电荷分布有关,它决定了分子在电场中受到的作用力。
2. 溶解性:由于极性分子中正负电荷分布不均匀,使得极性分子具有较大的溶解性。
极性溶剂如水常常能够溶解极性分子,而非极性分子则溶解性较差。
3. 极性键角度:极性键的角度对于分子的极性有重要影响。
如果分子中的极性键角度较小且对称,分子就会呈现较小的偶极矩;反之,如果极性键的角度较大且不对称,分子的偶极矩就会增大。
4. 分子形状:极性分子的分子形状也会影响其极性。
分子的形状决定了分子中正负电荷中心的位置,进而影响极性键的角度和分子的偶极矩。
三、极性分子的应用1. 化学反应:极性分子在化学反应中扮演着重要的角色。
它们常常通过与其他极性或非极性分子之间的相互作用发生反应,从而影响化学反应的速率和产物的选择性。
2. 溶剂:极性分子在溶剂中的作用是广泛的。
在溶液中,极性分子可以与溶剂分子发生氢键或其他相互作用,从而改变溶液的性质。
例如,水作为一种极性溶剂,能够溶解许多极性分子和离子。
3. 生物学:在生物学中,极性分子起着重要的作用。
例如,细胞膜由极性脂质构成,这种极性脂质能够形成一个“双层”结构,起到隔离细胞内外环境的作用。
4. 药物设计:在药物设计中,了解分子的极性对于预测分子的药效和代谢途径至关重要。
极性分子可以通过与目标蛋白质发生相互作用,从而改变蛋白质的构象和功能。
结论:极性分子是化学中的一个重要概念,对于理解化学反应、溶解性、生物学和药物设计等领域具有重要意义。
键的极性与分子的极性范德华力和氢键及其对物质性质的影响

(氢2)键范及德其中华对力存物主质要在性影质响氢的物影质键响的物的理是性质H,范2德O华分力越子大,物之质的间熔,、氮沸点族越元高。素氢化物中存在氢键的是 NH 分子之间。 ②若中心原子有孤电子对,则为极性分子;若无孤电子对,则为非极性分子。
卤间族。元素氢化3物中存在氢键的是HF分子之间,氧族元素氢化物中存在氢键的是H2O分子之间,氮族元素氢化物中存间普遍存在的作用力称为范德华力。范德华力约比化学键 的键能小1~2个数量级。 2.性质 (1)结构相似的物质,相对分子质量越大,范德华力越大;分子的极 性越大,范德华力也越大。 (2)范德华力主要影响物质的物理性质,范德华力越大,物质的熔、 沸点越高。
一二三
Cl2、Br2、I2均为第ⅦA族元素的单质,它们的组成和化学性质相似, 你能解释常温下它们的状态分别为气体、液体、固体的原因吗?
作用 分子或原子 氢原子和电负性很大的原子
粒子 (稀有气体) 形成的分子之间
强度 比较
共价键>氢键>范德华力
共价键
原子间通过 共用电子对 所形成的相 互作用
原子
一
二
范德华力
氢键
共价键
影响 强度 的因 素
①随着分子 极性和相对 分子质量的 增大而增大 ②组成和结 构相似的物 质,相对分子 质量越大,分 子间作用力 越大
一二三
①若中心原子A的化合价的绝对值等于该元素所在的主族序数,则为非极性分子,若不等则为极性分子; (1)只含有非极性键的分子一定是非极性分子,如P4。
5.存在 (2)含极性键的分子,如果分子结构是空间对称的,则为非极性分子,否则为极性分子。
能理解范德华力、分子极性对物质性质的影响。
(完整word版)考点12 化学键与极性分子和非极性分子完美版

考点12化学键与极性分子和非极性分子△考纲要求△1。
理解离子键、共价键的涵义。
2。
理解极性键和非极性键.了解极性分子和非极性分子,了解分子间作用力,初步了解氢键及其对物质物理性质的影响.☆考点透视☆一、化学键1.定义:相邻的原子之间强烈的相互作用叫做化学键离子键极性共价键化学键共价键非极性共价键金属键2.离子键、共价键、金属键比较键型概念特点形成条件存在离子键阴、阳离子间通过静电作用所形成的化学键阴、阳离子间的相互作用活泼金属和活泼非金属通过得失电子形成离子键离子化合物共价键非极性键原子间通过共用电子对而形成的化学键共用电子对不发生偏移相同非金属元素原子的电子配对成键非金属单质某些化合物极性键共用电子对偏向一方原子不同非金属元素原子的电子配对成键共价化合物、某些离子化合物金属键金属阳离子与自由电子之间所形成的化学键金属阳离子与自由电子的相互作用金属单质金属单质二、极性分子和非极性分子(1)概念及特征在任何一个分子中都可以找到一个正电荷重心和一个负电荷重心,根据正负电荷重心是否重合,可一把分子分为极性分子和非极性分子.如果分子中正负电荷重心相重合,那就是非极性分子,如CO2。
l4。
C6H6(苯)、C2H4。
C2H2。
BF3等;否则即为极性分子,如H2O、NH3。
HX、H2O2等.分子中正负电荷的重心相距愈远,分子的极性愈显著,如果正负电荷的重心分离得很远,这个分子就属于离子型分子.如图所示:非极性分子极性分子离子型分子(2)判断AB n型分子是否有极性的经验规律若分子中A原子的最外层电子全部参与成键,这种分子一般为非极性分子,如CO2.CH4.BF3等;若A原子的最外层电子未全部参与成键,则为极性分子,如H2O、NH3等。
上述经验规律也可以表示为:A原子价电子数-A原子的键数=0,则为非极性分子;差值大于则为极性分子。
(3)典型实例本考点以概念说法较为常见,一般可应用具体实例验证叙述的对错。
实例了解越充分,对概念的理解就越透彻,解题速度也就越快.一些典型实例如下:①含极性键的非极性分子:CO2.CS2.BF、BCl3。
高中化学化学键笔记

化学键的概念1.定义:相邻的两个或多个原子(或离子)之间强烈的相互作用叫做化学键。
2.类型:(1) 离子键:由阴、阳离子之间通过静电作用所形成的化学键。
如NaCl、NH4Cl等。
(2) 共价键:原子之间通过共用电子对所形成的化学键。
如HCl、H2O等。
共价键包括极性共价键、非极性共价键①极性键:在化合物分子中,不同种原子形成的共价键,由于两个原子吸引电子的能力不同,共用电子对必然偏向吸引电子能力较强的原子一方,因而吸引电子能力较弱的原子一方相对的显正电性。
这样的共价键叫做极性共价键,简称极性键。
举例:HCl分子中的H-Cl键属于极性键。
②非极性键:由同种元素的原子间形成的共价键,叫做非极性共价键。
同种原子吸引共用电子对的能力相等,成键电子对匀称地分布在两核之间,不偏向任何一个原子,成键的原子都不显电性。
非极性键可存在于单质分子中(如H2中H—H键、O2中O=O键、N2中N≡N键),也可以存在于化合物分子中(如C2H2中的C—C键)。
以非极性键结合形成的分子都是非极性分子。
(3)金属键:化学键的一种,主要在金属中存在。
由自由电子及排列成晶格状的金属离子之间的静电吸引力组合而成。
化学反应本质就是旧化学键断裂和新化学键形成的过程。
(1)离子化合物:由阳离子和阴离子构成的化合物。
大部分盐(包括所有铵盐),强碱,大部分金属氧化物,金属氢化物。
活泼的金属元素与活泼非金属元素形成的化合物中不一定都是以离子键结合的,如AICI3不是通过离子键结合的。
非金属元素之间也可形成离子化合物,如铵盐都是离子化合物。
(2)共价化合物:主要以共价键结合形成的化合物,叫做共价化合物。
非金属氧化物,酸,弱碱,少部分盐,非金属氢化物。
(3)在离子化合物中一定含有离子键,可能含有共价键。
在共价化合物中一定不存在离子键。
几组概念的对比(1)离子键与共价键的比较(2)离子化合物与共价化合物的比较(3)化学键、分子间作用力、氢键的比较物质中化学键的存在规律(1)离子化合物中一定有离子键,可能还有共价键,简单离子组成的离子化合物中只有离子键,如:NaCl、Na2O等。
化学键离子键的知识点总括

化学键离子键的知识点总括一.化学键1.定义:相邻的两个或多个原子或离子之间强烈的相互作用叫做化学键。
2.类型:Ⅰ离子键:由阴、阳离子之间通过静电作用所形成的化学键。
Ⅱ 共价键:原子之间通过共用电子对所形成的化学键。
①极性键:在化合物分子中,不同种原子形成的共价键,由于两个原子吸引电子的能力不同,共用电子对必然偏向吸引电子能力较强的原子一方,因而吸引电子能力较弱的原子一方相对的显正电性。
这样的共价键叫做极性共价键,简称极性键。
举例:HCl分子中的H-Cl键属于极性键。
②非极性键:由同种元素的原子间形成的共价键,叫做非极性共价键。
同种原子吸引共用电子对的能力相等,成键电子对匀称地分布在两核之间,不偏向任何一个原子,成键的原子都不显电性。
非极性键可存在于单质分子中如H2中H—H键、O2中O=O键、N2中N≡N键,也可以存在于化合物分子中如C2H2中的C—C键。
以非极性键结合形成的分子都是非极性分子。
Ⅲ 金属键:化学键的一种,主要在金属中存在。
由自由电子及排列成晶格状的金属离子之间的静电吸引力组合而成。
二.化学反应本质就是旧化学键断裂和新化学键形成的过程。
1.离子化合物:由阳离子和阴离子构成的化合物。
大部分盐包括所有铵盐,强碱,大部分金属氧化物,金属氢化物。
注意:教材中在讲到离子键、共价键的形成条件时,一般讲“活泼金属与活泼非金属”元素间易形成离子键,而“非金属元素间”易形成共价键。
“活泼金属”一般指第IA族和第IIA族的钠、镁、钾、钙等金属,“活泼非金属”一般指第VIA族的氧元素和第VIIA族的氟、氯、溴等。
需要注意三个问题,一是“活泼金属”也可以与较不活泼的非金属形成离子键,如Na2S、KI等。
二是金属元素与非金属元素也可以形成共价键,如氯化铝等,不过在中学阶段,一般考查到的金属元素与非金属元素形成的化学键均为离子键。
三是非金属元素间也可以形成离子键,如NH4Cl等。
2.共价化合物:主要以共价键结合形成的化合物,叫做共价化合物。
化学键的极性与原子电负性

化学键的极性与原子电负性1. 引言化学键是化学元素之间相互作用的结果,是构成化合物的基本单位。
化学键的性质直接影响化合物的结构和性质。
其中,化学键的极性是一个重要的概念,它反映了化学键中原子之间电子分布的不均匀性。
而原子电负性是描述原子吸引和保留电子能力的物理量,是衡量化学键极性的关键因素。
本文将从理论和实例两个方面探讨化学键的极性与原子电负性的关系。
2. 化学键极性的概念化学键的极性是指在共价键中,由于两个原子电负性的差异,导致电子密度在化学键上的不均匀分布,形成电子云的偏移。
这种电子云的偏移使得化学键两侧的原子呈现出部分正负电荷,即化学键的极性。
化学键的极性可分为三种类型:非极性键、极性键和离子键。
3. 原子电负性的概念原子电负性是描述原子在共价键中吸引和保留电子能力的物理量,通常用符号χ表示。
电负性 values range from 0.7(非金属性最弱的金属铯[Cs])to 4.0(非金属性最强的非金属氟[F])。
电负性的大小与原子的电子亲和能、第一电离能和原子半径有关。
电负性越大,原子吸引和保留电子的能力越强。
4. 化学键极性与原子电负性的关系化学键的极性与原子电负性密切相关。
在共价键中,当两个原子的电负性相等时,共用电子对将均匀地分布在这两个原子之间,形成的化学键为非极性键。
例如,在氢气(H-H)和氮气(N≡N)分子中,两个原子具有相同的电负性,因此共价键为非极性。
当两个原子的电负性不等时,共用电子对将偏向电负性较大的原子,形成极性共价键。
极性共价键两侧的原子呈现部分正负电荷,使得化学键具有极性。
例如,在氯化氢(H-Cl)分子中,氯原子的电负性大于氢原子,因此共用电子对偏向氯原子,形成极性共价键。
原子电负性差异越大,共价键的极性越强。
当两个原子的电负性差距很大时,可能形成离子键。
在离子键中,电子从电负性较小的原子转移到电负性较大的原子,形成离子。
例如,在氯化钠(NaCl)中,钠原子的电负性小于氯原子,电子从钠原子转移到氯原子,形成离子键。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
在两个电负性不同的原子之间形成的共价键,叫做极性(共价)键
通常,极性键是由两个不同种的原子形成的,比如:
单键有:H-O、H-Cl、C-H、C-O等等
双键有:C=O、S=O、P=O、C=N等等
三键有:C≡N等
极性键的极性,取决于两个成键原子之间的电负性差异
差异越大,电子对越偏向于电负性强的原子一侧,键的极性越强.
通常,如果两个成键原子是同一种的,那么就是非极性键,如:
H-H、O-O、Cl-Cl、C=C、N≡N等
但是特别地,如果同种的两个原子所处的化学环境不相等,电负性有所差异那么两个原子之间形成的共价键将带有一定的极性,如:
臭氧O3中的两根O-O键,叠氮酸根[N3]-中的两根N=N键
被其他基团所共轭的C=C-C=O结构中的C=C键和C-C键等。
