初高中实验衔接及氯气实验室制取装置
Cl 氯气的实验室制取及拓展

目录
1.氯气实验室制法的拓展
基础知识 △
化学反应原理:MnO2+4HCl(浓)===== MnCl2+Cl2↑+2H2O
△ 仪器装置类型:固+液――→气
收集方法:向上排空气法或排饱和食盐 水法
尾气吸收:Cl2 有毒,用 NaOH 溶液吸 收,防止污染环境
联想拓展 被强氧化剂氧化 Cl- ―――――――→ Cl2
目录
即时应用 1.(2013·西安十校联考)小刚同学用 MnO2 和浓盐酸制氯气并 设计如下实验装置用于制取纯净的无水氯化铜。回答有关问 题:
目录
2.(2013·江西重点中学联考)某化学活动小组设计如下图所示 实验装置(部分夹持装置已略去),以探究潮湿的 Cl2 与 Na2CO3 反应的产物。
(1)写出装置 A 中发生反应的化学方程式: _________________________________________________。
用 KMnO4、KClO3、Ca(ClO)2 做氧化 剂与浓盐酸反应均可制得 Cl2 不加热 固+液 ――→ 气(H2、CO2)
△ 固+固――→气(KClO3→O2)
收集方法的选择与气体密度、溶解性 及在空气中的稳定性等有关
根据有害气体的性质,常设置点燃转 化、试剂吸收等处理装置
目录
2.实验室要制取的气体―决―定→反应原理―决―定→试剂和条件―确―定→ 发生装置、净化装置、收集装置、尾气处理装置的选择。 3.完整实验装置
目录Βιβλιοθήκη 目录特别提醒:1用 KMnO4、K2Cr2O7 代替 MnO2 时,不需加热; 用 MnO2 时,必须用浓盐酸,稀盐酸不反应。 2验满方法 ①将湿润的淀粉-KI 试纸靠近盛 Cl2 的瓶口,观察到试纸立即 变蓝,则证明已集满。 ②将湿润的蓝色石蕊试纸靠近盛 Cl2 的瓶口,观察到试纸立即 发生先变红后退色的变化,则证明已集满。 ③实验室制取 Cl2 时,常常根据氯气的颜色判断是否收集满。 3实验结束后,先使反应停止并排出残留的 Cl2,再拆卸装置, 避免污染空气。 4尾气吸收时,不能用澄清石灰水吸收 Cl2,因为溶液中含 CaOH2 量少,吸收不完全。
氯气的实验室制备原理及制备装置

氯气的实验室制备原理及制备装置
氯气是一种常见的化学气体,通常在实验室中可以通过以下原理和装置进行制备。
制备原理:
氯气通常是通过盐酸和含氯化合物(如氯化钠)的反应来制备的。
盐酸和含氯化合物反应生成氯气和相应的盐类,化学方程式如下所示:
2 NaCl + 2 HCl → 2 Na+ + 2 Cl+ H2↑。
制备装置:
1. 生成氯气的装置通常由两个瓶子组成,一个瓶子中放置盐酸(浓盐酸或稀盐酸均可),另一个瓶子中放置含氯化合物(如氯化钠)。
2. 两个瓶子通过管道连接,管道中间有一段干燥剂如无水氯化钙,用于吸收生成的气体中的水分。
3. 在实验过程中,首先向含氯化合物的瓶子中加入适量的盐酸,两者反应生成氯气,通过管道流入干燥剂,再由干燥剂进入收集瓶中。
操作步骤:
1. 将盐酸加入含氯化合物瓶中。
2. 等待反应生成氯气,气体通过管道流入干燥剂。
3. 收集瓶中收集氯气,可以通过水柱法或倒吸法等方法收集氯气。
需要注意的是,在实验室中制备氯气时,氯气具有毒性和腐蚀性,操作人员应佩戴防护眼镜和手套,确保实验室通风良好,避免
氯气泄漏。
同时,氯气也是一种强氧化剂,与易燃物质接触时会产
生剧烈反应,因此需要谨慎操作。
以上就是氯气的实验室制备原理及制备装置的相关内容,希望
能够对你有所帮助。
氯气实验室制取教学设计

氯气实验室制取教学设计一、实验目的本实验旨在通过实际操作,让学生了解氯气的性质、制备方法和应用,并培养学生实验操作的能力。
二、实验原理氯气是一种无色刺激性气体,密度比空气大。
氯气可通过电解盐水制取,电解时阴极反应产生氢气,阳极反应产生氯气。
三、实验器材和药品1.氯化钠溶液2.导电池(含两个电极)3.酸性氯化钾溶液4.滴管5.橡皮注射器6.试管7.吸管四、实验步骤1.实验前准备:将导电池放在实验台上,并将两个电极浸入氯化钠溶液中,注意阴阳极的正确连接。
2.将导电池的正极连接至阳极端,负极连接至阴极端。
3.打开导电池电源,调节电流强度为适当值。
4.开启导电池电源后,观察电解池中的变化,在阴极端产生气泡,阳极则无气泡产生。
5.用滴管取一滴酸性氯化钾溶液,滴于气泡之上,观察气泡颜色变化。
6.用橡皮注射器吸取气泡,将其转移到试管内,用饱和盐溶液封闭试管,观察试管内气泡的变化。
7.在试管开口处,用吸管吸取气体,将一小部分气体脱离实验装置。
8.关闭导电池电源,结束实验。
五、实验注意事项1.实验过程中要注意安全,严禁直接吸入氯气,以免发生危险。
2.操作时需佩戴安全眼镜和实验手套,避免溅到皮肤和眼睛。
3.操作导电池时要注意正确连接,禁止误接触电源。
六、实验结果与讨论根据实验步骤进行操作后,可以观察到阴极端产生气泡,阳极端则无气泡产生。
当滴加酸性氯化钾溶液时,气泡会变为橙黄色,这是因为沙氏反应(4OH¯→O2 + 2H2O + 4e¯)的产物氧气(O2)与酸性氯化钾溶液中的氯化钾(KCl)反应生成臭氧。
将气泡吸入试管中后加入饱和盐溶液封闭试管,观察到试管内气泡的变化,可以发现气泡的体积在饱和盐溶液中有所减小。
七、实验总结通过本实验的操作,学生对氯气的制备方法有了更深入的了解,认识到氯气的性质及其应用。
同时,通过实验操作,培养了学生实验操作的能力和观察、记录实验现象的能力。
八、实验延伸1.可以通过进一步研究氯气和其他物质的反应,探究氯气的应用领域。
氯气的制备及高中常见气体制备知识拓展
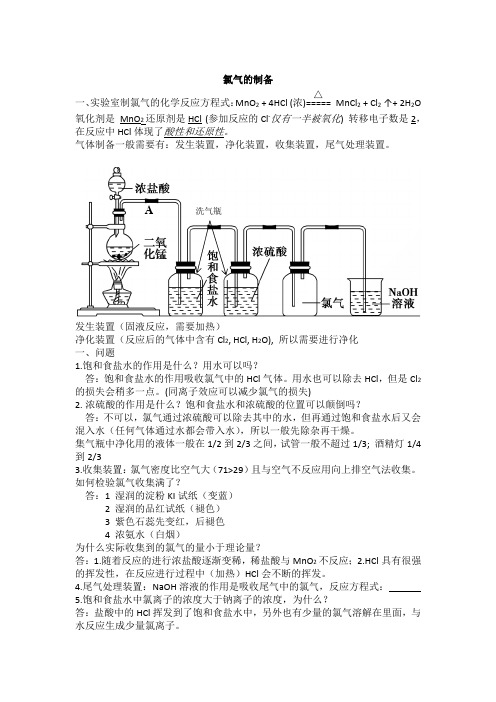
氯气的制备一、实验室制氯气的化学反应方程式:MnO 2 + 4HCl (浓)=====△ MnCl 2 + Cl 2 ↑+ 2H 2O氧化剂是 MnO 2还原剂是HCl (参加反应的Cl -仅有一半被氧化) 转移电子数是2,在反应中HCl 体现了酸性和还原性。
气体制备一般需要有:发生装置,净化装置,收集装置,尾气处理装置。
发生装置(固液反应,需要加热)净化装置(反应后的气体中含有Cl 2, HCl, H 2O), 所以需要进行净化一、问题1.饱和食盐水的作用是什么?用水可以吗?答:饱和食盐水的作用吸收氯气中的HCl 气体。
用水也可以除去HCl ,但是Cl 2的损失会稍多一点。
(同离子效应可以减少氯气的损失)2. 浓硫酸的作用是什么?饱和食盐水和浓硫酸的位置可以颠倒吗?答:不可以,氯气通过浓硫酸可以除去其中的水,但再通过饱和食盐水后又会混入水(任何气体通过水都会带入水),所以一般先除杂再干燥。
集气瓶中净化用的液体一般在1/2到2/3之间,试管一般不超过1/3; 酒精灯1/4到2/33.收集装置:氯气密度比空气大(71>29)且与空气不反应用向上排空气法收集。
如何检验氯气收集满了?答:1 湿润的淀粉KI 试纸(变蓝)2 湿润的品红试纸(褪色)3 紫色石蕊先变红,后褪色4 浓氨水(白烟)为什么实际收集到的氯气的量小于理论量?答:1.随着反应的进行浓盐酸逐渐变稀,稀盐酸与MnO 2不反应;2.HCl 具有很强的挥发性,在反应进行过程中(加热)HCl 会不断的挥发。
4.尾气处理装置:NaOH 溶液的作用是吸收尾气中的氯气,反应方程式:5.饱和食盐水中氯离子的浓度大于钠离子的浓度,为什么?答:盐酸中的HCl 挥发到了饱和食盐水中,另外也有少量的氯气溶解在里面,与水反应生成少量氯离子。
A 洗气瓶6. 将干燥的红纸条放在A 处导管口,红纸条会褪色吗?为什么?答:会褪色,氯气中含有水蒸气,会有HClO 生成,具有漂白作用。
新高一化学(初升高)暑假课(人教版)第08讲 氯气的实验室制法 (教师版)

第08讲氯气的实验室制法1、掌握氯气的制备原理及装置。
2、能结合实验室制取Cl 2的装置特点设计制备其他气体的实验装置,提升实验能力。
3、通过对比实验掌握氯离子的检验方法,培养证据推理与科学探究能力。
一、氯气的实验室制法1、反应原理(1)在实验室中,通常用浓盐酸与二氧化锰反应来制取氯气,反应的化学方程式:MnO 2+4HCl(浓)===△MnCl 2+Cl 2↑+2H 2O ,离子方程式:MnO 2+4H ++2Cl -===△Mn 2++Cl 2↑+2H 2O 。
(2)该反应的氧化剂是MnO 2,浓盐酸既表现还原性,又表现酸性。
2、制备装置(1)气体发生装置类型:固+液气。
(2)发生装置所用主要仪器:分液漏斗、圆底烧瓶、酒精灯。
(3)除杂装置:装置C 的作用是除去Cl 2中少量的HCl 气体;装置D 的作用是干燥氯气(或除去氯气中的水蒸气)。
3、收集方法(1)向上排空气法(氯气的密度大于空气的)。
(2)排饱和食盐水法(氯气在饱和氯化钠溶液中的溶解度很小,用此法可除去实验中挥发产生的氯化氢气体)。
4、验满方法(1)方法一:观察到E 中充满黄绿色气体,则证明已集满。
(2)方法二:将湿润的淀粉碘化钾试纸靠近盛氯气的瓶口,观察到试纸立即变蓝,则证明已集满。
(3)方法三:将湿润的蓝色石蕊试纸靠近盛氯气的瓶口,观察到试纸立即发生先变红后褪色的变化,则证明已集满。
5、尾气处理烧杯F 中盛放的液体是NaOH 溶液,该液体的作用是吸收过量的氯气,防止污染环境。
(1)稀盐酸与MnO 2不反应,制取氯气时必须选用浓盐酸;加热温度不宜过高,以减少氯化氢的挥发。
(2)制取的氯气有毒,且在加热时容易逸出,所以应选用分液漏斗,而不用长颈漏斗。
(3)尾气处理时,不能用澄清石灰水吸收氯气,因为澄清石灰水中的Ca(OH)2含量少,吸收不完全。
(4)实验结束后,先使反应停止并排出装置中残留的氯气,再拆卸装置,避免污染空气。
6、实验室制取氯气的注意事项(1)必须用浓盐酸,稀盐酸不反应。
第11讲氯气的实验室制法(教师版)2023年暑假初升高化学精准衔接课

一、氯气的实验室制法1. 基本原理与装置实验原理试剂 选择 浓盐酸+强氧化性物质(如MnO 2、KMnO 4、KClO 3等)实验 装置 图方 程 式装置 选择固液加热型发生装置/固液不加热型发生装置【答案】 MnO 2 + 4HCl(浓) =====△MnCl 2 + Cl 2↑+ 2H 2O 2KMnO 4 + 16HCl===2KCl + 2MnCl 2 + 5Cl 2↑ + 8H 2O KClO 3 + 6HCl(浓) === KCl + 3H 2O + 3Cl 2↑ 2. 制备氯气的优化装置知识预习知识导航第11讲 氯气的实验室制法、氯离子的检验3.Cl 2的验满方法(1)将湿润的淀粉-KI 试纸放在集气瓶口,观察到试纸立即变蓝,则证明已集满。
原理:Cl 2 + 2KI === I 2 + 2KCl ,置换出的I 2遇淀粉变蓝;(2)将湿润的蓝色石蕊试纸放在集气瓶口,观察到试纸_______________,则证明已集满。
【答案】先变红后褪色思考与交流:往某溶液中滴加AgNO 3,产生白色沉淀,能否说明溶液中含有Cl -【答案】不能,也会和AgNO 3反应产生白色沉淀。
二、氯离子的检验实验探究1. 氯离子(Cl -)的检验方法(1)检验原理:__________________________________。
(2)检验步骤:取少量待测液于试管中,加入________酸化的_________溶液,若_______________,说明溶液中含有Cl -。
【答案】 Ag ++Cl -===AgCl↓ 稀硝酸 AgNO 3 产生白色沉淀思考与交流:参考氯离子检验的思路,硫酸根离子应该如何检验?资料卡片——硫酸根离子的检验题型一:氯气的实验室制法对点训练先在被检测的溶液中加入足量的稀盐酸,以排除,的干扰,再加入BaCl 2溶液,若产生白色沉淀,则说明溶液中含有硫酸根离子。
在3支试管中分别加入2~3 mL 稀盐酸、NaCl 溶液、Na 2CO 3溶液,然后各滴入几滴AgNO 3溶液,观察现象。
实验室制取氯气装置图

实验室制取氯气装置图公司标准化编码 [QQX96QT-XQQB89Q8-NQQJ6Q8-MQM9N]
以下是实验室制取氯气的装置,在图中饱和食盐水的作用是吸收氯化氢
吸收氯化氢
,浓硫酸的作用是干燥
干燥
,F中盛放的溶液是氢氧化钠溶液
氢氧化钠溶液
,起的作用是吸收尾气
吸收尾气
.
考点:气体的净化(除杂);气体的干燥(除水);碱的化学性质.专题:实验性简答题.分析:实验室可以采用加热二氧化锰固体和浓盐酸的方法制取氯气,产生的氯气中混有氯化氢、水蒸气,氯气有毒,必须进行尾气处理,可以使用氢氧化钠溶液吸收.解答:解:加热二氧化锰固体和浓盐酸的方法制取氯气时,产生的氯气中容易混有氯化氢气体,要除去氯化氢气体,所选的除杂试剂只能吸收氯化氢而不能吸收氯气,故可以使用饱和食盐水将其除去,浓硫酸具有吸水性,可以除去氯气中混有的水蒸气,氯气有毒,必须进行尾气处理,防止其造成空气污染.
所以本题答案为:吸收氯化氢,干燥,氢氧化钠溶液,吸收尾气.。
2022年暑假新高一化学衔接第13讲 氯气的制取与性质(讲义)(解析版)

第13讲 氯气的制取与性质【学习目标】1.初步认识工业上电解饱和食盐水制取氯气的反应原理。
2.学会实验室制取氯气的方法。
3.了解氯气的物理性质和化学性质。
4.了解氯水的成分和性质。
【基础知识梳理】 一、氯气的发现1.氯元素在自然界中的存在在自然界中,氯元素全部以化合态的形式存在。
海水中蕴含丰富的氯元素,它主要以氯化钠、氯化镁等氯化物的形式存在。
2.氯气的发现1774年,瑞典化学家舍勒将软锰矿与浓盐酸混合加热,意外的产生一种具有强烈刺激性气味的黄绿色气体。
1810年,英国化学家戴维仔细研究了这种气体,并将其命名为氯气。
二、氯气的实验室制法 1.反应原理实验室常用MnO 2将浓盐酸中化合态的氯元素氧化为游离态的氯气,化学方程式: MnO 2+4HCl(浓)=====△MnCl 2+Cl 2↑+2H 2O 。
2.仪器装置(1)气体发生装置类型:固+液――→△气。
(2)发生装置所用仪器的名称为分液漏斗、圆底烧瓶。
3.收集方法用向上排空气法,理由是氯气与空气不反应且密度比空气的大。
4.尾气处理烧杯内盛放的液体是NaOH 溶液,其作用是吸收过量的氯气,防止污染环境。
【例1】有关实验室制取氯气的说法中,正确的是( )A .能用排水法收集氯气B .如果加入足量的MnO 2,盐酸将会完全反应C .可以用澄清石灰水来吸收氯气D .如果加入足量的浓盐酸,MnO 2将会完全反应答案:D解析:A.氯气可溶于水,不能用排水法收集,错误;B.实验室制取氯气时,必须用浓盐酸,盐酸变稀后不再与MnO 2反应,错误;C.由于Ca(OH)2微溶于水,石灰水的浓度较小,只能不宜用石灰水吸收氯气,错误;D.当浓盐酸足量时,MnO 2会完全与浓盐酸反应,正确。
故选D 。
三、氯气的工业制法1.实验探究——模拟工业制备氯气(1)按下图所示电解饱和食盐水的装置进行实验。
①接通电源,观察铁棒和石墨棒上发生的现象。
通电一段时间后,将小试管套在a 管上,收集U 形管左端产生的气体。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
培元中学2016届高一化学周末练习(第13周)
一、实验室制备氯气装置如下图所示,回答下列问题:
A B C D E
(1) 实验室制备氯气的化学方程式为
(2)如何对该装置进行气密性检查?
(3)A装置中各玻璃仪器名称为、和,
(4) B装置中装的药品是,其用途是,
(5)C装置中装的药品是,其用途是,
(6) D装置用途是,其收集满的实验现象为
(7) E装置中装的药品是,其用途是,对应的
化学方程式为
二、常见的制备气体各装置如下图所示,请按要求回答下列问题:
①②③④⑤⑥⑦⑧⑨⑩
(1)大理石和稀盐酸反应制备CO2气体,其反应方程式为
则按“气体的产生→净化→收集→尾气处理”顺序用编号连接起来
(2)锌片和稀硫酸反应制备H2气体,其反应方程式为
则按“气体的产生→净化→收集→尾气处理”顺序用编号连接起来
其尾气处理的方程式为
(3)实验室制备O2气体的方法有两种:
A.加热高锰酸钾固体,其反应方程式为
则按“气体的产生→净化→排气法收集”顺序用编号连接起来
B.双氧水在二氧化锰固体催化下反应生成O2,其反应方程式为
则按“气体的产生→净化→收集”顺序用编号连接起来
制备O2无需尾气处理,因为
(4)针对⑦装置回答下列问题:
ⅰ.若收集O2、Cl2等气体则气体从口进,口出,(填“A”或“B”,下同)若收集H2、NH3等气体,则气体从口进,口出;
ⅱ.若瓶内加入适量浓硫酸作为气体干燥装置,则气体从口进,口出;
ⅲ.若瓶内充满水作为排水取气装置,则气体从口进,口出,能否用该装置收集氯气?
(填“能”或“否”),若否,则应如何修改
三、选择题
1.二氧化锰与浓盐酸作用制氯气的反应中,作为还原剂的HCl和参加反应的HCl物质的量比是()A.1∶1 B.2∶1 C.1∶2 D.任意比
2.在实验室中制取纯净、干燥的氯气,常使生成的氯气依次通过两个洗气瓶,这两个瓶内盛放的试剂依次是()①盐酸②饱和食盐水③浓硫酸④石灰水⑤烧碱溶液
A.①②B.②③C.③⑤D.②④
3.实验室制取下述各组物质,所用的气体发生装置可以相同的是()
A.H2,O2B.O2,Cl 2C.Cl2,H2D.H2,CO2
4.实验室制氯气时有如下操作,操作顺序正确的是()
①连接好装置,检查气密性
②缓缓加热,加快反应,使气体均匀逸出
③在烧瓶中加入二氧化锰粉末
④往分液漏斗中加入浓盐酸,再缓缓滴入烧瓶中
⑤用向上排空气法收集氯气,尾气导入吸收剂中
A ①②③④⑤
B ④③①②⑤
C ①③④②⑤
D ①④③②⑤
5.用1mol MnO2和含HCl为4mol浓盐酸充分反应(共热),在不考虑HCl挥发的情况下,得到的
氯气物质的量是().
A等于2molB等于1mol C小于1molD大于1mo l。
