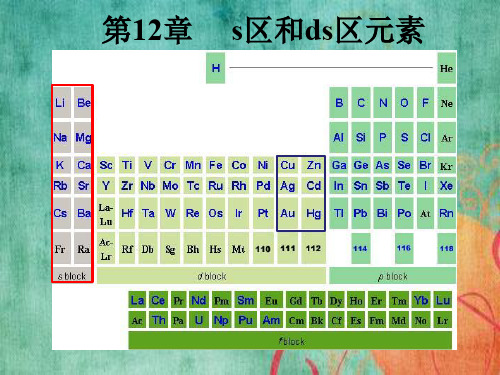
无机化学S区元素概述单质及其物理化学性质
s区和ds区元素吉林大学无机化学
H 2 (g)
HCl
③ Cu,Ag,Au可溶于氧化性酸
Cu 4HNO3 (浓) Cu(NO 3 )2 2NO2 2H 2O Ag 2HNO3 (浓) AgNO 3 NO2 H 2O Cu 2H 2SO4 (浓) CuSO 4 SO2 2H 2O 2Ag 2H 2SO4 (浓) Ag 2SO4 (s) SO2 2H 2O Au 4HCl(浓) HNO3 (浓)
3Hg 8HNO3 (稀,过量) Hg(NO 3 )2 2NO 4H 2O
6Hg(
过量)
8HNO
3
(稀)
冷
3Hg
2
(NO
3
)
2
(4) 锌与OH-,NH3反应
2NO 4H 2O
Zn
2OH
2H 2O
Zn(OH)
24
H2
Zn
4NH3
2H 2O
Zn(NH
4Au 8NaCN 2H2O O2 4Na[Au(CN)2 ] 4NaOH
2
Au(CN
)2
Zn
Zn(CN
)
2 4
2
Au
Solvay制碱法(氨碱法)
海水
饱和吸收氨的海水
NH3
NaCl,H2O
CaCO3 煅烧
CaCO3CaO+CO2
NaCl
CO2
H2O NH3
Na++Cl-+NH3+CO2+H2O NaHCO3(s)+NH4++Cl-
常用酸和碱—s区元素单质及化合物的性质识用

波长 / nm 670.8 589.2 766.5 780.0 455.5 714.9 687.8 553.5
•与水作用
2 M(s) + 2 H2O (l) → 2 M+(aq) + 2 OH-(aq) + H2(g)
M(s) + 2 H2O (l)→ M2+(aq) + 2 OH-(aq) + H2(g)
Rb
Cs
Be
Mg
Ca
Sr
Ba
ⅠA
原子序 数
价电子构 金属半径 熔点 沸点
型
(pm) (℃) (℃)
硬度
(金刚石 =10)
Li (锂) 3
2s1
152 180.5 1342 0.6
Na (钠) 11
3s1
186 97.82 882.9 0.4
K (钾) 19
4s1
227 63.25 760 0.5
Rb (铷) 37
化合价键特征:以离子键结合为特征,但在某些情况下 仍显一定程度的共价性。
其中Li和Be,由于具有较小的原子半径,电离能高于 同族其它元素,形成共价键的倾向比较显著,常表现出与 同族元素不同的化学性质。
锂 、铍的特殊性----- 对角线规则
Li Be B C Na Mg AI Si
周期系中有些元 素的性质常与它右下 方相邻的另一元素类 似,这种关系叫对角 线关系。
性质
m.p./K MOH 在水中的 溶解度/(mol·L-1)
Li Na K Rb Cs 453.69 370.96 336.8 312.04 301.55
5.3 26.4 19.1 17.9 25.8
•与液氨的作用
元素化学 第二章s区元素

碱金属与碱土金属
(4)溶解度 碱金属氢氧化物(MOH)易溶于水,放热 碱土金属氢氧化物在水中溶解度小于碱金 属氢氧化物。
氢氧化物 溶 解 度 -1 /m o l· L B e(O H ) 2 8× 10
-6
M g (O H ) 2 5× 10
-4
C a(O H ) 2 1 .8 × 1 0
-2
1
1. s区元素概述 1.1 s区元素 碱金属(IA ): ns1 氧化态为+1 s区 Li, Na, K, Rb, Cs, Fr 碱土金属(IIA ): ns2 氧化态为+2 Be, Mg, Ca, Sr, Ba, Ra 都是活泼金属
2
碱金属与碱土金属
存在形式 (1)钠和钾: 熔盐NaCl、海水 天然氯化钾、光卤石(KCl) (2)钙和镁: 白云石 、方解石 、菱镁矿 、石膏 (3)锶和钡: 天青石(SrSO4) ,重晶石(BaSO4)
2NH
2
H 2 (g)
2 Na( s) 2 NH 3 (l ) 2 NaNH 2 H 2 ( g )
(4) 焰色反应 碱金属和碱土金属中的钙、锶、钡及其挥发 性化合物在无色火焰中灼烧,火焰有特征颜橙红 深红 绿
Li
Be
B
Al
C
Si
34
Na Mg
碱金属与碱土金属
4.2 锂与镁的相似性 ⑴ 单质与氧作用生成正常氧化物 ⑵ 氢氧化物均为中强碱,且水中溶解度不大 ⑶ 氟化物、碳酸盐、磷酸盐均难溶 ⑷ 氯化物均能溶于有机溶剂中 ⑸ 碳酸盐受热分解,产物为相应氧化物
碱金属与碱土金属
3.3 氢氧化物 制备: M 2O
H 2 O 2 MOH
MO H 2 O M ( OH ) 2
无机化学第七章S区元素

无机化学第七章S区元素第七章主要介绍了S区元素的性质和应用。
S区元素是指周期表中第16族元素,包括氧、硫、硒、碲和钋。
这些元素具有一些共同的性质和特点,包括氧化态的规律和趋势、同族元素的化学性质等。
S区元素的氧化态规律和趋势是其重要的特点之一、氧化态是指元素在化合物中的电荷数。
在S区元素中,氧通常呈-2的氧化态,露卜那呈-1的氧化态,硫、硒和碲的氧化态则比较复杂,可以是正或负的多个值。
这种规律是由于这些元素的外层电子结构决定的。
氧的外层有6个电子,可以通过接受2个电子来填满外层,从而达到稳定的8个电子的结构。
而露卜那的外层只有一个电子,可以通过捐赠一个电子来达到稳定的结构。
而硫、硒和碲的外层电子结构类似,有6个电子,可以通过得失2个电子来达到稳定的8个电子的结构。
在S区元素中,氧是一个非金属元素,而硫、硒和碲则是亚稳金属。
氧具有较高的电负性,能够与其他元素形成较强的电负性键。
它在自然界中广泛存在,包括空气中的氧气、水中的水分子等。
由于氧的高电负性,它可以与其他元素形成氧化物,包括过氧化物、酸性氧化物和碱性氧化物等。
氧化物有着重要的应用,例如过氧化氢可用作漂白剂和消毒剂。
硫、硒和碲是黄顺子亚稳金属,它们具有较高的化学活性。
它们主要存在于矿石中,包括铁矿石中的硫化铁矿石。
硫还广泛存在于化学品中,包括硫酸、硫酸铜等。
硫还可以形成众多的无机化合物,例如硫化物和亚硫酸盐。
硫化物在冶金工业中有重要应用,例如焦炭的熔融炉和脱硫设备。
在亚稳金属中,硒是比较特殊的元素。
它可以形成六亚硒酸盐,具有良好的光敏性。
六亚硒酸盐可以用于摄影中的胶片和相纸的显影剂,以及红外线辐射计的探测剂。
此外,硒还可以形成硒化物,具有一定的半导体性能。
碲也是一种亚稳金属,具有类似硒的性质。
它可以形成一种黑色固体的碲化铋,具有比较好的半导体性能。
碲化铋被广泛应用于红外线成像和热电传感器等领域。
除了硫、硒和碲,S区元素中还有钋,它是一种放射性元素。
s区元素及稀有气体知识归纳及有效数字与化学计算

合物是可以制得的。不久澳洲国立大学的拉多姆宣布了化学上一 奇闻,氦能够与碳结合形成分子。像CHexx+不仅存在,而且能 够用实验手段观察到,并借助计算机算出了CHe33+、CHe44+的 键长分别为:0.1209 nm,0.1212 nm。 1、Ne、He的化合物难以合成的主要原因是什么? 2、如果CHe33+、CHe44+果真存在的话,请写出它们的立体结构 式;
2、溶解性:LiOH、Li2CO3、Li3PO4;Na[Sb(OH)6]、 NaAc•Zn(Ac)2•3UO2(Ac)2•9H2O;KClO4、KHC4H4O6、 K4[PtCl6]、K2Na[Co(NO2)6]、K[B(C6H5)4];半径比规则
3、盐类带结晶水的能力 Z/r比越高,结合水的能力越强。 CaCl2干燥剂(除氨和乙醇) 4、形成复盐的能力 光卤石:MCl•MgCl2•6H2O;K+、Rb+、Cs+ 矾类:M2SO4•MgSO4•6H2O;K+、Rb+、Cs+ MIMIII(SO4)2•12H2O;MI= Na+、K+、Rb+、Cs+ ; MIII= Al3+、Cr3+、Fe3+、Co3+ 5、热稳定性:金属越活泼,盐稳定性越高 6、重要盐类:碳酸钠(苏打、纯碱)
有效数字和化学计算
一、有效数字的问题
1、定义:从第一位非零数字开始到最后一位数字 1.0005 0.5000 6.021023 0.00035 pH=12.35
2、进取规则: (1)四舍六入五成双 (2)一次修约到指定位数,不能分两次以上 0.5464、0.5466、0.5465、0.5475、0.546504、0.54749
普通化学S区元素
S区元素概述
(2) 与水作用 ● 碱金属被水氧化的反应为: 2 M(s) + 2 H2O (l) → 2 M+(aq) + 2 OH-(aq) + H2(g)
Li
●
Na
K
碱土金属被水氧化的反应为:
M(s) + 2 H2O (l)→ M+(aq) + 2 OH-(aq) + H2(g)
远不如相邻碱金属那样剧烈,镁和铍在水和空气中因生成致
S区元素概述
(3) 焰色反应 (flame reaction) 碱金属和碱土金属的化合物在无色火焰中燃烧 时 , 会 呈 现 出 一 定 的 颜 色 , 称 为 焰 色 反 应 (flame reaction)。可以用来鉴定化合物中某元素的存在,特 别是在野外。
元 颜 素 色 Li 深红 670.8 Na 黄 589.2 K 紫 766.5 Rb 红紫 780.0 Cs 蓝 455.5 Ca 橙红 714.9 Sr 深红 687.8 Ba 绿 553.5
密的氧化物保护膜而显得十分稳定。
S区元素概述
Question 2
Solution
锂的标准电极电势比钠或钾的标准电极 电势小,为什么 Li与水反应没有其他金属 与水的反应激烈? Li Na 453.69 370.96 5.3 26.4 K Rb Cs 336.8 312.04 301.55 19.1 17.9 25.8
金属锂
S区元素用途
1. 制造氢化锂、氨化锂和合成有机锂化合物,后者用做
有机化学中的还原剂和催化剂; 2. 制造合金Al-Li(含锂3 % ),因质量轻和强度大而用于空
间飞行器;
3. 制造高功率长效电池(用于手表、计算机、心脏起搏 器等); 4. 同位素(在天然锂中约占7.5%)受中子轰击产生热核 武器的主要原料氚:
s区元素知识点总结

9.4.1 晶型
重要盐类:卤化物、硝酸盐、硫酸盐、碳酸盐。 晶体类型:
绝大多数是离子晶体,但碱土金属卤 化物有一定的共价性。 例:Be2+极化力强, BeCl2为共价化合物。
BeCl2 MgCl2 CaCl2 SrCl2 BaCl2 熔点/ ℃ 415 714 775 874 962
通性: • 易与H2直接化合成MH、MH2离子
型化合物;
• 与O2形成正常氧化物、过氧化物、 超氧化物;
• 易与H2O反应(除Be、Mg外), 与非金属作用形成相应的化合物。 注:它们的活泼性有差异
电金原 离属子 能性半 、、径 电还增 负原大 性性 减增 小强
IA
IIA
Li
Be
Na
Mg
K
Ca
Rb
Li2O
Na2O2 KO2
镁 带 的 燃 烧
发出耀眼的白光
2、与H2作用 s区元素的单质(除Be、Mg外)均能与氢
形成离子型氢化物。 (1)均为白色晶体, 热稳定性差
LiH NaH KH RbH CsH NaCl
-90.4 -57.3 -57.7 -54.3 -49.3 -441
△ fHm / kJ·mol-1
§9.3 氧化物和氢氧化合物
9.3.1 氧化物 9.3.2 氢氧化物
9.3.2 氢氧化物
碱金属和碱土金属的氢氧化物都是白 色固体。
•易吸水而潮解 MOH易溶于水,放热。
碱土金属溶解度(20℃)
氢氧化物 Be(OH)2 Mg(OH)2 Ca(OH)2 Sr(OH)2 Ba(OH)2
溶解度 /mol·L-1
8×10-6 2.1×10 -4 2.3 ×10-2 6.6 ×10-2 1.2 ×10-1
无机化学第三版课件第17章 s 区元素

● 与CO2 的作用
Li2O + CO2 = Li2CO3 2 Na2O2 + 2CO2 = 2 Na2CO3 + O2 4 KO2 + 2 CO2 = 2 K2CO3 + 3 O2
二、氢氧化物
M 2 O, MO MOH, M(OH) 2
H 2O
● 溶解度
碱金属氢氧化物 在水中溶解度都 很大,但是碱土 金属氢氧化物在 水中溶解度要小 的多。 ● 易吸水溶解 LiOH 碱 性 递 增
第17章
Chapter 17
s 区元素
s-Block Elements
s 区元素在周期表中的位置
本章教学要求
1. 掌握 s 区元素的电子构型与性质递s 区元素的氢化物、氧化物、氢氧化
物的性质,特别注意氢氧化物的碱性变 化规律。 3.了解 s 区元素的重要盐类化合物。 4.了解对角线规则。
化学活泼性
升 硬 熔 华 度 沸 能 点 极 水 电 电 化 合 负 离 力 能 性 能
递 减
递 增
§9-2
●
●
单质
都是最活泼的金属
同一族自上而下性质的变化有规律
●
●
通常只有一种稳定的氧化态
形成的化合物大多是离子型的
一、单质的物理性质
碱金属密度小、硬度小、熔点低、导电性 强,是典型的轻金属。碱土金属的密度、 熔点和沸点则较碱金属为高。锂是固体单 质中最轻的,它的密度约为水的一半。碱 土金属的密度稍大些。
Ti + 4NaCl + 2H2
(3) 与 H2O 作用
● 碱金属被 H2O 氧化: 2 M + 2 H2O = 2 M+ + 2 OH-+ H2↑
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
无机化学S区元素概述单质及其物理化学性质S区元素是指周期表中第三周期的元素,包括Sc、Ti、V、Cr、Mn、Fe、Co、Ni、Cu和Zn。
这些元素的单质是指它们在自然界中以纯态存在
的形态。
下面将对这些S区元素的单质及其物理化学性质进行概述。
Scandium(Sc)是一种银白色金属,熔点1541℃,沸点2836℃。
它
的密度为2.989 g/cm³,熔化热为15.8 kJ/mol。
Scandium的化学性质活泼,可以与氢气、氧气和氮气反应。
它可以形成多种化合物,如ScCl3、
Sc2O3等。
Titanium(Ti)是一种银灰色金属,熔点1668℃,沸点3260℃。
它
的密度为4.506 g/cm³,熔化热为13.8 kJ/mol。
Titanium具有低密度、
高强度和良好的耐腐蚀性。
它与氧、氮、氢等非金属元素反应生成化合物,如TiO2、TiN等。
Vanadium(V)是一种银白色金属,熔点1890℃,沸点3380℃。
它的
密度为6.0 g/cm³,熔化热为21.5 kJ/mol。
Vanadium的化学性质活泼,
可以与氧气、氮气和氟气反应。
它可以形成多种氧化态,如V2O5、VO2等。
Chromium(Cr)是一种银灰色金属,熔点1907℃,沸点2672℃。
它
的密度为7.18 g/cm³,熔化热为20.5 kJ/mol。
Chromium的外层电子构
型为3d54s1,具有良好的抗腐蚀性。
它可以形成多种化合物,如Cr2O3、CrCl3等。
Manganese(Mn)是一种银灰色金属,熔点1244℃,沸点1962℃。
它
的密度为7.21 g/cm³,熔化热为13.2 kJ/mol。
Manganese与氧气反应生
成二氧化锰(MnO2),具有一定的催化性能。
它还可以形成多种化合物,
如MnCl2、MnSO4等。
Iron(Fe)是一种银灰色金属,熔点1538℃,沸点2861℃。
它的密
度为7.874 g/cm³,熔化热为13.8 kJ/mol。
Iron的化学性质稳定,可以
与氧气反应生成氧化铁(Fe2O3)。
它还可以形成多种配合物和合金,如FeCl2、FeSO4等。
Cobalt(Co)是一种银灰色金属,熔点1495℃,沸点2870℃。
它的
密度为8.90 g/cm³,熔化热为16.2 kJ/mol。
Cobalt与氮、硫等非金属
元素反应生成化合物,如Co(NO3)2、CoS等。
它还可形成多种配合物和磁
性材料。
Nickel(Ni)是一种银白色金属,熔点1455℃,沸点2913℃。
它的
密度为8.91 g/cm³,熔化热为17.2 kJ/mol。
Nickel与氧气反应生成氧
化镍(NiO),具有良好的耐腐蚀性。
它还可以形成多种配合物和合金,
如NiCl2、NiFe等。
Copper(Cu)是一种红色金属,熔点1085℃,沸点2562℃。
它的密
度为8.96 g/cm³,熔化热为13.1 kJ/mol。
Copper具有良好的导电、导
热性能,可以与硫、氯等非金属元素反应生成化合物,如Cu2S、CuCl2等。
Zinc(Zn)是一种银白色金属,熔点419.53℃,沸点907℃。
它的密
度为7.134 g/cm³,熔化热为7.32 kJ/mol。
Zinc与氧气反应生成氧化锌(ZnO),具有一定的抗腐蚀性。
它还可以形成多种配合物和合金,如
ZnCl2、ZnAl等。
综上所述,S区元素的单质具有一系列特定的物理化学性质。
它们的
密度、熔点、沸点各不相同,但都在一定范围内。
这些元素在自然界中以
纯态存在,可以与不同的非金属元素反应生成不同的化合物。
由于它们的
化学性质和物理性质的差异,这些S区元素具有广泛的应用领域,如金属
合金、电子材料和催化剂等。
