元素周期表的性质
化学元素的周期表和性质

化学元素的周期表和性质一、周期表的构成1.周期表是化学元素按照原子序数递增排列的表格,目前包含118种元素。
2.周期表分为七个周期,横排,周期数等于元素原子的最外层电子层数。
3.周期表有十六个族,竖排,族数代表元素原子的最外层电子数。
二、周期表的规律1.周期规律:电子层数相同的元素,从左至右原子半径逐渐减小,金属性逐渐减弱,非金属性逐渐增强。
2.族规律:同一族元素,原子半径随着周期数增加而增大,金属性随着周期数增加而增强,非金属性随着周期数增加而减弱。
三、元素的性质1.原子半径:原子核外电子层数越多,原子半径越大;同一周期中,从左至右原子半径逐渐减小。
2.金属性:元素的金属性随着原子序数的增大而减弱;同一族中,金属性随着周期数的增加而增强。
3.非金属性:元素的非金属性随着原子序数的增大而增强;同一族中,非金属性随着周期数的增加而减弱。
4.最高正化合价:主族元素的最高正化合价等于其最外层电子数(O、F元素除外)。
5.最低负化合价:主族元素的最低负化合价等于其最外层电子数减8(O、F元素除外)。
6.周期表在化学反应中的应用:根据元素的位置,判断其在化学反应中的角色,如氧化剂、还原剂等。
7.周期表在材料科学中的应用:根据元素的性质,选择合适的元素制备具有特定性能的材料。
8.周期表在生物体内的应用:了解元素在生物体内的分布和作用,研究生物体生理功能与元素的关系。
五、学习周期表的建议1.熟悉周期表的基本构成,了解各个周期、族的元素分布。
2.掌握周期表的规律,能根据元素的位置判断其性质。
3.了解元素的主要性质和应用,提高对化学知识的运用能力。
4.平时多观察、多思考,将周期表与实际应用相结合,提高学习效果。
习题及方法:1.习题:元素X位于第四周期第Ⅷ族,原子序数为26,请写出元素X的名称。
方法:根据题目信息,我们可以知道元素X位于第四周期第Ⅷ族,原子序数为26。
查看周期表,第四周期第Ⅷ族的元素是铁(Fe)。
所以元素X的名称是铁。
化学元素周期表的元素性质

化学元素周期表的元素性质化学元素周期表是化学界广泛应用的一种分组化工具,它将各种元素按照一定的规律排列起来,向我们展示了元素的周期性和趋势性。
每个元素都有特定的原子性质和化学性质,在周期表中,这些性质根据元素的位置和排列有着明显的规律和变化。
本文将详细介绍一些常见元素的性质,包括物理性质、化学性质以及元素的周期趋势。
第一部分:元素周期表的基本结构与命名规则化学元素周期表是由英国化学家门德莱夫于1869年首次提出的。
它由一系列水平排列的横行和垂直排列的竖列组成,横行称为周期,竖列称为族。
横行的周期数越高,原子序数越大。
周期表的左侧是碱金属元素,右侧是气体元素,中间是过渡金属元素。
元素的命名规则遵循国际纯粹与应用化学联合会 (IUPAC) 的规定,通常采用拉丁文命名,并用缩写代表,如氢元素是H,氧元素是O。
第二部分:元素的物理性质元素的物理性质是指元素在无变化化学环境下所具有的性质。
其中包括原子量、电子排布、状态、熔点、沸点、导电性等。
例如,氧元素的原子量是16,电子排布为2,6,氧气在常温下是气体状态,熔点为-218.8°C,沸点为-183°C,而氧元素是一种良好的氧化剂。
第三部分:元素的化学性质元素的化学性质是指元素与其他元素或化合物发生化学反应时所表现出来的性质。
化学性质包括元素的化合价、化学活性、氧化还原性等。
举个例子,钠是一种具有强烈金属性质的化学元素,它具有+1的单一化合价,与氧元素反应时会产生氧化钠。
第四部分:元素的周期趋势在元素周期表中,第一周期只有两个元素,氢和氦。
随着周期数的增加,元素的原子量、原子半径、电子亲和能力、电离能等特性都会发生逐渐的变化。
比如,原子半径随着周期数增加而逐渐增大,而电离能随着周期数增加而逐渐增大。
这些周期性趋势对于理解元素的性质和预测元素的反应非常重要。
结语化学元素周期表是化学研究中不可或缺的基础工具,通过它我们可以了解各种元素的性质和趋势。
化学之元素周期表的性质
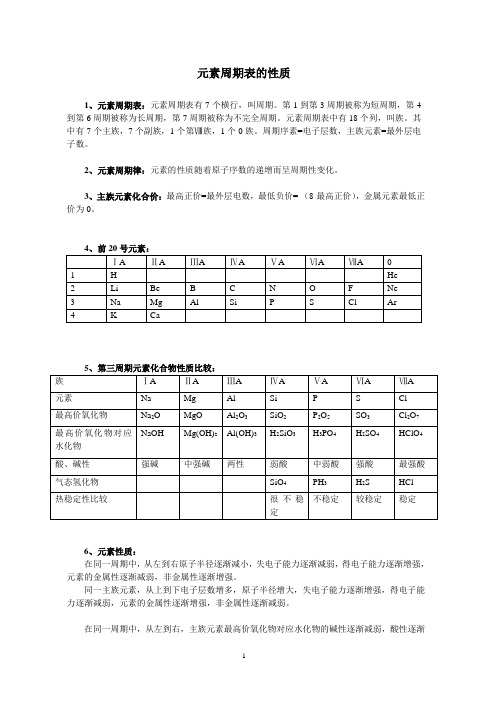
元素周期表的性质1、元素周期表:元素周期表有7个横行,叫周期。
第1到第3周期被称为短周期,第4到第6周期被称为长周期,第7周期被称为不完全周期。
元素周期表中有18个列,叫族。
其中有7个主族,7个副族,1个第Ⅷ族,1个0族。
周期序素=电子层数,主族元素=最外层电子数。
2、元素周期律:元素的性质随着原子序数的递增而呈周期性变化。
3、主族元素化合价:最高正价=最外层电数,最低负价=-(8-最高正价),金属元素最低正价为0。
4、前20号元素:ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 01 H He2 Li Be B C N O F Ne3 Na Mg Al Si P S Cl Ar4 K Ca5、第三周期元素化合物性质比较:族ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA元素Na Mg Al Si P S Cl最高价氧化物Na2O MgO Al2O3SiO2P2O5SO3Cl2O7NaOH Mg(OH)2Al(OH)3H2SiO3H3PO4H2SO4HClO4最高价氧化物对应水化物酸、碱性强碱中强碱两性弱酸中弱酸强酸最强酸气态氢化物SiO4PH3H2S HCl不稳定较稳定稳定热稳定性比较很不稳定6、元素性质:在同一周期中,从左到右原子半径逐渐减小,失电子能力逐渐减弱,得电子能力逐渐增强,元素的金属性逐渐减弱,非金属性逐渐增强。
同一主族元素,从上到下电子层数增多,原子半径增大,失电子能力逐渐增强,得电子能力逐渐减弱,元素的金属性逐渐增强,非金属性逐渐减弱。
在同一周期中,从左到右,主族元素最高价氧化物对应水化物的碱性逐渐减弱,酸性逐渐增强;它们气态氢化物的热稳定性逐渐增强。
在同一主族中,从上到下,元素最高价氧化物对应水化物的酸性逐渐减弱,碱性逐渐增强;它们的气态氢化物的热稳定性逐渐减弱。
原子半径金属性非金属性最高价氧化物对应水化物气态氢化物的稳定性酸性碱性同一横行减小减小增大减小增大增大同一列增大增大减小增大减小减小2011.11.12。
初一化学常见元素周期表及其特性概述

初一化学常见元素周期表及其特性概述化学是一门研究物质组成、性质、变化规律以及它们之间相互作用的科学。
在化学的学习中,元素周期表是一项重要的基础知识。
本文将对初一化学中常见的元素周期表及其特性进行概述。
一、元素周期表的基本结构元素周期表是以元素的原子序数递增的顺序排列,并且将具有相似性质的元素放在同一列中。
它由水平行(周期)和垂直列(族)组成。
每个元素在表中有两个数字表示,上方数字为原子序数,下方数字为原子量。
同时,元素周期表还将元素分为金属、非金属和半金属。
二、常见周期表元素及其特性概述1. 原子序数1的氢元素(H)氢是宇宙中最常见的元素之一,也是化学中最简单的元素。
氢是一种无色无味的气体,在常温下非常不稳定。
它易燃易爆,并且能够与其他元素形成化合物。
2. 原子序数6的碳元素(C)碳是生命的基础元素,存在于大部分有机物质中,如葡萄糖、脂肪和蛋白质。
碳有很强的化学稳定性,并且能够形成多种化合物。
3. 原子序数11的钠元素(Na)钠是一种常见的金属元素,常用化学符号为Na(来自于拉丁文Natrium)。
在室温下,钠是一种可以切割的银白色金属。
它具有很高的反应性,与水反应会发生剧烈的放热反应。
4. 原子序数17的氯元素(Cl)氯是一种非金属元素,常用化学符号为Cl。
氯以气体和盐酸的形式广泛存在。
它具有强烈的刺激性气味和剧毒性,并且可以消毒和净化水。
5. 原子序数25的锰元素(Mn)锰是一种过渡金属元素,常用化学符号为Mn。
它是一种银灰色金属,在常温下具有较高的硬度和延展性。
锰在自然界中广泛存在,在生物体中具有重要的生物功能。
6. 原子序数29的铜元素(Cu)铜是一种常见的金属元素,常用化学符号为Cu(来自于拉丁文Cuprum)。
铜呈红褐色,并具有良好的导电和导热性能。
它常用于电线、电器和建筑材料等领域。
7. 原子序数79的金元素(Au)金是一种珍贵的金属元素,常用化学符号为Au(来自于拉丁文Aurum)。
元素周期表性质

1 原子半径
(1)除第1周期外,其他周期元素的原子半径随原子序数的递增而减小;
(2)同一族的元素从上到下,随电子层数增多,原子半径增大.
2 元素化合价
(1)除第1周期外,同周期从左到右,元素最高正价由碱金属+1递增到+7,非金属元素负价由碳族-4递增到-1(氟无正价,氧无+6价,除外);
(2)同一主族的元素的最高正价、负价均相同
(3) 所有单质都显零价
3 单质的熔点
(1)同一周期元素随原子序数的递增,元素组成的金属单质的熔点递增,非金属单质的熔点递减;
(2)同一族元素从上到下,元素组成的金属单质的熔点递减,非金属单质的熔点递增
4 元素的金属性与非金属性
(1)同一周期的元素电子层数相同.因此随着核电荷数的增加,原子越容易得电子,从左到右金属性递减,非金属性递增;
(2)同一主族元素最外层电子数相同,因此随着电子层数的增加,原子越容易失电子,从上到下金属性递增,非金属性递减.
5 最高价氧化物和水化物的酸碱性
元素的金属性越强,其最高价氧化物的水化物的碱性越强;元素的非金属性越强,最高价氧化物的水化物的酸性越强.
6 非金属气态氢化物
元素非金属性越强,气态氢化物越稳定.同周期非金属元素的非金属性越强,其气态氢化物水溶液一般酸性越强;同主族非金属元素的非金属性越强,其气态氢化物水溶液的酸性越弱.
7 单质的氧化性、还原性
一般元素的金属性越强,其单质的还原性越强,其氧化物的阳离子氧化性越弱;元素的非金属性越强,其单质的氧化性越强,其简单阴离子的还原性越弱.。
化学元素周期表的周期性性质

化学元素周期表的周期性性质化学元素周期表是化学领域中的基础知识,其中包含了丰富的信息和规律。
该周期表按照元素的原子序数排列,并将它们分为一组一周期的方式展示。
通过研究周期表,我们可以了解元素的周期性性质及其在化学反应中的行为。
本文将详细探讨化学元素周期表的周期性性质。
1. 原子半径的周期性变化原子半径指的是原子中心到最外层电子轨道的距离。
在周期表中,原子半径呈现出一定的周期性变化。
一般而言,原子半径随着原子序数的增加而减小。
这是由于核电荷的增加导致了电子云的收缩。
然而,在同一周期内,原子半径会随着电子层的增加而增加。
这是因为电子层的增加会增加电子层之间的屏蔽效应,从而减小核电荷对外层电子的吸引力,使得原子半径增大。
2. 电离能的周期性变化电离能是指在气态下,从一个原子中去掉一个最外层电子所需的能量。
周期表中的电离能也呈现出一定的周期性变化。
一般来说,原子的电离能随着原子序数的增加而增大。
这是由于随着原子序数的增加,核电荷也会增加,电子与核之间的相互作用力增加,从而需要更多的能量才能将电子从原子中移除。
类似于原子半径,同一周期内的电离能会随着电子层数的增加而减小,这是因为电子层数的增加减小了核电荷对外层电子的吸引力。
3. 电负性的周期性变化电负性是指一个原子吸引和结合电子的能力。
周期表中的元素的电负性也呈现出一定的周期性变化。
一般而言,原子的电负性随着原子序数的增加而增大。
这是由于原子中的电子数增加,从而增强了核对外层电子的吸引能力。
然而,电负性在同一周期内并不会有明显的变化。
4. 化合价的周期性变化化合价是指元素在化合物中与其他元素结合时所具有的价数。
周期表中的元素的化合价也呈现出一定的周期性变化。
一般来说,原子的化合价可以通过其所在族别来确定。
例如,位于ⅠA族的元素通常具有+1的化合价,而位于ⅤA族的元素则通常具有-3的化合价。
5. 金属性与非金属性的周期性变化周期表中的元素还可以根据它们的化学性质被分为金属性和非金属性。
元素周期表中的独特性质

元素周期表中的独特性质元素周期表是化学中最重要的工具之一,它以一种有序的方式展示了所有已知元素的性质和特点。
每个元素都有其独特的性质,这些性质对于我们理解和应用化学至关重要。
本文将探讨元素周期表中一些独特的性质,展示它们对化学研究和实际应用的重要性。
1. 原子序数和周期性规律元素周期表按照原子序数的增加顺序排列,原子序数是指元素原子核中的质子数。
这种排列方式揭示了元素的周期性规律,即元素的性质和特点会随着原子序数的增加而周期性地变化。
例如,周期表中的第一周期元素是氢和氦,它们都只有一个电子层,因此具有类似的化学性质。
而随着原子序数的增加,元素的电子层数也增加,导致元素的性质发生变化。
这种周期性规律使得我们能够预测和理解元素的性质,为化学研究和应用提供了基础。
2. 周期表中的元素分类元素周期表按照元素的性质和特点将元素分为不同的类别。
最常见的分类方式是将元素分为金属、非金属和过渡金属。
金属元素具有良好的导电性和热传导性,而非金属元素则通常是绝缘体或半导体。
过渡金属元素则具有特殊的化学性质,常用于催化剂和合金制备。
这种分类方式使得我们能够更好地理解和研究不同元素的性质,并在实际应用中选择合适的元素。
3. 元素周期表中的同位素元素周期表中的同位素是指具有相同质子数但不同中子数的元素。
同位素具有相似的化学性质,但在物理性质上可能有所不同。
同位素的存在使得我们能够进行同位素标记和追踪,这在医学、环境科学和地质学等领域具有重要应用。
例如,同位素碳-14被广泛用于放射性碳定年,同位素铯-137则用于测量土壤侵蚀速率。
同位素的研究和应用为我们提供了更深入的了解和利用元素的机会。
4. 元素周期表中的反应性元素周期表中的元素反应性也是其独特性质之一。
一般来说,金属元素倾向于失去电子成为阳离子,而非金属元素倾向于获得电子成为阴离子。
这种反应性使得元素能够与其他元素发生化学反应,形成化合物。
例如,氯气与钠金属反应可以生成氯化钠,这是我们日常生活中常见的食盐。
元素周期表规律及性质

一、元素周期表
精选ppt
1
精选ppt
2
元素周期表编排原则
1.把电子层数相同的各种元素,按原子 序数递增的顺序从左到右排成横行;
2.把最外层电子数相同的各种元素, 按电子层数递增由上到下排成纵行。
精选ppt
3
元素周期表的结构
1.周期
将具有相同电子层数而又按原子序数递增 的顺序排列的一系列元素(一个横行)为一个 周期。
精选ppt
8
感谢亲观看此幻灯片,此课件部分内容来源于网络, 如有侵权请及时联系我们删除,谢谢配合!
周 期
横行
周期
1不完全
表
7主族
18个 16个 7副族 纵行 族 1 Ⅷ族
1 0族
精选ppt
6
元素在周期表中的位置
周期序数=电子层数 主族序数=最外层电子数
表中位置
原子结构
Al:第3周期 ⅢA族
S:第3周期 ⅥA族
精选ppt
7
元素的分布
金属元素(约五分之四)主族、副族 非金属元素 主族 过渡元素 副族 放射性元素
元素周期表中有七个横行即七个周期 周期序数=电子层数
3个短周期:一、二、三周期叫短周期
3个长周期:四、五、六周期叫长周期
1个不完全周期:第七周期叫不完全周期
精选ppt
4
元素周期表的结构
2.族
把最外层电子数相同的元素按电子层数递 增的顺序从上到下排成的纵行称为一个族。
周期表有18个纵行有16个族
用ⅠA、
ⅡA…表
7个主族:由短周期和长周期元素共同组成的 示。
族,第 1、2、13、14、15、16、17纵行。 7个副族:由长周期元素构成的族。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
