认识晶体
第三章第一节 晶体的常识

第一节晶体的常识1、认识晶体和非晶体的本质差异,明白晶体的特征和性质。
2、了解获得晶体的途径。
3、明白晶胞的概念,学会晶胞中微粒数的计算方法(均摊法),能依照晶胞的结构确定晶体的化学式。
晶体与非晶体[学生用书P35]1、晶体与非晶体的本质差异23、晶体的特点(1)自范性①定义:晶体能自发地呈现多面体外形的性质。
②形成条件之一:晶体生长速率适当。
③本质原因:晶体中粒子在微观空间里呈现周期性的有序排列。
(2)各向异性:许多物理性质(强度、导热性、光学性质等)常常会表现出各向异性。
(3)有序性:外形和内部质点排列的高度有序、(4)熔点:有固定的熔点。
1、判断正误(正确的打“√”,错误的打“×")。
(1)晶体有自范性但其微粒排列无序、()(2)晶体具有各向同性,非晶体具有各向异性。
()(3)晶体有固定的熔点、()(4)熔融态物质快速冷却即可得到晶体。
( )(5)熔融的硝酸钾冷却可得晶体,故液态玻璃冷却也能得到晶体。
( )(6)粉末状的固体也有估计是晶体。
( )答案:(1)×(2)× (3)√(4)× (5)× (6)√2、下列物质中属于晶体的是________。
A、橡胶B、玻璃C、食盐ﻩD、水晶E、塑料ﻩF、胆矾解析:固体有晶体和非晶体之分,晶体是内部微粒(原子、离子或分子)在空间按一定规律呈周期性有序排列构成的具有规则几何外形的固体,如食盐、冰、金属、水晶、大部分矿石等都是晶体;非晶体中内部粒子的排列则相对无序,如玻璃、橡胶等都是非晶体。
答案:CDF1、晶体与非晶体的区别(1)依据是否具有自范性晶体具有自范性,能自发地呈现多面体的外形,而非晶体不具有自范性。
(2)依据是否具有各向异性晶体具有各向异性,在不同方向上质点排列一般是不一样的,而非晶体不具有各向异性。
(3)依据是否具有固定的熔、沸点晶体具有固定的熔、沸点,给晶体加热时,当温度升高到某温度时便马上熔化或汽化,在熔化过程中,温度始终保持不变,而非晶体没有固定的熔、沸点。
2024全国高考真题化学汇编:认识晶体
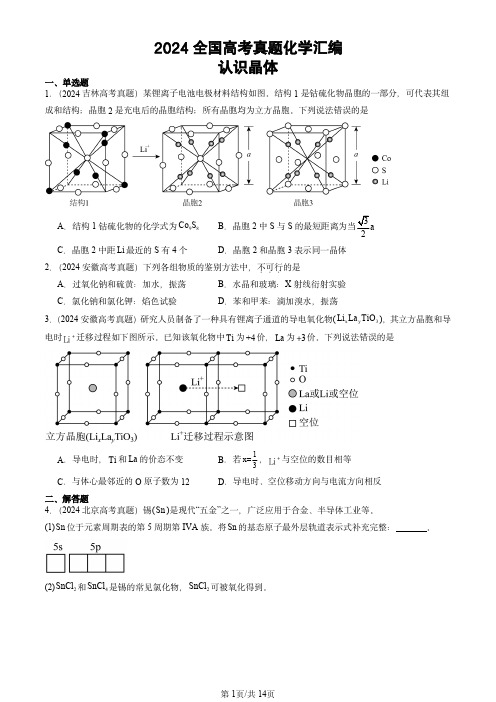
2024全国高考真题化学汇编认识晶体一、单选题1.(2024吉林高考真题)某锂离子电池电极材料结构如图。
结构1是钴硫化物晶胞的一部分,可代表其组成和结构;晶胞2是充电后的晶胞结构;所有晶胞均为立方晶胞。
下列说法错误的是A .结构1钴硫化物的化学式为98Co SB .晶胞2中S 与S 的最短距离为当3a 2C .晶胞2中距Li 最近的S 有4个D .晶胞2和晶胞3表示同一晶体2.(2024安徽高考真题)下列各组物质的鉴别方法中,不可行...的是A .过氧化钠和硫黄:加水,振荡B .水晶和玻璃:X 射线衍射实验C .氯化钠和氯化钾:焰色试验D .苯和甲苯:滴加溴水,振荡3.(2024安徽高考真题)研究人员制备了一种具有锂离子通道的导电氧化物(x y 3Li La TiO ),其立方晶胞和导电时+Li 迁移过程如下图所示。
已知该氧化物中Ti 为+4价,La 为3 价。
下列说法错误的是A .导电时,Ti 和La 的价态不变B .若1x=3,+Li 与空位的数目相等C .与体心最邻近的O 原子数为12D .导电时、空位移动方向与电流方向相反二、解答题4.(2024北京高考真题)锡(Sn )是现代“五金”之一,广泛应用于合金、半导体工业等。
(1)Sn 位于元素周期表的第5周期第IVA 族。
将Sn 的基态原子最外层轨道表示式补充完整:。
(2)2SnCl 和4SnCl 是锡的常见氯化物,2SnCl 可被氧化得到。
①2SnCl 分子的VSEPR 模型名称是。
②4SnCl 的Sn Cl —键是由锡的轨道与氯的3p 轨道重叠形成σ键。
(3)白锡和灰锡是单质Sn 的常见同素异形体。
二者晶胞如图:白锡具有体心四方结构;灰锡具有立方金刚石结构。
①灰锡中每个Sn 原子周围与它最近且距离相等的Sn 原子有个。
②若白锡和灰锡的晶胞体积分别为31v nm 和32v nm ,则白锡和灰锡晶体的密度之比是。
(4)单质Sn 的制备:将2SnO 与焦炭充分混合后,于惰性气氛中加热至800C ,由于固体之间反应慢,未明显发生反应。
《认识晶体》 学历案

《认识晶体》学历案一、学习主题认识晶体二、学习目标1、了解晶体的基本概念和特征,能够区分晶体和非晶体。
2、掌握晶体的微观结构,理解晶体中粒子的排列规律。
3、学习晶体的分类方法,认识常见的晶体类型。
4、了解晶体的性质,如熔点、硬度、导电性等,并能解释其与晶体结构的关系。
三、学习资源1、教材:《化学》相关章节。
2、网络资源:科普视频、晶体结构模拟软件。
3、实验器材:晶体标本、显微镜。
四、学习过程(一)引入在我们的生活中,有许多物质呈现出美丽而规则的外形,比如晶莹剔透的钻石、雪花的形状、食盐的颗粒等。
这些物质都属于晶体。
那么,什么是晶体呢?晶体又有哪些独特的性质和结构呢?让我们一起来探索晶体的奥秘。
(二)晶体与非晶体1、观察与比较(1)展示晶体标本(如食盐、石英、明矾等)和非晶体标本(如玻璃、松香、橡胶等),引导学生观察它们的外观。
(2)让学生用手触摸,感受它们的质地。
2、总结晶体与非晶体的特点(1)晶体具有规则的几何外形,而非晶体没有。
(2)晶体具有固定的熔点,在熔化过程中温度不变;非晶体没有固定的熔点,在熔化过程中温度不断升高。
(三)晶体的微观结构1、利用多媒体展示晶体的微观结构模型(1)展示氯化钠晶体中钠离子和氯离子的排列方式。
(2)展示金刚石晶体中碳原子的四面体结构。
2、讲解晶体中粒子的排列规律(1)晶体中的粒子在空间上按照一定的规律周期性地重复排列。
(2)这种周期性的排列决定了晶体的性质。
(四)晶体的分类1、根据粒子种类分类(1)离子晶体:由阴、阳离子通过离子键结合而成,如氯化钠、氯化铯等。
(2)原子晶体:由原子通过共价键结合而成,如金刚石、二氧化硅等。
(3)分子晶体:由分子通过分子间作用力结合而成,如干冰、冰等。
(4)金属晶体:由金属阳离子和自由电子通过金属键结合而成,如铁、铜等。
2、根据晶体的几何外形分类(1)立方晶系:如氯化钠晶体。
(2)六方晶系:如石墨晶体。
(3)单斜晶系:如石膏晶体。
知识讲解——认识晶体 金属晶体与离子晶体(基础)

认识晶体金属晶体与离子晶体(基础)编稿:房鑫审稿:张灿丽【学习目标】1、从晶体的一般性认识出发,了解晶体与非晶体的本质区别。
2、从组成微粒和微粒间相互作用的不同,认识金属晶体和离子晶体的结构及其性质特点。
3、能列举金属晶体的基本规程模型——简单立方堆积、钾型、镁型和铜型。
4、能根据离子晶体的结构特征解释其物理性质;了解离子晶体的特征;了解晶格能的应用,知道晶格能的大小可以衡量离子晶体中离子键的强弱。
【要点梳理】要点一、晶体的特性、分类1.晶体的概念人们把内部微粒(原子、离子或分子)在空间按一定规律做_______ _构成的固体物质称为晶体。
2.晶体的特征(1)晶体具有____ ____、各向异性、特定的对称性三个重要特征。
(2)晶体的自范性是指晶体能够自发地呈现________的________的多面体外形。
晶体的各向异性是指晶体在不同的方向上表现出不同的________性质。
晶体的对称性指晶体的外形呈现轴对称性或面对称性。
3.晶体的分类根据晶体内部微粒的种类和微粒间相互作用的不同,可以将晶体分为______ __、___ _____、____ ____和________。
对于常见的晶体,例如:氯化钠是Na+与Cl-通过_____ ___键形成的晶体,称为离子晶体;金属铜是以________键为基本作用所形成的晶体,称为金属晶体;金刚石是碳原子间完全通过_______键形成的晶体,称为原子晶体;冰是水分子间通过______ __形成的晶体,称为分子晶体。
要点诠释:四种晶体的比较答案:1.周期性重复排列2.(1)自范性(2)封闭规则物理3.离子晶体金属晶体原子晶体分子晶体离子金属共价分子间作用力要点二、晶体结构的堆积模型晶胞1.晶体结构的堆积模型(1)X射线衍射实验测定的结果表明,组成晶体的金属原子,离子或分子在没有其他因素(如氢键)影响时,在空间的排列大都服从_______ _原理,这是因为在金属晶体、离子晶体和分子晶体的结构中,金属键、离子键和分子间作用力均没有________,以紧密堆积的方式________体系的能量,使晶体变的比较________。
晶体结构与性质 晶体结构与性质知识点

晶体结构与性质晶体结构与性质知识点第34讲晶体结构与性质(一)(考纲要求)1、理解离子键的形成,能根据离子化合物的结构特征解释其物理性质。
2、了解原子晶体的特征,能描述金刚石、二氧化硅等原子晶体的结构与性质的关系。
3、理解金属键的含义,能用金属键理论解释金属的一些物理性质。
4、了解化学键和分子间作用力的区别。
5、了解氢键的存在对物质性质的影响,能列举含有氢键的物质。
6、了解分子晶体与原子晶体、离子晶体、金属晶体的结构微粒、微粒间作用力的区别。
7、了解简单配合物的成键情况。
(课前预习区)一、认识晶体1、晶体的定义:微观粒子在空间按一定规律做周期性重复排列构成的固体物质2、晶体的特性:(1)有规则的几何外形(自范性:在适宜的条件下,晶体能够自发的呈现封闭的、规则的多面体外形。
)(2)有确定的熔点(3)各向异性:在不同的方向上表现不同的性质(4)具有特定的对称性3、晶体是由晶胞堆积得到的,故晶胞就能反映整个晶体的组成。
利用晶胞可以求化学式——均摊法。
均摊法是指每个晶胞平均拥有的粒子数目。
若某个粒子为N 个晶胞所共有,则该粒子有1/N属于此晶胞。
以正方体晶胞为例,晶胞中不同位置的粒子对晶胞的贡献为:顶点原子_______属于此晶胞棱上原子_______属于此晶胞面上原子_______属于此晶胞体内原子完全属于此晶胞若晶胞为六棱柱,则顶点原子有________属于此晶胞,棱上有________属于此晶胞。
练习、硼镁化合物刷新了金属化合物超导温度的最高记录。
该化合物晶体结构中的重复结构单元如图所示。
十二个镁原子间形成正六棱柱,两个镁原子分别在棱柱上底、下底的中心;六个硼原子位于棱柱内。
则该化合物的化学式可表示为A 、Mg 14B 6 B 、MgB 2 ()● ○ Mg BC 、Mg 5B 12D 、Mg 3B 2二、晶体结构1、金属晶体(1)金属键:_____________________________________________________________成键微粒:________________________特征:影响金属键强弱因素及对金属性质的影响:(2)金属晶体:(3)金属晶体物理性质的解释2、离子晶体(1)离子键:____________________________________________________________成键微粒:_________________ 特征:____________________________影响离子键强弱因素:(2)离子晶体定义:(3)晶格能:①影响因素②与离子晶体性质的关系:晶格能越大,形成的离子晶体越,且熔点越,硬度越。
晶体硅常识

晶体硅常识——技术部王丙宽2010-12-05一、简单的认识晶体二、硅材料的结构及性质三、硅材料的制备四、硅材料在光伏领域的应用一、简单的认识晶体什么是晶体?晶体是内部质点在三维空间周期性重复排列的固体。
即具有格子构造的固体。
日常所见到的固体分为非晶体和晶体两大类,非晶体物质的内部原子排列没有一定的规律,当断裂时断口也是随机的,如塑料和玻璃等,而称之为晶体的物质,外形呈现天然的有规则的多面体,具有明显的棱角与平面,其内部的原子是按照一定的规律整齐的排列起来,所以破裂时也按照一定的平面断开,如食盐、水晶等。
晶体的基本性质(1)均一性:同一晶体任何部位的物理性质和化学组成均相同。
(2)对称性:所有的晶体都是对称的。
晶体的对称不但表现在外形上,其内部构造和物理性质也是对称的。
(3)稳定性:在相同的热力学条件下,晶体与同种成分的非晶质体、液体、气体相比,以晶体最为稳定。
(4)定熔性:指晶体具有固定熔点的性质。
(5)各向异性晶体的几何度量和物理性质常随方向不同而表现出量的差异。
(6)自限性(自范性)晶体在合适的条件下,能自发地长成规则几何多面体外形。
二、硅材料的性质及结构硅的性质及结构•为什么硅材料成为应用最广泛、最重要的半导体材料•原因之一:硅元素是地球上存量丰富的元素之一(氧是第一、硅次之)、无毒性;同时能与氧形成稳定的钝化层SiO2,在集成电路设计中SiO2绝缘层非常重要;•原因之二:在制作成本上,集成电路用的硅片都是由直拉法(Czochralski Method)生产的,CZ工艺中适度的氧含量使硅片的机械强度增加,硅片直径成倍增长,成本迅速下降,集成电路得到广泛的应用。
硅的性质及结构1、硅在元素周期表中的位置:硅材料的性质及结构硅材料的性质及结构2、元素硅有关性质:•晶体硅为灰色,无定形硅为黑色,密度2.33克/立方厘米,熔点1414℃,沸点2355℃,•晶体硅属于原子晶体,硬而有光泽,有半导体性质。
《晶体的常识》

1、什么是晶体?什么是非晶体?
晶体——具有规则几何外形的固体 非晶体——没有规则几何外形的固体 2、晶体有什么特点和性质?
(1) 晶体有自范性 (2)晶体具有各向异性 (3)晶体具有固定的熔点
3、晶体和非晶体的本质区别是什么?
构成固体的粒子在三维空间里是否呈现周 期性的有序排列
4.晶体形成的途径
(2)在该晶体中,氧、钙、钛的粒子个数比是________。 答案 (1)6 (2)3∶1∶1
答案
学生自主学习
课堂互动探究
学习效果检测
课时作业
4
73
8
51
62
1
5、下列是NaCl晶胞示意图,晶胞中Na+和 Cl¯的个数比是多少?
该晶胞中有 4个Na+4个Cl-
1∶1
正六棱柱晶胞
顶点: 1/6 面心: 1/2 (上、下)棱:1/4 侧棱: 1/3
正确的是( A) A.ZXY3 C.ZX4Y8
B.ZX2Y6 D.ZX8Y12
4.在高温超导领域中,有一种化合物叫钙钛矿,其晶体结构中有代表性 的最小单位结构如图所示。试回答:
(1) 在 该 晶 体 中 , 每 个 钛 离 子 周 围 与 它 最 近 且 距 离 相 等 的 钛 离 子 有 ________个。
[课堂练习]
1.下列物质都是固体,其中不是晶体的 是( A )
①橡胶 ②水晶 ③冰 ④干冰 ⑤ 冰醋酸 ⑥石蜡 ⑦玻璃
A.①⑥⑦ B.①②⑦ C.②④⑤⑦ D.①③⑥⑦
2.晶体是一类非常重要的材料,在很多领域都 有广泛的应用。下列对晶体硅的叙述中正确的
是( C )
A.形成晶体硅的速度越快越好 B.晶体硅没有固定的熔点 C.可用X-射线衍射实验来鉴别晶体硅和玻璃 D.晶体硅与非晶体的本质区别是有固定熔点
3.1 认识晶体 练习(解析版)—鲁科版选择性必修2

第三章 不同聚集状态的物质与性质第1节 认识晶体一.选择题:本题共10小题,每题2分,共20分。
每小题只有一个选项符合题意。
1.下表列出了有关晶体的知识,其中错误的是( )【答案】B【解析】干冰为分子晶体,构成微粒为分子,微粒间作用力为范德华力。
2.下列有关晶胞的叙述,不正确的是( ) A .晶体中的晶胞不一定都是平行六面体 B .晶胞是晶体中基本的结构重复单元 C .已知晶胞的结构,可推知晶体的结构D .使用“切割法”计算晶胞的微粒数,处于顶点、棱、面、体心对晶胞的贡献分别为18、14、12、1【答案】D【解析】六方晶胞中,处于顶点上的微粒对晶胞的贡献为16。
3.下列关于晶体的说法正确的是( )A .将饱和CuSO 4溶液降温,析出的固体不是晶体B .可以用划痕的方法鉴别宝石和玻璃制品C.石蜡和玻璃都是非晶体,但它们都有固定的熔点D.蓝宝石在不同方向上的硬度一定相同【答案】B【解析】A选项,将饱和的CuSO4溶液降温,可析出胆矾,胆矾属于晶体。
B选项,一般宝石的硬度较大,玻璃制品的硬度较小,可以根据有无划痕来鉴别。
C选项,非晶体没有固定的熔点。
D选项,由于晶体具有各向异性,所以蓝宝石在不同方向上的硬度有一定差异。
4.晶体具有各向异性,如石墨在与层垂直的方向上的电导率是与层平行的方向上的电导率的1104。
晶体的各向异性主要表现在( )①硬度②导热性③导电性④光学性质A.①③B.②④C.①②③D.①②③④【答案】D【解析】晶体具有各向异性,主要表现在硬度、导热性、导电性、光学性质等多项物理性质中。
5.科学家发现一种由某金属原子M和非金属原子N构成的气态团簇分子,如图所示。
顶角和面心的原子是M 原子,棱的中心和体心的原子是N原子,它的化学式为( )A.M4N4 B.MN C.M14N13D.M4N5【答案】C【解析】由气态团簇分子和示意图可知其分子式可由示意图查原子个数来确定,M原子共14个,N原子共13个,即分子式为M14N13,C项正确。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第3章物质的聚集状态与物质性质
第1节认识晶体
【自学目标】
1.能区分晶体与非晶体,知道晶体的重要特征。
2.了解A1、A3 型密堆积。
3.知道晶胞是晶体的最小结构重复单元,能用切割法计算一个晶胞种实际拥有的微粒数。
【自学助手】
1.晶体的特性是。
2.的晶体称为离子晶体;的晶体称为金属晶体;
的晶体称为原子晶体;的晶体称为分子晶体。
3.因为金属键、离子键、分子间的相互作用没有,所以组成金属晶体、离子晶体、分子晶体的微粒服从原理。
4.金属晶体的结构形式可归结为等径圆球的密堆积。
其中,每一层都是最紧密堆积,也就是每个等径球与周围相接触。
而层与层之间的堆积时有多种方式:
一种是“…ABAB…”重复方式,叫型的最密堆积,一种是“…ABCABC…”重复方式,叫型的最密堆积。
5.晶胞是晶体结构中最小的,是从晶体结构中截取下来的大小、形状完全相同的。
6.在晶胞中,平行六面体的顶点上的微粒为个晶胞共有;在面心上的微粒为个晶胞共有;在棱的中心上的微粒为个晶胞共有。
【思维点拨】
【例题1】关于晶体的下列说法正确的是
A.在晶体中只要有阴离子就一定有阳离子B.在晶体中只要有阳离子就一定有阴离子
C.离子晶体的熔点一定比金属晶体的高D.分子晶体的熔点一定比金属晶体的低
【解答】A正确。
B不正确,在金属晶体中含金属阳离子而不含阴离子。
C不正确,金属钨的熔点比所有的离子晶体高。
D不正确,单质汞在常温下为液态,而分子晶体碘、硫在常温下为固态。
【答案】A
【例题2】某离子晶体晶胞结构如图所示,X位于立方体的顶点,Y位于立方体的中心。
试分析:
(1)在一个晶胞中有个X,个Y,所以该晶体的化学式为_____ _____。
(2)晶体中距离最近的2个X与一个Y所形成的夹角∠XYX角度为________(填角的度数)【解答】(1)Y的个数为1,X的个数为4×1/8=1/2,所以X︰Y=1︰2,化学式是XY2
(2)X与Y之间的连线构成了正四面体,类似甲烷(CH
4)
的结构,所求的∠XYX等于甲烷中的键角,即109.5°。
【答案】(1)1;1/2;(2)109.5°
【自我检测】
1.下列各对物质中,化学键类型和晶体类型完全相同的是()
A.NaCl和NaOH B.Br2和H2O.CCl4和FeCl3 D.CO2和SiO2
2.某单质晶体一定不是()
A.离子晶体B.分子晶体C.原子晶体D.金属晶体
3.下列叙述正确的是()
A.任何晶体中,若含有阳离子也一定含有阴离子
B.离子晶体中可能含有共价键
C.离子晶体中只含有离子键不含有共价键
D.分子晶体中只存在分子作用力,不含有其他化学键
4.下列有关金属元素特征的叙述中正确的是()
A.金属元素的原子只有还原性,离子只有氧化性
B.金属元素在化合物中一定显正价
C.金属元素在不同化合物中的化合价均不同
D.金属单质在常温下都是固体
5.含有离子的晶体()
A.一定是离子晶体B.可能是分子晶体
C.可能是原子晶体D.可能是金属晶体
6.下列说法一定正确的是()
A.其水溶液导电的一定是离子晶体
B.熔融态导电的一定是离子晶体
C.固态导电的一定是金属晶体
D.固态不导电熔融态导电的一定是离子晶体
7.碘的熔、沸点较低,其原因是()
A.碘的非金属性较弱B.I2中I—I键不稳定
C.碘分子的分子间作用力比较小D.碘的氧化性较弱
8.下列叙述中正确的是()
A.分子晶体中一定存在共价键B.离子晶体中一定含金属元素
C.原子晶体中一定不存在离子键D.离子晶体中不可能存在共价键
9.干冰气化时发生变化的是()
A.分子内共价键B.分子间作用力
C.分子间的距离D.分子内原子间的距离
10.有关A1型密堆积与A3型密堆积的说法中正确的是()
A.A1型密堆积是最密堆积,A3型密堆积不是最密堆积。
B.两者都是最密堆积,其中A1型密堆积是一、三、五…各层球心重合,二、四、六…各层球心重合;A3型密堆积是四、五、六层…分别和一、二、三层球心重合。
C.原子晶体一般都采用A1型密堆积或A3型密堆积。
D.只有金属晶体才可能采用A1型密堆积或A3型密堆积。
11.能与氢氧化钠溶液反应的原子晶体是()
A.铝B.金刚石C.硅D.二氧化硅
12.下列说法中错误的是()
A.分子晶体中范德华力没有方向性和饱和性,所以分子晶体一般都采取密堆积,但要受到分子形状的影响。
B.离子晶体一般都是非等径球的密堆积
C.由于共价键的方向性和饱和性,原子晶体堆积的紧密程度大大降低。
D.配位数就是配位键的数目。
13.对于A1型密堆积的描述错误的是()
A.A1型密堆积晶体的晶胞也叫面心立方晶胞。
B.面心立方晶胞的每个顶点上和每个面的中心上都各有一个金属原子
C.平均每个面心立方晶胞中有14个金属原子
D.平均每个面心立方晶胞中有4个金属原子
14.将H2S、HF、HCl、HI、CH4、NH3、H2O、MgCl2、SiO2、CO2、SO2、NaCl、NaOH等化合物按以下要求填空:
(1)具有强极性键的弱酸是 ,具有强极性键的强酸是 ,具有弱极性键的强酸是 ,具有弱极性键的弱酸是 ,其水溶液有强碱性的是 ,其水溶液有弱碱性的是 。
(2)属于离子化合物的是 。
(3)属于分子晶体的氧化物是 ,
属于原子晶体的氧化物是 。
(4)具有正四面体构型的化合物是 ,难溶于水的气态氢化物是 ,难溶于水的氧化物是 。
[探索提高]
15.金属铜的晶胞是一个“面心立方体”(注:八个顶点和六个面分别有一个金属原子)。
则金属铜平均每个晶胞中有__________个金属原子组成的。
已知铜的摩尔质量是64g·mol—1,金属铜的密度是8.93g·cm-3。
则金属铜的晶胞体积是。
计算过程为:
第1节认识晶体
1.B
2.A
3.B
4.B
5.D
6.D
7.C
8.C
9.BC 10.B 11.CD 12.D 13.C 14.(1)HF;HCl;HI;H2S;NaOH;NH3(2)Mg Cl2、NaCl、NaOH;
(3)CO2、SO2、H2O;SiO2
(4)CH4;H2S 、CH4;SiO2
15.4;4.76×10-23cm-3。
