基础化学3套期末考试卷AB卷带答案 模拟测试题
《基础化学》期末考试试卷附答案

《基础化学》期末考试试卷附答案一、选择题(共10小题,每小题4分,共40分)1、某反应的ΔrHmΘ<0 ,当温度升高时,其平衡常数的数值将()。
A、增大B、不变C、减小D、先增大后减小2、当主量子数n=3时,则角量子数l的取值为()。
A、1、2、B、0、1、2C、0、1D、0、±1、3、某温度下,反应2NO(g)+O2(g)=2NO2(g)达到平衡,是因为()。
A、反应已停止B、反应物中的一种已消耗完C、正逆反应的速率相等D、反应物均已消耗完毕4、下列化合物晶体中,既存在离子键又存在共价键的是()。
A、H2OB、NaBrC、CH3OHD、Na2O25、蔗糖的凝固点为()。
A、0℃B、高于0℃C、低于0℃D、无法判断6、已知某元素核外电子排布式为1s22s22p2,该元素在周期表中所属的分区为()。
A、s区B、d区C、f区D、p区7、质量作用定律只适用于()。
A、实际上能进行的反应B、一步完成的简单反应C、化学反应方程式中反应物和产物的化学式系数均为1的反应D、已进行完的反应8、对于反应Cr2O72-+ 6Fe2+ + 14H+ = 2Cr3+ + 6Fe3+ + 7H2O,其ΔrGm= –nFE,式中n等于()。
A、1B、6C、3D、129、下列物质中熔点最高的是()。
A、SiB、CO2C、ZnSD、Fe3C10、下列叙述中错误的是()。
A、原电池的反应是氧化还原反应B、原电池的能量变化是由化学能变为电能C、原电池的能量变化是由电能变为化学能D、原电池的负极发生氧化反应二、填空题(共15空,每空2分,共30分)1、原电池(-)Pt |Fe2+(C1),Fe3+(C2)|| Fe2+(C3),Fe3+(C4)| Pt(+)负极上发生的电极反应式:____________________;正极上发生的电极:______________________________________。
基础化学期末考试卷

(C)分子中具有三中心四电子的大∏键 (D)分子中具有三中心二电子的大∏键 5、已知:E (Cl2/Cl-)=1.36V, E (MnO2/Mn2+)=1.23V,实验室利用 MnO2 与浓盐酸反应制备
Cl2,此时由两电对 MnO2/Mn2+和 Cl2/Cl-组成的原电池的电动势为(
)。
(A)E <0,E<0
。 ;多原子分子
单质有(至少给出 2 个例子)
;巨型分子单质有(至少给出
3 个例子)
;
8、用 EDTA 准确滴定金属离子 M2+的必要条件为_________。
9、[Cu(NH3)3]2+ 的累积稳定常数 β3 与反应[Cu(NH3)2]2+ + NH3 _________ (填“相同”or“不同”)。
(C) CH4 > H2O > NH3 > HF
(D) HF > H2O > NH3> CH4
3、下列物质中,还原性最强的是( )。
(A)MnO4-
(B)CrO42-
(C)CoO(OH)
(D)Fe(OH)2
4、有关 B2H6 分子的叙述正确的是( )。
(A)具有强还原性,燃烧时可放出大量的热
(B)分子结构式为
4、EDTA 在水溶液中是______ 元酸,在水溶液中的形式分别为_______________________。 5、以反应 Cr2O72- + 6Cl- +14H+ = 2Cr3+ + 3Cl2(g) + 7H2O 组成原电池,其标准态的电池符号为
。
6、(NH4)2HPO4 水溶液的质子条件式为 7、常见的小分子单质有(至少给出 5 个例子)
人教版2021-2022学年上学期高三化学期末检测卷及答案(含三套题)

密 线学校 班级 姓名 学号密 封 线 内 不 得 答 题人教版2021--2022学年上学期期末考试卷高三 化学(满分:100分 时间: 90分钟)题号一 二 三 四 总分 得分一、选择题(本题包括14小题,每小题3分,共42分,每小题只有一个选项符合题意)1.(3分)2008年9月25日21时10分,“神舟七号”顺利升空,并实施首次空间出舱活动.飞船的太阳能电池板有“飞船血液”之称,我国在砷化镓太阳能电池研究方面处于国际领先水平,下列有关说法正确的是( )A .砷元素符号为As ,位于元素周期表中第四周期ⅤA 族B .酸性:砷酸>磷酸C .镓元素符号为Ga ,单质不能与水反应D .碱性:Ga (OH )3<Al (OH )3 2.(3分)下列说法正确的是( )A .工业用SiO 2与焦炭制取单质硅过程中,生成的气体产物是COB .硫在空气中燃烧的产物是SO 2,在纯净氧气中燃烧的产物是SO 3C .钠在敞口容器中长期存放和在空气中燃烧的产物都是Na 2O 2D .镁在空气中和纯净氧气中燃烧的产物都只有MgO3.(3分)常温下,水的电离达到平衡:H 2O ⇌H ++OH ﹣△H >0.下列叙述正确的是( )A .向水中加入稀氨水,平衡逆向移动,c (OH ﹣)降低 B .向水中加入少量固体硫酸氢钠,c (H +)增大,K W 不变C .向水中加入少量固体CH 3COONa ,平衡逆向移动,c (H +)降低D .将水加热,K W 增大,pH 不变 4.(3分)下列说法不正确的是( )A .根据沸点差异可以判断两种液体混合物是否可用蒸馏方法进行分离B .根据固体溶解度曲线可以判断物质结晶的方法C .根据△H 可以判断化学反应能否自发进行D .根据化学平衡常数可以判断化学反应进行的限度 5.(3分)下列化学反应的离子方程式正确的是( ) A .向Ba (OH )2溶液中滴加NH 4HSO 4溶液至刚好沉淀完全:Ba 2++2OH ﹣+NH 4++H ++SO 42﹣═BaSO 4↓+NH 3•H 2O+H 2O B .碳酸氢铵溶液与足量氢氧化钠溶液反应:NH 4++OH ﹣═NH 3•H 2O密 线学校 班级 姓名 学号密 封 线 内 不 得 答 题C .将少量SO 2气体通入足量的NaClO 溶液中:SO 2+2ClO﹣+H 2O═SO 32﹣+2HClOD .稀硝酸中加入过量的铁屑:3Fe+8H ++2NO 3﹣═3Fe 3++2NO↑+4H 2O6.(3分)在a L Al 2(SO 4)3和(NH 4)2SO 4的混合溶液中加入b mol BaCl 2,恰好使溶液中的SO 42﹣离子完全沉淀;如加入足量强碱并加热可得到c mol NH 3气,原溶液中的Al 3+离子浓度(mol/L )为( ) A .B .C .D .7.(3分)青石棉(cricidolite )是一种致癌物质,是《鹿特丹公约》中受限制的46种化学品之一,其化学式为Na 2Fe 5Si 8O 22(OH )2.青石棉用稀硝酸溶液处理时,还原产物只有NO ,下列说法不正确的是( ) A .青石棉是一种硅酸盐产品 B .青石棉中含有一定量的石英晶体 C .青石棉的化学组成可表示为:Na 2O•3FeO•Fe 2O 3•8SiO 2•H 2OD .1mol 青石棉能使1molHNO 3被还原 8.(3分)下列说法正确的是( )A .常温下醋酸分子不可能存在于pH >7的碱性溶液中B .常温下向氯化铵溶液中加入少量氨水使溶液的pH =7,则混合溶液中c (Cl ﹣)>c (NH 4+) C .0.1mol•L﹣1的氯化铵溶液与0.05mol•L﹣1的氢氧化钠溶液等体积混合溶液中离子浓度 c (Cl ﹣)>c (NH 4+)>c (Na +)>c (OH ﹣) D .0.1mol•L﹣1硫化钠溶液中离子浓度关系c (Na +)=c (S 2﹣)+c (HS ﹣)+c (H 2S )9.(3分)下列离子在指定溶液中一定能大量共存的是( )①加入Al 能放出H 2的溶液中:Fe 2+、Al 3+、NO 3﹣、Cl ﹣、S 2﹣②在pH =11的溶液中:Na +、AlO 2﹣、NO 3﹣、S 2﹣、SO 32﹣③由水电离的c (H +)=10﹣12mol•L﹣1的溶液中:Cl ﹣、HCO 3﹣、NO 3﹣、NH 4+、F ﹣④加入Mg 能放出H 2的溶液中:Mg 2+、NH 4+、Cl ﹣、K +、SO 42 A .②④B .①②④C .①③④D .①②10.(3分)三聚氰酸[C 3N 3(OH )3]可用于消除汽车尾气中的NO 2.其反应原理为:C 3N 3(OH )33HNCO ;8HNCO+6NO 27N 2+8CO 2+4H 2O下列说法正确的是( )A .C 3N 3(OH )3与HNCO 为同一物质B .HNCO 是一种很强的氧化剂C .1molNO 2在反应中转移的电子为4molD .反应中NO 2是还原剂密 线学校 班级 姓名 学号密 封 线 内 不 得 答 题11.(3分)根据下列事实得出的结论正确的是( )A .Na 2SO 3试样白色沉淀沉淀不溶解;结论:此Na 2SO 3试样已变质 B .稀硫酸产生少量气泡产生大量气泡;结论:CuSO 4对此反应有催化作用 C .某溶液冒着白雾产生白烟;结论:此溶液为浓盐酸 D .无色试液呈黄色;结论:此溶液一定含有Na +12.(3分)下列有关沉淀溶解平衡的说法正确的是( ) A .K sp (AB 2)小于K sp (CD ),则AB 2的溶解度小于CD 的溶解度B .在氯化银的沉淀溶解平衡体系中,加入蒸馏水,氯化银的K sp 增大C .在氯化银的沉淀溶解平衡体系中,加入碘化钾固体,氯化银沉淀可转化为碘化银沉淀D .在碳酸钙的沉淀溶液平衡体系中,通入CO 2气体,溶解平衡不移动13.(3分)X 、Y 元素的原子,在化学反应中都容易失去电子而形成与Ne 相同的电子层结构,已知X 的原子序数比Y 的原子序数大,下列说法中正确的是( ) A .X 的金属性比Y 的金属性强B .常温下,X 和Y 都不能从水中置换出氢C .Y 元素的最高化合价比X 元素的最高化合价高D .Y 元素的最高价氢氧化物碱性比X 元素最高价氢氧化物碱性强14.(3分)下列装置或操作能达到实验目的的是( )A .实验室制取并收集O 2B .构成铜锌原电池C .检查装置气密性D .利用排空气法收集CO 2二、(本题包括2小题,共20分)15.(2分)下列实验操作、试剂保存方法和实验室事故处理,一定正确的是 (填序号)。
基础化学考试模拟题及答案

基础化学考试模拟题及答案一、判断题(共100题,每题1分,共100分)1.烯烃很容易被氧化,冷的稀高锰酸钾碱性溶液就能把烯烃氧化。
A、正确B、错误正确答案:A2.配位滴定指示剂称为金属指示剂,它本身是一种金属离子。
A、正确B、错误正确答案:B3.凡是基准物质,使用之前都需进行干燥(恒重)处理。
A、正确B、错误正确答案:A4.有机化合物在一定的条件下从一个分子中脱去一个小分子,而生成不饱和化合物的反应,叫做消去反应。
A、正确B、错误正确答案:A5.中和10mLHCl溶液(c=0.1mol·L-1)和10mLHAc溶液(c=0.1mol·L-1)所需NaOH溶液(c=0.1mol·L-1)的体积相同。
A、正确B、错误正确答案:A6.酸碱指示剂的变色与溶液中的氢离子浓度无关。
A、正确B、错误正确答案:B7.缓冲溶液中,其他条件相同时,缓冲对的pKa越接近缓冲溶液的pH时,该缓冲溶液的缓冲容量就一定越大。
A、正确B、错误正确答案:A8.铬黑T指示剂在pH=7~11范围使用,其目的是为减少干扰离子的影响。
A、正确B、错误正确答案:B9.普通酸度计通电后可立即开始测量。
A、正确B、错误正确答案:B10.乙醇与浓硫酸共热到170度时,主要发生分子内脱水,生成乙烯。
A、正确B、错误正确答案:A11.通常所谓的配位滴定法,主要是指EDTA滴定法。
A、正确B、错误正确答案:A12.乙烯在一定条件下可以聚合生成聚乙烯。
A、正确B、错误正确答案:A13.EDTA滴定某金属离子有一允许的最高酸度(PH值),溶液的PH 再增大就不能准确滴定该金属离子了。
A、正确B、错误正确答案:B14.影响化学反应平衡常数数值的因素是反应物的浓度、温度、催化剂、反应产物的浓度等。
A、正确B、错误正确答案:B15.指示剂在溶液中显现的颜色是随着指示剂的浓度变化而变化。
B、错误正确答案:B16.溶解度在1~10g之间的物质叫微溶物质。
基础化学模拟试题3答案.doc
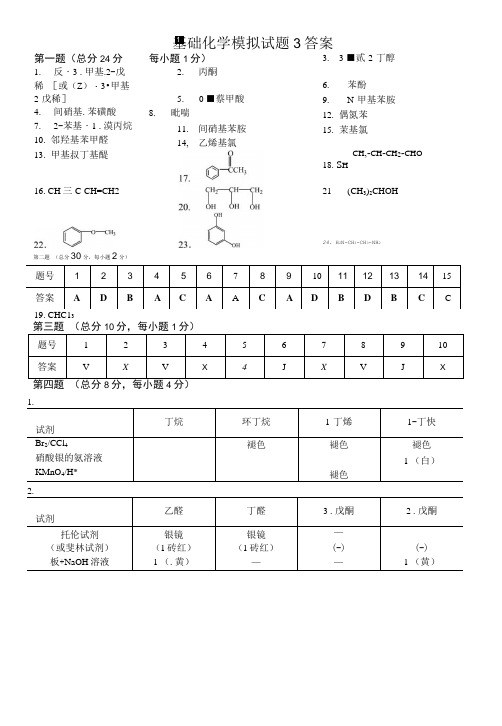
第二题 (总分30分,每小题2分) 题号 1234567 89101112131415 答案A DB AC A AC AD B D B CC第一题(总分24分1. 反・3 .甲基.2-戊稀 [或(Z )・3•甲基-2-戊稀]4. 间硝基.苯磺酸 7. 2-苯基・1 .漠丙烷 10. 邻羟基苯甲醛 13. 甲基叔丁基醍16. CH 三C-CH=CH219. CHC13每小题1分)2. 丙酮5.0 ■蔡甲酸8.毗喘11. 间硝基苯胺 14, 乙烯基氯3. 3 ■贰-2-丁醇 6.苯酚9.N-甲基苯胺12. 偶氮苯 15. 茉基氯CH ,-CH -CH 2-CHO18. S H 21(CH 3)2CHOH第三题 (总分10分,每小题1分)题号 1 2 3 45 6 7 8 9 10答案VXVX4JXVJX第四题 (总分8分,每小题4分)1.试剂 丁烷环丁烷 1-丁烯 1-丁快Br 2/CCl 4 硝酸银的氨溶液KMnO 4/H*褪色褪色 褪色褪色1 (白)2.试剂乙醛 丁醛 3 .戊酮 2 .戊酮托伦试剂 银镜 银镜 —(或斐林试剂) (1砖红) (1砖红)(-) (-) 板+NaOH 溶液1 (.黄)——1 (黄)基础化学模拟试题3答案1=24. H 2N-CH 3-CH 3-NH 2第五题(总分20分,第1题8分,第2题12分)1. CH3C = CH + H2林"•催化剂〉CH]CH = CH2 ................................................................... 2 分CH[CH = CH, + HC1 T CH4CH.CHQCH、C 三CH + Na - >CH.C 三CNa◊ )CH.C = CNa + CH.CH.CH.C1 ——CH.C = CCH9CH2CH, + NaCl ...............................................2 分COCH 3 COCH 3 CH ^CH 32. C CH J COCI. 人 H NO 】-人Zn-Hg『仁每M 无水心3 M 昭。
基础化学模拟试题3答案
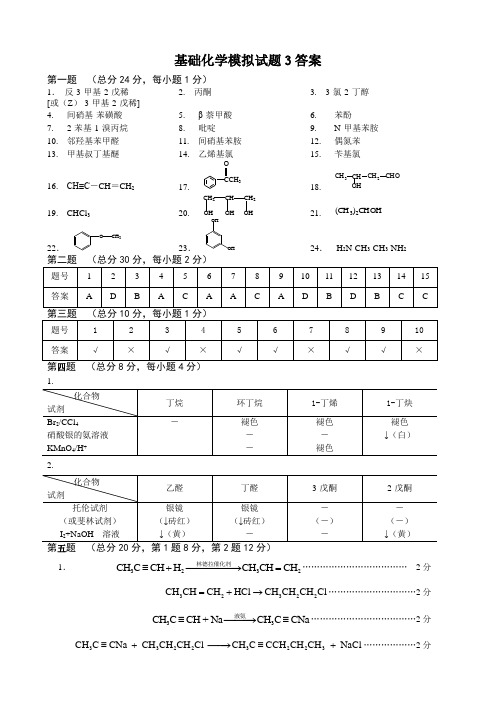
第五题 (总分 20 分,第 1 题 8 分,第 2 题 12 分)
1.
林德拉催化剂 CH3C CH H2 CH3CH CH2 ……………………………… 2 分
CH3CH CH2 HCl CH3CH2CH2Cl …………………………2 分
液氨 CH3C CH + Na CH3C CNa ………………………………2 分
=1.262V…………………………………………………………2
基础化学模拟试题 3 答案
第一题 (总分 24 分,每小题 1 分)
1. 反-3-甲基-2-戊稀 [或(Z)-3-甲基-2-戊稀] 4. 间硝基-苯磺酸 7. 2-苯基-1-溴丙烷 10. 邻羟基苯甲醛 13. 甲基叔丁基醚 2. 5. 8. 11. 14. 丙酮 β-萘甲酸 吡啶 间硝基苯胺 乙烯基氯
CH3C CNa CH3CH2CH2Cl CH3C CCH2CH2CH3 NaCl ………………2 分
COCH3 COCH3 NO2
Zn Hg HCl
CH2CH3
2.
CH3COCl AlCl3 无 水
HNO3 H2SO4
每步…4 分
NO2
第六题(总分 8 分)
解:电极反应为 Cr2O72-+14H++6e
2 Cr3++7H2O ………………………………3
14
则
2 Cr2 O7 H+ 0.0592V ……3 Cr2O /Cr Cr2O /Cr lg 2 3+ 6 Cr 27 3+
27
3+
= 1.232V
基础化学期末考试试题

一、填空题(共20分)1、主量子数n为4时,其轨道总数为,电子层电子的最大容量为。
2、根据共价键形成时原子轨道重叠方式不同,共价键可分为和两种。
3、在等温等压条件下,系统的焓变ΔH=。
4、质量作用定律适用的范围是。
5、用有效数字表示下列计算结果:(3。
202+0。
01301)×12。
9= ;158。
7÷2 - 5。
11×10-3 = .6、已知NaHCO3注射液的质量浓度为50g/L,则其物质的量浓度为mol/L。
(NaHCO3的摩尔质量为84 g/ mol)。
7、医学上的等渗溶液的渗透浓度范围是。
8、在NH4Cl—NH3&#8226;H2O的体系中,抗酸成分是。
9、用0。
1 mol/L的NaOH溶液滴定0.1 mol/L的HC1溶液20 ml,选用的指示剂是.10、[Ag(NH3)2]OH的名称是。
二、选择题(共20分)1、下列各组量子数中不合理的是().A、n=2,l=1,m=0B、n=3,l=2,m=1C、n=2,l=2,m=lD、n =3,l=2,m=22、原子序数为7的氮元素,原子核外电子排布式为( )。
A、1S22S22P1B、1S22S22P2C、1S22S22P3D、1S22S22P43、已知PC13分子中,中心原子采用不等性SP3杂化,则分子的空间构型为()。
A、直线型B、平面三角型C、三角锥形D、正四面体4、在水分子之间存在的主要作用力是()A、氢键B、取向力C、色散力D、诱导力5、下列各种函数中,不属于状态函数的是().A、恒压反应热B、反应的焓变C、系统的内能D、物质的标准生成自由能6、今有反应:A+B=C,其速率方程式为:u=kCACB,下列说法正确的是()。
A、这反应一定是基元反应B、这反应一定是复杂反应C、这是个一级反应D、这是个二级反应7、用万分之一的天平称取的质量为2.3801g一级标准物质K2Cr2O7,则其相对误差是()。
A、±0。
大学化学期末复习试题3套含答案.doc

试卷类别[A][B] 使用班级使用学期2009 上任课教师夏华王运宏程国娥教研室主任审核签字中国地质大学(武汉)考试出题专用纸教务处其分子的键级是, 02分子的分子轨道式是。
其分子的键级是07.注:分子的极性答p等于零或大于零8.纯水中加入SbCb少量,现象:*方程式:若要抑制反应,则要加入的试剂为:9.Mg(OH)2(S)白色沉淀中加入NH4C1(S),现象:,方程:用溶度积规则解释:_________________________________________________________________________________________________________ O]0.在如4分子之间存在着力;在BF3分子和H20分子之间存在着力;在H2O分子之间存在着力o11.氧原子4S轨道的能量 (大于、小于、等于)3d的轨道的能量。
三、简要回答下列问题:(5x3 = 15分)1.100 g铁粉在25°C溶于盐酸生成氯化亚铁(FeC12),(l)这个反应在烧杯中发生;(2)这个反应在密闭贮瓶中发生;两种情况相比,哪个放热较多?简述理由。
准平衡常数。
四、计算题(30分)1.100ml浓度为0.20 mol・dm-3的HAc与等体积等浓度的NaOH混合,计算溶液的pH值。
已知K (HAc) = 1.8x10 t2.298K时,NH4HS(S)的分解反应如下:NH4HS(S) — NH3(g) + H2S(g)将NH4HS(s)放入一真空容器中,平衡时,测得压力为66.66kPa,求反应的爪°;若容器中预先已有NH3(g),其压力为40.00kPa,则平衡时的总压为多少?3.在pH=9.00 的NH4C1-NH3缓冲溶液中,NH3浓度为0.072 mo"dm 3。
向100.0 ml 该溶液中加入 1.0 xl0「4 mol C U(A C)2 O已矢口Kl {[Cu(NH3)4]2+}= 2.1x10%K^[Cu(OH)2]= 2.2x10-2°。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
班级学号姓名※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※装订线基础化学模拟试题1题号一二三四五总分得分一、填空题(共20分,每空1分)1.用邻苯二甲酸氢钾(KHP)测定NaOH溶液的浓度,这种确定浓度的操作,称为。
而邻苯二甲酸氢钾称为物质。
2.在滴定分析中,根据指示剂变色时停止滴定的这一点称为,而该点与化学计量点不一致而引起的误差称为。
3.在混合溶液中加入某种沉淀剂时,离子发生先后沉淀的现象,称为。
4.莫尔法是以作指示剂,在介质中用标准滴定溶液测定卤素混合物含量的方法。
5.某元素基态原子的核外电子分布的原子实表示式为〔Ar〕3d104s24p5,则该原子的价电子构型为,原子序数为,元素符号为。
6.NH3分子构型为三角锥形,中心原子N采取杂化,键角∠HNH 109°28′(提示:填写>,=或<)。
7.已知φɵ(Fe3+/Fe2+)=0.771V,φɵ(Fe2+/Fe)=—0.447V,根据铁元素的标准电势图可知,Fe2+在水中发生岐化反应(能或不能),在配制其盐溶液时,常常放入适量的铁粉防止Fe2+被。
8.[]36K Fe(CN)命名为,其中心离子为配位体为,配位原子为,配位数为。
二、选择题(共20分,每题2分)()1.某反应在一定条件下达到化学平衡,且平衡转化率为65%,若其他条件不变,加入催化剂,则平衡转化率将A.大于65% B.等于65% C.小于65% D.等于100%()2.已知25℃时,反应Fe2 + (aq) + Ag + (aq) Fe3 + (aq) + Ag(s)的平衡常数Kθ=2.98,当Fe2 + 、Ag + 、Fe3 + 的浓度均为0. 010mol/L时,则该反应将A.自发向右进行B.处于化学平衡状态C.自发向左进行D.不能判定()3.已知下列反应的平衡常数:H2(g) + S(s) H2S(g)1KθS(s) + O2(g) SO2(g)2Kθ则反应H2(g) + SO2(g) O2(g) + H2S(g)的平衡常数003Kθ为A.12K Kθθ+B.12K Kθθ-C.12/K KθθD.12K Kθθ⋅()4.欲配制pH=3的缓冲溶液,选择下列那种物质与其共轭酸(或共轭碱)的混合溶液比较合适A.HCOOH(θaK=1.77×10-4)B.HAc(θaK=1.75×10-5)C.NH3(θbK=1.8×10-5)D.HCN(θaK=6.2×10-10)()5.若c(12H2SO4)=0.2000 mol/L,则c(H2SO4)为A. 0.5000mol/LB. 0.2000mol/LC. 0.4000mol/LD. 0.1000mol/L()6.在BaSO4的饱和溶液中,加入稀硫酸,使其溶解度减小的现象称为A.盐效应B.缓冲作用C.同离子效应D.配位效应()7.精制食盐时,用BaCl2 除去粗食盐中的SO42-,若使SO42-离子沉淀完全[已知θspK(BaSO4)=1.1×10-10],需控制Ba2+离子浓度为A.>1×10-5 mol/L B.>1.1×10-5mol/LC.<1.1×10-5 mol/L D.>1.1×10-6mol/L()8.已知,θϕ(MnO4-/Mn2+)=1.507V,θϕ(Cr2O72-/Cr3+)=1.232V,则在25℃,标准状态下,下列物质的氧化性由强到弱的顺序,正确的是A.Cr2O72->MnO4-B.Mn2+>Cr3+C.MnO4->Cr2O72-D.Cr3+>Mn2+()9.下列各组物质沸点比较正确的是A.F2>Cl2B.NH3<PH3C.CCl4<CH4D.CH3OH<CH3CH2OH()10.已知φɵ(Fe3+/Fe2+)= 0.771V,φɵ(Cu2+/Cu)= 0.3419V,φɵ(Fe2+/Fe)= -0.447V,则在水溶液中能够共存的物质是A.Cu2+ ,Fe2+B.Cu ,Fe3+C.Fe,Fe3+D.Cu2+, Fe三、判断题(共10分,每题1分)()1.一般化学反应,在一定的温度范围内,温度每升高10℃,反应速率增加到原来的2~4倍。
()2.若维持总压不变,往N2(g) + 3H2(g) 2NH3(g)平衡系统充入惰性气体,则平衡向生成NH3的方向移动。
()3.配离子的稳定常数和不稳定常数的关系是/1K Kθθ=稳不稳。
()4.H2PO4-的共轭酸是HPO42-。
()5.沉淀转化通常由溶解度小的难溶电解质向溶解度大的难溶电解质方向转化,两种沉淀的溶解度之差越大,沉淀转化越容易进行。
()6.反应CaCO3(s)CaO(s)+CO2(g)的平衡常数表达式为1/()2p CO'。
()7.在25℃及标准态下,规定氢的电极电势为零。
班级学号姓名※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※装订线(6]3-溶液中加入H2SO4,溶液由无色变为黄色的现象称为同离子效应。
(AgCl+2NH3[Ag(NH3)2]++Cl-的转化平衡常数θK为θspK·θK稳。
(K2CrO4指示剂的浓度(或用量)应比理论计算值高一些。
四、简答题(共20分,1题8分,2题、3题各6分)2CO(g)+O2(g) 2CO2(g);0mHθ∆<并回答采取哪些措施,可以使化学平衡向正反应方向移动?KMnO4+ K2SO3 + H2SO4MnSO4 + K2SO4+ H2O3MnO4-/Mn2+的电极反应及298.15K时的能斯特方程表达式五、计算题(共30分,每题10分)1Fe2 + (aq) + Ag + (aq) Fe3 + (aq) + Ag(s)的平衡常数=2.98,当Fe2 + 、Ag + 浓度均为0. 010mol/L,Fe3 + 的浓度均为0. 100mol/L时2 + 、Ag + 、Fe3 + 的平衡浓度。
(2)求Ag +的平衡转化率。
2.已知 1.75×10-5,试计算0.10mol/L NaAc溶液的pH和Ac—的解离度。
\3.已知Cu(OH)2和Fe(OH)3的溶度积分别为θ1spK=2.2×10-20,θ2spK=2.6×10-39。
在2.0mol/LCuSO4溶液中,含有0.010mol/LFe3+杂质,如何通过控制溶液pH的来除杂?基础化学模拟试题1答案第一题(每空1分,共20分)1.标定,基准5.4s24p5,35,Br2.滴定终点,终点误差6.sp3不等性,<3.分步沉淀7.不能,氧化4.K2CrO4,中性或弱碱性,AgNO38.六氰合铁(Ⅲ)酸钾,Fe3+,CN-,C,61 2 3 4 5 6 7 8 9 10B AC AD C B C D B1 2 3 4 5 6 7 8 9 10√×√××√√×√×1.答:该反应的特征是气体分子数减少的放热反应,因此采取增大压力和加热的措施可使该反应平衡向正反应方向移动,若能及时分离产物也可使平衡向正反应方向移动。
2.2 KMnO4+ 5 K2SO3 + 3 H2SO4=== 2 MnSO4 + 6 K2SO4+ 3 H2O班级学号姓名※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※装订线3.解电极反应MnO4-+ 8H+ + 5e-Mn2+ + 4H2Oφ(MnO4-/Mn2+)=φɵ(MnO4-/Mn2+)+-842[MnO][H]0.0592lg5[Mn]++⋅五、计算题(每题10分,共30分)1.解⑴设反应达平衡时,Ag +的转化浓度为x。
则Fe2 + (aq) + Ag + (aq) Fe3 + (aq) + Ag(s)开始浓度/(mol·L-1) 0.100 0.100 0.0100变化浓度/(mol·L-1) x x x平衡浓度/(mol·L-1) 0.100−x0.100−x0.0100 + x3++2+FeAg FeKθ=⎡⎤⎣⎦⎡⎤⎡⎤⋅⎣⎦⎣⎦即()20.01002.980.100xx+=-…………………2分0.013mol/Lx=………………………………………1分()3+Fe0.01000.0130.023mol/Lc=+=…………………1分()()2++Fe Ag0.01000.0130.087mol/Lc c==-=…………………2分⑵()+Aga=()+0.013100%100%Ag0.1000xc??=13% (4)分2.解:NaAc Na+ + Ac—Ac—+H2O HAc + OH—……………………………2分141051.0105.7101.7510WbaKKKθθ---⨯===⨯⨯…………………2分因为/bc Kθ=0.10/5.7×10-10>500 (2)分所以[OH-1065.7100.107.510bK cθ--=⨯⨯=⨯pOH=-lg[OH-]=-lg7.5×10-6=5.1pH=14-pOH=14-5.1=8.9 (2)分637.5107.510%0.10ccα--∆⨯===⨯…………………2分3.解欲使Cu2+产生沉淀所需最低OH-浓度为()-OHc'=()2012+2.2102.0CuspKcθ-⨯='=1.0×10-10()-OHc=1.05×10-10mol/L …………………1分pOH=-lg()-OHc'=-lg(1.0×10-10)= 10.0…………………1分pH=14-pOH=14-10=4.0 …………………1分欲使Fe3+开始产生沉淀所需最低OH-浓度为()-OHc'=()3923+2.610330.010FespKcθ-⨯='=6.4×10-13 …………………1分()-OHc=6.4×10-13 mol/LpOH=-lg6.4×10-13=12.2 …………………1分pH=14-12.2=1.8 …………………1分沉淀Fe3+所需OH-浓度小,首先产生Fe(OH)3沉淀。
