普通化学习题与解答(第二章)演示教学
普通化学作业答案第2章
2.4rHm=2fHm(CO2,g)+3fHm(H2O,l)+(-1)fHm(CH3OCH3,l)+(- 3)fHm(O2,g)
fHm(CH3OCH3,l) =2fHm(CO2,g) +3fHm(H2O,l)-rHm= -183 kJmol-1
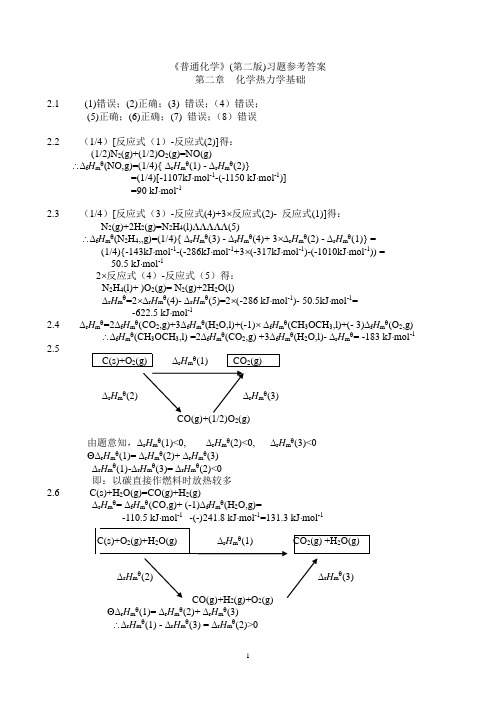
2.5
C(s)+O2(g)rHm(1) CO2(g)
由题意知,rHm(1)<0,rHm(3)<0
故:以水煤气作燃料时放热较多
2.7均为熵增过程。
2.8标准状态下:
rHm
rSm
<0
<0
低温自发
<0
>0
任意温度均自发
>0
>0
高温自发
>0
<0
任意温度均不可能自发
2.9
(2)(反应为气体物质的量增加的过程,rSm>0)
2.10
不可以。因为物质的Sm,不是指由参考状态的元素生成该物质(B=+1)反应的标准摩尔熵。
rSm(298K)=4Sm(Fe,s)+3Sm(CO2,g)+(-2)Sm( Fe2O3,s)+
(-3)Sm(C,s)=557.98Jmol-1K-1
反应在标准状态下自发进行:
rGm(T)rHm(298K)-TrSm(298K)
T>[rHm(298K)/rSm(298K)] ,即T>839K
故以木炭为燃料时,因最高温度低于839K,反应不可能自发。
2.11
H: -40 kJ -40 kJ
G: -38kJ -38 kJ
S: -6.7JK-1-6.7 JK-1
第二章补充习题及答案普通化学

第二章补充习题及答案普通化学概念、习题与解答化学反应基本原理——判断题1、指定单质的fGm、fHm、Sm皆为零。
(错:指定单质S不为零,)θmθθθ(错:升高温度正逆反应速率都增大,不会减小)10、反应活化能越大,反应速率也越大。
(错:相同温度下,活化能越大,速率常数越小,一般讲速率也越小)11、若反应速率方程式中浓度的指数等于反应方程式中反应物的系数,则该反应使基元反2、ΔrSm>0的反应都能自发进行。
(错:该条件只能判断对应温度孤立系统、标准状态下自发)3、rGm<0的反应必能自发进行。
(错:该条件只能判断对应温度标准状态4、若生成物的分子数比反应物的分子数多,则该反应的ΔrSm>0(错:主要看气体分子数)5、CaCO3在高温下可以发生分解反应,故该反应为吸热熵增。
(对:)6、根据能量最低原理,放热反应是自发进行的。
(错:影响自发性因素还有混乱度)7、冰在室温下自动融化成水,是熵增起了重要作用的结果。
(对:)8、化学反应的熵变与温度有关,但随温度变化不明显。
(对:温度变化没有引起状态变化的前提下)9、对于可逆反应C()+H2O(g)=CO(g)+H2(g),rHm0,升高温度使正增大,逆减小,故平衡向右移动。
应。
(错:例如H2(g)+I2(g)=2HI的反应就不是基元反应)12、反应级数取决于反应方程式中反应物的计量系数。
(错:非基元反应必须以试验为依据)13、根据分子碰撞理论,具有一定能量的分子在一定方位上发生有效碰撞,才可能生成产物。
(对)14、根据质量作用定律,反应物浓度增大,则反应速率加快,所以反应速率常数增大。
(错:速率常数与浓度无关)15、反应速率常数与温度有关,而与反应物浓度无关。
(对)二、选择题1热力学函数的定义与性质1-1下列各热力学函数中,哪一个为零:(B)(A)fGm(I2,g.298K)(B)fHm(Br2,l.298K)概念、习题与解答(C)Sm(H2,g.298K)(D)fGm(O3,g.298K)(E)fHm(CO2,g.298K)(C)对孤立体系而言,rSm>0的反应总是自发进行的。
普通化学第二章练习及解析教学文稿

第2章 化学反应的基本原理1. 判断题(对的在括号内填“√”号,错的填“×”号) (1)S r ∆为正值的反应均是自发反应。
(2)某一给定反应达到平衡后,若平衡条件不变,分离除去某生成物,待达到新的平衡后,则各反应物和生成物的分压或浓度分别保持原有定值。
( )(3)对反应系统)g (H )g (CO )g (O H )s (C 22+=+,1m r molkJ 3.131)K 15.298(H -θ⋅=∆。
由于化学方程式两边物质的化学计量数(绝对值)的总和相等,所以增加总压力对平衡无影响。
( )(4)上述反应达到平衡后,若升高温度,则正反应速率v(正)增加,逆反应速率v(逆)减小,结果平衡向右移动。
( )(5)反应的级数取决于反应方程式中反应物的化学计量数(绝对值)。
( ) (6)催化剂能改变反应的历程,降低反应的活化能,但不能改变反应的θm r G ∆。
( )(7)在常温常压下,空气中的N 2和O 2是长期存在而不化合生成NO 。
且热力学计算表明这表明N 2(g )+ O 2(g )=2NO (g )0)15.298(>>∆K G m r θ,则N 2和O 2混合气必定也是动力学稳定系统。
( ) (8)已知CCl 4不会与H 2O 反应,但CCl 4+2H 2O=CO 2+4HCl(aq)的)15.298(K G m r θ∆ 193379-⋅⋅-=molkJ ,则必定是热力学不稳定而动力学稳定系统。
( ) 答案 (1×)(2×)(3×)(4×)(5×)(6√)(7√)(8√) 2. 单选题(将所有正确答案的标号填入空格内)(1)真实气体行为接近理想气体性质的外部条件是( ) (a )低温高压 (b )高温低压 (c )低温高压 (d )高温高压(2)某温度时,反应)g (HBr 2)g (Br )g (H 22=+的标准平衡常数2104K -θ⨯=,则反应)g (Br 21)g (H 21)g (HBr 22+=的标准平衡常数θK 等于( ) (a)21041-⨯(b)21041-⨯(c) 2104-⨯(3)升高温度可以增加反应速率,主要是因为( ) (a) 增加了分子总数 (b) 增加了活化分子百分数 (c) 降低了反应的活化能 (d) 促使平衡向吸热方向移动(4)已知汽车尾气无害化反应反应)g (CO )g (N 21)g (CO )g (NO 22+=+的1m r mol kJ 2.373)K 15.298(H -θ⋅-=∆,要有利于取得有毒气体NO 和CO 的最大转化率,可采取的措施是( )(a) 低温低压(b) 高温高压 (c) 低温高压(d) 高温低压(5)一个化学反应达到平衡时,下列说法中正确的是( ) (a)各物质的浓度或分压不随时间而变化(b) 0=∆θm r G(c)正逆反应的速率常数相等(d)如果寻找到该反应的高效催化剂,可以提高其平衡转化率 答案1b 2b 3b 4c 5a 3. 填空题 (1)对于反应:)g (NH 2)g (H 3)g (N 322=+;1m r molkJ 2.92)K 15.298(H -θ⋅-=∆, 若升高温度(例如升高100K ),则下列各项如何变化(填写:不变,基本不变,增大或减小。
人教版高中化学必修2第二章课后答案

人教版高中化学必修2习题解答第一节习题1、从能量的角度看,断开化学键要,形成化学键要。
一个化学反应是释放能量还是吸收能量取决于。
答:吸收能量;放出能量;反应物的总能量与生成物的总能量的相对大小。
2、从能量形式上看,化学反应中的能量变化通常表现为的变化,所有的燃烧反应都要能量。
答:热量;放出。
3、生活中和生产上最常用的燃料里所含的主要元素有,他们在燃烧后生成的化合物主要是。
答:C、H;CO2、H2O4、下列反应中,属于放热反应的是,属于吸热反应的是。
①煅烧石灰石(主要成分是CaCO3)制生石灰(CaO)②燃烧木炭取暖③炸药爆炸④酸和碱的中和反应⑤生石灰与水作用制熟石灰⑥食物因氧化而腐败答:②③④⑤⑥;①。
5、下列说法中错误的是()。
A.人类目前所直接利用的能量大部分是由化学反应产生的B.煤、石油、天然气是由当今世界最重要的三种化石燃料C.我国目前最主要的能源是煤炭D.人体运动所消耗的能量与化学反应无关答:D6、下列说法中错误的是()A.化学反应必然伴随发生能量变化B.化学变化中的能量变化主要是由化学键变化引起的C.化学反应中能量变化的大小与反应物的质量多少无关D.能量变化是化学反应的基本特征之一答:C7、金刚石和石墨是碳元素的两种结构不同的单质(同素异形体)。
在100kP时,1mol石墨转化为金刚石,要吸收1.895kJ的热量。
据此,试判断在100kP压强下,下列结论正确的是()。
A.石墨比金刚石稳定B.金刚石比石墨稳定C.1mol石墨比1mol金刚石的总能量高D.1mol石墨比1mol金刚石的总能量低答:AD8、阅读下面的叙述,回答有关问题“生物质”是指由植物或动物生命体衍生得到的物质的总称。
作为人类解决能源危机重要途径之一的“生物质能”,主要指用树木、庄家、草类等植物直接或间接提供的能量。
古老的刀耕火种、烧柴做饭、烧炭取暖等粗放用能方式正在被现代科学技术所改变。
(1)下面有关“生物质能”的说法,不正确的是()。
初三化学-第二章知识点讲解和习题练习

第二章知识点回顾2.1(一)空气是由什么组成的1.测定空气中氧气的含量空气中氧气含量的测定探究步骤:(1)将图2-3所示集气瓶内加少量水,容积划分为五等份,并加以标记。
(2)在带橡胶塞和导管的燃烧匙内装满红磷,将胶皮管上的弹簧夹夹紧,把燃烧匙内的红磷放在酒精灯火焰上点燃,并迅速伸入集气瓶内,塞紧橡胶塞,观察现象。
实验现象:红磷燃烧,放出热量,产生大量白烟。
反应的文字表达式:红磷+氧气――→点燃五氧化二磷。
(3)待集气瓶冷却到室温后,把导管插入盛水的烧杯中,打开弹簧夹,观察现象。
实验现象:水沿导管进入集气瓶,进入集气瓶内水的体积约占集气瓶内空气总体积的1/5。
实验讨论:(1)红磷在集气瓶中燃烧,消耗了什么气体?(氧气)(2)红磷在集气瓶中未能全部燃烧,说明了什么?(集气瓶内的氧气已消耗完)(3)集气瓶中剩余的气体主要是什么?有什么性质?(氮气;不能燃烧也不支持燃烧,难溶于水)(4)打开弹簧夹后,为什么集气瓶中能吸入约占集气瓶容积1/5的水?(氧气约占空气总体积的1/5,集气瓶中剩余气体不与红磷反应,不溶于水也不与水反应)实验结论:由该实验现象,可以得出以下结论:氧气约占空气总体积的1/5。
拓展思考:(1)点燃的红磷(用燃烧匙)为什么要迅速伸入集气瓶并塞紧瓶塞?如果将点燃的红磷慢慢伸入集气瓶,结果又如何?(避免集气瓶中部分气体受热逸出;测定结果偏大)(2)为什么要等待集气瓶冷却到室温后,再打开弹簧夹?(如果燃烧刚结束就打开弹簧夹,集气瓶内气体还处于受热膨胀状态,压强变化不明显;测定结果偏小)(3)如果实验中,红磷在集气瓶里已经消耗完,对实验结果有无影响?为什么?(红磷量不足,测定结果偏小)(4)如果将该实验中的红磷改成木炭,对实验结果有何影响?(木炭燃烧生成的是二氧化碳,生成的气体的体积会弥补反应消耗的氧气的体积,集气瓶内气压几乎不变,无法测量氧气含量)(5)拉瓦锡的实验得出结论:氧气约占空气总体积的1/5,而我们实验中,为什么气体减少的体积小于1/5?有没有可能大于1/5?(①红磷量少,未能将容器内氧气完全消耗;②塞子未塞紧,装置漏气;③容器未冷却至室温就打开弹簧夹。
大学普通化学课后答案第二章

θ θ r H m (298K) B f H m,B (298K) B θ { f H m,CaCO3 (s) (393.511 (62.8)}kJ mol1 )
1537 5kJ mol-1 .
故:
θ f Hm,CaCO3 (s) 1206789kJ mol-1 .
-92.3
f H m ( 298K ) / kJ mol
θ
-1
θ θ r H m,1(298.15K) B f H m,B (298.15K) B θ { f H m,HCl(aq) (92.3)}kJ mol1
73.3kJ mol-1
故:
θ f Hm,HCl(aq) 165.6kJ mol-1
故:
θ f Gm,HCl(g) 95.27kJ. mol1
习题14
解:
θ f H m (298 K) / kJ mol 1 θ Sm (298 K) / J mol 1 K 1
H2O(l) H2 (g) 1 O2 (g) 2
-285.838 0 0
69.940
故该过程吸热
习题5 解: (1)
CaO(s) CO2 (g) CaCO3 (s)
θ f H m (298 K) / kJ mol 1 -635.6 -393.511
θ θ r H m (298K) B f H m,B (298K) B θ { f H m,CaCO3 (s) (635.6) (393.511 kJ mol1 )}
说明同一物质在不同反应中,在误差范围内,其标准摩尔生成焓相同
习题9
解: (1)
SiO2 (s) 2H2 (g) Si(s) 2H2O(l)
普通化学第二章补充习题及答案分解

20XX.XX.XX
普通化学第二章补充习题及答 案分解
XX,a click to unlimited possibilities
汇报人:XX
目 录
01 单 击 添 加 目 录 项 标 题 02 习 题 部 分 03 答 案 部 分
01
添加章节标题
02
习题部分
选择题
题目:下列物质中,属于氧化物的是() A. O2 B. H2O C. NaOH D. H2CO3 答 案:B A. O2 B. H2O C. NaOH D. H2CO3
题目:普通化学第二章补充习题及答案分解中,填空题的答案 均可以在书中找到。 答案:正确 答案:正确
判断题
题目:普通化学第二章补充习 题及答案分解中包含判断题。
题目:判断题的答案只有对和 错两种选择。
题目:判断题主要考察学生对 基础知识的掌握程度。
题目:判断题有助于学生加深 对知识点的理解。
计算题
答案:B
题目:下列物质中,含有氧分子的是() A. O2 B. H2O C. NaOH D. H2CO3 答 案:A A. O2 B. H2O C. NaOH D. H2CO3
答案:A
题目:下列物质中,属于纯净物的是() A. O2和H2O的混合物 B. 液态氧和液态 氮的混合物 C. 石灰石和食盐的混合物 D. 稀盐酸和稀硫酸的混合物 答案:B
涉及化学方程式的计算
有关化学平衡的计算
添加标题
添加标题
有关物质的量的计算
添加标题
添加标题
有关热力学第一定律的计算
03
答案部分
选择题答案
答案:C
答案:D
答案:B
答案:A
普通化学习题与解答(第二章)

第二章 化学反应的基本原理和大气污染1、是非题(对的在括号内填“+”号,错的填“-”号)(1)r S ∆ 为正值的反应均是自发反应。
(-) (2)某一给定反应达到平衡后,若平衡条件不变,分离除去某生成物,待达到新的平衡,则各反应物和生成物的分压或浓度分别保持原有定值。
(-)(3)对反应系统122()()()(),(298.15)131.3r m C s H O g CO g H g H K kJ mol θ-+=+∆= 。
由于化学方程式两边物质的化学计量数(绝对值)的总和相等,所以增加总压力对平衡无影响。
(-) (4)上述(3)中反应达到平衡后,若升高温度,则正反应速率v (正)增加,逆反应速率v (逆)减小,结果平衡向右移动。
(-)(5)反应的级数取决于反应方程式中反应物的化学计量数(绝对值)。
(-) (6)催化剂能改变反应历程,降低反应的活化能,但不能改变反应的rmG θ∆。
(+)(7)在常温常压下,空气中的N 2 和O 2 能长期存在而不化合生成NO 。
且热力学计算表明22()()2()N g O g NO g +=的(298.15)0r m G K θ∆ ,则N 2 和O 2混合气必定也是动力学稳定系统。
(+)(8)已知4CCl 不会与2H O 反应,但422()2()()4()CCl l H O l CO g HCl aq +=+的1(298.15)379.93r m G K kJ mol θ-∆=- ,则必定是热力学不稳定而动力学稳定的系统。
(+)2、选择题(将所有正确答案的标号填入空格内)(1)真实气体行为接近理想气体性质的外部条件是 (b )(a )低温高压 (b )高温低压 (c )低温低压 (d )高温高压 (2)某温度时,反应22()()2()H g Br g HBr g +=的标准平衡常数2410K θ-=⨯,则反应2211()()()22HBr g H g Br g =+的标准平衡常数K θ等于 (b )(a )21410-⨯ (b (c )2410-⨯ (3)升高温度可以增加反应速率,最主要是因为 (b )(a )增加了分子总数(b )增加了活化分子的百分数 (c )降低了反应的活化能 (d )促使平衡向吸热方向移动(4)已知汽车尾气无害化反应221()()()()2NO g CO g N g CO g +=+的(298.15)0r m H K θ∆≤,要有利于取得有毒气体NO 和CO 的最大转化率,可采取的措施是 ( c) (a )低温低压 (b )高温高压 (c )低温高压 (d )高温低压(5)温度升高而一定增大的量是 (bc )(a ) r m G θ∆ (b )吸热反应的平衡常数K θ(c )液体的饱和蒸气压 (d )反应的速率常数k(6)一个化学反应达到平衡时,下列说法中正确的是 ( a) (a )各物质的浓度或分压不随时间而变化(b )r m G θ∆=0(c )正、逆反应的速率常数相等(d )如果寻找到该反应的高效催化剂,可提高其平衡转化率3、填空题(1)对于反应: 1223()3()2();(298)92.2r m N g H g NH g H K kJ mol θ-+=∆=-若升高温度(约升高100 K),则下列各项将如何变化(填写:不变,基本不变,增大或减小。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
普通化学习题与解答(第二章)第二章 化学反应的基本原理和大气污染1、是非题(对的在括号内填“+”号,错的填“-”号)(1)r S ∆ 为正值的反应均是自发反应。
(-)(2)某一给定反应达到平衡后,若平衡条件不变,分离除去某生成物,待达到新的平衡,则各反应物和生成物的分压或浓度分别保持原有定值。
(-)(3)对反应系统122()()()(),(298.15)131.3r m C s H O g CO g H g H K kJ mol θ-+=+∆=g 。
由于化学方程式两边物质的化学计量数(绝对值)的总和相等,所以增加总压力对平衡无影响。
(-)(4)上述(3)中反应达到平衡后,若升高温度,则正反应速率v (正)增加,逆反应速率v (逆)减小,结果平衡向右移动。
(-) (5)反应的级数取决于反应方程式中反应物的化学计量数(绝对值)。
(-)(6)催化剂能改变反应历程,降低反应的活化能,但不能改变反应的r m G θ∆。
(+)(7)在常温常压下,空气中的N 2 和O 2 能长期存在而不化合生成NO 。
且热力学计算表明22()()2()N g O g NO g +=的(298.15)0r mG K θ∆?,则N 2 和O 2混合气必定也是动力学稳定系统。
(+)(8)已知4CCl 不会与2H O 反应,但422()2()()4()CCl l H O l CO g HCl aq +=+的1(298.15)379.93r m G K kJ mol θ-∆=-g ,则必定是热力学不稳定而动力学稳定的系统。
(+)2、选择题(将所有正确答案的标号填入空格内)(1)真实气体行为接近理想气体性质的外部条件是 (b )(a )低温高压 (b )高温低压 (c )低温低压 (d )高温高压(2)某温度时,反应22()()2()H g Br g HBr g +=的标准平衡常数2410K θ-=⨯,则反应2211()()()22HBr g H g Br g =+的标准平衡常数K θ等于 (b )(a )21410-⨯ (b (c )2410-⨯ (3)升高温度可以增加反应速率,最主要是因为 (b )(a )增加了分子总数(b )增加了活化分子的百分数 (c )降低了反应的活化能 (d )促使平衡向吸热方向移动(4)已知汽车尾气无害化反应221()()()()2NO g CO g N g CO g +=+的(298.15)0r m H K θ∆≤,要有利于取得有毒气体NO 和CO 的最大转化率,可采取的措施是 ( c) (a )低温低压 (b )高温高压 (c )低温高压 (d )高温低压(5)温度升高而一定增大的量是 (bc )(a ) r m G θ∆ (b )吸热反应的平衡常数K θ(c )液体的饱和蒸气压 (d )反应的速率常数k(6)一个化学反应达到平衡时,下列说法中正确的是 ( a) (a )各物质的浓度或分压不随时间而变化(b )r m G θ∆=0(c )正、逆反应的速率常数相等(d )如果寻找到该反应的高效催化剂,可提高其平衡转化率3、填空题(1)对于反应: 1223()3()2();(298)92.2r mN g H g NH g H K kJ mol θ-+=∆=-g 若升高温度(约升高100 K),则下列各项将如何变化(填写:不变,基本不变,增大或减小。
)r m H θ∆: 基本不变 r m S θ∆: 基本不变 r m G θ∆: 增大 K θ: 减小v(正): 增大 v (逆): 增大 (2)对于下列反应:12()()2();(298)172.5r mC s CO g CO g H K kJ mol θ-+=∆=g 。
若增加总压力或升高温度或加入催化剂,则反应速率常数k (正)、k (逆)和反应速率v (正)、v (逆)以及标准平衡常数K θ、平衡移动的方向等将如何?分别填人下表中。
(3)造成平流层中臭氧层破坏的主要物质有 CFC 、哈龙、N 2O 、NO 、CCl 4、CH 4等;主要的温室气体有 CO 2、CH 4、N 2O 、CFC 、O 3等 ;形成酸雨的大气污染物主要是 SO 2、NO x 等 。
4、不用查表,将下列物质按其标准m S θ(298K)值由大到小的顺序排列,并简单说明理由。
(a)K(s) (b)Na(s) (c)Br 2(1) (d) Br 2 (g) (e)KCl(s)解:m S θ(298K )值由大到小的顺序为2()()d Br g >2()()c Br l >()()e KCl s >()()a K s >()()b Na s说明 (1)同一物质2Br 气态时的熵大于液态时的;(2)一般(相对分子质量相近时)液体的熵大于固体物质的熵; (3)一般说来,当温度和聚集状态相同时,分子或晶体结构较复杂(内部微观粒子较多)的物质的熵大于分子或晶体结构较简单(内部微观粒子较少)的物质的熵。
K(s)和Na(s)的原子结构属同一族,K 的结构较Na 的复杂。
5、定性判断下列反应或过程中熵变的数值是正值还是负值。
(1)溶解少量食盐于水中;(2)活性炭表面吸附氧气; (3)碳与氧气反应生成一氧化碳。
解:(1)熵变为正值;(2)熵变为负值;(3)熵变为正值。
6、利用下列两个反应及其r m G θ∆(298K )值,计算34Fe O (s )在298K 时的标准生成吉布斯函数。
122332()()();(298)742.22r m Fe s O g Fe O s G K kJ mol θ-+=∆=-g123344()()3();(298)77.7r m Fe O s Fe s Fe O s G K kJ mol θ-+=∆=-g解: 22332()()()2Fe s O g Fe O s += (1)23344()()3()Fe O s Fe s Fe O s += (2)(1)4(2)3⨯+,可得 2343()2()()Fe s O g Fe O s += (3)故 34,,3(298)(298)f m Fe O r m G K G K θθ∆=∆={},1,21(298)4(298)3r m r m G K G K θθ⨯∆⨯+∆={}11(742.2)4(77.7)3kJ mol -⨯-⨯+-g = -1015.51kJ mol -g7、通过热力学计算说明下列水结冰过程:22()()H O l H O s →在298K 标准状态时能否自发进行。
已知冰在298K 时的标准摩尔生成吉布斯函数为-236.71kJ mol -g 。
解: 22()()H O l H O s →1(298)/f m G K kJ mol θ-∆g -237.129 -236.7,(298)(298)r m B f m B BG K v G K θθ∆=∆∑=﹛(-236.7)-(-237.129)﹜1kJ mol -g =0.41kJ mol -g >0 故在298K 的标准状态时,水结冰的过程不能自发进行。
8、试用教材附录3中的标准热力学数据,计算下列反应的(298)r mS K θ∆和(298)r m G K θ∆(1) 23423()4()4()Fe s H O l Fe O H g +=+ (2) 22()2()()()Zn s H aq Zn aq H g +++=+ (3) 22()()()2()CaO s H O l Ca aq OH aq +-+=+(4) 21()()()2AgBr s Ag s Br l =+解:(1) 23423()4()()4()Fe s H O l Fe O s H g +=+11(298)/m S K J mol K θ--g g 27.28 69.91 146.4 130.6841(298)/f m G K kJ mol θ-∆g 0 -237.129 -1015.4 0,(298)(298)r m B m B BS K v S K θθ∆=∑=﹛130.864×4+146.4-69.91×4-27.28×3﹜11J mol K --g g= 307.711J mol K --g g,(298)(298)r m B f m B BG K v G K θθ∆=∆∑=﹛(-1015.4)-(-237.129)×4﹜1kJ mol -g = -66.91kJ mol -g(2) 22()2()()()Zn s H aq Zn aq H g +++=+11(298)/m S K J mol K θ--g g 41.63 0 -112.1 130.6841(298)/f m G K kJ mol θ-∆g 0 0 -147.06 0,(298)(298)r m B m B BS K v S K θθ∆=∑=﹛130.864+(-112.1)-41.63﹜11J mol K --g g= -23.011J mol K --g g,(298)(298)r m B f m B BG K v G K θθ∆=∆∑= -147.61kJ mol -g(3) 22()()()2()CaO s H O l Ca aq OH aq +-+=+11(298)/m S K J mol K θ--g g 39.75 69.91 -53.1 -10.751(298)/f m G K kJ mol θ-∆g -604.03 -237.129 -553.58 -157.244,(298)(298)r m B m B BS K v S K θθ∆=∑=﹛(-10.75)×2+(-53.1)-69.91-39.75﹜11J mol K --g g= -184.311J mol K --g g,(298)(298)r m B f m B BG K v G K θθ∆=∆∑=﹛(-157.244)×2+(-553.58)-(-237.129)-(-604.03)﹜1kJ mol -g= -26.911kJ mol -g(4) 21()()()2AgBr s Ag s Br l =+11(298)/m S K J mol K θ--g g 170.1 42.55 152.2311(298)/f m G K kJ mol θ-∆g -96.90 0 0,(298)(298)r m B m B BS K v S K θθ∆=∑=﹛152.231×12+42.55-170.1﹜11J mol K --g g = -54.111J mol K --g g,(298)(298)r m B f m B BG K v G K θθ∆=∆∑= 96.901kJ mol -g9、用锡石(SnO 2)制取金属锡,有建议可用下列几种方法:(1)单独加热矿石,使之分解。
