普通化学习题与解答第二章
普通化学习题与解答第二章

普通化学习题与解答第二章第二章普通化学习题与解答一、选择题1. 下列哪个是粘度最小的物质?A. 黄铜B. 液态氧C. 水银D. 橄榄油2. 一种固体物质在室温下不导电,也不溶于水以及醇类溶剂,属于下列哪一类物质?A. 镁B. 铜C. 木炭D. 锌3. 下列哪种金属在室温下是液态的?A. 铁B. 银C. 铝D. 汞4. 完全燃烧1g甲烷所需的氧气体积为V1,完全燃烧1g乙烷所需的氧气体积为V2,则下列关系正确的是:A. V1 = V2B. V1 < V2C. V1 > V2D. 无法确定5. 下列哪种化合物是无机化合物?A. 葡萄糖B. 甲烷C. 乙醇D. 二氧化碳二、填空题1. 化学元素周期表上有多少个元素?2. 氧元素的原子序数是多少?3. 氮元素的化学符号是什么?4. 分子式C6H12O6代表着哪种有机化合物?5. 有机化合物在室温下一般是__(固体/液体/气体)。
三、解答题1. 简述中性溶液的特征以及如何制备中性溶液。
中性溶液的特征是指其酸性和碱性的浓度相等,pH值为7。
要制备中性溶液,可以采取以下两种方法:方法一:将酸性溶液与碱性溶液缓慢地滴加到一个容器中,直到酸碱浓度相等,pH值为7时停止滴加。
方法二:使用酸碱指示剂,如酚酞,将酸性溶液和碱性溶液逐滴混合,颜色由红变成无色,表示达到中性。
2. 请解释为什么在实验室中要用称量瓶来称量固体物质。
在实验室中用称量瓶来称量固体物质主要是为了保证称量结果的准确性和精确性。
称量瓶具有较小的容量,可以减少气体的容积,不会因固体粉末的散落而产生较大的误差。
此外,称量瓶具有较好的密封性能,可以防止固体物质与外界环境的接触,避免水分、氧气等物质对固体的影响,保持固体的质量稳定。
3. 简述无机化合物与有机化合物的区别,并给出两个具体的例子。
无机化合物是指由无机元素组成的化合物,其化学性质相对稳定,大多数无机化合物是金属离子与非金属离子之间的化合物,常见的无机化合物有氯化钠(NaCl)、硫酸铜(CuSO4)等。
普通化学作业答案第2章
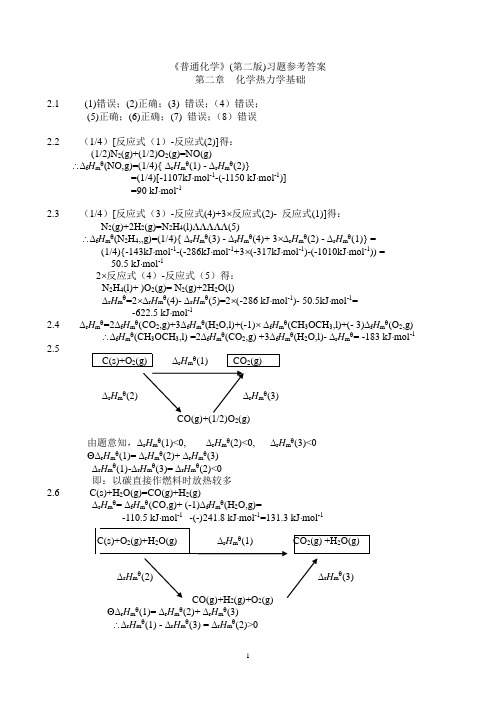
2.4rHm=2fHm(CO2,g)+3fHm(H2O,l)+(-1)fHm(CH3OCH3,l)+(- 3)fHm(O2,g)
fHm(CH3OCH3,l) =2fHm(CO2,g) +3fHm(H2O,l)-rHm= -183 kJmol-1
2.5
C(s)+O2(g)rHm(1) CO2(g)
由题意知,rHm(1)<0,rHm(3)<0
故:以水煤气作燃料时放热较多
2.7均为熵增过程。
2.8标准状态下:
rHm
rSm
<0
<0
低温自发
<0
>0
任意温度均自发
>0
>0
高温自发
>0
<0
任意温度均不可能自发
2.9
(2)(反应为气体物质的量增加的过程,rSm>0)
2.10
不可以。因为物质的Sm,不是指由参考状态的元素生成该物质(B=+1)反应的标准摩尔熵。
rSm(298K)=4Sm(Fe,s)+3Sm(CO2,g)+(-2)Sm( Fe2O3,s)+
(-3)Sm(C,s)=557.98Jmol-1K-1
反应在标准状态下自发进行:
rGm(T)rHm(298K)-TrSm(298K)
T>[rHm(298K)/rSm(298K)] ,即T>839K
故以木炭为燃料时,因最高温度低于839K,反应不可能自发。
2.11
H: -40 kJ -40 kJ
G: -38kJ -38 kJ
S: -6.7JK-1-6.7 JK-1
2023新人教版高一化学课后习题答案第二章

2023新人教版高一化学课后习题答案第二章第一节选择题1.D2.A3.B4.C5.B6.A7.D8.C9.A10.B第二节解答题1. 什么是化学键?化学键的种类有哪些?化学键是指两个或多个原子之间通过共用电子或者转移电子而形成的牢固的联系。
化学键的种类有离子键、共价键和金属键。
离子键是由电子转移形成的,并且通常在金属与非金属之间形成。
共价键是由电子共享形成的,并且通常在非金属与非金属之间形成。
金属键是由金属原子间的电子云形成的。
2. 什么是离子键?离子键的特点是什么?离子键是由电子转移形成的化学键。
离子键的特点是:•通常在金属与非金属之间形成;•电子从金属原子转移到非金属原子,形成带正电荷的离子和带负电荷的离子;•离子之间通过静电引力相互吸引,形成牢固的连接。
3. 什么是共价键?共价键的特点是什么?共价键是由电子共享形成的化学键。
共价键的特点是:•通常在非金属与非金属之间形成;•电子成对地在原子之间共享,形成共用电子对;•共价键可以是单键、双键或者三键;•共价键的强度通常比离子键弱。
4. 解释一下以下化学式中的键的类型和性质:H2O、NaCl、CH4。
•H2O:其中的键类型为共价键。
H2O是水分子的化学式,其中两个氢原子和一个氧原子通过共用电子形成共价键。
水分子是极性分子,由于氧原子比氢原子的电负性更大,因此水分子中的氧原子带负电荷,氢原子带正电荷。
•NaCl:其中的键类型为离子键。
NaCl是氯化钠的化学式,其中钠离子和氯离子通过电子转移形成离子键。
钠离子带正电荷,氯离子带负电荷。
由于正负电荷之间的静电引力,钠离子和氯离子紧密连接。
•CH4:其中的键类型为共价键。
CH4是甲烷的化学式,其中碳原子和四个氢原子通过共用电子形成共价键。
甲烷是非极性分子,碳原子和氢原子的电负性相近,因此甲烷中的化学键没有电荷分布不均匀的情况。
5. 什么是全球气候变暖?全球气候变暖的原因是什么?全球气候变暖是指地球气候系统的气温整体上升的现象。
普通化学第六版课后习题答案

习题2:答案为C,因为C选项中的物质是离子晶体,离子键的键能较大,熔点较高。
习题3:答案为D,因为D选项中的物质是原子晶体,原子间共价键的键能很大,熔点极高。
习题4:答案为A,因为A选项中的物质是分子晶体,分子间作用力较小,沸点较低。
第4章答案
习题4-3:答案
习题4-1:答案
习题4-2:答案
习题4-4:答案
解析过程:对每个选项进行详细解释
解析答案:答案详见PPT
题目类型:选择题
第4章解析
题目类型:选择题
解析答案:答案详见PPT
解析内容:对第4章课后习题进行详细解析,包括解题思路、方法、技巧等
注意事项:提醒学生注意易错点、难点和重点
汇报人:XX
感谢观看
02
习题解析
第1章解析
题目类型:选择题、填空题、计算题等
习题答案:提供第1章课后习题的答案及解析
注意事项:解题时需要注意的细节和易错点
解析内容:涉及的知识点、解题思路、答案解析等
第2章解析
习题2.1:答案详解
习题2.2:答案详解
习题2.3:答案详解
习题2.4:答案详解
第3章解析Βιβλιοθήκη 注意事项:提醒学生注意易错点
XX,a click to unlimited possibilities
普通化学第六版课后习题答案
目录
01
习题答案
02
习题解析
01
习题答案
第1章答案
习题1.1答案:略
习题1.2答案:略
习题1.3答案:略
习题1.4答案:略
第2章答案
习题1:答案为B,因为B选项中的物质是分子晶体,分子间作用力较小,熔点较低。
《普通化学》课后习题答案

普通化学第一章 习题答案1. 答案(1-)(2-)(3+)(4-)2. 答案(1c )(2d )(3a )(4d )(5abd )(6ad )(7d )(8d )3. 答案(1)燃烧前后系统的温度(2)水的质量和比热(3)弹式量热计热容4..答案:根据已知条件列式 K C g K g J g molg mol J b )35.29659.298](120918.4[5.0122100032261111-+⨯⋅⋅-=⨯⋅⋅⨯----- C b =849J.mol -15.答案:获得的肌肉活动的能量=kJ mol kJ mol g g8.17%3028201808.311=⨯⋅⨯⋅--6. 答案:设计一个循环 3× )(2)(32s Fe s O Fe →×3→)(243s O Fe )(3s FeO ×2(-58.6)+2(38.1)+6p q =3(-27.6) 17.166)1.38(2)6.58()6.27(3-⋅-=----=mol kJ q p7.答案:由已知可知 ΔH=39.2 kJ.mol -1 ΔH=ΔU+Δ(PV )=ΔU+P ΔVw ‘=-P ΔV= -1×R ×T = -8.314×351J = -2.9kJ ΔU=ΔH-P ΔV=39.2-2.9=36.3kJ8.下列以应(或过程)的q p 与q v 有区别吗? 简单说明。
(1)2.00mol NH 4HS 的分解NH 4HS(s) NH 3(g)+H 2S(g) (2)生成1.00mol 的HCl H 2(g)+Cl 2(g) 2HCl(g) (3)5.00 mol CO 2(s)(干冰)的升华CO 2(s)CO 2(g) (4)沉淀出2.00mol AgCl(s) AgNO 3(aq)+NaCl(aq) AgCl(s)+NaNO 3(aq)9.答案:ΔU-ΔH= -Δ(PV )=-Δn g RT (Δn g 为反应发生变化时气体物质的量的变化) (1)ΔU-ΔH=-2×(2-0)×8.314×298.15/1000= - 9.9kJ(2)ΔU-ΔH=-2×(2-2)×R ×T= 0(3)ΔU-ΔH=-5×(1-0)×8.314×(273.15-78)/1000= -8.11kJ (4)ΔU-ΔH=-2×(0-0)×R ×T= 010.(1)4NH 3(g)+3O 2(g) = 2N 2(g) +6H 2O(l) 答案 -1530.5kJ.mol -1(2)C 2H 2(g) + H 2(g) = C 2H 4(g) 答案 -174.47kJ.mol -1 (3)NH 3(g) +稀盐酸 答案 -86.32kJ.mol -1 写出离子反应式。
普通化学习题与解答第二章

题目:在等温、等压条件下自发反应总是向着 ΔH - TΔS < 0 的方向进行,因此,在等温、等压条件下,自发反 应总是向着 ΔH - TΔS < 0 的方向进行。
● 解答:K = [C][D] / ([A][B]^2) ● 题目:在一定温度下,向一个容积不变的容器中通入1mol N2和3mol H2及固体催化剂,使之反应:N2(g) + 3H2(g) ⇌ 2NH3(g);ΔH = -92.4kJ/mol,平衡时容器内气体压强为起始时的80%。此时,若向容器
中充入1mol N2、3mol H2和1mol NH3,则平衡移动的方向为____。 解答:向容器中充入$1molN_{2}$、$3molH_{2}$和$1molNH_{3}$,等效为开始充入$2molN_{2}$、$6molH_{2}$,与原起始量之比 相同,为等效平衡,平衡时各物质的浓度相等,则平衡不移动,故答案为:不移动。
● A.NH3的体积分数一定小于反应前混合气体的2v逆(NH3) ● C.平衡时体系中N2、H2、NH3的物质的量之比一定为1:3:2 ● D.平衡时体系中N2、H2、NH3的物质的量之和一定等于起始时体系的总物质的量
● 题目:请写出下列反应的平衡常数表达式:A + 2B → C + D 解答:K = [C][D] / ([A][B]^2)
添加标题
注意事项:在书写平衡常数表达式时,需要注意各组分的化学计量数,它反映了反应中各物质的计 量关系。在本题中,化学计量数分别是1、2、3、4。
题目:请写出下列反应的平衡常数表达式:A + 2B → 3C + 4D 解答:平衡常数表达式为 K = [C]^3[D]^4/[A][B]^2 解释:根据平衡常数的定义,平衡常数等于生成物浓度幂之积与反应物浓度幂之积的比值 注意事项:在书写平衡常数表达式时,需要注意反应物和生成物的浓度幂之积的次序和指数
同济大学普通化学第一章、二章习题答案(详细)

∴fG (298k, CO2(g) ) = 1/3 )kJmol1=kJmol1
19.解6CO2(g)+ 6H2O(l)==C6H12O6(s)+ 6O2(g)
fG (298k)kJmol10
∴rG (298k)=[( 6 ) ( 6 ) ]kJmol1=kJmol1>0
∴lnK(500k)= = =
∴K(500k) =1010
解法二:
∵ ln =
= =
∴ =10-7
∴K(500k) =10-7K(298k)=10-7(1016) =1010
23.解:N2(g) +3H2(g) ==2NH3(g)
fH (298k)/ kJmol100
S (298k)/ Jmol1k1
∴rG (298k)=[(2(2] kJmol1=kJmol1>0
∴此反应不能自发进行。
21.解 (1)MgCO3(s) ==MgO(s)+CO2(g)
fH (298k)/ kJmol1
S (298k)/ Jmol1k1
fG (298k) /kJmol1
∴rH (298k)=[+((]=kJmol1
∴该正反应为吸热反应。
25.解: 平衡反应2SO2(g)+O2(g)2SO3(g)
= ( )Jmol1k1=Jmol1k1
18.解:2Fe2O3(s) + 3C (s ,石墨)==4 Fe (s) + 3 CO2(g)
fH (298k)/ kJmol1
S (298k)/ Jmol1k1
fG (298k)/ kJmol1
大学普通化学课后答案第二章

θ θ r H m (298K) B f H m,B (298K) B θ { f H m,CaCO3 (s) (393.511 (62.8)}kJ mol1 )
1537 5kJ mol-1 .
故:
θ f Hm,CaCO3 (s) 1206789kJ mol-1 .
-92.3
f H m ( 298K ) / kJ mol
θ
-1
θ θ r H m,1(298.15K) B f H m,B (298.15K) B θ { f H m,HCl(aq) (92.3)}kJ mol1
73.3kJ mol-1
故:
θ f Hm,HCl(aq) 165.6kJ mol-1
故:
θ f Gm,HCl(g) 95.27kJ. mol1
习题14
解:
θ f H m (298 K) / kJ mol 1 θ Sm (298 K) / J mol 1 K 1
H2O(l) H2 (g) 1 O2 (g) 2
-285.838 0 0
69.940
故该过程吸热
习题5 解: (1)
CaO(s) CO2 (g) CaCO3 (s)
θ f H m (298 K) / kJ mol 1 -635.6 -393.511
θ θ r H m (298K) B f H m,B (298K) B θ { f H m,CaCO3 (s) (635.6) (393.511 kJ mol1 )}
说明同一物质在不同反应中,在误差范围内,其标准摩尔生成焓相同
习题9
解: (1)
SiO2 (s) 2H2 (g) Si(s) 2H2O(l)
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第二章 化学反应的基本原理和大气污染1、是非题(对的在括号内填“+”号,错的填“-”号)(1)r S ∆ 为正值的反应均是自发反应。
(-) (2)某一给定反应达到平衡后,若平衡条件不变,分离除去某生成物,待达到新的平衡,则各反应物和生成物的分压或浓度分别保持原有定值。
(-)(3)对反应系统122()()()(),(298.15)131.3r mC s H O g CO g H g H K kJ mol θ-+=+∆=。
由于化学方程式两边物质的化学计量数(绝对值)的总和相等,所以增加总压力对平衡无影响。
(-) (4)上述(3)中反应达到平衡后,若升高温度,则正反应速率v (正)增加,逆反应速率v (逆)减小,结果平衡向右移动。
(-)(5)反应的级数取决于反应方程式中反应物的化学计量数(绝对值)。
(-)(6)催化剂能改变反应历程,降低反应的活化能,但不能改变反应的rmG θ∆。
(+)(7)在常温常压下,空气中的N 2 和O 2 能长期存在而不化合生成NO 。
且热力学计算表明22()()2()N g O g NO g +=的(298.15)0r mG K θ∆,则N 2 和O 2混合气必定也是动力学稳定系统。
(+)(8)已知4CCl 不会与2H O 反应,但422()2()()4()CCl l H O l CO g HCl aq +=+的1(298.15)379.93r m G K kJ mol θ-∆=-,则必定是热力学不稳定而动力学稳定的系统。
(+)2、选择题(将所有正确答案的标号填入空格内)(1)真实气体行为接近理想气体性质的外部条件是 (b )(a )低温高压 (b )高温低压 (c )低温低压 (d )高温高压 (2)某温度时,反应22()()2()H g Br g HBr g +=的标准平衡常数2410K θ-=⨯,则反应2211()()()22HBr g H g Br g =+的标准平衡常数K θ等于 (b )(a )21410-⨯ (b (c )2410-⨯ (3)升高温度可以增加反应速率,最主要是因为 (b )(a )增加了分子总数(b )增加了活化分子的百分数 (c )降低了反应的活化能 (d )促使平衡向吸热方向移动(4)已知汽车尾气无害化反应221()()()()2NO g CO g N g CO g +=+的(298.15)0r m H K θ∆≤,要有利于取得有毒气体NO 和CO 的最大转化率,可采取的措施是 ( c) (a )低温低压 (b )高温高压 (c )低温高压 (d )高温低压(5)温度升高而一定增大的量是 (bc )(a ) r m G θ∆ (b )吸热反应的平衡常数K θ(c )液体的饱和蒸气压 (d )反应的速率常数k(6)一个化学反应达到平衡时,下列说法中正确的是 ( a) (a )各物质的浓度或分压不随时间而变化(b )r m G θ∆=0(c )正、逆反应的速率常数相等(d )如果寻找到该反应的高效催化剂,可提高其平衡转化率3、填空题(1)对于反应: 1223()3()2();(298)92.2r mN g H g NH g H K kJ mol θ-+=∆=- 若升高温度(约升高100 K),则下列各项将如何变化(填写:不变,基本不变,增大或减小。
)r m H θ∆: 基本不变 r m S θ∆: 基本不变 r m G θ∆: 增大 K θ: 减小v(正): 增大 v (逆): 增大 (2)对于下列反应:12()()2();(298)172.5r mC s CO g CO g H K kJ mol θ-+=∆=。
若增加总压力或升高温度或加入催化剂,则反应速率常数k (正)、k (逆)和反应速率v (正)、v (逆)以及标准平衡常数K θ、平衡移动的方向等将如何?分别填人下表中。
(3)造成平流层中臭氧层破坏的主要物质有 CFC 、哈龙、N 2O 、NO 、CCl 4、CH 4等;主要的温室气体有 CO 2、CH 4、N 2O 、CFC 、O 3等 ;形成酸雨的大气污染物主要是 SO 2、NO x 等 。
4、不用查表,将下列物质按其标准m S θ(298K)值由大到小的顺序排列,并简单说明理由。
(a)K(s) (b)Na(s) (c)Br 2(1) (d) Br 2 (g) (e)KCl(s)解:m S θ(298K )值由大到小的顺序为2()()d Br g >2()()c Br l >()()e KCl s >()()a K s >()()b Na s说明 (1)同一物质2Br 气态时的熵大于液态时的;(2)一般(相对分子质量相近时)液体的熵大于固体物质的熵; (3)一般说来,当温度和聚集状态相同时,分子或晶体结构较复杂(内部微观粒子较多)的物质的熵大于分子或晶体结构较简单(内部微观粒子较少)的物质的熵。
K(s)和Na(s)的原子结构属同一族,K 的结构较Na 的复杂。
5、定性判断下列反应或过程中熵变的数值是正值还是负值。
(1)溶解少量食盐于水中;(2)活性炭表面吸附氧气; (3)碳与氧气反应生成一氧化碳。
解:(1)熵变为正值;(2)熵变为负值;(3)熵变为正值。
6、利用下列两个反应及其r m G θ∆(298K )值,计算34Fe O (s )在298K 时的标准生成吉布斯函数。
122332()()();(298)742.22r m Fe s O g Fe O s G K kJ mol θ-+=∆=-123344()()3();(298)77.7r m Fe O s Fe s Fe O s G K kJ mol θ-+=∆=-解: 22332()()()2Fe s O g Fe O s += (1)23344()()3()Fe O s Fe s Fe O s += (2)(1)4(2)3⨯+,可得 2343()2()()Fe s O g Fe O s += (3)故 34,,3(298)(298)f m Fe O r m G K G K θθ∆=∆={},1,21(298)4(298)3r m r m G K G K θθ⨯∆⨯+∆={}11(742.2)4(77.7)3kJ mol -⨯-⨯+-= -1015.51kJ mol -7、通过热力学计算说明下列水结冰过程:22()()H O l H O s →在298K 标准状态时能否自发进行。
已知冰在298K 时的标准摩尔生成吉布斯函数为-236.71kJ mol -。
解: 22()()H O l H O s →1(298)/f m G K kJ mol θ-∆ -237.129 -236.7,(298)(298)r m B f m B BG K v G K θθ∆=∆∑=﹛(-236.7)-(-237.129)﹜1kJ mol -=0.41kJ mol ->0 故在298K 的标准状态时,水结冰的过程不能自发进行。
8、试用教材附录3中的标准热力学数据,计算下列反应的(298)r mS K θ∆和(298)r m G K θ∆(1) 23423()4()4()Fe s H O l Fe O H g +=+ (2) 22()2()()()Zn s H aq Zn aq H g +++=+ (3) 22()()()2()CaO s H O l Ca aq OH aq +-+=+(4) 21()()()2AgBr s Ag s Br l =+解:(1) 23423()4()()4()Fe s H O l Fe O s H g +=+11(298)/m S K J mol K θ-- 27.28 69.91 146.4 130.6841(298)/f m G K kJ mol θ-∆ 0 -237.129 -1015.4 0,(298)(298)r m B m B BS K v S K θθ∆=∑=﹛130.864×4+146.4-69.91×4-27.28×3﹜11J mol K --= 307.711J mol K --,(298)(298)r m B f m B BG K v G K θθ∆=∆∑=﹛(-1015.4)-(-237.129)×4﹜1kJ mol - = -66.91kJ mol -(2) 22()2()()()Zn s H aq Zn aq H g +++=+11(298)/m S K J mol K θ-- 41.63 0 -112.1 130.6841(298)/f m G K kJ mol θ-∆ 0 0 -147.06 0,(298)(298)r m B m B BS K v S K θθ∆=∑=﹛130.864+(-112.1)-41.63﹜11J mol K --= -23.011J mol K --,(298)(298)r m B f m B BG K v G K θθ∆=∆∑= -147.61kJ mol -(3) 22()()()2()CaO s H O l Ca aq OH aq +-+=+11(298)/m S K J mol K θ-- 39.75 69.91 -53.1 -10.751(298)/f m G K kJ mol θ-∆ -604.03 -237.129 -553.58 -157.244,(298)(298)r m B m B BS K v S K θθ∆=∑=﹛(-10.75)×2+(-53.1)-69.91-39.75﹜11J mol K --= -184.311J mol K --,(298)(298)r m B f m B BG K v G K θθ∆=∆∑=﹛(-157.244)×2+(-553.58)-(-237.129)-(-604.03)﹜1kJ mol - = -26.911kJ mol -(4) 21()()()2AgBr s Ag s Br l =+11(298)/m S K J mol K θ-- 170.1 42.55 152.2311(298)/f m G K kJ mol θ-∆ -96.90 0 0,(298)(298)r m B m B BS K v S K θθ∆=∑=﹛152.231×12+42.55-170.1﹜11J mol K --= -54.111J mol K --,(298)(298)r m B f m B BG K v G K θθ∆=∆∑= 96.901kJ mol -9、用锡石(SnO 2)制取金属锡,有建议可用下列几种方法:(1)单独加热矿石,使之分解。
