高铁酸盐
氢氧化亚铁、高铁酸盐的制备实验探究 --2024年高考化学考点微专题(解析版)(全国版)
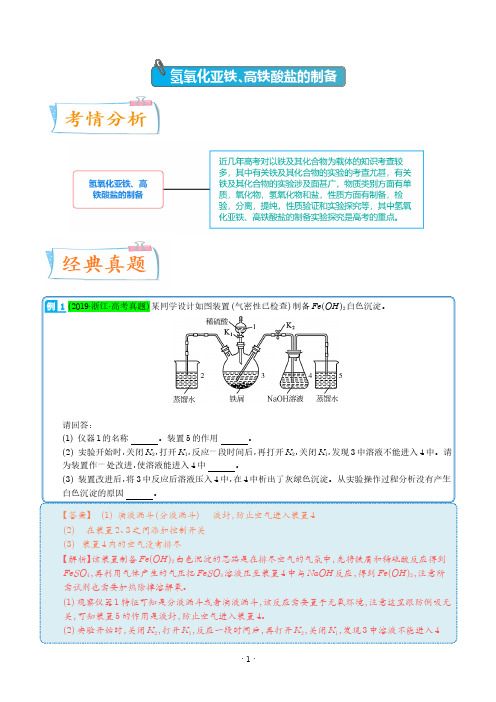
氢氧化亚铁、高铁酸盐的制备1(2019·浙江·高考真题)某同学设计如图装置(气密性已检查)制备Fe(OH)2白色沉淀。
请回答:(1)仪器1的名称。
装置5的作用。
(2)实验开始时,关闭K2,打开K1,反应一段时间后,再打开K2,关闭K1,发现3中溶液不能进入4中。
请为装置作一处改进,使溶液能进入4中。
(3)装置改进后,将3中反应后溶液压入4中,在4中析出了灰绿色沉淀。
从实验操作过程分析没有产生白色沉淀的原因。
【答案】 (1)滴液漏斗(分液漏斗) 液封,防止空气进入装置4(2) 在装置2、3之间添加控制开关(3) 装置4内的空气没有排尽【解析】该装置制备Fe(OH)2白色沉淀的思路是在排尽空气的气氛中,先将铁屑和稀硫酸反应得到FeSO4,再利用气体产生的气压把FeSO4溶液压至装置4中与NaOH反应,得到Fe(OH)2,注意所需试剂也需要加热除掉溶解氧。
(1)观察仪器1特征可知是分液漏斗或者滴液漏斗,该反应需要置于无氧环境,注意这里跟防倒吸无关,可知装置5的作用是液封,防止空气进入装置4。
(2)实验开始时,关闭K2,打开K1,反应一段时间后,再打开K2,关闭K1,发现3中溶液不能进入4中。
如此操作,不行的原因在于仪器1产生的H2从左侧导管溢出,那么没有足够的压强不能将FeSO4溶液挤出,因而在装置2、3之间添加控制开关即可。
(3)灰绿色沉淀产生的原因是Fe(OH)2被空气氧化,因为装置4中空气没有完全排尽。
2(2022·北京东城·统考二模)以相同的流速分别向经硫酸酸化和未经酸化的浓度均为0.1mol·L-1的FeSO4溶液中通入O2.溶液中pH随时间的变化如下图所示。
已知:0.1mol·L-1Fe3+生成Fe(OH)3,开始沉淀时pH=1.5,完全沉淀时pH=2.8下列说法不正确的是A.由图1可知,酸化的FeSO4溶液中发生反应:4Fe2++O2+4H+=4Fe3++2H2OB.图2中,t=0时刻,FeSO4溶液pH=5.7是由于Fe2+发生了水解反应C.由图2可知,未酸化的FeSO4溶液中发生反应生成Fe(OH)3的同时还生成了H+D.若向FeSO4溶液中先加入过量NaOH溶液再通入O2,pH先增大后明显减小【答案】D【解析】A.由图1可知,向酸化的FeSO4溶液中通入氧气,溶液的pH值未超过1.4,则亚铁离子被氧化为铁离子,还没开始沉淀,即发生的氧化还原反应为:4Fe2++O2+4H+=4Fe3++2H2O,A正确;B.由于未加硫酸酸化,但t=0时刻,FeSO4溶液pH=5.7,则说明是亚铁离子水解导致的,其水解方程式为:Fe2++2H2O⇌Fe(OH)2+2H+,B正确;C.由图2的曲线变化趋势可知,溶液中的反应使其pH值下降,根据氢氧化铁的沉淀范围可知,氧气将亚铁离子氧化为氢氧化铁沉淀,同时生成氢离子,该反应为:4Fe2++O2+10H2O=4Fe(OH)3↓+8H+,C正确;D.根据所给条件可知,若向FeSO4溶液中先加入过量NaOH溶液再通入O2,发生的反应为:Fe2+ +2OH-=Fe(OH)2↓,4Fe(OH)2+O2+2H2O=4Fe(OH)3,所以加入氢氧化钠后,溶液的pH会增大,通入氧气后,由于消耗水,溶液中氢氧根离子浓度会继续增大,D错误;故选D。
新型水处理剂——高铁酸盐

新型水处理剂——高铁酸盐作者:张新中来源:《化学教学》2007年第08期文章编号:1005-6629(2007)08-0076-03中图分类号:G632.479 文献标识码:B1702年,德国化学和物理学家Georg Stahl最先发现并报道了高铁酸盐,随后对高铁酸盐的研究一直没有中断过。
1897年在实验室中合成出高铁酸钾。
20世纪70年代以后,高铁酸盐被开发成一种非氯的新型高效饮水消毒剂和水处理剂,国内外均作过较多的报道。
用作水处理剂时,高铁酸盐有以下特点:①高铁酸盐(钠、钾)是六价铁盐,具有很强的氧化性,溶于水中能释放大量的原子氧,从而非常有效地杀灭水中的细菌和病毒,具有杀菌力高、快速的特点。
试验结果证明,若水源中细菌含量未超过20万一30万个/mL时,用浓度6mg/L的高铁酸钾处理30min,即可基本上将细菌杀死,水中残存的细菌含量小于100个/mL,达到饮用水质的标准。
②高铁酸盐自身被还原成新生态的Fe(OH)3,这是一种品质优良的无机絮凝剂,能高效地除去水中的微细悬浮物。
实验证明,由于其强烈的氧化和絮凝共同作用,高铁酸盐的消毒和除污效果,全面优于含氯消毒剂和高锰酸盐。
③高铁酸盐除了具有优异的氧化漂白、高效絮凝、优良的杀菌作用以外,它还可迅速有效地去除废水中的有机污染物、重金属离子以及使废水脱色、脱臭,还可以控制冷凝循环水中生物粘垢的形成。
高铁酸盐除臭主要是氧化掉诸如硫化氢(H2S)、甲硫醇(CH3SH)、甲基硫[(CH3)3S]、氨气(NH3)等恶臭物质,将其转化为安全无味的物质。
由于高铁酸盐在整个pH值范围都具有极强的氧化性,因而用于淤泥除臭处理是较为理想的方法。
④高铁酸盐在整个水的消毒和净化过程中,不会产生三氯甲烷等任何对人体有害的物质,不会引入有害生物体的二次污染。
⑤高铁酸盐适用的pH范围比含氯药剂宽,处理后的水无嗅无味,口感好,而且成本也低于其它净水剂。
因此,高铁酸盐是当今理想的多功能水处理剂,被科学家们公认为绿色消毒剂。
分析高铁酸盐的制备、性质及在水处理中的运用

分析高铁酸盐的制备、性质及在水处理中的运用摘要:高铁酸盐是一种具有一定的氧化杀菌功效的水处理药剂,可广泛用于水和废水的处理,将水达到可使用的标准。
本文论述了高铁酸盐的制备方法,分析了通过对高铁酸盐用于水处理时发挥的化学性质及其应用现状,对于高铁酸盐在水处理行业的应用和推广奠定良好的基础,具有重要的意义。
关键词:高铁酸盐;化学性质;水处理;制备方法引言高铁酸盐具有强氧化性,它可以杀死大量的微生物,比普通杀菌药剂效果好,不会产生二次污染,且不会形产生对人体有害的物质,现阶段,我国很多的地方都采用高铁酸盐对水进行处理,因为这种药剂使用过程比较便捷,容易购买,需要配备的材料较少,节省了处理水的成本,让水二次使用,所以,这种药剂已经被广泛应用到了各个领域当中。
一、制备高铁酸盐的方法高铁酸盐制备的过程比较简单,其制备方式也有很多中,现阶段我国主要的制备方式一共有三种,第一种是电解法,对其使用原理进行分析,推算出其电解的化学方程式,然后根据化学方程式准备材料器具,进行制备;第二种制备方式是氧化法,运用次氯酸盐进行氧化;最后一种制备方式时熔融法,通过高温的作用,结合相关的化学药品进行高铁酸盐的制备。
1.熔融制备法这种制备方式相对来说比较简单,主要的制备理念就是对其进行温度的控制,通过高温的作用力,形成高铁酸盐。
但是这种制备方式危险性比较大,如果操作不当很容易发生危险。
在制备时,要将温度控制在360摄氏度左右,上下不超过10摄氏度。
并让其在碱性的环境中进行高温作业。
整个化学制备理念是,FeSO4或者Fe2O3结合Na2O2在高温的作用下,形成高铁酸盐。
采用这种方式来制备高铁酸盐,虽然操作起来简单,但却不好控制,除了需要控制好温度外,还要对制备的环境进行控制,空气的湿润程度等都会对制备结果产生影响。
2.氧化制备法这种氧化制备方式主要通过次氯酸盐的氧化作用来制备高铁酸盐,这种制备过程同样需要在碱性的环境下,先制备出Fe(OH)3,然后使其和NaClO还有NaOH 进行反应,生成Na2FeO4,最后让Na2FeO4和KOH反应生成高铁酸盐。
高铁酸盐在废水中的作用

高铁酸盐在工业废水中的应用1高铁酸盐用于有机污染物的降解高铁酸盐和被还原生成的铁的中间氧化态都有极强的氧化性。
此外,高铁酸盐能够将水分子分解成具有强氧化性的原子氧,可以氧化有机污染物,并可能将有机物最终分解为二氧化碳。
同时,还原产物Fe(OH)3具有混凝、吸附性能,也有助于有机污染物的去除。
高铁酸钾可将羟胺、N-甲基羟胺、N-苯胲、邻甲基羟胺分别快速氧化成氮氧化物、亚硝基甲烷、亚硝基苯、甲醇和氮气;还可将硫代硫酸盐、苯亚磺酸盐、蛋氨酸、甘氨酸、苯丙氨酸、丝氨酸、二甲亚砜分别快速氧化成亚硫酸盐、苯磺酸盐和对应的砜。
高铁酸钾去除有机污染物的效能主要取决于高铁酸钾与有机物的比例,过量的高铁酸钾对去除有机污染物是有利的。
研究结果表明高铁酸钾与有机物的质量配比在3∶1~5∶1之间,pH<8条件下高铁酸钾降解苯、氯苯、烯丙苯、苯酚的百分率分别为18%~47%、23%~47%、85%~100%、32%~55%。
高铁酸钾与有机物固定物质的量比为5∶1,pH在8~9条件下高铁酸钾与不同有机物污染物速率常数和半衰期(有机物消耗一半所需要的时间)。
2高铁酸盐用于无机污染物的氧化高铁酸盐具有极强的氧化能力,可以将无机污染物氧化成无害的物质,同时高铁酸盐分解的产物Fe(OH)3具有良好的混凝、吸附共沉淀功能,可将有害离子沉降从体系中除去。
高铁酸钾对Cu2+、Pb2+、Cd2+、Cr3+等重金属离子具有较强的去除作用。
质量浓度分别为31.9、104、56.2、27.5 mg/L的Cu2+、Pb2+、Cd2+、Cr3+的废水中,加入适量的高铁酸钾其去除率分别为98.0%、98.9%、98.6%、94.5% [15]。
Y.Lee,在一定的条件下高铁酸盐去除As(Ⅲ)的效能主要取决于高铁酸钾与有机物的比例和反应时间,Fe(VI)与As(Ⅲ)的比例为3∶2时,高铁酸盐可以将As(Ⅲ)氧化成As(V),进而沉淀去除。
河水的除砷实验表明用2.0 mg/L Fe(Ⅵ),可将水中砷的质量浓度由原来的517 g/L降到50 g/L。
电化学法制备高铁酸盐应用与研究

电化学法制备高铁酸盐应用与研究摘要:高铁酸盐是集消毒、氧化、絮凝、吸附等为一体的高效多功能环保型水处理药剂,广泛应用于水处理中,具有广阔的应用前景。
然而,制备成本高、稳定性差等因素制约了高铁酸盐的大量使用。
本文综述了高铁酸盐的电化学制备方法,探讨了各种影响因素对高铁酸盐合成效率的影响,提出了高铁酸盐制备过程中的一些建议,总结了高铁酸盐的现场制备的研究进展。
abstract: ferrate is one of the water treatment chemicals with characters of disinfection, oxidation, flocculation and adsorption which is widely used in water treatment and has broad application prospects. however, the high cost of preparation and poor stability restricted the large use of ferrate. this paper summarized the electrochemical preparation methods of ferrate, discussed the various influential factors on the synthesis efficiency of ferrate,proposed some of the recommendations during the preparation of ferrate and summarized the ferrate progress in the preparation.关键词:高铁酸盐;电化学法;水和废水处理key words: ferrate;electrochemical method;water and wastewater treatment中图分类号:o646 文献标识码:a 文章编号:1006-4311(2013)22-0320-020 引言高铁酸盐是一种氧化性非常强的氧化剂,在水处理、有机合成和超铁电池等方面具有重要的潜在应用价值,以其独特的环境友好性受到人们越来越多的关注。
高铁酸盐的稳定性研究进展

第21卷第3期2009年9月河南工程学院学报(自然科学版)JOURNAL OF HE NAN I N STI T UTE OF E NGI N EER I N G Vol 121,No 13Sep.2009高铁酸盐的稳定性研究进展高玉梅,丁小会(河南工程学院材料与化学工程系,河南郑州450007)摘 要:高铁酸盐是一种绿色环保净水剂.通过对影响高铁酸盐稳定性的因素与提高其稳定性所采取的措施的综述,得出影响高铁稳定性的因素主要有高铁自身浓度、Fe 3+、pH 值、溶液中杂质、存放环境等;一般采取加入稳定剂或制备成负载型高铁酸盐的方法延长高铁酸盐的存放时间.今后应着重对优化制备工艺流程,减少制备步骤进行研究.关键词:高铁酸盐;净水剂;稳定性中图分类号:O611.3 文献标识码:A 文章编号:1674-330X (2009)03-0018-04收稿日期:2009-03-16项金项目:河南工程学院青年教师科研基金项目(Y2007038).作者简介:高玉梅(1974-),女,河南宁陵人,讲师,硕士,主要从事无机物的制备与应用研究. 高铁酸盐是绿色环保净水剂,具有极强的氧化性和优良的絮凝功能,在水处理中可同时发挥氧化、絮凝、吸附、共沉、杀菌、消毒等协同作用,且不产生二次污染.在有机物的选择氧化、污水水质处理、杀菌消毒和环保型电池材料等方面有其独特作用[1-8].但高纯度固体高铁酸盐的生产成本高,使其工业化应用受到限制,液体高铁酸盐易制备,生产成本低,但Fe O 42-不论在酸(或碱)介质中均表现出不稳定性,储存周期短.因此,高铁酸盐的不稳定性对它的工业化应用是一种不利因素,往往在其作用尚未发挥时,它就已经分解成为三价铁而失去了氧化性能.近几年来,人们对影响高铁酸盐溶液稳定性的因素与改进途径做了一些研究.对这些研究进行评述,有助于人们全面了解高铁酸盐的性能,为高铁酸盐的应用及进一步研究提供参考.1 影响高铁酸盐稳定性的因素1.1 自身浓度的影响Schreyer 等[9]采用高纯度的高铁酸盐样品和定量分析方法,考查了高铁酸盐在水溶液中的稳定性及其影响因素,结果认为高铁酸盐的初始浓度对高铁酸根离子的分解有明显影响.当K 2Fe O 4的浓度小于0.025mol/L 时,1h 分解了11%,当Fe O 42-的浓度大于0.03mol/L 时,同样时间内,高铁几乎全部分解.0.01mol/L 的高铁溶液在2.5h 内分解了79.5%,而0.00191mol/L 的高铁溶液在3.8h 内分解了37.4%.因此,高铁溶液的浓度越低越稳定.王立立等[10]研究证实当Fe O 42-的浓度大于0.03mol/L 时,高铁迅速分解,在10m in 内达最大值;当Fe O 42-的浓度小于0.03mol/L 时,高铁在前60m in 内分解缓慢,达某一临界点后,突然加快分解速度.根据高铁酸盐的这一性质,在存放高铁酸盐时,其溶液浓度不能大.1.2 Fe 3+的影响王立立等[10]认为Fe 3+对Fe O 42-有明显的催化作用,Fe 3+的量越多,催化作用越明显,但一定量的Fe 3+在加入后的初始阶段发生激烈反应,然后Fe O 42-分解趋于平缓.Fe 3+对Fe O 42-的催化属于自催化作用,生成产物应该是铁的中间价态.贾汉东等[11]发现Fe (OH )3的存在对Fe O 42-有明显的催化作用且其量越大催化作用越剧烈.除尽Fe (OH )3的Fe O 42-稀溶液,在碱性介质中,即使50℃的高温也分解很少,这说明Fe (OH )3是造成Fe O 42-不稳定的首要因素.针对此,在贮备高铁溶液时应尽可能的除尽Fe (OH )3,以延长其存放时间.1.3 pH 值的影响W agner[12]认为温度和碱度是影响高铁酸盐溶液稳定性的主要因素,碱的浓度越大,高铁的稳定第3期高玉梅,等:高铁酸盐的稳定性研究进展性越强.过量的高铁酸钾保存在足够浓度的K OH溶液中,可以稳定存在很多年[13].Ernst,Teresa等[14]考查了pH对高铁酸盐分解的影响,在303K,pH=5.8~7时,高铁酸钾的分解速率方程为:d[Fe(Ⅲ)]/dt=k[Fe O42-]2,pH值为5.8、6.5、7的反应速率常数分别为8.94×103、5.16×103、1.5×103.pH=8时,分解速率方程为d[Fe(Ⅲ)]/dt=k[Fe O42-]2/[OH-],并指出高铁酸盐可能具有如下分解机理:Fe O42-+Fe O42-[Fe O4Fe O4]4-(1)[Fe O4Fe O4]4-2Fe O2-+O2-+3O(2)O2-+H2O2OH-(3)Fe O2-+H2O Fe(O)(OH)+OH-(4)2O O2(5)溶液pH值升高,Fe O42-的稳定性增强.pH=7时,8h后分解了51%,pH=8时,10h后分解了28.6%.稀溶液中,Fe O42-在pH=9.4~9.7时较稳定.宋亚瑞等[15]通过对高铁酸钾溶液分别在pH=6、7、9.5、11.5时的分析得到,高铁在碱性和强碱性介质中的稳定性高,在中性和酸性介质中的稳定性差.高铁酸盐溶液在pH﹥10时分解很少,所以高铁酸盐适宜制成高碱度的稀溶液存放.1.4 溶液中其他物质对高铁酸盐稳定性的影响Ettel V等[16]提出在浓碱液中,高铁酸盐的分解受痕量浓度的N i2+,Co2+的催化加速.Stuart[17]认为,Fe、N i、Co、Mo、Hg、V、Cr、Ru、Pt、Rh、O s、Ir、Pd等金属的高价离子及还原性杂质能促进高铁酸钾的分解.朱启安[18]的研究也证实了N i2+,Co2+对高铁溶液的稳定不利.贾汉东等[19]研究发现Cl O-对Fe O42-溶液具有稳定作用,而且Cl O-浓度越高,Fe O42-溶液越稳定.贾汉东还系统研究了阴、阳离子对高铁稳定性的影响发现:I O4-、Si O32-、L i+、Ti4+等对高铁溶液有稳定作用;I O3-、Cl O4-、Sn2+、Ba2+等对稳定高铁溶液有破坏作用[20].他还认为,Fe3+、Mn O2、Pb O2以及活性炭会加速高铁酸盐的分解; Zn2+和石墨使高铁酸盐溶液稳定[21].I-、P O43-等有利于高铁的稳定[22].张铁凯等[23]的研究证实了P O43-、I-对高铁的稳定作用.张彦平等[24]认为K+对高铁的稳定有促进作用.在硝酸铁投加量为85g/L时,采用4.4mol/L K OH制备的高铁溶液浓度为0.05mol/L;加入2mol/L KCl后,高铁溶液制备浓度增加到0.15mol/L.以上研究说明,要使高铁酸盐稳定,应避免Fe、N i、Co、Mo、Hg、V、Cr、Ru、Pt、Rh、O s、Ir、Pd等金属的高价离子及还原性杂质,而可以引入I O4-、Si O32-、L i+、Ti4+等离子.1.5 存放环境的影响温度也会影响高铁的分解,低温有利高铁的稳定.对于0.01mol/L Fe O42-溶液,25℃时2h分解了10%,而0.5℃时几乎没变化,0.5℃以下,高铁稳定存在的时间较长[25].光照条件和存放容器对高铁酸盐稳定性有明显影响.高玉梅等[26]通过在不同的光照条件下和在不同材质的容器中存放高铁酸盐溶液得出,紫外光对高铁酸盐有加速分解的作用,红外光没有明显的影响,可见光则居中.通过高铁酸盐溶液在玻璃瓶、玻璃瓶避光、聚乙烯塑料瓶、聚乙烯塑料瓶避光和聚酯塑料瓶中的存放稳定性研究,发现聚乙烯塑料瓶避光存放的高铁酸盐的稳定性最好,聚酯塑料瓶存放的分解最快,玻璃瓶避光存放仅次于聚乙烯塑料瓶避光存放.显然,高铁酸盐溶液在聚乙烯塑料瓶中避光存放,对其稳定有利.2 提高高铁酸盐稳定性的措施2.1 在制备过程中加入稳定剂朱启安等[18]在制备高铁酸钾中添加Na3P O4、Na3H2I O6、CuCl2・2H2O、Na2Si O3・9H2O等稳定剂,特别是同时添加CuCl2・2H2O、Na2Si O3・9H2O和Na3H2I O6等稳定剂,高铁酸钾的产率约从73%提高到88%;固态高铁酸钾在烧杯中经18d敞开放置,分解率由46%降低到5%;在温度为80℃、pH= 11的碱性溶液中,高铁酸钾完全分解的时间从8h 增加到16h.在制备过程中加入稳定剂,方法简单,容易操作,但缺点是在后续的处理过程中,需用有机溶剂,对环境造成污染.把高铁制成复合盐的应用值得进一步研究探讨.2.2 对初级产品进行稳定处理贾汉东等[27]在粘土中加入稳定剂、固强剂,压片成型,高温活化处理后,在碱性介质中用高铁酸钾浸泡至饱和,静止晾干,制得粘土负载高铁缓释剂.结果表明,粘土负载的Fe O42-可在水中缓慢溶出,浸出液的稳定性高.陈一萍[28]采用饱和水溶液法,以β2环糊精为包合材料,制成了复合高铁酸盐・91・河南工程学院学报(自然科学版)2009年包合物.筛选出最佳包合工艺,得到的复合高铁酸盐在一定时间内能缓慢释放.对包合物进行理化鉴别,分析复合高铁酸盐在应用β2环糊精包合前后的成分变化和包合效果.结果表明,改性后的复合高铁酸盐具有较高的高铁酸盐溶出浓度与持续时间,具有较好的稳定性.刘永春[29]在活性白土中加入20%高岭土作催化剂,30%活性炭为扩孔剂,通入空气1000℃条件下煅烧3h,制得多孔吸附剂,放入高铁溶液中24h,抽虑,干燥.该产品中的高铁30d 后仅分解了17.5%,未经处理的高铁6d分解了59.1%.张彦平等[30]在65℃的K OH介质中制备出复合高铁酸盐溶液,然后向复合高铁酸盐溶液中掺杂K2S2O8、KI、NaCl O3和NaSi O3,对高铁的稳定有一定的促进作用.苑宝玲等[31]采用缓(控)释放技术,利用硅藻土、氧化铝、分子筛三种吸附剂来负载高铁酸盐,制成了负载型高铁酸盐缓释剂.结果表明,负载型高铁酸盐缓释剂具有较高的高铁溶出浓度与持续时间.毛海荣等[32]通过在复合高铁酸盐溶液中添加稳定助剂A,有效抑制复合高铁酸盐在水溶液中的分解速率,延长其储存周期,改善了其稳定性能;高铁在水溶液中的分解速率随助剂A加入量的增加而降低.兰春华等[33]以切片石蜡为包覆壁材,高铁酸钾为包覆芯材,采用熔化悬浮冷凝法制备了包覆型高铁酸钾,并研究了它的缓释和稳定性能.研究表明,包覆的最佳工艺条件为水浴温度80℃左右,转速800转/m in、超声时间15m in,并且包覆过程中包覆壁材不会与高铁酸钾作用而破坏高铁酸钾的活性.通过向高铁溶液中加入稳定剂或制成负载型的高铁酸盐是稳定存放高铁酸盐的有效途径.对初级产品进行稳定处理制备负载型或复合型高铁酸盐的优点是处理后制成固体,运输方便且易于存放,高铁缓释体系在一定时间内缓慢释放氧化作用,可满足缓释消毒的要求.3 展望近几年,高铁酸盐作为净水剂的优越性能受到越来越多人的关注.但是迄今高铁酸盐没有市场产品,其主要原因是液体的高铁酸盐不稳定,而固体的高铁酸盐制备工艺繁琐、需控制在较低温度下缓慢反应,尤其是高铁的收率较低,致使其价格昂贵.今后应着重对优化制备工艺流程,减少制备步骤进行研究,可以考虑在初级的高铁酸盐(不经后续的纯化处理)中加入干燥剂,然后添加稳定剂制成固体的复合高铁酸盐或者压制成片剂.这样不但简化了制备工艺,避免了有机溶剂的污染,而且运输方便,为以后的工业化应用奠定基础.参考文献:[1] FROUZ ABAD I H,MOHAJER D,E NTEZ AR I M.Silverferrate Ag2Fe O4,an efficient selective oxidizing agent f orthe oxidati on of benzylic and allyic alcohols t o their corre2s ponding carbonyl co mpounds in ap r otic organic s olvents[J].Synthetic Co mmunicati ons,1986,16(2):211-223.[2] M I CHAE L D,JOHNS ON,JOHN F,et al.Kinetics andmechanis m of the ferrate oxidati on of thi osulfate and othersulfur-containing s pecies[J].I norg.Che m,1996,(35):6795-6799.[3] MA J,L I U W.Effectiveness and mechanis m of potassiu mferrate(Ⅵ)p reoxidati on for algae re moval coagulati on[J].W ater Research,2002,36(4):871-878.[4] MURSHE D M,ROCKSTRAW D A,HANS ON A T,et al.Rap id oxidati on of sulfide m ine tailings by reacti on withpotassiu m ferrate[J].Envir on mental Polluti on,2003,125(2):245-253.[5] 宋 华,王宝辉,张娇静.用绿色氧化剂高铁酸钾相转移催化氧化苯甲醇[J].化学通报,2006,7(3):220-223.[6] P OTTS M,CHURCHW E LL D.R.Re moval of radi onu2clides in waste waters utilizing potassiu m ferrate(V I)[J].Water Envir o mental Research,1994,66(2):107-109.[7] 曲久辉,王立立,田宝珍,等.高铁酸盐氧化絮凝去除饮用水中氨氮的研究[J].环境科学学报,2000,20(3):280-283.[8] L I CHT S,WANG B H,GHOSH S.Energetic ir on(Ⅵ)che m istry[J].The Super-Ir on Battery.Science,1999,285(13):1039-1042.[9] SCHERYER J M,OXK W ER MAN L T.Stability of the fer2rate(V I)i on in aqueous s oluti on[J].Anal Che m,1951(23):1312-1314.[10]王立立,曲久辉,王忠秋,等.高铁稳定性及其影响因素的研究[J].东北电力学院学报,1999,19(1):6-9.[11]贾汉东,马 宁,孙红宾,等.Fe O42-离子在水溶液中稳定性的研究[J].郑州大学学报,1999,31(1):67-69.[12]WAG NER W F,G UMP K R,HART E N.Fact ors affect2ing the stability of aqueous potassiu m ferrate(Ⅵ)s olu2・2・第3期高玉梅,等:高铁酸盐的稳定性研究进展ti ons [J ].Anal Che m,1952(24):1497-1498.[13]罗志勇.高铁酸钾的合成及其处理含酚废水的研究[D ].重庆:重庆大学,2003.[14]ERNST,TERES A,WAWRZE NCZYK T,et al .Effect ofpH on the kinetics of ferrate (Ⅵ)decompositi on [J ].Bull .Acad .Poc.Sci .Ser .Sci .Chi m ,1979,27(10):773-778.[15]宋亚瑞.高铁酸钾稳定性的研究及其氧化甲苯制苯甲醛的研究[D ].大庆:大庆石油大学,2005.[16]ETTE L V,VEPREK -SI SK A J.Reacti ons of very puresubstances V.decompositi on of ferrates in alkaline s olu 2ti ons [J ].Collect .Czech .Che mun .,1969,344(12):2182-2188.[17]ST UART L,BAOHU I W ,S US ANT A G .Energetic ir on(Ⅵ)Chem istry the super -ir on battery [J ].Science,1995(285):5430-5439.[18]朱启安,王树峰,黄伯清.提高高铁酸钾产率和稳定性的方法[J ].精细化工,2006,23(6):593-596.[19]贾汉东,鲍改玲,孙红宾.次氯酸根对高铁酸盐溶液的稳定作用[J ].无机盐工业,2002,34(5):4-5.[20]贾汉东,卫世乾,鲍改玲,等.加入阴、阳离子对高铁酸盐溶液稳定性的影响[J ].郑州大学学报(理学版),2006,38(1):101-104.[21]贾汉东,鲍改玲.过渡金属离子对高铁酸盐溶液稳定性的影响[J ].电池,2004,34(6):430-431.[22]DE I N I N GER J,P AUL.Pr ocess f or p reparing potassiu mferrate [P ].US 4405573,1983-09-11.[23]张铁凯,王宝辉,吴红军,等.卤化钾对碱液中高铁酸钾的稳定性研究[J ].无机盐工业,2005,37(3):11-13.[24]张彦平,许国仁,李圭白,等.K ~+对Fe (Ⅵ)生成的稳定促进作用和机理研究[J ].环境科学,2008,29(3):677-682.[25]WAG NER W F,G UMP K R,Hart E N.Fact ors affectingthe stability of aqueous potassiu m ferrate (Ⅵ)s oluti ons [J ].Anal .Che m.,1952(24):1497-1498.[26]高玉梅,贾汉东.光照对高铁酸盐溶液稳定性的影响[J ].应用化学,2004,21(4):425-427[27]贾汉东,申小清,马 宁,等.粘土负载高铁酸钾缓释剂的水溶出特性[J ].水处理技术,2000,26(2):98-101.[28]陈一萍.水处理剂高铁酸盐的改性研究[J ].无机盐工业,2008,40(6):19-22.[29]刘永春.新型高效水处理剂—Na 2Fe O 4的电合成及应用研究[D ].成都:四川大学,2002.[30]张彦平,许国仁,程恒卫,等.掺杂对复合高铁酸盐溶液稳定性的影响[J ].哈尔滨工业大学学报,2008,40(2):217-219.[31]苑宝玲,施肖亮,汤 新,等.负载型高铁酸盐缓释剂的缓释效果研究[J ].高技术通讯,2005,26(12):312-316.[32]毛海荣,刘一真.复合高铁酸盐在水溶液中稳定性的研究[J ].光谱学与光谱分析,2003,23(6):1206-1209.[33]兰春华.包覆型高铁酸钾的制备与应用[D ].福州:福州大学,2006.Prospects and Curren t Stud i es on the St ab ility of a Green Pur i fy i n g Agen t 2Ferra teG AO Yumei,D ING Xiaohui(D epart m ent of M a terial and Che m ica l Eng ineering,Henan Institute of Engineering,Zhengzhou 450007,Ch ina )Abstract:The ferrate is a green purifying agent .I n this paper,the affecting fact ors and the i m p r oving methods of the stability of ferratewere evaluated .The main fact ors of affecting stability of ferrate are:the concentrati on of ferrate,Fe3+,pH value,s oluti onof i m purities and st orage envir on ment .The st orage ti m e of ferrate was extended by adding stabilizers or p repared int o the supported ferrate .I n the future,op ti m izati on of the p reparati on p r ocess and reducti on of the p reparati on step s should be fur 2ther studied .Key words:ferrate;purifying agent;stability・12・。
工业上高铁酸盐的制备方程式

工业上高铁酸盐的制备方程式
高铁酸盐是一种重要的化学物质,它在工业上有着广泛的应用。
它的制备方程式是:
Fe2O3 + 3H2SO4 → 2Fe2(SO4)3 + 3H2O。
高铁酸盐是一种重要的化学物质,它是由二价铁氧化物和三价硫酸盐组成的复合物,其分子式为Fe2(SO4)3。
它在工业上有着广泛的应用,如用于制造染料、涂料、纸张、玻璃、陶瓷、橡胶、塑料等。
高铁酸盐的制备方程式是:Fe2O3 + 3H2SO4 → 2Fe2(SO4)3 + 3H2O。
在这个反应中,二价铁氧化物和三价硫酸盐发生反应,生成了高铁酸盐和水。
高铁酸盐的制备过程主要包括以下几个步骤:
1.首先,将二价铁氧化物和三价硫酸盐混合在一起,搅拌均匀,使其完全混合。
2.然后,将混合物加入反应釜中,加热至反应温度,使其发生反应。
3.最后,将反应液冷却,过滤,收集沉淀,即可得到高铁酸盐。
高铁酸盐的制备过程需要控制反应温度,以保证反应的顺利进行。
反应温度一般在150-200℃之间,过高或过低都会影响反应的效率。
此外,反应时间也需要控制,一般在1-2小时之内。
高铁酸盐的制备过程中,还需要注意安全措施。
由于反应温度较高,因此应当采取必要的防护措施,以防止反应过程中发生意外。
高铁酸盐的制备方程式是Fe2O3 + 3H2SO4 → 2Fe2(SO4)3 + 3H2O,它在工业上有着广泛的应用。
它的制备过程需要控制反应温度和反应时间,并采取必要的安全措施,以确保反应的顺利进行。
高铁酸盐在水中具有多种功能的绿色氧化剂

ECOLOGY区域治理高铁酸盐:在水中具有多种功能的绿色氧化剂*沈阳航空航天大学能源与环境学院 田禹,于航摘要:工业化和城市化的快速发展使我国经济实力迅猛提升,但是随之也出现了许多问题,环境问题就是其中最为严重的一个,各种污染物被排放到环境中,对人类的健康造成了很大的威胁[1]。
高铁酸盐作为一种具有氧化、消毒和吸附混凝等多功能的绿色水处理剂,在环境修复中具有广阔应用前景。
本文主要介绍了高铁酸盐的水处理技术研究进展,以及高铁酸盐的氧化新兴有机污染物的优势,并对未来的研究方向进行了展望。
关键词:高铁酸盐;多功能;研究方向中图分类号:V312+.2 文献标识码:A 文章编号:2096-4595(2020)39-0126-0001目前,氧化法是解决污染的主要方法。
高铁酸盐作为一种新兴的氧化剂,同时具备氧化、吸附、混凝、消毒以及提高污泥脱水率等多种功能,既可以用于预氧化阶段,又可以用于混凝处理阶段,同时还能够去除水体中存在的天然有机物(NOM)以及无机物[2]。
高铁酸盐包括Fe(VI)、Fe(V)、Fe(IV),Fe(VI)高铁酸盐极易溶于水,在水中一旦获得电子,就会被还原成中等价态而且更具活性的Fe(Ⅴ)和Fe(Ⅳ)的高铁酸盐物种,并最终形成Fe(Ⅲ)物种。
水溶液中的Fe(Ⅲ)主要以(FeOH)3形态存在,是一种絮凝剂,不但可以吸附有机污染物絮凝沉积从而增加有机污染物的去除效果,还可以吸附水体中的微生物、胶体颗粒和重金属,以达到净水效果[3]。
Fe(VI)对水源的处理已经显示出超过99.9%的总大肠杆菌的灭活率,结果表明,Fe(VI)可以在较宽pH范围内以低剂量或在短接触时间内就可导致大肠杆菌DNA聚合酶的氧化,进而产生不可逆的灭活性[3]。
高铁酸盐与臭氧不同,高铁酸盐不与溴离子反应,不易形成致癌的溴酸根离子[4]。
斑马鱼胚胎死亡试验表明,高铁酸盐的氧化产物并不会对水体造成二次污染。
高铁酸盐可以快速杀灭大肠杆菌,并可以有效破坏污泥结构,提高污泥脱水性能[5]。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高铁酸盐在能源、环保等方面有着广泛的用途。
湿法、干法制备高铁酸盐的原理如下表所示。
(1)工业上用湿法制备高铁酸钾(K 2 FeO 4)的流程如下图所示:
①反应I的化学方程式为。
②反应II的离子方程式为。
③加入饱和KOH溶液的目的是。
(2)高铁酸钾是一种理想的水处理剂,其处理水的原理
为,__________。
(3)干法制备K 2 FeO 4的反应中,氧化剂与还原剂的物质的量之比为。
(4)高铁电池是正在研制中的可充电干电池,上图为该电池和常用的高
能碱性电池的放电曲线,由此可得出的高铁电池的优点有、。
(1)①2NaOH + C l 2=NaCl + NaClO + H 2 O(2分)
②3ClO- + 10OH- + 2Fe 3+=2FeO 42- + 3Cl- + 5H 2 O(2分)
③增大K + 浓度,促进K 2 FeO 4晶体析出(2分)
(2)高铁酸钾有强氧化性,能杀菌消毒产生的Fe(OH) 3有吸附性,有絮凝作用(2分)(3)3∶1(2分)(4)放电时间长工作电压稳定(2分)
下图是无机物A~M在一定条件下的转化关系(部分产物及反应条件未列出)。
其中,I是由第三周期元素组成的单质中熔点最高的金属,K是一种红棕色气体。
提示:4FeS
+11O 2高温,2Fe 2 O 3+8SO 2
2
请填写下列空白:
(1)在周期表中,组成单质G的元素位于第________周期________族。
(2)在反应⑦中氧化剂与还原剂的物质的量之比为________。
(3)在②、③、⑥、⑨中既属于化合反应又属于非氧化还原反应的是________(填序号)。
(4)反应④的离子方程式是_____________________________________。
、KOH共熔,可制得一种“绿色”环保高效净水剂K 2 FeO 4(高铁(5)将化合物D与KNO
3
酸钾),同时还生成KNO
和H 2 O。
该反应的化学方程式是________________________。
2
(1)四Ⅷ
(2)1∶2
(3)③
(4)3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O
(5)Fe2O3+3KNO3+4KOH=2K2FeO4+3KNO2+2H2O。
