非无菌产品微生物限度检查:微生物计数法(15版中国药典公示稿)
2015版中国药典微生物限度记录

培养基的配制
使用容器
配制培养基使用的容器应该是玻璃器皿或搪瓷器皿等。 禁用金属容器如:铁、铜、铝容器。
培养基制备方法
实验室指南
溶解培养基应当用水浴加热进行溶解。 测定pH值 矫正pH,配制培养基必须矫正pH,并进行验证。 培养基灭菌后冷却至室温( 25 ℃)进行 pH 测试。培 养基pH范围不得超过规定的正负0.2。 <高压灭菌前的pH值应比最终pH值高0.2左右>
2015版药典微生物检查法修订内容——结果判断 微生物计数法和控制菌检查法结果判断
不再规定复试,通过实验室调查、回顾、分析结果 的准确性。
限度标准以指数方式表示:
10的一次方cfu:可接受的最大限度为20;
10 的二次方 cfu ,可接受的最大限度为 200 ;以此类 推。
2015版药典通则非无菌产品微生物限度标准增订内容
4.微生物限度标准
5.控制菌检查:保留部分生化试验 6. 修订后,控制指标更合理,计数方法及标准合理、 准确,反映真实污染情况
2015版药典微生物检查法修订内容——环境要求
目前我国药品微生物检测对环境的要求与国际标准 分级不一致。 国际要求:只要洁净环境分为 A 级、 B 级、 C 级、 D 级。 A (百级)、 B (千级)、 C (万级)、 D (十万级)。 协调案要求:试验在经过设计的可避免外来微生物 污染供试品的环境下进行。 我国修订后药品微生物限度检查对检测环境的要求: 无菌环境下符合微生物技术检验要求,单向流空气 区域内进行。
(二)2015版药典微生物检查法修订内容——环境要求
1. 强调了“微生物实验的各项工作应在专属的区域 进行,以降低交叉污染、假阳性结果和假阴性结 果的风险”。 2.无菌检查 修订前 万级(C级)下局部百级(A)或隔离器 修订后 B+A级或建议D级背景下隔离器 3.微生物限度检查 修订前 万级(C)下局部百级(A) 修订后 不低于D级背景下的B级单向流空气区域内 进行。
(2015年版药典)非无菌药品微生物限度检查操作规程
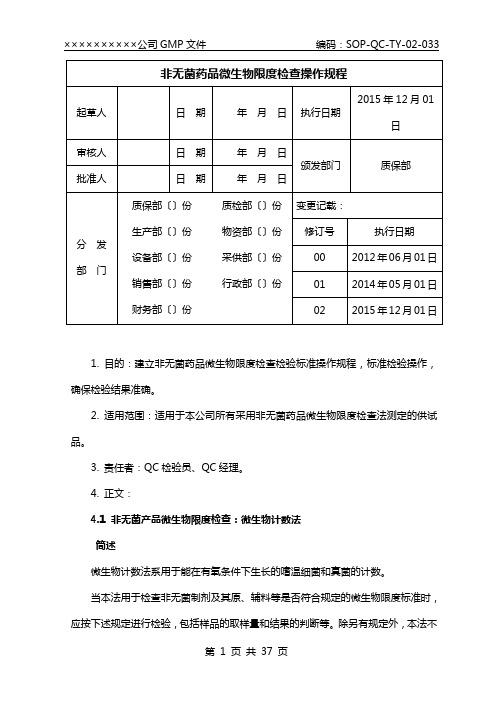
1. 目的:建立非无菌药品微生物限度检查检验标准操作规程,标准检验操作,确保检验结果准确。
2. 适用范围:适用于本公司所有采用非无菌药品微生物限度检查法测定的供试品。
3. 责任者:QC检验员、QC经理。
4. 正文:4.1 非无菌产品微生物限度检查:微生物计数法简述微生物计数法系用于能在有氧条件下生长的嗜温细菌和真菌的计数。
当本法用于检查非无菌制剂及其原、辅料等是否符合规定的微生物限度标准时,应按下述规定进行检验,包括样品的取样量和结果的判断等。
除另有规定外,本法不适用于活菌制剂的检查。
本检查法可采用替代的微生物检查法,包括自动检测方法,但必须证明替代方法等效于药典规定的检查方法。
微生物计数试验应在受控洁净环境下的局部洁净度不低于B 级的单向流空气区域内进行。
检验全过程必须严格遵守无菌操作,防止再污染,防止污染的措施不得影响供试品中微生物的检出。
单向流空气区域、工作台面及环境应定期进行监测。
如供试品有抗菌活性,应尽可能去除或中和。
供试品检查时, 假设使用了中和剂或灭活剂,应确认其有效性及对微生物无毒性。
供试液制备时如果使用了外表活性剂,应确认其对微生物无毒性以及与所使用中和剂或灭活剂的相容性。
计数方法计数方法包括平皿法、薄膜过滤法和最可能数法〔Most-Probable-NumberMethod,简称MPN 法〕。
MPN 法用于微生物计数时精确度较差,但对于某些微生物污染量很小的供试品,MPN 法可能是更适合的方法。
供试品检查时, 应根据供试品理化特性和微生物限度标准等因素选择计数方法,所选的方法必须具备检测充足样品量的能力,以保证所获得的试验结果能够判断供试品是否符合规定。
所选方法的适用性须经确认。
计数培养基适用性检查和供试品计数方法适用性试验供试品微生物计数中所使用的培养基应进行适用性检查。
供试品的微生物计数方法应进行方法适用性试验,以确认所采用的方法适合于该产品的微生物计数。
假设检验程序或产品发生变化可能影响检验结果时,计数方法应重新进行适用性试验。
2015年版微生物限度检验操作规程

青岛**有限公司文件
目的建立微生物限度检查操作规程,规范操作,保证结果的准确性。
范围成品、辅料、内包装袋及纯化水的检验。
责任品管部微生物限度检验人员内容
概述:本检验操作规程依据中国药典2015年版四部《通则1105 非无菌产品微生物限度检查:微生物计数法》和《通则1106 非无菌产品微生物限度检查:控制菌检查法》进行检查。
微生物计数法
一、计数方法
1.微生物计数法系用于能在有氧条件下生长的嗜温细菌和真菌的计数。
2、计数方法本法包括平皿法、薄膜过滤法。
3、计数培养基适用性检查和供试品计数方法适用性检查供试品微生物计数中所使用的培养基应进行适用性检查。
供试品的微生物计数方法应进行方法适用性试验,以确定采用的方法适合于该产品的微生物计数。
4、菌种及菌液的制备
4.1试验用菌株的传代次数不得超过5代(从菌种保藏中心获得的干燥菌种为第0袋),并采用适宜的菌种保藏技术进行保藏。
计数培养基适用性检查和计数方法适用性试验见表1。
4.2菌液制备按表1规定培养各试验菌株。
取金黄色葡萄球菌、铜绿假单胞菌、枯草芽孢杆菌、白色念珠菌的新鲜培养物,用PH7.0无菌氯化钠-蛋白胨缓冲液或0.9%无菌氯化钠溶液制成适宜浓度的菌悬液;取黑曲霉的新鲜培养物加入3-5ml含0.05%(ml/ml)聚山梨酯80的PH7.0无菌氯化钠-蛋白胨缓冲液或0.9%无菌氯化钠溶液,将孢子洗脱。
采用适宜的方法吸出孢子悬液至无菌试管中,用含0.05%(ml/ml)聚山梨酯80的PH7.0无菌氯化钠-蛋白胨缓冲液或0.9%无菌氯化钠溶液制成适宜浓度的黑曲霉孢
微生物限度检验操作规程(SOP-ZL65-2)第1 页共 17 页。
2015版中国药典微生物限度解析

(MPN法) 1.3 计数培养基适用性检查和供试品计数方法适用
性试验:菌种及菌液制备、培养基适用性检查 、计数方法适用性试验。 1.4 供试品检查:检验量、供试品检查 1.5 结果判断 1.6 稀释液、冲洗液及培养基
1.1 总则:
• 微生物计数法系用于能在有氧条件下生长的嗜温 细菌和真菌的计数。
• 当本法用于检查非无菌制剂及其原、辅料等是否 符合规定的微生物限度标准时,应按规定进行检 验,包括样品的取样量和结果的判断等。除另有 规定外,本法不适用于活菌制剂的检查。
30~35 ℃ 不超过3天
20~25 ℃ 不超过5天
每一试验菌株平行制备2 管或2 个平皿;接种量50~100cfu ; 同时,用相应的对照培养基替代被检培养基进行上述试验。 结果判定:
若被检培养基上的菌落平均数不小于对照培养基上的菌落 平均数的70 %,且菌落形态大小与对照培养基上的菌 落一致,判该培养基的适用性检查符合规定。
1.3 计数培养基适用性检查和供试品计 数方法适用性试验
• 供试品微生物计数中所使用的培养基应进 行适用性检查。
• 供试品的微生物计数方法应进行方法适用 性试验【10版:方法验证】, 以确认所 采用的方法适合于该产品的微生物计数。
• 若检验程序或产品发生变化可能影响检验 结果时, 计数方法应重新进行适用性试 验。
1.3.3计数方法适用性试验
1. 供试液制备 2. 接种和稀释 3. 抗菌活性的去除与灭活 4. 供试品中微生物的回收
– 平皿法 – 薄膜过滤法 – 最可能数法(MPN 法)
5. 结果判断
1.4 供试品检查
• 1.4.1检验量
– 检验量即一次试验所用的供试品量(g、ml
2015年药典 通则1106 非无菌产品微生物限度检查

通则1106 非无菌产品微生物限度检查:控制菌检查法控制菌检查法系用于在规定的试验条件下,检查供试品中是否存在特定的微生物。
当本法用于检查非无菌制剂及其原、辅料等是否符合相应的微生物限度标准时,应按下列规定进行检验,包括样品取样量和结果判断等。
供试品检出控制菌或其他致病菌时,按一次检出结果为准,不再复试。
供试液制备及实验环境要求同“非无菌产品微生物限度检查:微生物计数法”。
如果供试品具有抗菌活性,应尽可能去除或中和。
供试品检查时, 若使用了中和剂或灭活剂,应确认有效性及对微生物无毒性。
供试液制备时如果使用了表面活性剂,应确认其对微生物无毒性以及与所使用中和剂或灭活剂的相容性。
培养基适用性检查和控制菌检查方法适用性试验供试品控制菌检查中所使用的培养基应进行适用性检查。
供试品的控制菌检查方法应进行方法适用性试验,以确认所采用的方法适合于该产品的控制菌检查。
若检验程序或产品发生变化可能影响检验结果时,控制菌检查方法应重新进行适用性试验。
菌种及菌液制备菌种试验用菌株的传代次数不得超过5 代(从菌种保藏中心获得的干燥菌种为第0 代),并采用适宜的菌种保藏技术进行保存,以保证试验菌株的生物学特性。
金黄色葡萄球菌(Staphylococcus aureus)〔CMCC(B)26 003〕铜绿假单胞菌(Pseudomonas aeruginosa)〔CMCC(B)10 104〕大肠埃希菌(Escherichia coli)〔CMCC(B)44 102〕乙型副伤寒沙门菌(Salmonella paratyphi B)〔CMCC(B)50 094〕白色念珠菌(Candida albicans)〔CMCC(F)98 001〕生孢梭菌(Clostridium sporogenes)〔CMCC(B)64 941〕菌液制备将金黄色葡萄球菌、铜绿假单胞菌、大肠埃希菌、沙门菌分别接种于胰酪大豆胨液体培养基中或在胰酪大豆胨琼脂培养基上,30~35℃培养18~。
752015年药典 通则1105 非无菌产品微生物限度检查

752015年药典通则1105 非无菌产品微生物限度检查通则1105非无菌产品微生物限度检查:微生物计数;微生物计数法系用于能在有氧条件下生长的嗜温细菌和;微生物计数试验环境应符合微生物限度检查的要求;如供试品有抗菌活性,应尽可能去除或中和;供试液制备时如果使用了表面活性剂,应确认其对微生;计数方法;计数方法包括平皿法、薄膜过滤法和最可能数法(Mo;供试品检查时,应根据供试品理化特性和微生物限度标;计数培养基适用通则1105 非无菌产品微生物限度检查:微生物计数法微生物计数法系用于能在有氧条件下生长的嗜温细菌和真菌的计数。
当本法用于检查非无菌制剂及其原、辅料等是否符合规定的微生物限度标准时,应按下述规定进行检验,包括样品的取样量和结果的判断等。
除另有规定外,本法不适用于活菌制剂的检查。
微生物计数试验环境应符合微生物限度检查的要求。
检验全过程必须严格遵守无菌操作,防止再污染,防止污染的措施不得影响供试品中微生物的检出。
单向流空气区域、工作台面及环境应定期进行监测。
如供试品有抗菌活性,应尽可能去除或中和。
供试品检查时, 若使用了中和剂或灭活剂,应确认其有效性及对微生物无毒性。
供试液制备时如果使用了表面活性剂,应确认其对微生物无毒性以及与所使用中和剂或灭活剂的相容性。
计数方法计数方法包括平皿法、薄膜过滤法和最可能数法(Most-Probable-Number Method,简称MPN 法)。
MPN 法用于微生物计数时精确度较差,但对于某些微生物污染量很小的供试品,MPN 法可能是更适合的方法。
供试品检查时,应根据供试品理化特性和微生物限度标准等因素选择计数方法,检测的样品量应能保证所获得的试验结果能够判断供试品是否符合规定。
所选方法的适用性须经确认。
计数培养基适用性检查和供试品计数方法适用性试验供试品微生物计数中所使用的培养基应进行适用性检查。
供试品的微生物计数方法应进行方法适用性试验,以确认所采用的方法适合于该产品的微生物计数。
2015年版中国药典微生物限度检查技术方法意见稿
附录×××非无菌产品微生物限度检查:微生物计数法微生物计数法系用于能在有氧条件下生长的嗜温细菌和真菌的计数。
当本法用于检查非无菌制剂及其原、辅料等是否符合规定的微生物限度标准时,应按下述规定进行检验,包括样品的取样量和结果的判断等。
除另有规定外,本法不适用于活菌制剂的检查。
本检查法可采用替代的微生物检查法,包括自动检测方法,但必须证明替代方法等效于药典规定的检查方法。
微生物计数试验应在受控洁净环境环境洁净度10 000 级下的局部洁净度不低于B100 级的单向流空气区域内进行。
检验全过程必须严格遵守无菌操作,防止再污染,防止污染的措施不得影响供试品中微生物的检出。
单向流空气区域、工作台面及环境应定期按《医药工业洁净室(区)悬浮粒子、浮游菌和沉降菌的测试方法》的现行国家标准进行监测。
如供试品有抗菌活性,应尽可能去除或中和。
供试品检查时, 若使用了中和剂或灭活剂,应确认其有效性及对微生物无毒性。
供试液制备时如果使用了表面活性剂,应确认其对微生物无毒性以及与所使用中和剂或灭活剂的相容性。
计数方法计数方法包括平皿法、薄膜过滤法和最可能数法(Most-Probable-NumberMethod,简称MPN 法)。
MPN 法用于微生物计数时精确度较差,但对于某些微生物污染量很小的供试品,MPN 法可能是更适合的方法。
供试品检查时, 应根据供试品理化特性和微生物限度标准等因素选择计数方法,同时所选的方法的供试品用量必须具备检测充足样品量的能力,能够以保证所获得的试验结果能够判断供试品是否符合规定。
所选方法的适用性须经确认。
计数培养基适用性检查和计数方法适用性试验供试品微生物计数中所使用的培养基应进行适用性检查。
供试品的微生物计数方法应进行方法适用性试验,以确认所采用的方法适合于该产品的微生物计数。
若检验程序或产品发生变化可能影响检验结果时,计数方法应重新进行适用性试验。
表 1 试验菌液的制备和使用试验菌株试验菌液的制备计数培养基适用性检查计数方法适用性试验需氧菌总数计数霉菌和酵母菌总数计数需氧菌总数计数霉菌和酵母菌总数计数金黄色葡萄球菌〔CMCC(B)26 003)〕胰酪大豆胨琼脂或胰酪大豆胨肉汤,培养温度30 ~35℃,培养时间18~24小时胰酪大豆胨琼脂和胰酪大豆胨肉汤,培养温度30 ~35℃,培养时间不超过3 天,接种量不大于100cfu胰酪大豆胨琼脂/ 胰酪大豆胨肉汤(MPN 法),培养温度30~35℃,培养时间不超过 3 天,接种量不大于100cfu铜绿假单胞菌(Pseudomonas aeruginosa)〔CMCC(B)10 104〕胰酪大豆胨琼脂或胰酪大豆胨肉汤,培养温度30 ~35℃,培养时间18~24小时胰酪大豆胨琼脂和胰酪大豆胨肉35℃,培养时间不超过3 天,接种量不大于100cfu胰酪大豆胨琼脂/ 胰酪大豆胨肉汤(MPN 法),培养温度30~35℃,培养时间不超过 3 天,接种量不大于100cfu枯草芽孢杆菌(Bacillussubtilis)〔CMCC(B) 63 501〕胰酪大豆胨琼脂或胰酪大豆胨肉汤,培养温度30 ~胰酪大豆胨琼脂和胰酪大豆胨肉汤,培养温度30 ~胰酪大豆胨琼脂/ 胰酪大豆胨肉汤(MPN 法),培养温度注:当需用玫瑰红钠琼脂培养基测定霉菌和酵母菌总数时,应进行培养基灵敏度检查,检查方法同沙氏葡萄糖琼脂培养基。
中国药典2015版 四部 9202 非无菌产品微生物限度检查指导原则
为更好应用非无菌产品微生物限度检查:微生物计数法(通则1105)、非无菌产品微生物限度检查:控制菌检查法(通则1106)及非无菌药品微生物限度标准(通则110 7),特制定本指导原则。
非无菌药品中污染的某些微生物可能导致药物活性降低,甚至使药品丧失疗效,从而对患者健康造成潜在的危害。
因此,在药品生产、贮藏和流通各个环节中,药品生产企业应严格遵循GMP的指导原则,以降低产品受微生物污染程度。
非无菌产品微生物计数法、控制菌检查法及药品微生物限度标准可用于判断非无菌制剂及原料、辅料等是否符合药典的规定,也可用于指导制剂、原料、辅料等微生物质量标准的制定,及指导生产过程中间产品微生物质量的监控。
本指导原则将对微生物限度检查方法和标准中的特定内容及应用做进一步的说明。
1. 非无菌产品微生物限度检查过程中,如使用表面活性剂、灭活剂及中和剂,在确定其能否适用于所检样品及其用量时,除应证明该试剂对所检样品的处理有效外,还须确认该试剂不影响样品中可能污染的微生物的检出(即无毒性),因此无毒性确认试验的菌株不能仅局限于验证试验菌株,而应当包括产品中可能污染的微生物。
2. 供试液制备方法、抑菌成分的消除方法及需氧菌总数、霉菌和酵母菌总数计数方法应尽量选择微生物计数方法中操作简便、快速的方法,同时,所选用的方法应避免损伤供试品中污染的微生物。
对于抑菌作用较强的供试品,在供试品溶液性状允许的情况下,应尽量选用薄膜过滤法进行试验。
3. 对照培养基系指按培养基处方特别制备、质量优良的培养基,用于培养基适用性检查,以保证药品微生物检验用培养基的质量。
对照培养基由中国食品药品检定研究院研制及分发。
4. 进行微生物计数方法适用性试验时,若因没有适宜的方法消除供试品中的抑菌作用而导致微生物回收的失败,应采用能使微生物生长的更高稀释级供试液进行方法适用性试验。
此时更高稀释级供试液的确认要从低往高的稀释级进行,最高稀释级供试液的选择根据供试品应符合的微生物限度标准和菌数报告规则而确定,如供试品应符合的微生物限度标准是lg需氧菌总数不得过10 3 cfu,那么最高稀释级是1:10 3 。
《中国药典》2015年版微生物计数法实例
《中国药典》2015年版----微生物计数法实例
中国药典2015年版
1105 非无菌产品微生物限度检查:微生物计数法
• 计数培养基适用性检查 • 供试品计数方法适用性试验
1106 非无菌产品微生物限度检查:控制菌检查法
• 培养基适用性检查 • 控制菌检查方法适用性试验
1107 非无菌药品微生物限度标准
1:10 180 1800
1:100 15 1500
1:1000 3 3000
结果判断 • 101cfu:可接受的最大菌数为
20; • 102cfu:可接受的最大菌数为
200; • 103cfu:可接受的最大菌数为
2000,以此类推。
一个化学口服固体制剂,需 氧菌计数结果见表,报告菌 落数?符合规定,不符合规
计数
• 若同稀释级两个平皿的菌落数 平均值不小于15,则两个平皿 的菌落数不能相差1倍或以上。
• 需氧菌总数测定宜选取平均菌 落数小于300cfu的稀释级,霉 菌和酵母菌总数测定宜选取平 均菌落数小于100cfu的稀释级, 作为菌数报告的依据。取最高 的平均菌落数,计算1g、1mL、 10cm2供试品中所含的微生物 数,取两位有效数字报告。
水不溶性非油脂类供试品
• pH7.0无菌氯化钠-蛋白胨缓冲液,或pH7.2磷酸盐缓冲液,或TSB溶解或稀释成1:10供试液。分散力较差的 供试品可在稀释液中加入表面活性剂如0.1%的聚山梨酯80,使供试品分散均匀。必要时进一步稀释。
油脂类供试品
• 取供试品加入无菌十四烷酸异丙酯使溶解,或与最少量并能使供试品乳化的无菌聚山梨酯80或其他无抑菌 性的无菌表面活性剂充分混匀。必要时进一步稀释。
菌液 对照组
(菌)
• 取9.9mL稀释液代替供试品,按试验组操作加入试验菌液同试验组试验。
15版《中国药典》微生物学检验技术实施指导与修订解读
一、15版药典结构—总述
药典由原来的三部改为四部,预计15年7月颁布执行: 其中一部、二部、三部分别为中药、化药、生物药, 四部:中国药典2015版总则,主要包括:
凡例:主要增加对检测方法适用性、制剂通则、辅料 标准适用性等的要求
杨凌化药质量部QC周国娟 电话:15991721352 2015.04.21
目录
一、15版药典结构; 二、非无菌产品微生物检查; 2.1微生物计数法 2.2控制菌检查法 2.3微生物限度标准 三、微生物实验室质量控制内容; 3.1实验菌株的质量控制 3.2培养基的质量控制实验 3.3微生物鉴定技术 四、制药用水的检验及修订内容; 五、药品微生物实验室规范指导原则增修订的内容
2.1微生物计数法
定义:系指对能在有氧条件下生长的嗜温细菌和 真菌的计数,不适用于活菌制剂的检查。本法 适用于检查非无菌制剂及其原料、辅料等是否 符合规定的微生物限度标准。
2015版 1105非无菌产品微生物限度检查--微生物计数 法
2.1微生物计数法
1、试验环境
操
2、供试液制备
作
流
3、培养基配制
1、根据供试品的理化特性与生物学特性,来制备供 试液。常用的制备方法详见“通则1105非无菌产 品微生物限度检查--微生物计数法”中规定。其 中不同于10版药典就是缓冲液、某些样品量的规 定有所变化;
2、供试液的浓度,按照方法确认的结论进行确定;
3、供试液制备若需加温时,应均匀加热,且温度不 应超过45℃;
程
4、试验方法选择
5、培养计数及结果报告
2.1微生物计数法—试验环境
项目
检测 环境
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
胰酪大豆胨 琼脂培养基 和胰酪大豆 胨液体培养 基,培养温 度 30 ~ 35℃,培养 时间不超过 3 天,接种 量不大于 100cfu
胰酪大豆胨 琼脂培养基 / 胰酪大豆 胨液体培养 基 ( MPN 法),培养 温 度 30 ~ 35 ℃ , 培 养 时间不超过 3 天,接种量 不大于 100cfu
计数培养基适用性检查 计数方法适用性试验
试验菌株
试验菌液 的制备
需氧菌总数 计数
霉菌和酵 母菌总数
计数
需氧菌总数 计数
霉菌和酵 母菌总数
计数
金黄色葡萄球菌 (Staphylococcus
aureus) 〔CMCC(B)26 003)〕
胰酪大豆 胨琼脂培 养基或胰 酪大豆胨 液体培养 基,培养温 度 30 ~ 35℃,培养 时 间 18 ~ 24 小时
获得丰富
的孢子
注:当需用玫瑰红钠琼脂培养基测定霉菌和酵母菌总数时,应进行培养基适用性检查,
检查方法同沙氏葡萄糖琼脂培过 5 代(从菌种保藏中心获得的干燥菌
种为第 0 代),并采用适宜的菌种保藏技术进行保存,以保证试验菌株的生物学
特性。计数培养基适用性检查和计数方法适用性试验用菌株见表 1。
胰酪大豆胨 琼脂培养基 ( MPN 法 不 适用),培 养温度 30~ 35 ℃ , 培 养 时间不超过 5 天,接种量 不大于 100cfu
沙氏葡萄 糖琼脂培 养基,培养 温度 20~ 25℃,培养 时间不超 过 5 天,接 种量不大 于 100cfu
沙氏葡萄 胰酪大豆胨 沙 氏 葡 萄 胰酪大豆胨 沙氏葡萄
糖琼脂培 琼 脂 培 养 糖 琼 脂 培 琼脂培养基 糖琼脂培
黑曲霉
养基或马 基,培养温 养基,培养 ( MPN 法 不 养基,培养
(Aspergillusniger) 铃薯葡萄 度 30 ~ 温度 20~ 适用),培 温度 20~
〔CMCC(F) 98 003〕 糖琼脂培 35℃,培养 25℃,培养 养温度 30~ 25℃,培养
养基,培养 时间不超过 时 间 不 超 35℃,培养 时间不超
温度 20~ 5 天,接种 过 5 天,接 时间不超过 过 5 天,接
第三次公示稿
25℃,培养 量 不 大 于 种 量 不 大 5 天,接种量 种量不大
时间 5~7 100cfu
于 100cfu 不 大 于 于 100cfu
天,或直到
100cfu
计数方法 计数方法包括平皿法、薄膜过滤法和最可能数法(Most-Probable-Number Method,简称 MPN 法)。MPN 法用于微生物计数时精确度较差,但对于某些微 生物污染量很小的供试品,MPN 法可能是更适合的方法。 供试品检查时,应根据供试品理化特性和微生物限度标准等因素选择计数方 法,检测的样品量应能保证所获得的试验结果能够判断供试品是否符合规定。所 选方法的适用性须经确认。
胰酪大豆
胨琼脂培
养基或胰
铜绿假单胞菌
酪大豆胨
(Pseudomonas
液体培养
aeruginosa)〔CMCC(B) 基,培养温
10 104〕
度 30 ~
35℃,培养
时 间 18 ~
24 小时
胰酪大豆胨 琼脂培养基 和胰酪大豆 胨液体培养 基,培养温 度 30 ~ 35℃,培养 时间不超过 3 天,接种 量不大于 100cfu
胰酪大豆胨 琼脂培养基 / 胰酪大豆 胨液体培养 基 ( MPN 法),培养 温 度 30 ~ 35 ℃ , 培 养 时间不超过 3 天,接种量 不大于 100cfu
第三次公示稿
枯草芽孢杆菌 (Bacillus subtilis) 〔CMCC(B) 63 501〕
胰酪大豆 胨琼脂培 养基或胰 酪大豆胨 液体培养 基,培养温 度 30 ~ 35℃,培养 时 间 18 ~ 24 小时
计数培养基适用性检查和供试品计数方法适用性试验 供试品微生物计数中所使用的培养基应进行适用性检查。 供试品的微生物计数方法应进行方法适用性试验,以确认所采用的方法适合 于该产品的微生物计数。 若检验程序或产品发生变化可能影响检验结果时,计数方法应重新进行适用 性试验。
表 1 试验菌液的制备和使用
第三次公示稿
内,用含 0.05%聚山梨酯 80 的 pH7.0 无菌氯化钠-蛋白胨缓冲液或 0.9%无菌氯 化钠溶液制成适宜浓度的黑曲霉孢子悬液。
菌液制备后若在室温下放置,应在 2 小时内使用;若保存在 2~8℃,可在 24
小时内使用。黑曲霉孢子悬液可保存在 2~8℃,在验证过的贮存期内使用。
阴性对照
为确认试验条件是否符合要求,应进行阴性对照试验, 阴性对照试验应无
第三次公示稿
组菌落数减去供试品对照组菌落数的值小于菌液对照组菌落数值的 50%,可采用
下述方法消除供试品的抑菌活性。
⑴ 增加稀释液或培养基体积。
⑵加入适宜的中和剂或灭活剂。
中和剂或灭活剂(表 2)可用于消除干扰物的抑菌活性,最好在稀释液或培
养基灭菌前加入。若使用中和剂或灭活剂,试验中应设中和剂或灭活剂对照组,
白色念珠菌 (Candida albicans) 〔CMCC(F) 98 001〕
沙氏葡萄 糖琼脂培 养基或沙 氏葡萄糖 液体培养 基,培养温 度 20 ~ 25℃,培养 时间 2~3 天
胰酪大豆胨 琼脂培养 基,培养温 度 30 ~ 35℃,培养 时间不超过 5 天,接种 量不大于 100cfu
沙氏葡萄 糖琼脂培 养基,培养 温度 20~ 25℃,培养 时间不超 过 5 天,接 种量不大 于 100cfu
第三次公示稿
若需要,调节供试液 pH 值至 6~8。必要时,用同一稀释液将供试液进一步 10 倍系列稀释。
肠溶及结肠溶制剂供试品 取供试品,加入 pH6.8 无菌磷酸盐缓冲液(用于 肠溶制剂)或 pH7.6 无菌磷酸盐缓冲液(用于结肠溶制剂),置 45℃水浴中,振 摇,使溶解,制成 1∶10 的供试液。必要时,用同一稀释液将供试液进一步 10 倍 系列稀释。
气雾剂、喷雾剂供试品 取供试品,置-20℃或其它适宜温度冷冻约 1 小时, 取出,迅速消毒供试品开启部位,用无菌钢锥在该部位钻一小孔,放至室温,并 轻轻转动容器,使抛射剂缓缓全部释出。供试品亦可采用其它适宜的方法取出。 用无菌注射器从每一容器中吸出全部药液于无菌容器中混合,然后取样检查。
贴膏剂供试品 取供试品,去掉防粘层,将粘贴面朝上放置在无菌玻璃或塑料 器皿上,在粘贴面上覆盖一层适宜的无菌多孔材料(如无菌纱布),避免贴膏剂 粘贴在一起。将处理后的贴膏剂放入盛有适宜体积并含有表面活性剂(如聚山梨 脂 80 或卵磷脂)稀释液的容器中,振荡至少 30 分钟。必要时,用同一稀释液将 供试液进一步 10 倍系列稀释。
第三次公示稿
养基进行上述试验。 被检固体培养基上的菌落平均数与对照培养基上的菌落平均数的比值应在
0.5-2 范围内,且菌落形态大小应与对照培养基上的菌落一致;被检液体培养基 管与对照培养基管比较,试验菌应生长良好。
计数方法适用性试验 ⒈供试液制备 根据供试品的理化特性与生物学特性,采取适宜的方法制备供试液。供试液制备 若需加温时,应均匀加热,且温度不应超过 45℃。供试液从制备至加入检验用培 养基,不得超过 1 小时。 常用的供试液制备方法如下。如果下列供试液制备方法经确认均不适用,应 建立其他适宜的方法。 ⑴ 水溶性供试品 取供试品,用 pH7.0 无菌氯化钠-蛋白胨缓冲液,或 pH7.2 磷酸盐缓冲液,或胰酪大豆胨液体培养基溶解或稀释制成 1:10 供试液。 若需要,调节供试液 pH 值至 6~8。必要时,用同一稀释液将供试液进一步 10 倍系列稀释。水溶性液体制剂也可用混合的供试品原液作为供试液。 ⑵ 水不溶性非油脂类供试品 取供试品,用 pH7.0 无菌氯化钠-蛋白胨缓冲 液,或 pH7.2 磷酸盐缓冲液,或胰酪大豆胨液体培养基制备成 1:10 供试液。分 散力较差的供试品,可在稀释液中加入表面活性剂如 0.1%的聚山梨酯 80,使供 试品分散均匀。若需要,调节供试液 pH 值至 6~8。必要时,用同一稀释液将供 试液进一步 10 倍系列稀释。 ⑶油脂类供试品 取供试品,加入无菌十四烷酸异丙酯使溶解,或与最少量 并能使供试品乳化的无菌聚山梨酯 80 或其他无抑菌性的无菌表面活性剂充分混 匀。表面活性剂的温度一般不超过 40℃(特殊情况下,最多不超过 45℃),小 心混合,若需要可在水浴中进行,然后加入预热的稀释液使成 1∶10 供试液, 保温,混合,并在最短时间内形成乳状液。必要时,用稀释液或含上述表面活性 剂的稀释液进一步 10 倍系列稀释。 ⑷需用特殊方法制备供试液的供试品 膜剂供试品取供试品,剪碎,加 pH7.0 无菌氯化钠-蛋白胨缓冲液,或 pH7.2 磷酸盐缓冲液,或胰酪大豆胨液体培养基,浸泡,振摇,制成 1∶10 的供试液。
菌生长。如阴性对照有菌生长,应进行偏差调查。
培养基适用性检查
微生物计数用的成品培养基、由脱水培养基或按处方配制的培养基均应进行
培养基适用性检查。
按表 1 规定,接种不大于 100cfu 的菌液至胰酪大豆胨液体培养基管或胰酪
大豆胨琼脂培养基平板或沙氏葡萄糖琼脂培养基平板,置表 1 规定条件下培养。
每一试验菌株平行制备 2 管或 2 个平皿。同时,用相应的对照培养基替代被检培
第三次公示稿
1105 非无菌产品微生物限度检查:微生物计数法
微生物计数法系用于能在有氧条件下生长的嗜温细菌和真菌的计数。 当本法用于检查非无菌制剂及其原、辅料等是否符合规定的微生物限度标准 时,应按下述规定进行检验,包括样品的取样量和结果的判断等。除另有规定外, 本法不适用于活菌制剂的检查。 微生物计数试验环境应符合微生物限度检查的要求。检验全过程必须严格遵 守无菌操作,防止再污染,防止污染的措施不得影响供试品中微生物的检出。单 向流空气区域、工作台面及环境应定期进行监测。 如供试品有抗菌活性,应尽可能去除或中和。供试品检查时, 若使用了中和 剂或灭活剂,应确认其有效性及对微生物无毒性。 供试液制备时如果使用了表面活性剂,应确认其对微生物无毒性以及与所使 用中和剂或灭活剂的相容性。
