分子原子离子及元素的关系
初中化学分子、原子、离子6大类型知识点

知识点一原子:化学变化中的最小微粒。
(1)原子也是构成物质的一种微粒。
例如少数非金属单质(金刚石、石墨等)、金属单质(如铁、汞等)、稀有气体等。
(2)原子也不断地运动着;原子虽很小但也有一定质量。
对于原子的认识远在公元前5世纪提出了有关“原子”的观念。
但没有科学实验作依据,直到19世纪初,化学家道尔顿根据实验事实和严格的逻辑推导,在1803年提出了科学的原子论。
分子:保持物质化学性质的最小粒子。
(1)构成物质的每一个分子与该物质的化学性质是一致的,分子只能保持物质的化学性质,不保持物质的物理性质。
因物质的物理性质,如颜色、状态等,都是宏观现象,是该物质的大量分子聚集后所表现的属性,并不是单个分子所能保持的。
(2)“最小”不是绝对意义上的最小,而是保持物质化学性质的最小。
分子的性质(1)分子质量和体积都很小。
(2)分子总是在不断运动着的。
温度升高,分子运动速度加快,如阳光下湿衣物干得快。
(3)分子之间有间隔。
一般说来,气体的分子之间间隔距离较大,液体和固体的分子之间的距离较小。
气体比液体和固体容易压缩,不同液体混合后的总体积小于二者的原体积之和,都说明分子之间有间隔。
(4)同种物质的分子性质相同,不同种物质的分子性质不同。
我们都有这样的生活体验:若口渴了,可以喝水解渴,同时吃几块冰块也可以解渴,这就说明:水和冰都具有相同的性质,因为水和冰都是由水分子构成的,同种物质的分子,性质是相同的。
知识点二质子:1个质子带1个单位正电荷原子核(+)。
中子:不带电。
(原子不带电。
)电子:1个电子带1个单位负电荷。
(1)构成原子的粒子有三种:质子、中子、电子。
但并不是所有的原子都是由这三种粒子构成的。
如有一种氢原子中只有质子和电子,没有中子。
(2)在原子中,原子核所带的正电荷数(核电荷数)就是质子所带的电荷数(中子不带电),而每个质子带1个单位正电荷,因此,核电荷数=质子数,由于原子核内质于数与核外电子数相等,所以在原子中核电荷数=质子数=核外电子数。
分子和原子的联系与区别

分子和原子的联系与区别
分子和原子是化学概念中的两个重要概念,它们之间存在连接,但又有一些区别。
联系:
1. 组成关系:分子是由原子通过化学键连接而成的,一个分子通常由两个或多个原子组成。
2. 表示方式:分子和原子都有相应的化学式来表示。
分子可以用化学式或分子式(如H2O表示水分子)表示,原子则通常
用元素符号表示(如H表示氢原子)。
3. 物质存在形态:绝大多数物质是以分子的形式存在的,如水、氧气等。
原子通常以离子的形式存在,如钠离子Na+、氯离子Cl-等。
区别:
1. 组成粒子:分子是由两个或多个原子通过共享电子形成的。
原子是化学元素中的最小单位,由质子、中子和电子组成。
2. 电荷:分子中的原子在化学键中共享电子,因此不带电荷。
而原子可以带正电荷(失去电子形成阳离子)或负电荷(获得电子形成阴离子)。
3. 大小:分子通常比原子大,原子直径约为0.1纳米,而分子
的大小取决于组成其的原子数目和原子之间的化学键。
总结来说,分子是由原子通过化学键连接而成的,是物质存在的基本单位之一。
原子是最基本的物质单位,不能再分割为其他物质。
分子原子离子关系图

分子原子离子关系图简介分子、原子和离子是化学中的重要概念,它们代表了物质构成的基本单位。
分子由两个或多个原子通过化学键连接而成,而原子是构成物质的最小单位,离子是带电的原子或分子。
分子、原子和离子之间存在着特定的关系,理解这些关系对于理解化学反应和物质的性质至关重要。
本文将介绍分子、原子和离子的关系,并通过图表展示它们之间的联系。
分子分子是由两个或多个原子通过化学键连接形成的。
分子是化学反应的基本单位,物质的性质往往由分子的组成和结构决定。
不同的原子组合和连接方式可以形成各种不同的分子。
例如,水分子由两个氢原子和一个氧原子通过共价键连接而成,化学式为H2O。
原子原子是构成物质的最小单位。
每种元素都由特定的原子组成,具有自己独特的物理和化学性质。
原子由带正电荷的质子、不带电荷的中性子和带负电荷的电子组成。
质子和中性子位于原子核中,而电子则围绕原子核轨道运动。
原子的电子结构决定了原子的化学性质。
离子离子是带电的原子或分子。
当一个原子失去或获得一个或多个电子时,它将带有正电荷或负电荷,从而形成一个离子。
失去一个或多个电子的原子称为阳离子,带正电荷;获得一个或多个电子的原子称为阴离子,带负电荷。
离子通过电荷的吸引力与其他离子或原子相互作用,形成了离子键或离子化合物。
关系图下面是一个示例的分子、原子和离子之间的关系图:+---------++---- | 分子 | ----+| +---------+ || |分解 | | 结合| |v v+---------+ +-------------+----| 原子 | -----+----- | 离子 |-------+---------+ | +-------------+|合并 | 释放|v+------------+| 化学反应 |+------------+上图展示了分子、原子和离子之间的转化关系。
化学反应通常涉及原子和离子之间的重新组合。
例如,在化学反应中,分子可以发生分解,将分子中的原子释放出来。
分子、原子、离子及元素的关系
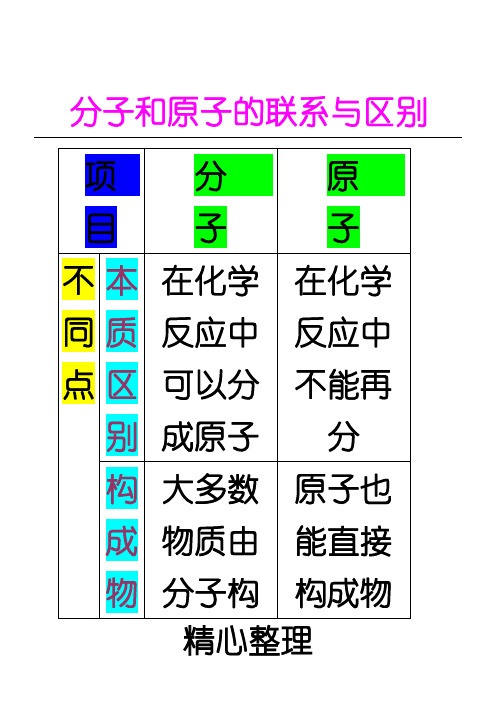
项分 目子 不 本 在化学 同 质 反应中 点 区 可以分
别 成原子 构 大多数 成 物质由
原 子 在化学 反应中 不能再 分 原子也 能直接
精心整理
物 分子构 构成物
质 成 质,但分
情
子是由
况
原子构
成的
相 1、 质量和体积都
同
很小
点 2、 都在不停地运
动
3、 粒子间由间隔
精心整理
稳定
结构
稀 =8 难得 极
有 (氦 失电 难
气为 子 发
体 2) (常 生
元
称为 化
素
稳定 学
结反
构) 应
精心整理
离子与原子的
比较
粒子 原
离
种类 子
子
阳离 阴离
子子
粒 核内 核内 核内
区 子 质子 质子 质子
结 数= 数> 数<
精心整理
构 核外 核外 核外 电子 电子 电子
别 数数 数 粒 不显 带正 带负 子 电性 电 电 电 性 用元 用阳 用阴 符 素符 离子 离子 号 号表 符号 符号
阴离子
失电子
失电子 构分 成裂
系
分
子
元素与原子的比较 精心整理
元
原
素
子
概 具有相同 化学变化
念 核电荷数 中的最小
(即核内 粒子
质子数)
的一类原
子的总称
区 只讲种 既将种
分 类,不讲 类,又讲
精心整理
个数 个数 使 用于描 用于描述 用 述物质 物质的微 范 的宏观 观构成 围 组成 举 水由氢元 每个水分 例 素和氧元 子由两个
分子、原子、离子、元素和化学式

分子、原子、离子、元素和化学式元素:具有相同核电荷数(即核内质子数)的一类原子总称元素。
原子的核电荷数(即核内质子数)决定原子或离子的元素种类。
①大部分单个的元素符号表示:一种元素、该元素的一个原子、一种单质但H N O Cl等符号不能表示单质,它们的单质是:H2 N2 O2 Cl2②地壳中元素按质量分数由多至少前四位是:O氧Si硅Al铝Fe铁。
铝是地壳中含量最多的金属元素。
③化学的“语法”: “某分子”由“某原子构成”“某物质”由“某元素组成”或“某某分子构成”(金属单质、稀有气体讲由某原子直接构成)例:水由氢元素和氧元素组成,水由水分子构成。
1个水分子由2个氢原子和1个氧原子构成元素、物质都是宏观概念,只表示种类,不表示个数。
不能说“水是由二个氢元素和一个氧元素组成”④具有相同核电荷数的粒子不一定是同种元素,下列粒子有相同的核电荷数:⑴H2和He ⑵CO、N2和Si ⑶O2、S和S2- ⑷OH-和F-元素、分子和原子的区别与联系元素组成物质宏观概念,只讲种类,不讲个数同类原子总称构成构成构成微观概念,既讲种类,又讲个数原子分子粒子:如原子、离子、分子、电子、质子等,它们都是微观概念,既表示种类又可表示个数。
分子、原子、离子都是构成物质的粒子。
金属单质和稀有气体由原子直接构成;非金属单质、非金属与非金属形成的共价化合物由分子构成,化合物中既有金属元素又有非金属元素的离子化合物是由离子构成。
分子:分子是保持物质化学性质的最小粒子。
分子由原子构成,例:1个水分子由2个氢原子和1个氧原子构成原子:原子是化学变化中的最小粒子。
(注意:原子不是构成物质的最小粒子。
)原子的的构成:原子由核外带负电的电子和带正电的原子核构成,原子核由带正电的质子和不带电的中子构成。
在不显电性的粒子里:核电荷数=质子数=核外电子数注意:原子不是构成物质的最小粒子。
原子只是化学变化中的最小粒子;普通氢原子核中只有质子无中子,氢原子的原子核就是一个质子。
分子、原子、离子、元素的关系初中化学

化学式表示一个分子; H2O、 CO2
化学式前加数目表示几
个分子。
3H2O、4CO2
元素符号右上方标上离 H+、 O2-
子所带电荷及数目;数 目在前,“+”或“-”在
2H+、5O2-
原子或 (一)关于分子的说法 离子
(1)物质是由分子构原成子的或离子构成
(2)保持物质性质的基本粒子是分子
(3)双氧水(H2O2)是由双氢氧分水子分和子氧构分成子
小于4
大于4 等于4
等于8 氦为2
易失
易得
电子
稳定结构
电子
(八)原子结构与元素周期表的关系
周期数 主族元素的族序数
电子层数 最外层电子数
(九)元素、原子、分子、离子的表示方法
元素 原子
分子
离子
表示方法
元素符号
实例
H、O、Mg
元素符号表示一个原子; H、O、Mg
元素符号前加数目表示
几个原子。
2H、3O、4Mg
ห้องสมุดไป่ตู้
讲种类,又讲个数,有 只讲种类,不讲个数。
量的意义。
如:一种元素,四种元
如:一个碳原子,一种 碳原子;三个氧原子
素,而不能说一个元素。
2、讨论微观时用构成 2、讨论宏观时用组成
原子内核电荷数即质子数决定元素的种类
(六)原子结构与元素分类的关系
一般
小于4
大于4 等于4
等于8 氦为2
一般
(七)原子结构与元素性质的关系
粒子种类 原 子
离子
阳离子 阴离子
区 粒子结构 质子数=电子数 质子数>电子数 质子数<电子数
别 粒子电性 不呈电性 带正电荷 带负电荷
原子分子离子元素的区别
原子分子离子元素区别达2010原子:指化学反应中最小微粒;元素:指拥有相同核电荷数一类原子总称;分子:是保持物体化学性质最小微粒;离子:是指原子由于自身或外界作用而失去或得到一个或几个电子使其达到最外层电子数为8个或2个稳定结构。
这一过程称为电离。
电离过程所需或放出能量称为电离能具体理解如下:一、原子“原子是化学变化中最小微粒”,这一概念有三层含义:1. 原子也是一种微观上粒子。
2. 在化学变化中原子不能再分,不同原子组合成分子。
3. 原子由更小微粒:中子、质子、电子组成。
二、元素“同一类原子总称称为元素”,这一概念理解应注意以下几点:1. 元素是一个宏观概念,及分子、原子不同,它只论种类,不论个数,没有数量意义。
2. 核电荷数或质子数是划分元素种类唯一标准,也即核电荷数或质子数相同原子或离子或同位素都是同一类元素,如氢原子H、氢离子H+、重氢原子H都是氢元素。
3. 同种类元素可以有不同存在状态,单质中元素称为游离态,一般游离态化学性质和物理性质及化合态不同。
三、分子“分子是保持物质化学性质一种最小微粒”,这一概念包含三层含义:1. 分子是一种微观粒子,组成物质微观粒子有多种(如原子、离子、质子等),分子只是其中一种。
2. 分子不是最小微粒,只是在“保持物质化学性质”这一点上讲它是一种最小微粒,相同分子性质相同,不同分子性质不同。
3. 分子是由更小微粒:原子构成。
“其实分子、原子、元素之间还是有很密切联系,从下面这个图可以大致看出来:一、原子、分子、元素之间联系说明:(1)原子构成分子;(2)分子构成物质,如碳原子和氧原子构成二氧化碳分子,二氧化碳分子构成二氧化碳;(3)原子可直接构成物质,如铁原子构成铁,氦气由氦原子构成;(4)(5)同类原子总称为元素,而元素又组成物质。
二、运用分子、原子、元素概念进行描述时应注意问题1. 直接由分子构成物质(以二氧化碳为例)可以说:(1)二氧化碳由碳和氧两种元素组成(元素不讲个数)(2)二氧化碳由二氧化碳分子构成(宏观物质不讲个数)(3)二氧化碳分子由碳原子和氧原子构成(前后一致都不讲个数)(4)一个二氧化碳分子由一个碳原子和两个氧原子构成(都讲个数)2. 直接由原子构成物质(如铁)可以说:(1)铁由铁元素组成(元素为宏观概念,只讲种类,不讲个数)(2)铁由铁原子构成(铁物质是宏观概念,不讲个数)。
2024年初中化学分子、原子和离子必考知识点总结
2024年初中化学分子、原子和离子必考知识点总结一、原子结构和元素周期表1. 原子的组成:原子由质子、中子和电子组成。
质子和中子位于原子的中心核心,电子围绕核心运动。
2. 元素周期表:元素周期表是化学元素按一定顺序排列的表格,包含了元素的名称、原子序数、原子量等信息。
元素周期表是按原子序数(即质子数)的顺序排列的。
二、离子1. 离子的定义:当一个原子失去或获得电子时,形成带电的粒子,这种带电的粒子称为离子。
2. 阳离子和阴离子:失去电子的离子称为阳离子(正离子),获得电子的离子称为阴离子(负离子)。
3. 离子的符号:阳离子通常用元素符号后加上正号(如Na+),阴离子通常用元素符号后加上负号(如Cl-)表示。
三、分子1. 分子的定义:由两个或更多原子通过共用电子形成的化学结构被称为分子。
2. 共价键:分子中原子之间的化学键称为共价键,是通过共享电子对来连接原子的。
3. 分子式:用化学元素符号表示分子中各种原子的数量比例的式子。
例如,水的分子式为H2O。
四、原子和分子的相对质量和化学式1. 原子的相对质量:原子的相对质量是指一个原子质量与质子质量的比值。
2. 分子的相对质量:分子的相对质量是指一个分子质量与质子质量的比值。
可以通过分子式计算得出。
3. 化学式:化学式是用化学符号表示化合物的组成和结构的一种简洁表达方式。
化学式可以表示分子、离子或晶体的组成。
五、原子和分子的化学变化1. 化学反应:原子和分子之间的重新排列被称为化学反应。
2. 反应物和生成物:参与化学反应的物质被称为反应物,反应后形成的新物质被称为生成物。
3. 反应物的消耗与生成物的生成:在化学反应中,反应物的质量会发生减少,而生成物的质量会发生增加。
六、元素与化合物1. 元素:由只含有相同种类原子的一种物质被称为元素。
2. 化合物:由含有不同种类原子的物质被称为化合物。
3. 氧化与还原:化合物中的某些原子失去电子被称为氧化,而其他原子获得电子被称为还原。
科教版初中化学分子、原子、离子和元素
分子、原子、离子和元素1、分子(1)定义:______________________________________ (2)表示方法:化学式,如氧气(O 2),二氧化碳(CO 2)(3)构成:分子由原子构成,例如:H 2O 表示1个水分子由1个氧原子和2个氢原子构成 (4)分子的性质:①分子体积和质量很小,解释现象:能闻到气味但看不见;②分子不停地运动,解释现象:闻到气味、物质的扩散、溶解、挥发;③分子间有间隔,解释现象:物质的热胀冷缩、物质的三态变化、气体的膨胀和压缩1+1≠2; ④同种分子化学性质相同,不同种分子化学性质不同,解释:液氧和氧气都可以燃烧。
2、原子(1)定义:________________________________________(2)表示方法:元素符号,如:Na 、O 【注】:多个原子在元素符号前加数字,如:6Fe (3)原子性质:①原子体积和质量很小 ③原子间有间隔②原子不停地运动 ④同种原子化学性质相同,不同种原子化学性质不同 (4)原子的结构:核外电子:每个电子带1个单位负电荷原子 原子核原子结构示意图:①小圈表示原子核; ②圈内数字表示核内质子数; ③“+”表示原子核带正电; ④弧线表示电子层;⑤弧线上的数字表示该层的电子数。
(5)相对原子质量①相对原子质量是个比值,以碳12原子质量的1/12作为标准,单位为1, 相对原子质量=12/112原子质量的一个碳一个原子的实际质量-;②相对原子质量≈质子数+中子数。
小结:①核电荷数=质子数=核外电子数=原子序数,原子不显电性的原因;②原子核由质子和中子构成,但原子核中可以不含中子,如氢原子; ③质子数不一定等于电子数; ④相对原子质量≈质子数+中子数。
3、离子(1)定义:带电的原子或原子团,常见原子团:NH 4+、NO 3-、 OH -、 SO 42- 、CO 32- (2)离子形成(设:原子最外层电子数为X )当X > 4时,原子__得电子 形成阴离子,带_________当X < 4时,原子__电子 形成阳离子,带_________ (3)分类:阴离子(O 2-、F 、NO 3-、OH -、SO 42-、CO 32-);阳离子(Na +、NH 4+) (4)离子结构示意图Na Na + Cl Cl -原子:质子数=核外电子数; 阳离子:质子数﹥核外电子数; 阴离子:质子数﹤核外电子数 (5)分子、原子和离子的比较(1)由原子直接构成的物质:稀有气体(如He 、Ne)、金属(如Hg 、Fe )、某些固态非金属(如C 、Si ); (2)由分子构成的物质:双原子(如:H 2、O 2、HCl )、多原子(如:O 3、H 2O 、CO 2); (3)由离子构成的物质:例:NaCl 。
初中化学分子、原子、离子最全面的必考知识点
初中化学||分子、原子、离子最全面的必考知识点初中化学知识还是偏向于理论性的,这都是为高中的实验模块做好基础知识准备!必考知识点一原子:化学变化中的最小微粒。
(1)原子也是构成物质的一种微粒。
例如少数非金属单质(金刚石、石墨等);金属单质(如铁、汞等);稀有气体等。
(2)原子也不断地运动着;原子虽很小但也有一定质量。
1803年道尔顿提出了科学的原子论。
分子:保持物质化学性质的最小粒子。
(1)构成物质的每一个分子与该物质的化学性质是一致的,分子只能保持物质的化学性质,不保持物质的物理性质。
(2)“最小”不是绝对意义上的最小,而是保持物质化学性质的最小。
分子的性质(1)分子质量和体积都很小。
(2)分子总是在不断运动着的。
温度升高,分子运动速度加快。
(3)分子之间有间隔。
一般说来,气体分子间隔距离较大,液体和固体的分子之间的距离较小。
(4)同种物质的分子性质相同,不同种物质的分子性质不同。
必考知识点二质子:1个质子带1个单位正电荷原子核(+)。
中子:不带电原子不带电。
电子:1个电子带1个单位负电荷。
(1)构成原子的粒子有三种:质子、中子、电子。
但并不是所有的原子都是由这三种粒子构成的。
有一种氢原子中只有质子和电子,没有中子。
(2)在原子中,原子核所带的正电荷数(核电荷数)就是质子所带的电荷数(中子不带电),而每个质子带1个单位正电荷。
因此,核电荷数=质子数,由于原子核内质于数与核外电子数相等,所以在原子中核电荷数=质子数=核外电子数。
原子中存在带电粒子,为什么原子不显电性?原子是由带正电的原子核和核外带负电的电子构成,原子核又是由质子和中子构成,质子带正电,中子不带电;原子核所带正电荷和核外电子所带负电荷相等,但电性相反,所以整个原子不显电性。
必考知识点三分子和原子的区别在于化学反应中可再分,构成分子中的原子重新组合成新物质的分子在化学反应中不可再分,化学反应前后并没有变成其它原子。
相似点:(1)都是构成物质的基本粒子;(2)质量、体积都非常小,彼此间均有一定间隔,处于永恒的运动中;(3)同种分子(或原子)性质相同,不同种分子(或原子)性质不同;(4)都具有种类和数量的含义。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
粒子电 性
不显电性
带正电
带负电
符号
用元素符号表示,如
Na、S
用阳离子符号表示,如
Na 、Mg
用阴离子符号表示,如
Cl 、OH
联系
得到电子得到电子
阳离子 原子 阴离子
失去电子失去电子
分子、原子与离子的比较
微粒
项目
分Hale Waihona Puke 子原 子离 子概 念
保持物质化学性质的最小粒子
就是化学变化中的最小粒子
区分
只讲种类,不讲个数
既将种类,又讲个数
使用范围
用于描述物质的宏观组成
用于描述物质的微观构成
举例
水由氢元素与氧元素组成,或说水中含有氢元素与氧元素
每个水分子由两个氢原子与一个氧原子构成
联系
元素与原子就是总体与个体的关系,原子就是元素的个体,就是构成并体现元素性质的最小微粒;元素就是一类原子的总称,一种元素可以包含几种原子
元素的性质,特别就是它的化学性质,与元素原子的最外层电子数关系密切
非金属元素
≥4(氢为1)
易得到电子使最外层达到8个电子的稳定结构
稀有气体元素
=8(氦为2)
难得失电子(常称为稳定结构)
极难发生化学 反应
离子与原子的比较
粒子种类
原 子
离 子
阳离子
阴离子
区
别
粒子结 构
核内质子数=核外电子数
核内质子数>核外电子数
化学计量数与符号的关系
化学式、元素符号、离子符号前加上化学计量数,如:2H、2H 、3Na ,只表示分子、原子、离子的“个数”,不表示物质与元素
联
系
得电子 得电子
阳离子 原子 阴离子
失电子 失电子
构 分
成 裂
分子
元素与原子的比较
元素
原子
概念
具有相同核电荷数(即核内质子数)的一类原子的总称
化学变化中的最小粒子
带电的原子或原子团
表示方法
用化学式表示,如:
H 、He
用元素符号表示,如:
H、Fe
用离子符号表示,如:
Na 、CO
微 粒
的
运 动
物理变化就是分子运动的结果,如:水的蒸发
化学变化就是原子运动的结果,如:水的电解
离子运动的结果可能就是物理变化,也可能就是化学变化,如:NaCl的溶解就是物理变化,NaCl与AgNO 反应就是化学变化
分子与原子的联系与区别
项 目
分 子
原 子
不同点
本质区别
在化学反应中可以分成原子
在化学反应中不能再分
构成物
质情况
大多数物质由分子构成
原子也能直接构成物质,但分子就是由原子构成的
相 同 点
1、质量与体积都很小
2、都在不停地运动
3、粒子间由间隔
4、都就是构成物质的粒子
5、同种粒子性质相同,不同种粒子性质不同
注 意
事 项
1、分子就是保持物质化学性质的最小粒子
2、原子就是化学变化中的最小粒子
3、分子就是由原子构成的
4、对于原子直接构成的物质,原子就是保持其化学性质的最小粒子
元素原子的结构特征与元素化学性质的关系
元素类别
最外层电子数
得失电子趋势
性质
结论
金属元素
<4
易失去最外层电子使次外层达到稳定结构
较易发生化学反应
