(推荐)常用缓冲溶液的配制和PH计校正溶液配置方法
常用缓冲溶液的配制及PH计校正溶液配置方法

常用缓冲溶液的配制方法1.甘氨酸–盐酸缓冲液(0.05mol/L)2.邻苯二甲酸–盐酸缓冲液(0.05 mol/L)邻苯二甲酸氢钾分子量= 204.23,0.2 mol/L邻苯二甲酸氢溶液含40.85克/升3.磷酸氢二钠–柠檬酸缓冲液24Na2HPO4·2H2O分子量= 178.05,0.2 mol/L溶液含35.01克/升。
C4H2O7·H2O分子量= 210.14,0.1 mol/L溶液为21.01克/升。
4.柠檬酸–氢氧化钠-盐酸缓冲液① 使用时可以每升中加入1克克酚,若最后pH 值有变化,再用少量50% 氢氧化钠溶液或浓盐酸调节,冰箱保存。
5.柠檬酸–柠檬酸钠缓冲液(0.1 mol/L )6872柠檬酸钠Na 3 C 6H 5O 7·2H 2O :分子量294.12,0.1mol/L 溶液为29.41克/毫升。
6.乙酸–乙酸钠缓冲液(0.2 mol/L )Na 2Ac·3H 2O 分子量 = 136.09,0.2 mol/L 溶液为27.22克/升。
7.磷酸盐缓冲液242Na 2HPO 4·12H 2O 分子量 = 358.22,0.2 mol/L 溶液为71.64克/升。
Na 2HPO 4·2H 2O 分子量 = 156.03,0.2 mol/L 溶液为31.21克/升。
(2)磷酸氢二钠–磷酸二氢钾缓冲液(1/15 mol/L )242KH 2PO 4分子量 = 136.09,1/15M 溶液为9.078克/升。
8.磷酸二氢钾–氢氧化钠缓冲液(0.05M )9.巴比妥钠-盐酸缓冲液(18℃)10.Tris–盐酸缓冲液(0.05M ,25℃)50毫升0.1M 三羟甲基氨基甲烷(Tris )溶液与X 毫升0.1N 盐酸混匀后,加水稀释至100三羟甲基氨基甲烷(Tris )HOCH2 CH2OH CHOCH2 NH2分子量=121.14;0. 1M 溶液为12.114克/升。
常用缓冲溶液的配制和PH计校正溶液配置方法之欧阳家百创编

常用缓冲溶液的配制方法欧阳家百(2021.03.07)1.甘氨酸–盐酸缓冲液(0.05mol/L)X毫升0.2 mol/L甘氨酸+Y毫升0.2 mol/L HCI,再加水稀释至200毫升甘氨酸分子量= 75.07,0.2 mol/L甘氨酸溶液含15.01克/升。
2.邻苯二甲酸–盐酸缓冲液(0.05 mol/L)X毫升0.2 mol/L邻苯二甲酸氢钾+ 0.2 mol/L HCl,再加水稀释到20毫升邻苯二甲酸氢钾分子量= 204.23,0.2 mol/L邻苯二甲酸氢溶液含40.85克/升3.磷酸氢二钠–柠檬酸缓冲液Na2HPO4分子量= 14.98,0.2 mol/L溶液为28.40克/升。
Na2HPO4·2H2O分子量= 178.05,0.2 mol/L溶液含35.01克/升。
C4H2O7·H2O分子量= 210.14,0.1 mol/L溶液为21.01克/升。
4.柠檬酸–氢氧化钠-盐酸缓冲液①使用时可以每升中加入1克克酚,若最后pH值有变化,再用少量50% 氢氧化钠溶液或浓盐酸调节,冰箱保存。
5.柠檬酸–柠檬酸钠缓冲液(0.1 mol/L)柠檬酸C6H8O7·H2O:分子量210.14,0.1 mol/L溶液为21.01克/升。
柠檬酸钠Na3 C6H5O7·2H2O:分子量294.12,0.1 mol/L溶液为29.41克/毫升。
6.乙酸–乙酸钠缓冲液(0.2 mol/L)Na2Ac·3H2O分子量= 136.09,0.2 mol/L溶液为27.22克/升。
7.磷酸盐缓冲液(1)磷酸氢二钠–磷酸二氢钠缓冲液(0.2)Na2HPO4·2H2O分子量= 178.05,0.2 mol/L溶液为85.61克/升。
Na2HPO4·12H2O分子量= 358.22,0.2 mol/L溶液为71.64克/升。
Na2HPO4·2H2O分子量= 156.03,0.2 mol/L溶液为31.21克/升。
常用缓冲溶液的配制和PH计校正溶液配置方法之欧阳德创编
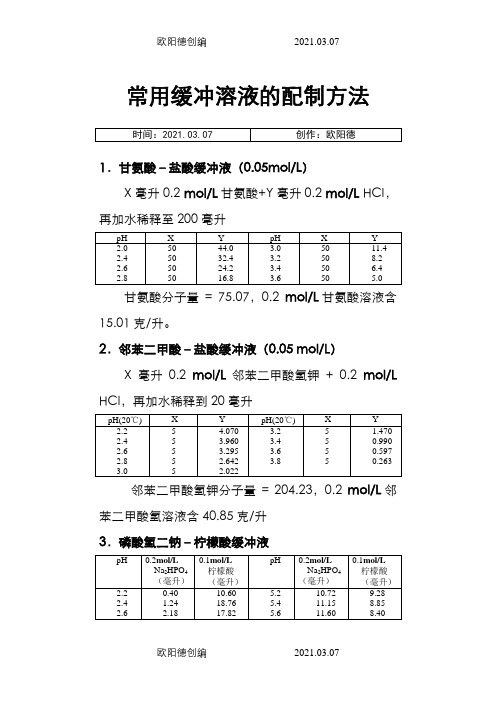
常用缓冲溶液的配制方法1.甘氨酸–盐酸缓冲液(0.05mol/L)X毫升0.2 mol/L甘氨酸+Y毫升0.2 mol/L HCI,再加水稀释至200毫升甘氨酸分子量= 75.07,0.2mol/L甘氨酸溶液含15.01克/升。
2.邻苯二甲酸–盐酸缓冲液(0.05 mol/L)X毫升0.2mol/L邻苯二甲酸氢钾+ 0.2mol/L HCl,再加水稀释到20毫升邻苯二甲酸氢钾分子量= 204.23,0.2mol/L邻苯二甲酸氢溶液含40.85克/升3.磷酸氢二钠–柠檬酸缓冲液Na2HPO4分子量= 14.98,0.2mol/L溶液为28.40克/升。
Na2HPO4·2H2O分子量 = 178.05,0.2 mol/L溶液含35.01克/升。
C4H2O7·H2O分子量= 210.14,0.1mol/L溶液为21.01克/升。
4.柠檬酸–氢氧化钠-盐酸缓冲液①使用时可以每升中加入1克克酚,若最后pH值有变化,再用少量50% 氢氧化钠溶液或浓盐酸调节,冰箱保存。
5.柠檬酸–柠檬酸钠缓冲液(0.1 mol/L)柠檬酸C6H8O7·H2O:分子量210.14,0.1 mol/L溶液为21.01克/升。
柠檬酸钠Na3C6H5O7·2H2O:分子量294.12,0.1 mol/L溶液为29.41克/毫升。
6.乙酸–乙酸钠缓冲液(0.2 mol/L)Na2Ac·3H2O分子量 = 136.09,0.2 mol/L溶液为27.22克/升。
7.磷酸盐缓冲液(1)磷酸氢二钠–磷酸二氢钠缓冲液(0.2)Na2HPO4·2H2O分子量 = 178.05,0.2 mol/L溶液为85.61克/升。
Na2HPO4·12H2O分子量= 358.22,0.2mol/L 溶液为71.64克/升。
Na2HPO4·2H2O分子量 = 156.03,0.2 mol/L溶液为31.21克/升。
常用缓冲溶液的配制和PH计校正溶液配置方法之欧阳地创编
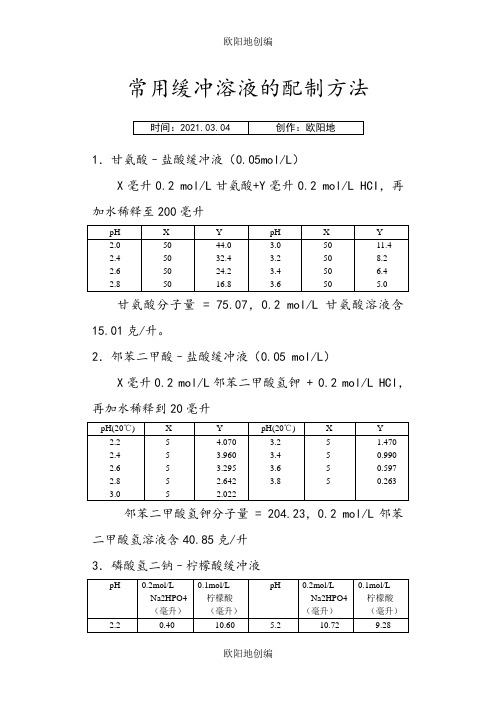
常用缓冲溶液的配制方法1.甘氨酸–盐酸缓冲液(0.05mol/L)X毫升0.2 mol/L甘氨酸+Y毫升0.2 mol/L HCI,再加水稀释至200毫升甘氨酸分子量 = 75.07,0.2 mol/L甘氨酸溶液含15.01克/升。
2.邻苯二甲酸–盐酸缓冲液(0.05 mol/L)X毫升0.2 mol/L邻苯二甲酸氢钾 + 0.2 mol/L HCl,再加水稀释到20毫升邻苯二甲酸氢钾分子量 = 204.23,0.2 mol/L邻苯二甲酸氢溶液含40.85克/升3.磷酸氢二钠–柠檬酸缓冲液Na2HPO4分子量 = 14.98,0.2 mol/L溶液为28.40克/升。
Na2HPO4·2H2O分子量 = 178.05,0.2 mol/L溶液含35.01克/升。
C4H2O7·H2O分子量 = 210.14,0.1 mol/L溶液为21.01克/升。
4.柠檬酸–氢氧化钠-盐酸缓冲液①使用时可以每升中加入1克克酚,若最后pH值有变化,再用少量50% 氢氧化钠溶液或浓盐酸调节,冰箱保存。
5.柠檬酸–柠檬酸钠缓冲液(0.1 mol/L )柠檬酸C6H8O7·H2O:分子量210.14,0.1 mol/L 溶液为21.01克/升。
柠檬酸钠Na3 C6H5O7·2H2O:分子量294.12,0.1 mol/L 溶液为29.41克/毫升。
6.乙酸–乙酸钠缓冲液(0.2 mol/L )Na2Ac·3H2O 分子量 = 136.09,0.2 mol/L 溶液为27.22克/升。
7.磷酸盐缓冲液(1)磷酸氢二钠–磷酸二氢钠缓冲液(0.2)Na2HPO4·2H2O分子量 = 178.05,0.2 mol/L溶液为85.61克/升。
Na2HPO4·12H2O分子量 = 358.22,0.2 mol/L溶液为71.64克/升。
Na2HPO4·2H2O分子量 = 156.03,0.2 mol/L溶液为31.21克/升。
常用缓冲溶液的配制和PH计校正溶液配置方法之欧阳引擎创编

常用缓冲溶液的配制方法欧阳引擎(2021.01.01)1.甘氨酸–盐酸缓冲液(0.05mol/L)X毫升0.2 mol/L甘氨酸+Y毫升0.2 mol/L HCI,再加水稀释至200毫升甘氨酸分子量= 75.07,0.2 mol/L甘氨酸溶液含15.01克/升。
2.邻苯二甲酸–盐酸缓冲液(0.05 mol/L)X毫升0.2 mol/L邻苯二甲酸氢钾+ 0.2 mol/L HCl,再加水稀释到20毫升邻苯二甲酸氢钾分子量= 204.23,0.2 mol/L邻苯二甲酸氢溶液含40.85克/升3.磷酸氢二钠–柠檬酸缓冲液Na2HPO4分子量 = 14.98,0.2 mol/L 溶液为28.40克/升。
Na2HPO4·2H2O 分子量 = 178.05,0.2 mol/L 溶液含35.01克/升。
C4H2O7·H2O 分子量 = 210.14,0.1 mol/L 溶液为21.01克/升。
4.柠檬酸–氢氧化钠-盐酸缓冲液① 使用时可以每升中加入1克克酚,若最后pH 值有变化,再用少量50% 氢氧化钠溶液或浓盐酸调节,冰箱保存。
5.柠檬酸–柠檬酸钠缓冲液(0.1 mol/L )柠檬酸C6H8O7·H2O :分子量210.14,0.1 mol/L 溶液为21.01克/升。
柠檬酸钠Na3 C6H5O7·2H2O :分子量294.12,0.1 mol/L 溶液为29.41克/毫升。
6.乙酸–乙酸钠缓冲液(0.2 mol/L )Na2Ac·3H2O 分子量 = 136.09,0.2 mol/L 溶液为27.22克/升。
7.磷酸盐缓冲液(1)磷酸氢二钠–磷酸二氢钠缓冲液(0.2)Na2HPO4·2H2O分子量= 178.05,0.2 mol/L溶液为85.61克/升。
Na2HPO4·12H2O分子量= 358.22,0.2 mol/L溶液为71.64克/升。
2021年常用缓冲溶液的配制和PH计校正溶液配置方法
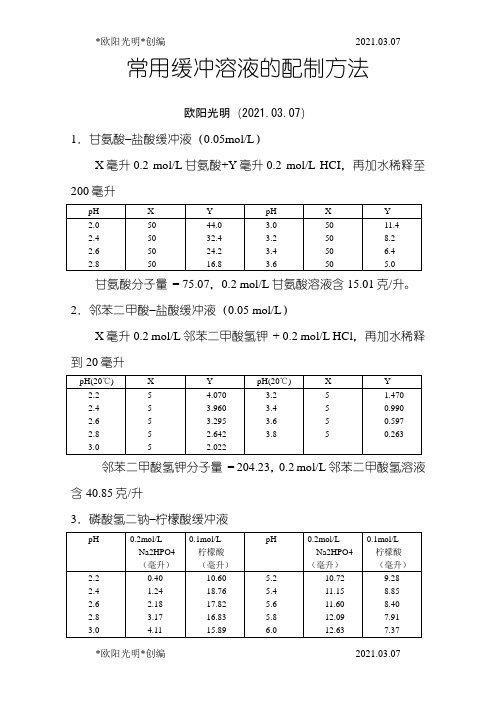
常用缓冲溶液的配制方法欧阳光明(2021.03.07)1.甘氨酸–盐酸缓冲液(0.05mol/L)X毫升0.2 mol/L甘氨酸+Y毫升0.2 mol/L HCI,再加水稀释至200毫升甘氨酸分子量= 75.07,0.2 mol/L甘氨酸溶液含15.01克/升。
2.邻苯二甲酸–盐酸缓冲液(0.05 mol/L)X毫升0.2 mol/L邻苯二甲酸氢钾+ 0.2 mol/L HCl,再加水稀释到20毫升邻苯二甲酸氢钾分子量= 204.23,0.2 mol/L邻苯二甲酸氢溶液含40.85克/升3.磷酸氢二钠–柠檬酸缓冲液Na2HPO4分子量= 14.98,0.2 mol/L溶液为28.40克/升。
Na2HPO4·2H2O分子量= 178.05,0.2 mol/L溶液含35.01克/升。
C4H2O7·H2O分子量= 210.14,0.1 mol/L溶液为21.01克/升。
4.柠檬酸–氢氧化钠-盐酸缓冲液①使用时可以每升中加入1克克酚,若最后pH值有变化,再用少量50% 氢氧化钠溶液或浓盐酸调节,冰箱保存。
5.柠檬酸–柠檬酸钠缓冲液(0.1 mol/L)柠檬酸C6H8O7·H2O:分子量210.14,0.1 mol/L溶液为21.01克/升。
柠檬酸钠Na3 C6H5O7·2H2O:分子量294.12,0.1 mol/L溶液为29.41克/毫升。
6.乙酸–乙酸钠缓冲液(0.2 mol/L)Na2Ac·3H2O分子量= 136.09,0.2 mol/L溶液为27.22克/升。
7.磷酸盐缓冲液(1)磷酸氢二钠–磷酸二氢钠缓冲液(0.2)Na2HPO4·2H2O分子量= 178.05,0.2 mol/L溶液为85.61克/升。
Na2HPO4·12H2O分子量= 358.22,0.2 mol/L溶液为71.64克/升。
Na2HPO4·2H2O 分子量 = 156.03,0.2 mol/L 溶液为31.21克/升。
常用缓冲溶液的配制和PH计校正溶液配置方法
常用缓冲溶液的配制和P H计校正溶液配置方法精选文档TTMS system office room 【TTMS16H-TTMS2A-TTMS8Q8-常用缓冲溶液的配制方法1.甘氨酸–盐酸缓冲液(L)X毫升 mol/L甘氨酸+Y毫升 mol/L HCI,再加水稀释至200毫升甘氨酸分子量 = , mol/L甘氨酸溶液含克/升。
2.邻苯二甲酸–盐酸缓冲液( mol/L)X毫升 mol/L邻苯二甲酸氢钾 + mol/L HCl,再加水稀释到20毫升邻苯二甲酸氢钾分子量 = , mol/L邻苯二甲酸氢溶液含克/升3.磷酸氢二钠–柠檬酸缓冲液Na2HPO4分子量 = , mol/L溶液为克/升。
Na2HPO4·2H2O分子量 = , mol/L溶液含克/升。
C 4H2O7·H2O分子量 = , mol/L溶液为克/升。
4.柠檬酸–氢氧化钠-盐酸缓冲液①使用时可以每升中加入1克克酚,若最后pH值有变化,再用少量50%氢氧化钠溶液或浓盐酸调节,冰箱保存。
5.柠檬酸–柠檬酸钠缓冲液( mol/L)柠檬酸C 6H 8O 7·H 2O :分子量, mol/L 溶液为克/升。
柠檬酸钠Na 3 C 6H 5O 7·2H 2O :分子量, mol/L 溶液为克/毫升。
6.乙酸–乙酸钠缓冲液( mol/L )Na 2Ac·3H 2O 分子量 = , mol/L 溶液为克/升。
7.磷酸盐缓冲液(1)磷酸氢二钠–磷酸二氢钠缓冲液()Na2HPO4·2H2O分子量 = , mol/L溶液为克/升。
Na2HPO4·12H2O分子量 = , mol/L溶液为克/升。
Na2HPO4·2H2O分子量 = , mol/L溶液为克/升。
(2)磷酸氢二钠–磷酸二氢钾缓冲液(1/15 mol/L)1M溶液为克/升。
Tris溶液可从空气中吸收二氧化碳,使用时注意将瓶盖严。
常用缓冲溶液的配制和PH计校正溶液配置方法之欧阳文创编
常用缓冲溶液的配制方法1.甘氨酸–盐酸缓冲液(0.05mol/L)X毫升0.2 mol/L甘氨酸+Y毫升0.2 mol/L HCI,再加水稀释至200毫升甘氨酸分子量 = 75.07,0.2 mol/L甘氨酸溶液含15.01克/升。
2.邻苯二甲酸–盐酸缓冲液(0.05 mol/L)X毫升0.2 mol/L邻苯二甲酸氢钾 + 0.2 mol/L HCl,再加水稀释到20毫升邻苯二甲酸氢钾分子量 = 204.23,0.2 mol/L邻苯二甲酸氢溶液含40.85克/升3.磷酸氢二钠–柠檬酸缓冲液Na2HPO4分子量 = 14.98,0.2 mol/L溶液为28.40克/升。
Na2HPO4·2H2O分子量 = 178.05,0.2 mol/L溶液含35.01克/升。
C4H2O7·H2O分子量 = 210.14,0.1 mol/L溶液为21.01克/升。
4.柠檬酸–氢氧化钠-盐酸缓冲液①使用时可以每升中加入1克克酚,若最后pH值有变化,再用少量50% 氢氧化钠溶液或浓盐酸调节,冰箱保存。
5.柠檬酸–柠檬酸钠缓冲液(0.1 mol/L )柠檬酸C6H8O7·H2O:分子量210.14,0.1 mol/L 溶液为21.01克/升。
柠檬酸钠Na3 C6H5O7·2H2O:分子量294.12,0.1 mol/L 溶液为29.41克/毫升。
6.乙酸–乙酸钠缓冲液(0.2 mol/L )Na2Ac·3H2O 分子量 = 136.09,0.2 mol/L 溶液为27.22克/升。
7.磷酸盐缓冲液(1)磷酸氢二钠–磷酸二氢钠缓冲液(0.2)Na2HPO4·2H2O 分子量 = 178.05,0.2 mol/L 溶液为85.61克/升。
Na2HPO4·12H2O 分子量 = 358.22,0.2 mol/L 溶液为71.64克/升。
Na2HPO4·2H2O 分子量 = 156.03,0.2mol/L 溶液为31.21克/升。
缓冲溶液的配制和PH计校正溶液配置方法
缓冲溶液的配制和PH计校正溶液配置方法缓冲溶液是由一种酸和一种碱或它们的盐所组成的溶液,能够稳定pH值。
缓冲溶液通常用于实验室的化学分析、生物学实验和工业生产中。
下面是一种常见的缓冲溶液的配制方法:1.选择合适的酸和碱:首先要根据需要稳定的pH值选择合适的酸和碱。
常用的酸包括盐酸、硫酸和醋酸,常用的碱包括氢氧化钠和氢氧化铵。
2.确定理论浓度:根据所需缓冲溶液的体积和理论浓度,计算所需的酸和碱的摩尔量。
3.酸和碱的配制:将所需量的酸和碱分别加入不同的容器中,并用去离子水稀释,直至达到理论浓度。
4.混合酸和碱:将酸和碱的溶液缓慢地倒入一个干净的容器中,同时搅拌,直到达到所需pH值。
5.最后的稳定性调整:如果溶液的pH值不稳定,可以使用其他酸或碱来调整pH值,直到稳定。
PH计校正溶液配置方法:pH计是一种用于测量溶液酸碱性的仪器,它需要定期校正以保证测量的准确性。
下面是一种常见的pH计校正溶液的配置方法:1.选择标定溶液:根据pH计的测量范围和需求,选择两个标定溶液。
一般来说,一种标定溶液应该是酸性的(pH值低于7),另一种标定溶液应该是碱性的(pH值高于7)。
常用的酸包括盐酸和硫酸,常用的碱包括氢氧化钠和氢氧化铵。
2.确定理论浓度:根据所需标定溶液的体积和理论浓度,计算所需的酸和碱的摩尔量。
3.酸和碱的配制:将所需量的酸和碱分别加入不同的容器中,并用去离子水稀释,直至达到理论浓度。
4.调整pH值:使用pH计测量标定溶液的实际pH值,如果与预期值不相符,使用其他酸或碱来调整pH值,直到达到所需的实际pH值。
5.校正pH计:按照pH计的使用说明书,将pH计插入标定溶液中,根据pH计的操作步骤进行校正。
6.记录和保管:记录标定溶液的批号、浓度和pH值,并妥善保存,以备后续校正或参考。
在配制缓冲溶液和pH计的校正溶液时,注意使用精密的仪器和试剂,并严格按照操作规程进行操作,以保证实验的精确性和准确性。
常用缓冲溶液配制和PH计校正溶液配置方法
常用缓冲溶液的配制方法1.甘氨酸–盐酸缓冲液(0.05mol/L)甘氨酸分子量 = 75.07,0.2 mol/L甘氨酸溶液含15.01克/升。
2.邻苯二甲酸–盐酸缓冲液(0.05 mol/L)邻苯二甲酸氢钾分子量 = 204.23,0.2 mol/L邻苯二甲酸氢溶液含40.85克/升3.磷酸氢二钠–柠檬酸缓冲液Na2HPO4分子量 = 14.98,0.2 mol/L溶液为28.40克/升。
Na2HPO4·2H2O分子量 = 178.05,0.2 mol/L溶液含35.01克/升。
C4H2O7·H2O分子量 = 210.14,0.1 mol/L溶液为21.01克/升。
4.柠檬酸–氢氧化钠-盐酸缓冲液液或浓盐酸调节,冰箱保存。
柠檬酸C 6H 8O 7·H 2O :分子量210.14,0.1 mol/L 溶液为21.01克/升。
柠檬酸钠Na 3 C 6H 5O7·2H 2O :分子量294.12,0.1 mol/L 溶液为29.41克/毫升。
227.磷酸盐缓冲液(1)磷酸氢二钠–磷酸二氢钠缓冲液(0.2)Na 2HPO 4·2H 2O 分子量 = 178.05,0.2 mol/L 溶液为85.61克/升。
Na 2HPO 4·12H 2O 分子量 = 358.22,0.2 mol/L 溶液为71.64克/升。
Na 2HPO 4·2H 2O 分子量 = 156.03,0.2 mol/L 溶液为31.21克/升。
Na 2HPO 4·2H 2O 分子量 = 178.05,1/15M 溶液为11.876克/升。
KH 2PO 4分子量 = 136.09,1/15M 溶液为9.078克/升。
8.磷酸二氢钾–氢氧化钠缓冲液(0.05M )巴比妥钠盐分子量=206.18;0.04M 溶液为8.25克/升10.Tris –盐酸缓冲液(0.05M ,25℃)50毫升0.1M 三羟甲基氨基甲烷(Tris )溶液与X 毫升0.1N 盐酸混匀后,加水稀释至100毫升。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
常用缓冲溶液的配制方法
1.甘氨酸–盐酸缓冲液(0.05mol/L)
X毫升0.2 mol/L甘氨酸+Y毫升0.2 mol/L HCI,再加水稀释至200毫升
2.邻苯二甲酸–盐酸缓冲液(0.05 mol/L)
X毫升0.2 mol/L邻苯二甲酸氢钾 + 0.2 mol/L HCl,再加水稀释到20毫升
邻苯二甲酸氢钾分子量 = 204.23,0.2 mol/L邻苯二甲酸氢溶液含40.85克/升3.磷酸氢二钠–柠檬酸缓冲液
24
Na2HPO4·2H2O分子量 = 178.05,0.2 mol/L溶液含35.01克/升。
C4H2O7·H2O分子量 = 210.14,0.1 mol/L溶液为21.01克/升。
4.柠檬酸–氢氧化钠-盐酸缓冲液
①使用时可以每升中加入1克克酚,若最后pH值有变化,再用少量50% 氢氧化
钠溶液或浓盐酸调节,冰箱保存。
柠檬酸C6H8O7·H2O:分子量210.14,0.1 mol/L溶液为21.01克/升。
柠檬酸钠Na3 C6H5O7·2H2O:分子量294.12,0.1 mol/L溶液为29.41克/毫升。
22
7.磷酸盐缓冲液
(1)磷酸氢二钠–磷酸二氢钠缓冲液(0.2)
Na2HPO4·2H2O分子量 = 178.05,0.2 mol/L溶液为85.61克/升。
Na2HPO4·12H2O分子量 = 358.22,0.2 mol/L溶液为71.64克/升。
Na2HPO4·2H2O分子量 = 156.03,0.2 mol/L溶液为31.21克/升。
Na2HPO4·2H2O分子量 = 178.05,1/15M溶液为11.876克/升。
KH2PO4分子量 = 136.09,1/15M溶液为9.078克/升。
8.磷酸二氢钾–氢氧化钠缓冲液(0.05M)
X毫升0.2M K2PO4 + Y毫升0.2N NaOH加水稀释至29毫升
9.巴比妥钠-盐酸缓冲液(18℃)
巴比妥钠盐分子量=206.18;0.04M溶液为8.25克/升
10.Tris–盐酸缓冲液(0.05M,25℃)
50毫升0.1M三羟甲基氨基甲烷(Tris)溶液与X毫升0.1N盐酸混匀后,加水稀释至100
C
HOCH2 NH2
分子量=121.14;
0.1M溶液为12.114克/升。
Tris溶液可从空气中吸收二氧化碳,使用时注意将瓶盖严。
11.硼酸–硼砂缓冲液(0.2M硼酸根)
2472硼酸H 2BO 3,分子量=61.84,0.2M 溶液为12.37克/升。
硼砂易失去结晶水,必须在带塞的瓶中保存。
硼砂Na 2B 4O 7·10H 2O,分子量=381.43;0.05M 溶液(=0.2M 硼酸根)含19.07克/升。
硼酸H 2BO 3,分子量=61.84, 0.2M 溶液为12.37克/升。
硼砂 易失去结晶水,必须在带塞的瓶中保存。
12.甘氨酸–氢氧化钠缓冲液(0.05M )
甘氨酸分子量=75.07;0.2M 溶液含15.01克/升。
13.硼砂-氢氧化钠缓冲液(0.05M 硼酸根)
硼砂Na 2B 4O 7·10H 2O,分子量=381.43;0.05M 溶液为19.07克
/升。
14.碳酸钠-碳酸氢钠缓冲液(0.1M ) 2+2+
Na2CO2·10H2O分子量=286.2;0.1M溶液为28.62克/升。
N2HCO3分子量=84.0;0.1M溶液为8.40克/升。
PH计校正溶液配置的标准方法
1)pH4,邻苯二甲酸氢钾标准缓冲液:
精密称取在115±5℃干燥2~3小时的邻苯二甲酸氢钾[KHC8H4O4]10.12g,加水使溶解并稀释至1000ml。
2)pH7,磷酸盐标准缓冲液(pH7.4):
精密称取在115±5℃干燥2~3小时的无水磷酸氢二钠4.303g与磷酸二氢钾1.179g,加水使溶解并稀释至1000ml。
另补充:磷酸盐标准缓冲液(pH6.8) 精密称取在115±5℃干燥2~3小时的无水磷酸氢二钠3.533g与磷酸二氢钾3.387g,加水使溶解并稀释至1000ml。
3)pH9,硼砂标准缓冲液:
精密称取硼砂[Na2B4O7·10H2O]3.80g(注意:避免风化),加水使溶解并稀释至1000ml,置聚乙烯塑料瓶中,密塞,避免与空气中二氧化碳接触。
(注:专业文档是经验性极强的领域,无法思考和涵盖全面,素材和资料部分来自网络,供参考。
可复制、编制,期待你的好评与关注)。
