利用荧光染料法检测单核苷酸多态性(SNP)
rtqpcr计算方法

rtqpcr计算方法实时荧光定量PCR(Real-Time Quantitative PCR),也被称为rtqPCR,是一种在生物医学研究中广泛应用的分子生物学技术。
该技术利用荧光标记的探针或者特定的荧光染料,对PCR过程中的产物进行实时监测,通过荧光信号的强弱来实时反映DNA的扩增情况,从而实现对DNA的定量分析。
rtqPCR具有高灵敏度、高特异性和高精度的特点,因此在基因表达分析、突变检测、基因定位等领域有着广泛的应用。
一、实验步骤1. 样品处理:提取待测样品的DNA,进行PCR扩增。
2. 荧光标记:在PCR反应体系中加入荧光标记的探针或者荧光染料。
3. 实时监测:PCR反应过程中,荧光信号被实时监测,并记录荧光信号的变化情况。
4. 数据分析:通过对比标准品或者内参基因的荧光信号,计算待测样品的基因表达量或者DNA拷贝数。
二、荧光染料及探针荧光染料:荧光染料是一种能够吸收特定波长的光并发出另一波长的光的物质,常用于标记DNA或RNA。
在rtqPCR中,常用的荧光染料包括SYBR Green和TaqMan。
SYBR Green是一种通用的染料,可与所有dsDNA结合并产生荧光,因此其特异性较差。
而TaqMan探针是一种专一的荧光染料,其特异性好,因此在基因突变和单核苷酸多态性(SNP)检测中应用广泛。
探针:探针是一种标记有荧光的特异性寡核苷酸片段,可与靶基因结合。
在PCR过程中,随着DNA的扩增,探针与靶基因的结合量增加,从而产生更多的荧光信号。
常用的探针包括TaqMan探针和分子信标。
TaqMan探针是一种较长的寡核苷酸片段,能够与靶基因进行高特异性结合。
分子信标则是一种更短的寡核苷酸片段,与靶基因的结合区域较短,因此具有更高的特异性。
三、数据分析数据分析是rtqPCR实验中非常重要的环节,通过对荧光信号的变化情况进行分析,可以计算出待测样品的基因表达量或者DNA拷贝数。
常用的数据分析方法包括相对定量和绝对定量。
实时荧光定量PCR的研究进展及其应用

实时荧光定量PCR的研究进展及其应用一、本文概述实时荧光定量PCR(Real-Time Quantitative PCR,简称qPCR)是一种在分子生物学领域广泛应用的分子生物学技术,它能够在PCR 扩增过程中实时监测反应产物的积累,从而精确地定量目标DNA或RNA的初始浓度。
自20世纪90年代诞生以来,qPCR技术以其高灵敏度、高特异性、快速性和定量准确等优点,在基因表达分析、病原体检测、基因型鉴定、基因突变分析、药物研发等多个领域发挥了重要作用。
随着技术的不断发展和完善,实时荧光定量PCR已成为现代生物学研究中不可或缺的工具。
本文旨在全面综述实时荧光定量PCR技术的最新研究进展,包括其原理、方法、技术优化、应用领域的拓展以及面临的挑战等。
文章首先简要介绍qPCR技术的基本原理和常用方法,然后重点论述近年来在技术优化、多重PCR、数字化PCR等方向上的进展。
接着,本文详细探讨实时荧光定量PCR在基因表达分析、病原体检测、基因型鉴定、基因突变分析、药物研发等领域的应用案例和前景。
文章还将讨论实时荧光定量PCR面临的挑战,如引物设计、数据分析等问题,并提出相应的解决方案。
通过本文的综述,读者可以对实时荧光定量PCR技术的最新进展和应用有一个全面的了解,为相关研究提供参考和借鉴。
二、实时荧光定量PCR的基本原理与技术特点实时荧光定量PCR(Real-time Fluorescent Quantitative PCR,简称qPCR)是一种在PCR扩增过程中,通过对荧光信号的实时检测,对特定DNA片段进行定量分析的技术。
其基本原理是利用荧光染料或荧光标记的特异性探针,在PCR反应过程中实时检测PCR产物量的变化,从而得到DNA模板的初始浓度。
实时性:通过荧光信号的实时检测,可以实时了解PCR产物的生成情况,无需PCR结束后进行电泳等后续操作,大大缩短了实验时间。
定量性:通过标准曲线的建立,可以准确地计算出DNA模板的初始浓度,实现了PCR的定量分析。
SNP分析原理方法及其应用

SNP分析原理方法及其应用SNP(Single Nucleotide Polymorphism,单核苷酸多态性)是指在基因组中的一些位置上,不同个体之间存在的碱基差异,是常见的遗传变异形式之一、SNP分析是研究SNP在基因与表型之间关联性的方法,用于揭示SNP与遗传疾病、药物反应性等的关系。
本文将介绍SNP分析的原理、方法以及其应用。
一、SNP分析原理1.SNP检测技术:SNP检测技术包括基于DNA芯片的方法、测序技术、实时荧光PCR等。
其中,高通量测序技术是最常用的SNP检测方法,可以同时检测数千个SNP位点。
2.数据分析与统计学方法:通过SNP检测技术获得的数据可以分为基因型数据(AA、AB、BB等)和等位基因频率数据(A频率、B频率等)。
统计学方法常用的有卡方检验、线性回归、逻辑回归等,用于研究SNP与表型之间的关联性。
二、SNP分析方法1.关联分析:关联分析是研究SNP与表型之间关联性的基本方法。
常用的关联分析方法包括单基因型分析、单SNP分析、基因组关联分析(GWAS)等。
单基因型分析主要是比较单个SNP的基因型在表型不同组之间的差异;单SNP分析是研究单个SNP是否与表型相关;GWAS是通过分析数万个SNP与表型之间的关系来找到与表型相关的SNP。
2. 基因型预测:基因型预测是根据已有的SNP数据,通过统计模型来预测个体的基因型。
常用的基因型预测方法有HapMap、PLINK等。
3. 功能注释:功能注释是研究SNP位点的生物学功能,揭示SNP与基因功能、表达水平之间的关系。
常用的功能注释工具有Ensembl、RegulomeDB等。
三、SNP分析应用1.遗传疾病研究:SNP与遗传疾病之间存在着密切的关系。
通过SNP分析可以发现与遗传疾病相关的SNP位点,进一步揭示疾病发生的机制,为疾病的诊断、治疗提供依据。
2.药物反应性研究:个体对药物的反应性往往存在较大差异,这与个体的遗传背景密切相关。
snp位点检测原理

snp位点检测原理宝子们!今天咱们来唠唠SNP位点检测原理这个超有趣的事儿。
SNP呀,全称单核苷酸多态性(Single Nucleotide Polymorphism)。
你可以把咱们的基因组想象成一本超级超级长的书,这书里的每个字就像一个核苷酸。
那SNP 呢,就好比这书里偶尔有一个字和别人那本一样的书里的字不一样。
比如说,你那本写的是“大”,别人的可能写成了“太”,就这么一个小小的差别。
那怎么检测这些小差别呢?有一种方法叫基因测序法。
这就像是一个超级仔细的校对员,要一个一个地把基因组这本书里的字都看一遍。
它是通过测定DNA序列,然后和标准的参考序列进行对比。
就像你拿着自己抄的课文和课本原文比对,一发现哪个字不一样,那可能就是SNP位点啦。
这个过程可不容易呢,就像在大海里捞针一样,但是技术发展到现在,已经能够比较高效地完成这个工作啦。
还有一种方法叫基因芯片技术。
这就像是一个布满了小陷阱的大网。
这个芯片上有好多好多已知的SNP位点对应的小片段。
然后把要检测的DNA样本放上去,如果样本里的DNA在某个SNP位点和芯片上的小片段匹配上了,就会有信号显示出来。
这就好比是小老鼠钻进了专门为它准备的小陷阱,然后我们就知道这个地方有SNP啦。
这种方法特别适合大规模的检测,一下子能检测好多好多的SNP位点呢。
另外呀,还有一种叫做TaqMan探针法。
这个方法有点像捉迷藏里的小机灵鬼。
它有专门设计的探针,这个探针就像一个小侦探,专门找特定的SNP位点。
当这个探针找到目标的时候,就会发出荧光信号。
你想啊,在黑暗里,突然有个地方亮起了小灯,那我们就知道,哦,这里就是我们要找的SNP位点啦。
这个方法准确性也很高呢。
SNP位点检测可是很重要的哦。
它就像一把神奇的小钥匙,可以打开好多健康的秘密。
比如说,有些SNP位点和疾病的发生有关系。
如果我们能准确检测到这些位点,就像提前知道了敌人的弱点一样。
对于那些可能患有某些遗传病的家庭来说,这就像是一盏希望的明灯。
snp鉴定流程

SNP(单核苷酸多态性)鉴定是研究基因变异和关联分析的重要方法。
SNP鉴定流程主要包括以下几个步骤:
1. 样本收集与DNA提取:从生物体(如血液、组织、细胞等)中提取DNA。
2. 基因组DNA定量:使用spectrophotometer(分光光度计)或其他相关设备,对提取的DNA进行定量,确保实验过程中的DNA浓度一致。
3. 基因组DNA酶切:根据实验需求,选择合适的酶切酶,对DNA进行酶切。
酶切后的DNA片段长度分布均匀,便于后续实验操作。
4. 连接酶切片段与荧光标记的适配子:将酶切后的DNA片段与荧光标记的适配子连接,形成复合物。
该步骤为后续杂交和检测打下基础。
5. 杂交与洗涤:将制备好的复合物在特定设备(如杂交箱)中进行杂交,然后洗涤去除未结合的荧光标记适配子。
6. 荧光检测与数据分析:将洗涤后的样本置于荧光检测设备中,检测荧光信号。
根据荧光信号的强弱,分析样本中的SNP位点。
7. 结果验证与分析:对检测结果进行验证,如PCR扩增、测序等。
进一步分析SNP位点的分布、频率等,探讨其与疾病、表型等因素之间的关系。
荧光定量PCR中探针法与染料法的区别

荧光定量PCR中探针法与染料法的区别:一、荧光定量PCR中探针法与染料法的描述:1.荧光定量PCR探针法:探针法即除了引物外另外设置一个探针,在探针的两端分别带上发光集团和淬灭集团,这个时候,两个平衡不发光,但是当DNA 通过引物合成的时候,探针被折断,释放出发光集团和淬灭集团,两个距离较远,发光集团产生荧光,被机器收集到信号,从而检测基因的量2、荧光定量PCR SYBR Green 染料法:染料能够与双链结合,当PCR扩增的时候,染料结合到DNA上,从而发光,单个的染料不发光,这样就能收集到信号,我们可以看出,染料法特异性不强,只要是双链的DNA都回结合发光。
二、荧光定量PCR中探针法与染料法的优缺点1、探针法通过探针可以增加反应收集信号的特异性,只有探针结合的片段上发生扩增才能收集到信号,能够用多重体系反应的方法,能够预测和提前进行反应条件的优化,缺点是要合成探针,成本高2、染料法经济实惠,可以做溶解曲线,分析全部PCR产物的TM值,缺点就是特异性没有探针法好【分享】定量pcr仪选则宝典:各自精彩的选择如何选择合适的定量PCR仪定量PCR仪主要由两部分组成,一个是PCR系统,一个是荧光检测系统。
选择定量PCR仪的关键——由于定量PCR必需借助样本和标准品之间的对比来实现定量的,对于定量PCR系统来说,重要的参数除了传统PCR的温控精确性、升降温速度等等,更重要的还在于样品孔之间的均一性,以避免微小的差别被指数级放大。
至于荧光检测系统,多色多通道检测是当今的主流趋势——仪器的激发通道越多,仪器适用的荧光素种类越多,仪器适用范围就越宽;多通道指可同时检测一个样品中的多种荧光,仪器就可以同时检测单管内多模版或者内标+样品,通道越多,仪器适用范围越宽、性能就更强大。
荧光检测系统主要包括激发光源和检测器。
激发光源有卤钨灯光源、氩离子激光器、发光二极管LED光源,前者可配多色滤光镜实现不同激发波长,而单色发光二极管LED价格低、能耗少、寿命长,不过因为是单色,需要不同的LED才能更好地实现不同激发波长。
单核苷酸多态性(SNP)分析
3
4/27/2013 | Life Technologies™ Proprietary and confidential
பைடு நூலகம்
克隆后测序
将PCR产物克隆后测序,每一个克隆中只含有一种类型的扩增产物,通 过挑取单一克隆可将两种差异的PCR产物分开,展示其中一种类型的扩 增产物单一峰型。可以检测缺失插入型突变,以及突变连锁。
4
4/27/2013 | Life Technologies™ Proprietary and confidential
1
4/27/2013 | Life Technologies™ Proprietary and confidential
通过峰图鉴别突变的要点
单一位点双峰 双峰位置由于两种碱基均分 荧光信号,导致峰型较矮 如果有干扰峰存在,建议正 反向覆盖这一区域两次,确 认是信号峰还是干扰峰
2
4/27/2013 | Life Technologies™ Proprietary and confidential
不适合PCR产物测序鉴定SNP的情况
1. 样品是多倍体(例如8倍体小黑麦)或者检测组织中部分含 有突变的细胞,这种情况有可能扩增出的突变产物在总产物 中含量很少,突变碱基贡献的荧光值很低,被当作背景峰型 压低,在结果中无法体现或无法判别。 2. 样品中的SNP为缺失插入型,由于出现后双峰无法辨别序列 信息。 3. 样品中SNP位点较多,需要确认连锁关系。 上述三种情况均可以采用克隆后测序解决。
PCR产物测序
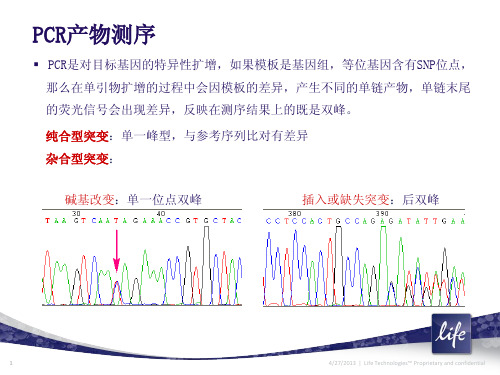
PCR是对目标基因的特异性扩增,如果模板是基因组,等位基因含有SNP位点, 那么在单引物扩增的过程中会因模板的差异,产生不同的单链产物,单链末尾 的荧光信号会出现差异,反映在测序结果上的既是双峰。 纯合型突变:单一峰型,与参考序列比对有差异 杂合型突变: 碱基改变:单一位点双峰 插入或缺失突变:后双峰
高分辨熔解技术常用荧光染料的SNP基因分型能力比较

高分辨熔解技术常用荧光染料的SNP基因分型能力比较尤崇革;李晓军;郜莉娜;李菲菲【摘要】目的评价LC Green、Syto 9和Eva Green 3种高分辨熔解(HRM)染料对单核苷酸多态性(SNP)基因分型的能力.方法以肿瘤坏死因子(TNF)基因启动子-857 C >T(rs1799724)位点为例,分别用上述3种荧光染料进行PCR-HRM检测,依据特征熔解曲线进行基因分型并测序验证.基因分型能力评价以野生型与纯合突变型PCR产物Tm值之差(△Tm)来表示.结果PCR-HRM检测到4种特征熔解曲线,经测序后发现第4条为双突变杂合,包含-863C>A(rs1800630)位点.HRM染料LC Green,Syto 9,EVa Green的基因分型能力分别为(0.52±0.030)℃、(0.51±0.066)℃和(0.39±0.152)℃.其中Syto 9野生型(CC)和突变型(TT)的变异系数(CV)均为0.03%,为3种染料中最低.结论3种染料均能用于HRM技术进行SNP基因分型,Syto 9和LC Green分辨率优于Eva Green,其中Syto 9易用性最好、Eva Green性价比最高.【期刊名称】《临床检验杂志》【年(卷),期】2011(029)008【总页数】3页(P575-577)【关键词】LC Green;Syto 9;Eva Green;高分辨熔解技术;单核苷酸多态性【作者】尤崇革;李晓军;郜莉娜;李菲菲【作者单位】南京军区南京总医院解放军临床检验医学研究所,南京210002;兰州大学第二医院中心实验室,兰州730030;南京军区南京总医院解放军临床检验医学研究所,南京210002;兰州大学第二医院中心实验室,兰州730030;兰州大学第二医院中心实验室,兰州730030【正文语种】中文【中图分类】Q75单核苷酸多态性(single nucleotide polymorphisms,SNPs)作为第三代遗传标记被广泛用于疾病基因组学和药物基因组学以及分子诊断研究。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
利用荧光染料法检测单核苷酸多态性(SNP)
单核苷酸多态性(single nucleotide polymorphism, SNP)是指基因组DNA中某一特定核苷酸位置上发生转换、颠换、插入或缺失等变化,并且任何一种等位基因在群体中的频率不小于1%。
一般来说,一个SNP位点只有两种等位基因,因此又叫双等位基因。
SNP是继RFLP 和STR后的第三代分子标记,具有数量多、分布广和遗传稳定等特点。
它与许多疾病直接相关,是决定人类疾病易感性和药物反应差异的主要因素。
因此,SNP分析对于群体遗传学、疾病相关基因的研究、新药研究、临床检验和分子诊断等领域有着重要作用。
荧光定量PCR中的SNP分析平台主要是基于等位基因特异性杂交原理,通过检测PCR过程中产生的荧光信号来区分等位基因,每检测一个SNP位点需要一对TaqMan探针(或分子信标)和一对位于检测位点的上下游引物。
下面介绍一种新的基于荧光定量PCR 检测SNP位点的方法,它不需要设计特异性的TaqMan探针,只是通过溶解曲线的分析来区分等位基因,从而大大降低了检测成本。
该方法使用了两种不同的等位基因特异性正向引物,每个正向引物3′端的最后一个碱基对应于SNP位点的二等位基因,反向引物都一样,并使用荧光染料(SYBRGreenI)来检测PCR产物。
纯合子基因组DNA只能被与其完全匹配的正向引物扩增,而杂合子基因组DNA能同时和两种正向引物结合扩增出两种PCR产物。
为了区分这两种扩增产物,我们在其中一个等位基因特异性引物的5′加一个20bp左右含GC重复序列。
由于DNA的溶解温度主要与其片段长度和GC含量有关,经过修饰后的引物的长度和GC含量明显高于另一个等位基因特异引物,因此,使用这两种引物后的PCR扩增产物有着不同的Tm值。
在PCR扩增结束后,运行一个溶解曲线程序,即让产物慢慢从60度升温到90度,从溶解曲线图上就可以分析出哪种等位基因参与了PCR扩增,由此也得到了相应的基因组的基因型。
补充一点:
1. 在PCR反应体系中,加入过量SYBR Green I荧光染料,SYBR荧光染料掺入DNA 双链后荧光信号显著增强;当DNA变性时SYBR Green I染料释放出来,荧光急剧减少;随后在聚合延伸过程中引物退火并形成PCR产物,SYBR Green染料与双链产物结合,经检
测获得荧光的净增量。
荧光信号的增加与PCR产物的增加完全同步。
荧光染料可以在反应末尾对扩增产物进行溶解,称为溶解曲线分析。
在溶解曲线分析过程中,随着温度从低于产物溶解点缓慢升到高于产物溶解点,定量PCR仪连续监测每个样品的荧光值。
基于产物长度和G/C含量的不同,扩增产物会在不同的温度点解链。
随着产物的解链就可以看到荧光值的降低并被仪器所测量。
对溶解曲线进行微分可以计算出溶解峰。
溶解峰可以反映反应中扩增到的产物,因此用溶解曲线数据就可以进行定量监督了。
2 .HRM,即High Resolution Melt,高分辨率溶解曲线,这是一种通过比对不同DNA分子溶解度的不同从而检测突变的方法。
可以用来检测突变、SNP等,目前在突变筛查、产前诊断、肿瘤早期诊断乃至生物分子进化方面都有应用,不过大部分的文章都集中在国外。
可以进行HRM检查的机器要求要在DNA双链变性的过程中以0.1-0.3度/s的速率变化,从而保证所做出曲线的准确性。
目前我所知道的能进行检测的仪器包括:RotorGene 6000(主要用于RT-PCR,HRM属于副业);HR-1(Idaho tech),单通道,一次上样10微升,需要毛细管,不能进行PCR;Lightscanner,多通道,分96和384两种,不能进行PCR)。
