物化课后习题,第10章,化学动力学
物理化学习题详细答案

葛华才等编.《物理化学》(多媒体版)配套部分章节的计算题解.高等教育出版社第一章热力学第一定律第二章热力学第二定律第三章多组分系统第四章化学平衡第五章相平衡第六章化学动力学第七章电化学第八章界面现象第九章胶体化学第十章统计热力学第一章热力学第一定律计算题1. 两个体积均为V 的密封烧瓶之间有细管相连,管内放有氮气。
将两烧瓶均放入100℃的沸水时,管内压力为50kPa。
若一只烧瓶仍浸在100℃的沸水中,将另一只放在0℃的冰水中,试求瓶内气体的压力。
解:设瓶内压力为p′,根据物质的量守恒建立如下关系:(p′V/373.15)+ (p′V/273.15)= 2(pV/373.15)即p′=2×50 kPa/(1+373.15/273.15)=42.26 kPa2. 两个容器A 和B 用旋塞连接,体积分别为1dm3 和3dm3,各自盛有N2 和O2(二者可视为理想气体),温度均为25℃,压力分别为100kPa 和50kPa。
打开旋塞后,两气体混合后的温度不变,试求混合后气体总压及N2 和O2的分压与分体积。
解:根据物质的量守恒建立关系式p 总(V A+V B)/ 298.15=( p A V A /298.15)+ (p B V B /298.15)得p 总= ( p A V A+ p B V B)/ (V A+V B) = (100×1+50×3) kPa/(1+3)=62.5 kPan(N2)= p A V A /RT A= {100000×0.001/(8.315×298.15)}mol = 0.04034 moln(O2)= p B V B /RT B= {50000×0.003/(8.315×298.15)}mol = 0.06051 mol葛华才编.《物理化学》(多媒体版)配套部分章节的计算题解.高等教育出版社-3 y (N 2)= n (N 2)/{ n (N 2)+ n (O 2)}= 0.04034/(0.04034+0.06051)=0.4y (O 2)=1- y (N 2)=1-0.4=0.6分压p (N 2)= y (N 2) p 总 = 0.4×62.5 kPa= 25 kPap (O 2)= y (O 2) p 总 = 0.6×62.5 kPa= 37.5 kPa分体积 V (N 2)= y (N 2) V 总 = 0.4×4 dm 3 = 1.6 dm 3V (O 2)= y (O 2) V 总 = 0.6×4 dm 3 = 2.4 dm 33. 在 25℃,101325Pa 下,采用排水集气法收集氧气,得到 1dm 3 气体。
天津大学物理化学教研室《物理化学》(第5版)(下册)配套题库

目 录第一部分 名校考研真题第7章 电化学第8章 量子力学基础第9章 统计热力学初步第10章 界面现象第11章 化学动力学第12章 胶体化学第二部分 课后习题第7章 电化学第8章 量子力学基础第9章 统计热力学初步第10章 界面现象第11章 化学动力学第12章 胶体化学答:分散相粒子直径d介于1~1000nm范围内的高分散系统称为胶体系统。
胶体系统的主要特征:高分散性、多相性和热力学不稳定性。
答:在暗室中,将一束经过聚集的光线投射到胶体系统上,在与入射光垂直的方向上,可观察到一个发亮的光锥,称为丁泽尔效应。
丁泽尔效应的实质是胶体粒子对光的散射。
可见光的波长在400~760nm的范围内,而一般胶体粒子的尺寸为1~1000nm。
当可见光投射到胶体系统时,如胶体粒子的直径小于可见光波长,则发生光的散射现象,产生丁泽尔效应。
答:胶体粒子带电、溶剂化作用和布朗运动是溶胶稳定存在的三个重要原因。
(1)胶体粒子表面通过以下两种方式而带电:①固体表面从溶液中有选择性地吸附某种离子而带电;②固体表面上的某些分子、原子在溶液中发生解离,使固体表面带电。
各胶体粒子带同种电荷,彼此之间相互排斥,有利于溶胶稳定存在。
(2)溶剂化作用:对于水为分散介质的胶体系统,胶粒周围存在一个弹性的水化外壳,增加了溶胶聚合的机械阻力,有利于溶胶稳定。
(3)布朗运动:分散相粒子的布朗运动足够强时,能够克服重力场的影响而不下沉,这种性质称为溶胶的动力稳定性。
答:胶体粒子带电、溶剂化作用及布朗运动是溶胶稳定的三个重要原因。
中和胶体粒子所带的电荷,降低溶剂化作用皆可使溶胶聚沉。
其中,加入过量的电解质(尤其是含高价反离子的电解质)是最有效的方法。
原因:增加电解质的浓度和价数,可以使扩散层变薄,斥力势能下降。
随电解质浓度的增加,使溶胶发生聚沉的势垒的高度相应降低。
当引力势能占优势时,胶体粒子一旦相碰即可聚沉。
答:乳化剂分子具有一端亲水而另一端亲油的特性,其两端的横截面通常大小不等。
物理化学中国石油大学课后习题答案第10章

1. 请根据质量作用定律写出下列基元反应的反应速率表示式(试用各种物质分别表示)。
()()()()21 A+B 2P 2 2A+B 2P 3 A+2B P+2S 4 2Cl+M Cl +M k k ⎯⎯→⎯⎯→⎯⎯→⎯→⎯解:()[][][][][]d A d B d P 11A d d 2d r k t t t =−=−==B ()[][][][][]2d A d B d P 112=2d d 2d r k t t t =−=−=A B()[][][][][][]2d A d B d P d S 113===A d 2d d 2d r k t t t t =−−=B ()[][][][]22d Cl d Cl 14==Cl 2d d r k t t=−M2. 某气相反应速率表示式分别用浓度和压力表示时为[]A nc c r k =−和,试求和之间的关系,设气体为理想气体。
A np p r k p =−c k p k 解: 设反应为 ()()A g B g p k⎯⎯→A Ad d np p p r k t=−=p 因A A p c RT =,代入上式得 ()()A A d d np p c RT r k t =−=c RT 则 ()1A A d d n n c p c c r k RT c k c t−−===An()1n c p k k RT −= 故()1np c k RT k −=3.时N 298K 2O 5(g)分解反应半衰期12t 为5.7h ,此值与N 2O 5的起始浓度无关,试求: (1)该反应的速率常数; (2)作用完成时所需时间。
90%解:(1)因反应的半衰期与反应物起始浓度无关,故此反应为一级反应,其反应速率常数为 1112ln 2ln 2h 0.1216h 5.7k t −−⎛⎞===⎜⎟⎝⎠(2)由一级反应的动力学方程1ln1kt y=−和转化率0.90y =,可得 1111ln ln h 18.94h 10.121610.9t k y ⎛⎞==×=⎜⎟−−⎝⎠4.某人工放射性元素,放出a 粒子,半衰期为15m 。
物理化学各章复习题 附答案

第一章化学热力学基础1.4 练习题1.4.1 判断题1.可逆的化学反应就是可逆过程。
2.Q和W不是体系的性质,与过程有关,所以Q + W也由过程决定。
3.焓的定义式H = U + pV是在定压条件下推导出来的,所以只有定压过程才有焓变。
4.焓的增加量DH等于该过程中体系从环境吸收的热量。
5.一个绝热过程Q = 0,但体系的DT不一定为零。
6.对于一定量的理想气体,温度一定,热力学能和焓也随之确定。
7.某理想气体从始态经定温和定容两过程达终态,这两过程的Q、W、DU与DH是相等的。
8.任何物质的熵值是不可能为负值和零的。
9.功可以全部转化为热,但热不能全部转化为功。
10.不可逆过程的熵变是不可求的。
11.某一过程的热效应与温度相除,可以得到该过程的熵变。
12.在孤立体系中,一自发过程由A→B,但体系永远回不到原来状态。
13.绝热过程Q = 0,即,所以d S = 0。
14.可以用一过程的熵变与热温熵的大小关系判断其自发性。
15.绝热过程Q = 0,而由于DH = Q,因而DH等于零。
16.按Clausius不等式,热是不可能从低温热源传给高温热源的。
17.在一绝热体系中,水向真空蒸发为水蒸气 <以水和水蒸气为体系>,该过程W>0,DU>0。
18.体系经过一不可逆循环过程,其DS体>0。
19.对于气态物质,C p-C V = n R。
20.在一绝热体系中有一隔板,两边分别是空气和真空,抽去隔板,空气向真空膨胀,此时Q = 0,所以DS=0。
1.4.2 选择题1.273K, p q时,冰融化为水的过程中,下列关系式正确的有.A.W<0 B. DH = Q P C. DH<0 D. DU<02.体系接受环境作功为160J,热力学能增加了200J,则体系.A.吸收热量40J B.吸收热量360JC.放出热量40J D.放出热量360J3.在一绝热箱,一电阻丝浸入水中,通以电流。
若以水和电阻丝为体系,其余为环境,则.A.Q> 0,W = 0,DU > 0 B.Q =0,W = 0,DU > 0C.Q = 0,W> 0,DU > 0 D.Q< 0,W = 0,DU < 04.任一体系经一循环过程回到始态,则不一定为零的是.A.DG B.DS C.DU D.Q5.对一理想气体,下列哪个关系式不正确.A. B.C. D.6.当热力学第一定律写成d U = δQ–p d V时,它适用于.A.理想气体的可逆过程 B.封闭体系的任一过程C.封闭体系只做体积功过程 D.封闭体系的定压过程7.在一绝热钢壁体系,发生一化学反应,温度从T1→T2,压力由p1→p2,则.A.Q>0,W>0,DU > 0 B.Q = 0,W<0,DU <0C.Q = 0,W>0,DU >0 D.Q = 0,W = 0,DU = 08.理想气体混合过程中,下列体系的性质,不正确的是.A.DS>0 B.DH =0 C.DG = 0 D. DU = 09.任意的可逆循环过程,体系的熵变.A.一定为零 B.一定大于零 C.一定为负 D.是温度的函数10.一封闭体系,从A→B变化时,经历可逆〔R〕和不可逆<IR>途径,则.A .Q R = Q IRB .C .W R = W IRD . 11.理想气体自由膨胀过程中.A .W = 0,Q >0,DU >0,DH =0B .W >0,Q =0,DU >0,DH >0C .W <0,Q >0,DU =0,DH =0D .W = 0,Q =0,DU =0,DH =012.H 2和O 2在绝热定容的体系中生成水,则.A .Q =0,DH >0,DS 孤 = 0B .Q >0,W = 0,DU >0C .Q >0,DU >0,DS 孤>0D . Q =0,W = 0,DS 孤>013.理想气体可逆定温压缩过程中,错误的有.A . DS 体= 0B . DU =0C .Q <0D . DH =014.当理想气体反抗一定的外压做绝热膨胀时,则.A. 焓总是不变的 B .热力学能总是不变的 C .焓总是增加的 D .热力学能总是减小的 15.环境的熵变等于.A .B .C .D . 1.4.3 填空题1.理想气体的定温可逆膨胀体系做的功最,定温可逆压缩过程环境做的功最。
物理化学第四版课后答案
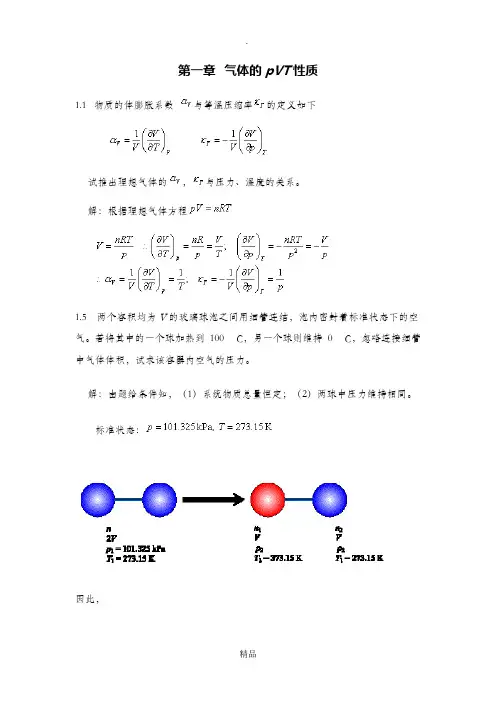
第一章气体的pVT性质1.1物质的体膨胀系数与等温压缩率的定义如下试推出理想气体的,与压力、温度的关系。
解:根据理想气体方程1.5两个容积均为V的玻璃球泡之间用细管连结,泡内密封着标准状态下的空气。
若将其中的一个球加热到100 C,另一个球则维持0 C,忽略连接细管中气体体积,试求该容器内空气的压力。
解:由题给条件知,(1)系统物质总量恒定;(2)两球中压力维持相同。
标准状态:因此,1.9 如图所示,一带隔板的容器内,两侧分别有同温同压的氢气与氮气,二者均可视为理想气体。
(1)保持容器内温度恒定时抽去隔板,且隔板本身的体积可忽略不计,试求两种气体混合后的压力。
(2)隔板抽取前后,H2及N2的摩尔体积是否相同?(3)隔板抽取后,混合气体中H2及N2的分压立之比以及它们的分体积各为若干?解:(1)等温混合后即在上述条件下混合,系统的压力认为。
(2)混合气体中某组分的摩尔体积怎样定义?(3)根据分体积的定义对于分压1.11 室温下一高压釜内有常压的空气,为进行实验时确保安全,采用同样温度的纯氮进行置换,步骤如下:向釜内通氮气直到4倍于空气的压力,尔后将釜内混合气体排出直至恢复常压。
重复三次。
求釜内最后排气至恢复常压时其中气体含氧的摩尔分数。
解:分析:每次通氮气后至排气恢复至常压p,混合气体的摩尔分数不变。
设第一次充氮气前,系统中氧的摩尔分数为,充氮气后,系统中氧的摩尔分数为,则,。
重复上面的过程,第n次充氮气后,系统的摩尔分数为,因此。
1.13 今有0 C,40.530 kPa的N2气体,分别用理想气体状态方程及van der Waals 方程计算其摩尔体积。
实验值为。
解:用理想气体状态方程计算用van der Waals计算,查表得知,对于N2气(附录七),用MatLab fzero函数求得该方程的解为也可以用直接迭代法,,取初值,迭代十次结果1.16 25 C时饱和了水蒸气的湿乙炔气体(即该混合气体中水蒸气分压力为同温度下水的饱和蒸气压)总压力为138.7 kPa,于恒定总压下冷却到10 C,使部分水蒸气凝结为水。
南京大学《物理化学》考试 第十章 化学动力学基础(一)

第十章化学动力学基础(一)物化试卷(一)1. 气相反应A + 2B ─> 2C,A 和 B 的初始压力分别为 p(A)和 p(B),反应开始时并无 C,若 p 为体系的总压力,当时间为 t 时,A 的分压为:(A) p(A)- p(B) (B) p - 2p(A)(C) p - p(B) (D) 2(p - p(A)) - p(B)2. 如果反应 2A + B = 2D 的速率可表示为: r = -1/2 dc(A)/dt = - dc(B)/dt = 1/2dc(D)/dt 则其反应分子数为:(A) 单分子(B) 双分子(C) 三分子(D) 不能确定3. 某反应进行完全所需时间是有限的,且等于c0/k,则该反应是:(A) 一级反应(B) 二级反应(C) 零级反应(D) 三级反应4. 某反应A → B,反应物消耗 3/4 所需时间是其半衰期的 5 倍,此反应为:(A) 零级反应(B) 一级反应(C) 二级反应(D) 三级反应5. 某反应无论反应物的起始浓度如何,完成 65% 反应的时间都相同,则反应的级数为:(A) 0 级反应(B) 1 级反应(C) 2 级反应(D) 3 级反应6. 一个反应的活化能是33 kJ/mol, 当 T = 300 K 时,温度每增加 1K,反应速率常数增加的百分数约是:(A) 4.5% (B) 90%(C) 11% (D) 50%7. 已知某反应的级数为一级,则可确定该反应一定是:(A) 简单反应(B) 单分子反应(C) 复杂反应(D) 上述都有可能8. 1-1 级对峙反应由纯 A 开始反应,当进行到 A 和 B 浓度相等的时间为: (正、逆向反应速率常数分别为 k1 ,k2)(A) t = ln(k1/k2)(B) t =1/(k1-k2)×ln(k1/k2)(C) t = 1/(k1+k2)×ln[2k1/(k1-k2)](D) t= 1/(k1+k2)×ln[k1/(k1-k2)]9. 反应 A B (I);A D (II),已知反应 I 的活化能 E1大于反应 II 的活化能E2,以下措施中哪一种不能改变获得 B 和 D 的比例?(A) 提高反应温度(B) 延长反应时间(C) 加入适当催化剂(D) 降低反应温度10. 化学反应速率常数的 Arrhenius 关系式能成立的范围是:(A) 对任何反应在任何温度范围内(B) 对某些反应在任何温度范围内(C) 对任何反应在一定温度范围内(D) 对某些反应在一定温度范围内11. 饱和分子间反应活化能一般都是:(A) 比较小(B) 167kJ/mol 以上(C) 不需要活化能(D) 400kJ/mol 以上12. 在反应 A B C,A D 中,活化能E1> E2> E3,C 是所需要的产物,从动力学角度考虑,为了提高 C 的产量,选择反应温度时,应选择:(A) 较高反应温度(B) 较低反应温度(C) 适中反应温度(D) 任意反应温度13. 反应2A → P 为二级反应,其半衰期:(A) 与无关(B) 与成正比(C) 与成反比(D) 与[A]成反比为反应物 A 的起始浓度。
物理化学课后习题答案(全)
第1章 物质的pVT 关系和热性质习 题 解 答1. 两只容积相等的烧瓶装有氮气,烧瓶之间有细管相通。
若两只烧瓶都浸在100℃的沸水中,瓶内气体的压力为0.06MPa 。
若一只烧瓶浸在0℃的冰水混合物中,另一只仍然浸在沸水中,试求瓶内气体的压力。
解: 21n n n +=2212112RT V p RT V p RT V p +=⋅2111121222112p T p T T p T T T T =+⎛⎝⎜⎞⎠⎟=+ ∴112222p T T T p ⋅+=MPa0.0507=MPa 06.02)15.273100()15.2730(15.2730⎥⎦⎤⎢⎣⎡××++++=2. 测定大气压力的气压计,其简单构造为:一根一端封闭的玻璃管插入水银槽内,玻璃管中未被水银充满的空间是真空,水银槽通大气,则水银柱的压力即等于大气压力。
有一气压计,因为空气漏入玻璃管内,所以不能正确读出大气压力:在实际压力为102.00kPa 时,读出的压力为100.66kPa ,此时气压计玻璃管中未被水银充满的部分的长度为25mm 。
如果气压计读数为99.32kPa ,则未被水银充满部分的长度为35mm ,试求此时实际压力是多少。
设两次测定时温度相同,且玻璃管截面积相同。
解:对玻璃管中的空气,p V p V 2211=kPa 0.96=kPa )66.10000.102(35251212−×==p V V p ∴ 大气压力 = kPa 28.100kPa )96.032.99(=+·28· 思考题和习题解答3. 让20℃、20 dm 3的空气在101325 Pa 下缓慢通过盛有30℃溴苯液体的饱和器,经测定从饱和器中带出0.950 g 溴苯,试计算30℃时溴苯的饱和蒸气压。
设空气通过溴苯之后即被溴苯蒸气所饱和;又设饱和器前后的压力差可以略去不计。
(溴苯Br H C 56的摩尔质量为1mol g 0.157−⋅)解:n pV RT 131013252010831452027315==×××+⎡⎣⎢⎤⎦⎥−().(.) mol =0.832 mol n m M 209501570==..mol =0.00605mol p py p n n n 22212101325732==+=×= Pa 0.006050.832+0.00605 Pa4. 试用范德华方程计算1000 g CH 4在0℃、40.5 MPa 时的体积(可用p 对V 作图求解)。
物化课后习题,第10章,化学动力学
第八章 化学动力学 —— 课后习题解答难度级别:基础 ★ ,基础 2★,综合 3★,综合 4★,超纲 5★对于作业:公式有必要切记,可是平时作业时最好是自己着手推导出比较简单的公式,而不是直接翻书,找到公式,套公式,这样的解题方式不值得提议。
1.(基础 ★ )气体反响 2222为一级反响。
在-5 -1 。
求半衰期和反响 2h 后分SO Cl = SO + Cl 593K 时的 k = × 10s解的百分比。
解: t 1/ 2 ln 20.69331500 s (计算有点误差 31507 s ),k 2.20 10 5lnc 0xkt2.2 10 523600 1.584 10 1c 0c 01 ,x 1.1716 1c 0 x 1.1716c 01.1716100% 14.65%x1c 02.(基础 ★ )镭原子演变成一个 Rn 和一个 α粒子。
它的半衰期是 1622 年,反响是一级。
问 1g 无水溴化镭 RaBr 在 10 年内能放出多少RnRn 的量用 0℃ ,标准压力下的体积( cm 3)来表示。
2 解: kln 2 / t 1/ 2 0.692 /1622 4.273 10 4 a 1 ,lnc 0 xkt 4.273 10 4 10 4.273 10 3 ,c 0c 01.00428c 0 x1g 无水溴化镭的物质的量为在同一个密闭的容器中1 0.00259mol ,也就是溴离子物质的量3860.00259 1.00428x 1.105 10 5 mol0.00259 x故 1g 无水溴化镭在10 年内能放出在0℃ ,标准大气压下 Rn 的体积为- 533V = × 10×× 10= 0.248 cm【讨论】(1)元素周期表应看作为一个常用的工具备在身边, Ra 的原子量为 226,溴的原子量为 80;( 2)单位是灵便的,能够依照详细的情况而定,目的则是为了方便计算;(3)无水溴化镭RaBr 2 不是气体这样在浓度表达上有问题吗4.(基础 ★ ★ )某二级反响在 a = b 时,经过 500s 原始物作用了 20%,问原始物作用 60%时须经过多少时间马鞍山,尹中兴, 2007 ,0.2c 00.2解: k0.8c 0 500c 0 ( c 0 0.2c 0 )500作用 60%需用的时间为0.6c 0kt0.2t , ∴ t =0.6 0.8c 0 500c 0 (c 0 0.6c 0 )0.8c 0 0.4c 03000 s5000.2【讨论】(1)有 a = b 这样的化学反响吗除了原子衰变 / 演变( 2)这个题目有什么本质意义( 3)建议在解题的过程中自己着手推导二级反响的c-t 关系式,并且最幸亏开始就写出二级反响的 c-t 公式来。
南京大学《物理化学》考试 第十章 化学动力学基础(一)
第十章化学动力学基础(一)物化试卷(一)1. 气相反应A + 2B ─> 2C,A 和 B 的初始压力分别为 p(A)和 p(B),反应开始时并无 C,若 p 为体系的总压力,当时间为 t 时,A 的分压为:(A) p(A)- p(B) (B) p - 2p(A)(C) p - p(B) (D) 2(p - p(A)) - p(B)2. 如果反应 2A + B = 2D 的速率可表示为: r = -1/2 dc(A)/dt = - dc(B)/dt = 1/2dc(D)/dt 则其反应分子数为:(A) 单分子(B) 双分子(C) 三分子(D) 不能确定3. 某反应进行完全所需时间是有限的,且等于c0/k,则该反应是:(A) 一级反应(B) 二级反应(C) 零级反应(D) 三级反应4. 某反应A → B,反应物消耗 3/4 所需时间是其半衰期的 5 倍,此反应为:(A) 零级反应(B) 一级反应(C) 二级反应(D) 三级反应5. 某反应无论反应物的起始浓度如何,完成 65% 反应的时间都相同,则反应的级数为:(A) 0 级反应(B) 1 级反应(C) 2 级反应(D) 3 级反应6. 一个反应的活化能是33 kJ/mol, 当 T = 300 K 时,温度每增加 1K,反应速率常数增加的百分数约是:(A) 4.5% (B) 90%(C) 11% (D) 50%7. 已知某反应的级数为一级,则可确定该反应一定是:(A) 简单反应(B) 单分子反应(C) 复杂反应(D) 上述都有可能8. 1-1 级对峙反应由纯 A 开始反应,当进行到 A 和 B 浓度相等的时间为: (正、逆向反应速率常数分别为 k1 ,k2)(A) t = ln(k1/k2)(B) t =1/(k1-k2)×ln(k1/k2)(C) t = 1/(k1+k2)×ln[2k1/(k1-k2)](D) t= 1/(k1+k2)×ln[k1/(k1-k2)]9. 反应 A B (I);A D (II),已知反应 I 的活化能 E1大于反应 II 的活化能E2,以下措施中哪一种不能改变获得 B 和 D 的比例?(A) 提高反应温度(B) 延长反应时间(C) 加入适当催化剂(D) 降低反应温度10. 化学反应速率常数的 Arrhenius 关系式能成立的范围是:(A) 对任何反应在任何温度范围内(B) 对某些反应在任何温度范围内(C) 对任何反应在一定温度范围内(D) 对某些反应在一定温度范围内11. 饱和分子间反应活化能一般都是:(A) 比较小(B) 167kJ/mol 以上(C) 不需要活化能(D) 400kJ/mol 以上12. 在反应 A B C,A D 中,活化能E1> E2> E3,C 是所需要的产物,从动力学角度考虑,为了提高 C 的产量,选择反应温度时,应选择:(A) 较高反应温度(B) 较低反应温度(C) 适中反应温度(D) 任意反应温度13. 反应2A → P 为二级反应,其半衰期:(A) 与无关(B) 与成正比(C) 与成反比(D) 与[A]成反比为反应物 A 的起始浓度。
化学动力学习题答案
化学动力学习题答案化学动力学习题答案化学动力学是研究化学反应速率的科学,它揭示了反应速率与反应物浓度、温度、催化剂等因素之间的关系。
在学习化学动力学的过程中,我们经常会遇到一些练习题,下面我将给出一些常见的化学动力学习题的答案,帮助大家更好地理解和掌握这一领域的知识。
1. 问题:已知反应A → B的速率方程为v = k[A],求当反应物A的浓度为0.1mol/L时,反应速率为多少?答案:根据速率方程v = k[A],将浓度[A]代入可得v = k × 0.1 = 0.1k。
所以当[A]为0.1mol/L时,反应速率为0.1k。
2. 问题:已知反应2A + B → C的速率方程为v = k[A]^2[B],求当反应物A的浓度为0.2mol/L,反应物B的浓度为0.3mol/L时,反应速率为多少?答案:根据速率方程v = k[A]^2[B],将浓度[A]和[B]代入可得v = k × (0.2)^2 × 0.3 = 0.012k。
所以当[A]为0.2mol/L,[B]为0.3mol/L时,反应速率为0.012k。
3. 问题:已知反应A → B的速率方程为v = k[A],当反应物A的浓度为0.1mol/L时,反应速率为0.05mol/L·s。
求速率常数k的值是多少?答案:根据速率方程v = k[A],将浓度[A]和反应速率v代入可得0.05 = k × 0.1,解得k = 0.5mol/L·s。
4. 问题:已知反应2A + B → C的速率方程为v = k[A]^2[B],当反应物A的浓度为0.2mol/L,反应物B的浓度为0.3mol/L时,反应速率为0.024mol/L·s。
求速率常数k的值是多少?答案:根据速率方程v = k[A]^2[B],将浓度[A]、[B]和反应速率v代入可得0.024 = k × (0.2)^2 × 0.3,解得k ≈ 0.8mol/L·s。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第八章 化学动力学* ——课后习题解答难度级别:基础★,基础2★,综合3★,综合4★,超纲5★关于作业:公式有必要牢记,但是平时作业时最好是自己动手推导出比较简单的公式,而不是直接翻书,找到公式,套公式,这样的解题方式不值得提倡。
1.(基础★)气体反应SO 2Cl 2 = SO 2 + Cl 2为一级反应。
在593K 时的k = 2.20×10-5 s -1。
求半衰期和反应2h 后分解的百分比。
解:1/25ln 20.693315002.2010t s k -===⨯(计算有点误差31507 s ), 5100ln2.21023600 1.58410c kt c x--==⨯⨯⨯=⨯- 00001 1.171611.1716100%14.65%1.17161c x x c x c c -===⨯=--,2.(基础★)镭原子蜕变成一个Rn 和一个α粒子。
它的半衰期是1622年,反应是一级。
问1g 无水溴化镭RaBr 2在10年内能放出多少Rn ?Rn 的量用0℃,标准压力下的体积(cm 3)来表示。
解:411/2ln 2/0.692/1622 4.27310k t a --===⨯,4300ln4.2731010 4.27310c kt c x--==⨯⨯=⨯-, 00 1.00428c c x∴=- 1g 无水溴化镭的物质的量为10.00259386mol =,也就是溴离子物质的量 在同一个密闭的容器中50.002591.00428 1.105100.00259x mol x-=⇒=⨯-故1g 无水溴化镭在10年内能放出在0℃,标准大气压下Rn 的体积为V = 1.105×10-5×22.4×103 = 0.248 cm 3【讨论】(1)元素周期表应该作为一个常用的工具备在身边,Ra 的原子量为226,溴的原子量为80;(2)单位是灵活的,可以根据具体的情况而定,目的则是为了方便计算;(3)无水溴化镭RaBr 2不是气体?这样在浓度表达上有问题吗? 4.(基础★★)某二级反应在a = b 时,经过500s 原始物作用了20%,问原始物作用60%时须经过多少时间?*马鞍山,尹振兴,2007,zhenxingyin@解:000000.20.2(0.2)5000.8500c k c c c c ==-⨯作用60%需用的时间为000000.60.2(0.6)0.8500c kt t c c c c ==-⨯, ∴t = 000.85000.630000.40.2c c ⨯⨯=s【讨论】(1)有a = b 这样的化学反应吗?除了原子衰变/蜕变?(2)这个题目有什么实际意义?(3)建议在解题的过程中自己动手推导二级反应的c-t 关系式,并且最好在开始就写出二级反应的c-t 公式来。
5.(综合3★)“一个反应进行完全所需时间是2t 1/2”这种说法对吗?反应物浓度降低75%所需时间,对(1)零级反应;(2)一级反应;(3)二级反应各为t 1/2的几倍?答:这种说法不正确,因为半衰期是反应物消耗一半所需的时间,不是一个反应进行完全的一半时间,所以一个反应进行完全所需的时间不可能是简单的2个半衰期的时间。
(那么推测一下,反应完全的时间是大于还是小于2t 1/2,或者不一定?)(1)零级反应:001/20.752c ct t k k==, ,∴1/2/ 1.5t t =,反应物降低75%所需的时间为其t 1/2的1.5倍;(2)一级反应:00001111ln 4ln ln ln 0.250.25c c t k c x k c k k ====- ,1/2ln 2t k=, ∴1/2/ln 4/ln 22t t ==,反应物降低75%所需时间为其t 1/2的2倍; (3)二级反应:0000110.753()0.25x t k c c x k c kc ===-g g ,1/201t kc =, ∴1/2/3t t =,反应物降低75%所需时间为其t 1/2的3倍【讨论】这道题非常好,挺有启发性,可以帮助我们加深对半衰期的理解,对比三类反应的特征,下面作一个简单的归纳(建议同学们都自己动手完成): (1)零级反应:x kt =,半衰期 01/22c t k=,与起始浓度有关,且成正比; (2)一级反应:00lnc kt c x =-,半衰期 1/2ln 2t k =,与起始浓度无关; (3)二级反应:00()xkt c c x =-,半衰期 1/201t kc =,与起始浓度有关,且成反比; 这里关键的问题是,我们能否对此给出一个解释,帮助理解为什么级数不同的反应,半衰期的特征不同呢?反应的级数在不同的条件下是否会发生变化? 6.(基础★★)证明一级反应完成99.9%所需时间是其半衰期的10倍。
证: 0000111ln ln ln10000.001c c t k c x k c k ===-,1/2ln 2t k=,∴1/2/ln1000/ln 29.96610t t ==≈,∴一级反应完成99.9%所需时间为其t 1/2的10倍 【讨论】有人采用如下方法证明,大家分析是否合理——证:设原始浓度为1,则体系经过一个半衰期反应了12,经过两个半衰期反应了21122⎛⎫+ ⎪⎝⎭,依此类推,经过10个半衰期反应了2101011111110.99922221024⎛⎫⎛⎫⎛⎫+++=-=-= ⎪ ⎪ ⎪⎝⎭⎝⎭⎝⎭L ,也就是说经过10倍半衰期的时间,一级反应完成了99.9%,以上每步都是可以反推的,因此命题得证。
8.(基础★★)在760℃加热分解N 2O 。
当N 2O 起始压力p 0 = 38.66 kPa 时,半衰期为255s ,p 0 = 46.66 kPa 时,半衰期为212s 。
求反应级数和时p 0 = 101.3 kPa 的半衰期。
解:利用公式1200lg()lg(255212)1110.9822lg()lg(46.6638.66)t t n p p '''=+=+=+≈''', ∴反应为2级反应 ∵1/201t kc =,∴1/2001/200t c p t c p '''''=='''',∴ 01/21/2038.6625597.62101.325p t t p ''⨯'''==≈' s 【讨论】(1)通常不是分数级数的时候,可以直接利用各级反应半衰期的特征来判断反应的级数。
以本题为例,我们不考虑分数级数,那么根据半衰期的特征可以直接判断是二级反应,因为t 1/2与p 0成反比关系;(2)我认为最好了解N 2O 的分解反应方程。
9.(应用★★)过氧化氢稀溶液在催化剂KI 的存在下按下式分解:2222()12KIg H O H O O −−→+25℃,101.3 kPa 下,测得不同时间内产生O2的体积如下表。
(1)试证明此反应为一级;(2)求该反应在25℃时的半衰期和速率常数。
t/min 0 5 10 20 32 54 74 84 V O2/cm 3 0 21 40.6 62.4 74.2 83.1 85.9 85.9 解:利用一级反应的公式001lnc k tc x=-,c o ∝V ∞-V o ,c o - x ∝V ∞-V t , 所以01lntV V k tV V ∞∞-=-,V o = o ,V ∞ = 85.9 cm 3,利用题目数据,t/min 0 5 10 20 32 54 74 84 V O2/cm 3 0 24 40.6 62.4 74.2 83.1 85.9 85.9 k/min -1 0.0655 0.0640 0.0648 0.0623 0.0634可以看出k 基础上为一常数,k = 0.0640 min -1,为一级反应,(2)该反应在25℃时的半衰期:1/2ln 210.83min t k== 【讨论】(1)1mol 气体,从0℃变为25℃,体积变化多少?(2)这是非常典型的例子,可以作为实验素材;(3)本题值得研究,例如,书本就没有关于本习题的例子,怎么解?还要时间间隔怎么确定? 11.(综合应用4★)反应A B C +→在一定温度下反应速率的数据如下: 第一次实验(p 0,A = 100kPa ,p 0,B = 0.4kPa )t/min 0 34.5 69.0 138 ∞ p c /kPa 0 0.2 0.3 0.375 0.4第二次实验(p 0,A = 400kPa ,p 0,B = 0.4kPa )t/min 0 34.5 69.0 ∞ p c /kPa 0 0.3 0.375 0.4求(1)此反应的速率方程a bC A B dp dt kp p =g 中的a 和b 值;(2)反应比速k 。
解:(某学生作业中的解答)由第一次实验图及数据可得:0.241000.440a ba b c A B dp kp p k dt ==⨯=① 由第二次实验图及数据可得:0.051000.45a b a bc A B dp kp p k dt ==⨯= ②②/①得,4a = 1.6667 ⇒ a = 0.3685 ≈ 0.5 ⇒ b = 1(这个过程实在是看出来其逻辑线路,似乎只是为了凑答案,这样做很不好) 故k = 0.00201 min -1·kPa -1/2解:(参考答案)首先认真分析反应的条件,p 0,A 与p 0,B 相比,可以发现两次实验p 0,A ?p 0,B ,因此,可以认为在反应过程中p 0,A 始终不变,作为一个常量来处理a b c A B dp kp p dt =就可以改写为bc Bdp k p dt'= 对于第一次实验,速率方程为100a bc B dp kp dt=,于是现在必须根据提供的实验数据来确定b 的值,方法就是首先观察数据的特征,然后用尝试法,试探着确定反应的级数。
首先排除是零级反应的可能性,把数据进行处理t/min 0 34.5 69.0 138 ∞ -ln(0.4-p c ) /kPa 0.916 1.609 2.303 0.375∞以-ln(0.4-p c )为纵坐标,以t 为横坐标,可得一条直线,故b = 1因此,在实验条件下,反应变为了一级反应,但是两次反应有所区别 第一次实验的速率方程为0.4ln1000.4a ckt p =-,第二次实验的速率方程为0.4ln4000.4a ckt p =-,把两组数据(34.5, 0.2)、(34.5, 0.3)分别代入上面的式子,并除,得a = 0.5所以反应的速率方程a bC A B dp dt kp p =g 中a = 0.5,b = 1;(2)把(34.5, 0.2)和a = 0.5,代入0.4ln1000.4a ckt p =-,得k = 0.002 kPa -1/2·min -1【讨论】(1)认真观察条件,找出特征,并做一些近似处理。
