植物组织培养研究进展
植物组织培养技术在园林植物育种中的应用进展

植物组织培养技术在园林植物育种中的应用进展植物组织培养技术是一种在无菌条件下,利用植物组织或细胞实现植物生长和繁殖的技术。
这种技术在园林植物育种方面具有非常广泛的应用,主要包括以下几个方面。
1、无性繁殖园林植物中有一些优良品种,但是通过自然繁殖很难获得足够的数量,使用组织培养技术可以通过无性繁殖的方式繁殖大量的优良品种。
例如,利用芽分化技术可以从植物的分生组织中分离出大量的愈伤组织和芽发生组织,然后通过培养和筛选,获得适量的高质量无性繁殖苗。
2、基因转化基因转化技术是指将外源DNA导入到植物细胞中,从而在植物体内实现外源基因的表达,增强其抗病性、抗旱性、耐盐性等性状,从而获得具有创新性和高附加值的育种材料。
这种技术主要利用细胞壁耐受性良好的愈伤组织和胚性组织进行基因转化,从而获得高效的转化结果。
在园林植物育种中,基因转化技术可以用于获得更适应环境的植物品种和更具观赏价值的植物品种。
3、突变育种突变育种是从植物已有的基因库中筛选出新的变异体,然后再选择合适的变异体进行育种的一种方法。
利用组织培养技术可以在植物体内人为诱导基因突变,形成新体型、形态、花色等各种性状的变异体,从而通过筛选和选育,获得更优良的品种。
4、快速繁殖和扩大材料植物组织培养技术可以实现快速繁殖和扩大育种材料的目的,同时可以避免因天气、病虫害等问题引起的生长停滞和死亡,保障育种进程的顺利进行。
例如,愈伤组织培养可以在较短时间内获得大量的愈伤组织,从而可以在较短时间内快速繁殖出大量的育苗,提高育种效率。
总之,植物组织培养技术在园林植物育种中具有极大的应用前景和潜力,可以大大提高园林植物的品质和数量,进一步促进园林事业的发展。
植物组织培养发展现状研究[]
![植物组织培养发展现状研究[]](https://img.taocdn.com/s3/m/374139c5998fcc22bcd10d97.png)
植物组织培养的发展研究进展摘要:植物组织培养作为一种有效的技术手段,已经被广泛应用于生产实践的各个领域。
本文综述了植物组织培养的应用现状,指出其在雨中和优种块繁等方面的科技支撑作用。
同时概述了有关新技术的开发利用,及应用前景展望。
植物组织培养是从20世纪30年代初期发展起来的一项生物技术。
植物组织培养是指在无菌条件下,将离体的植物器官、组织、胚胎、原生质体等,在人工配制的培养基上给予适宜的培养条件,进行繁殖的方法。
由于是在试管内培养,且培养的是脱离植株母体的培养物,故也称离体培养或试管培养。
目前,植物组织培养技术研究已经取得巨大的进展,在观赏植物,如菊花、牡丹、百合等方面有诸多应用。
同时,许多观赏植物已经实现产业化生产,建立了一套相对完善的快繁体系,取得了明显的经济和社会效益。
1 植物组织培养的过程组织培养的技术过程大致分为六步:植物培养材料的采集,培养材料的消毒预处理,制备外植体,接种和培养,根的诱导,炼苗移植。
以上个步骤均在无菌条件下进行。
2 植物组织培养的应用现状2.1 在植物育种方面的应用2.1.1单倍体育种单倍体植株往往不能结实,难以进行繁殖。
在培养中用秋水仙素处理,可使染色体加倍成纯合二倍体。
这种培养技术在育种上的应用多为单倍体育种。
单倍体育种具有高速、高效、基因型一次纯合等优点。
因此,通过花药或花粉的培养的单倍体育种已成为一种新的育种手段。
2.1.2 胚培养采用人工的方法在无菌条件县从种子中将成熟胚和未成熟的胚分离出来,然后放在人工合成的培养基上培养,使它发育成正常的植株,从而有效的克服远缘杂交不亲和的障碍,获得杂种植物。
目前,在这一方面获得成功的自交或远缘杂交不亲和性植物有怀地黄、矮牵牛、普通小麦、黑小麦等。
2.1.3 培养细胞突变体在组织培养过程中,细胞处于不断分生状态,易受培养条件和外界环境(如放射、化学物质)的影响而产生诱变,从中可以筛选出对人们有利的突变体,从而培育新品种。
植物组织培养研究进展

柳 和黑杨等植物 的形成层细胞时发现 ,虽然 在含 有葡萄糖 和盐 酸半胱 氨酸的 K o 溶液 中 , np 这些组织可 以不断增值几
个 月 ,但是 只有在培养基 中加入 B族维 生素和生长素 I A A 后 ,山毛柳 形成 层组织 的生长才 能显著增 加 ; a t rt G uh e 和 e Wht所 发展 的基本方法 , i e 奠定了植 物组织培养 的技术基础 .
关键词 : 物组 织培养 ; 用; 植 应 进展
中图分类号 :Q 4 . 9 46 文献标识码: A 文章编号 :1 7 — 6 X 2 0 )6 0 1 — 2 6 3 2 0 (0 7 0 — 0 6 0 于生长素 的发现及应 用 , B族维生素对植物细胞 生长 的重要
性被认 识 , 并被普遍采用 ;94年美 国的 Wht 13 i e由番茄根建
拥有形成一个完整植株的所必需的全部遗传信息 .利用这
一
特性 ,使植物成熟细胞 经历 了脱分化之后 , 形成 愈伤组
这项技 术已在科研 和生产 上得 到广泛应用成 为举 世瞩
织, 由愈伤组织再形成 完整 的植株 , 这个 过程 叫再分化【 l 1 . 目的生物技术之一 .该技术具有加速育种 、 缩短繁殖过程 , 改 良品质 , 节省空 间, 减少劳动 、 年试 验生产 , 终 不受 自然条
植物组织培养是 2 世纪之初 , 0 以植物生理学 为基础发 展起来 的- f新兴技术 ,是指在离体条件下 利用人工培养 - - i 基对植物器官 、 组织 、 细胞 、 生质体等进行 培养 , 原 使其 形成 完整 的植株 .它包括器官培养 、 尖分生组 织培养 、 茎 愈伤组 织培养 、 细胞 培养和原生 质体培养等 .其 中愈 伤组织 培养 最为常见 , 因为除茎尖分生组织培养 和少数 器官培养外 , 其 他类型都要经历愈伤组织阶段才能产生再生植株 .其 原理 是利用植物细胞 的全能性 .也就是指一个完整 的植 物细胞
我国植物组织培养研究进展
Fg2 T e I i. h l a
i d f ls e
0 f
∞ patfsecl r ndI I| i i u uei i _ sl t
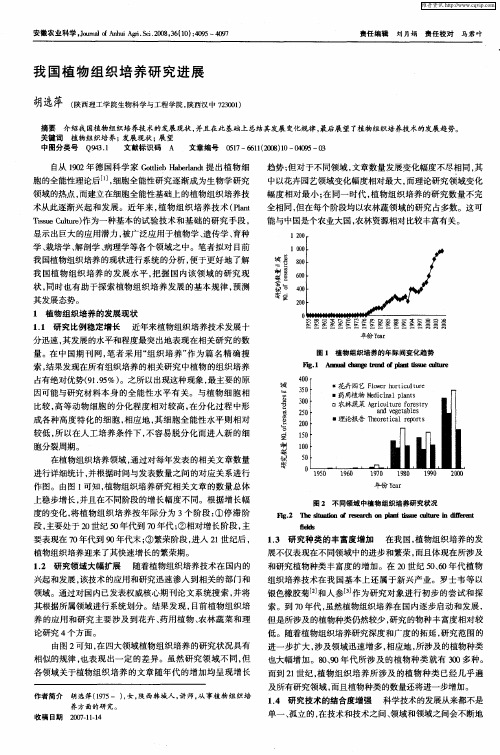
要表现在 7 年代到 9 年代末 ; 0 0 ③繁荣阶段 , 进入 2 世纪后 , l
植物组织 培养迎来 了其快速增长 的繁荣期 。 12 研究领域大 幅扩展 随着植物组织 培养技术在 国 内的 .
维普资讯
安徽农业科学 , unl f nu A a Si20 。6 l )4 9 O 7 J ra 0 hi g .c.O83 1o :05—49 o A
责任编辑
刘 月娟
责 任校对
马君叶
我 国植 物组 织培 养 研 究进 展
胡选萍 (西 工 院 物 学 工 学 ,西 中2o 陕 理 学 生 科 与 程 院陕 汉 7o) 31
-理论报告 Tertc lrprs hoe ia eot
毒
1 5 90 1 6 90 1 7 9O 1 8 9O 19 9O 2 O ∞
年份 Ya er
图 2 不 同领 域 中植物 组 织培 养 研 冤状 况
度的变化, 将植物组织培养按年际分为 3 个阶段 : ①停滞阶
段 , 处于 2 世纪 5 年代 到 7 年代 ; 主要 0 o 0 ②相对 增长 阶段 , 主
摘要 介 绍我 国植物 组织培 养技 术的发展 现状 , 并且在 此基础 上总结其发展 变化规律 , 最后展 望 了植物组 织培养技术 的发展 趋势 。 关键词 植 物组织培 养 ; 发展 现状 : 望 展 中图分类号 Q 4 . 931 文献标 识码 A 文章编 号 01— 6120)O O05 0 57 6 l(081 — 49 — 3
植物组织培养实验报告

植物组织培养实验报告目录1. 引言1.1 研究背景1.2 研究目的1.3 研究意义2. 实验方法2.1 材料准备2.2 实验步骤2.3 实验设计3. 结果与讨论3.1 实验结果3.2 结果分析3.3 结果讨论4. 结论引言研究背景植物组织培养是一种重要的生物技术手段,可用于植物繁殖、种质改良、病毒检测等方面。
通过培养植物的组织和细胞,可以实现对植物特定性状的调控和改善。
研究目的本实验旨在探究植物组织培养的基本原理和操作步骤,研究不同培养条件下植物组织生长情况,为植物生物技术的研究提供参考。
研究意义植物组织培养技术可以加快新品种选育的速度,提高植物的遗传改良效率,对于传统育种技术的完善和植物种质资源的保存具有重要意义。
实验方法材料准备- 植物组织样品- 培养基- 生长室- 培养瓶- 剪刀、消毒酒精等无菌操作工具实验步骤1. 准备培养基,对其进行灭菌处理。
2. 取样品进行无菌处理,切取植物组织。
3. 将植物组织置于培养基上,放入生长室进行培养。
4. 定期观察植物组织的生长情况,记录数据。
5. 根据实验设计,对不同处理组进行相应操作。
实验设计本实验设计了对照组和不同处理组,比较不同处理条件对植物组织生长的影响,以验证植物组织培养的有效性。
结果与讨论实验结果经过一段时间的培养,观察到植物组织在培养基上出现生长现象,不同处理组的生长情况有所不同。
结果分析通过对实验结果的分析,可以得出不同培养条件下植物组织生长的规律性,为进一步研究提供了重要依据。
结果讨论在讨论部分,对实验结果进行解释和归纳,总结出植物组织培养的特点和应用前景,为相关研究领域提供参考和启示。
结论植物组织培养是一种重要的生物技术手段,可以在植物繁殖、种质改良等领域发挥重要作用。
本实验结果表明,植物组织培养具有可行性和有效性,对于植物生物技术的发展和应用具有重要意义。
植物组织培养技术的研究进展

Ad a e f Pl n s u lu e v nc s o a t Tis e Cu t r
II N G ic , Y A NG A Y — hi Hua
( o e ty C l g 【 ui r u tr n o e t i ri tN n lg 3 3 0 . h n ) F r sr ol e。 F j n Ag i l ea d F rsr Unv .t a pn 5 0 1 C ia e a c u y e ̄ y Ab t a t s r c :Tis ec lu e s a wa f ce c e e r h.h s d v l p d r pd y I h s p p rn w d a c s i h i cp e  ̄ . u u t r ,a y o in e r s a c s a e eo e a i l . n t i a e e a v n e n t epr i l n a d me h d o i s e c lu e n h r b e d rn is e c lu e wihn r c n i e y a s w r e c i e . n t o ft u u t r .a d t e p o l m u i g t u u t r t i e e tf e r e e d s rb d s s v Ke o d : t s e c lu e a l s r t p a t y w r s i u u t r ;c lu ;p o o ls s
维普资讯
福建林学 院学报
20 ,2 1 :3 6 0 2 2 ( ) g ̄9
兰花组织培养研究进展
兰花组织培养研究进展穆玉珍,朱美瑶(重庆师范大学生命科学学院,重庆沙坪坝401331)综述了目前兰科植物组织培养的研究进展,着重从外植体的选择与消毒、褐化的防控、基础培养基、植物生长调节剂配方、天然植物成分等方面阐述了兰花组织培养技术研究进展,并总结了目前兰花组织培养过程中的常见问题,同时对未来兰花的研究进行了讨论与展望。
兰科植物;外植体;组织培养;培养基试验体系也在不断的试验研究中逐渐形成。
试验中通常取蒴果进行消毒,在无菌条件下剖开蒴果,取出种子播种到培养瓶中。
不同时期的蒴果萌发率不同。
有试验表明,春兰种子作为外植体时,授粉后8~9个月的种子萌发率较高,而墨兰的种子在3~5个月时容易萌发[2-3]。
预处理也可以提高种子的萌发率,研究者对种子进行1min 的超声波处理,种子萌发率达到20%;用蜗牛酶处理2~3min ,种子萌发率可达70%以上[4]。
1.2叶片叶片也可作为组织培养的材料,其取材对母株的伤害不大,受季节影响较小。
一般选取试管苗幼嫩的叶片,其更容易诱导原球茎,而成熟植株的叶片诱导成功的研究较少,多发生褐化死亡。
杨美纯等[5]研究发现,叶片正面向上放置时,诱导率更高,且对叶片进行切割,更利于切割边缘诱导出原球茎,切块应大于0.5cm ×0.5cm ,否则容易褐化死亡。
1.3花梗花梗常作为外植体材料,在多种兰科植物中皆有运用,如蝴蝶兰、大花蕙兰、文心兰等,国兰以花梗作为外植体的研究较少,多集中在种子、茎。
通过对石斛兰的研究发现,用带有节间的花梗进行诱导,会出现大部分死亡,从而使诱导效率较低[6]。
花梗的取材受到季节影响,通常不同时期的花梗诱导率也不同。
有试验发现,开花后的花梗比开花前幼嫩的花梗更容易诱导出芽[7]。
具体的原理还有待探究。
1.4茎尖茎尖是最早用于兰花组织培养的外植体,早在1960年,Morel [8]采用大花蕙兰的茎尖,诱导分化出了植株。
但茎尖的切取会对母株造成较大伤害,而且在茎尖的培养中,容易出现褐化现象[9]。
植物组织培养技术研究与应用
植物组织培养技术研究与应用随着现代科学技术的不断进步和发展,植物组织培养技术也得到了广泛的应用和发展。
植物组织培养技术主要是指通过培养植物的组织、细胞或器官,使其保持生长和分化能力,进而实现对植物生长过程的控制和调节。
该技术的应用范围较为广泛,主要包括植物繁殖、遗传改良、病毒测试、有害物质筛选和植物生长激素制备等。
一、植物组织培养技术的研究进展植物组织培养技术的研究、发展和应用始于上世纪六十年代。
在此之前,植物杂交育种只能够通过自然的杂交或小麦假体涂抹的方式来实现。
但是,这种方法要求天气条件良好、花期重合和品种特异性较强等条件。
随着植物组织培养技术的出现,解决了这些限制,为植物育种的进一步研究提供了条件。
目前,植物组织培养技术已经形成了一系列的研究方法和应用技术。
其中,最重要的技术包括植物体外微繁殖、植物体外遗传转化、植物体外生产次生代谢产物等。
植物体外微繁殖是指将植物组织或细胞在无菌条件下进行培养,使其快速分裂和增殖。
通过该方法,可以大量的繁殖同一品种的植株,并且不会因环境变化而受到影响,因此被广泛应用于植物育种领域。
植物体外遗传转化是指通过将目标基因导入到植物细胞中,使其在培养过程中发生转化和表达,这种技术成为了植物转基因的关键步骤之一。
在该技术的应用中,主要的挑战是如何精准的把目标基因导入到植物细胞中,以及如何使基因维持在植物体内。
植物体外生产次生代谢产物是指通过基因工程技术和植物细胞培养技术结合,生产一些人类所需的物质,例如药物,提炼纯度更高的化学物质等。
这种技术大大加快了植物次生代谢产物的生产过程,并且可以大幅提高产物的纯度和稳定性。
二、植物组织培养技术在植物育种中的应用植物组织培养技术是一个高效且最先进的育种方法,可用于改良杂交种、育成新品种以及生产素质较高的种质资源。
通过该技术,育种者可以根据需要,选择质量高、抗性强、适应性强等特点的植物细胞,进行有效的遗传改良。
下面列举几个常见的植物育种应用场景:1. 利用无性繁殖去除休眠期:无性繁殖可用于消除植物杂交后的休眠期,使杂交后代在不会发生困难的情况下快速生长。
植物组织培养技术的研究进展
植物组织培养技术的研究进展一、本文概述植物组织培养技术,作为一种在无菌条件下,通过人工操作将离体的植物组织、细胞或器官培养在人工配制的培养基上,使其再生为完整植株或生产具有经济价值的其他产品的技术,自其诞生以来,就在生物学、农业、林业、医药等领域引发了广泛的关注和研究。
本文旨在全面综述植物组织培养技术的研究进展,探讨其在实际应用中的潜力与挑战,以期为推动该领域的发展提供有益的参考。
本文将首先回顾植物组织培养技术的发展历程,梳理其从早期的摸索阶段到现代的精细化、高效化发展的主要历程。
接着,我们将重点关注近年来在植物组织培养技术方面取得的重要突破,包括培养基的优化、外植体选择的新策略、基因编辑技术在组织培养中的应用等。
我们还将探讨植物组织培养技术在植物育种、脱毒、次生代谢产物生产、生物反应器等方面的应用,并分析其在实际应用中的优势和局限性。
我们将对植物组织培养技术的未来发展进行展望,探讨如何通过技术创新和方法优化,进一步提高植物组织培养的效率和质量,以满足日益增长的农业生产需求和社会经济发展要求。
我们也将关注植物组织培养技术在应对全球气候变化、生物多样性保护等重大问题中的潜在作用,以期为推动植物组织培养技术的可持续发展提供新的思路。
二、植物组织培养技术的基本原理和方法植物组织培养技术,又称为植物微繁殖或植物细胞培养,是一种通过控制环境条件,利用植物细胞或组织的再生能力,在无菌条件下进行植物繁殖或遗传改良的技术。
其基本原理主要基于植物细胞的全能性,即植物体的每一个活细胞都含有该物种的全套遗传信息,并有能力发育成完整的植株。
植物组织培养的基本方法主要包括以下几个步骤:从植物体上获取所需的外植体(如叶片、茎尖、花药等)。
然后,通过表面消毒和切割处理,将外植体接入含有适当营养成分和植物生长调节剂的培养基中。
这些调节剂如细胞分裂素和生长素,对细胞的分裂和分化起着重要的调控作用。
接着,将接种后的外植体置于适宜的光照、温度和湿度条件下进行培养。
植物组织培养技术及应用进展
植物组织培养技术及应用进展摘要:当前,植物组织培养技术得到了快速发展。
本文系统介绍了植物组织培养的含义,以及植物组织培养技术应用于植物育种、应用于植物脱毒和快速繁殖、应用于植物有用产物生产、应用于植物种质资源保存和交换、应用于遗传、生理、生化和病理研究。
植物组织培养技术已经渗透到科研、生产和生活各个领域,必将为社会创造更大的价值和效益。
关键词:植物组织;培养技术;应用;进展1、引言当前,植物组织培养技术得到了快速发展。
人们可以利用植物的组织培养技术,生产优良无性系,为人们生产需要的多种代谢物质,单倍体、三倍体、多倍体及非整倍体。
这样细胞融合就打破种属间的界限,促进植物新品种的培育和种性的改良。
组织培养的植物细胞能够在细胞水平上研究的理想材料,加速植物快繁、花药培养、细胞器培养、原生质融合以及DNA重组技术。
因此,植物组织培养技术可以在各个植物科学的领域及农业、医药等多种行业。
这样就为社会创造了巨大的经济效益和社会效益。
2、植物组织培养技术的含义3、植物组织培养技术的应用现状3.1应用于植物育种当前,我国将植物组织培养应用于作物育种,特别是在:第一,单倍体育种。
单倍体育种的优点是高速、高效率、基因型一次纯合。
因此,通过花药或花粉培养的单倍体育种,而成为一种最新的育种手段,育成大面积种植的作物新品种。
我国在单倍体育种方面取得了重大成果。
我国育成了作物新品种—单育1号烟草品种,以及中花8号水稻和京花1号、京单92-2097小麦等面积栽培的作物新品种。
第二,胚胎培养。
植物的杂交不孕使远缘杂交不容易成功。
但是,采用胚的早期离体培养能够使胚正常发育和培养出杂交后代,以无性系繁殖获得数量较多、性状一致的群体,胚培养已在多个科属中成功。
这种技术就是把未受精的胚珠分离出来,在试管内用异种花粉在胚珠上萌发受精,产生的杂种胚在试管中发育成完整植株。
用胚乳培养可以获得三倍体植株,三倍体加倍后可得到六倍体,可育成多倍体新品种。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
植物组织培养研究进展摘要植物组织培养技术作为一种科研手段,发展异常迅猛。
从组织培养的原理、培养过程中遇到的问题以及前景和展望这3方面综述了我国近几年植物组织培养的新研究。
关键词: 组织培养;存在问题;措施;发展20 世纪后半叶,植物组织培养发展十分迅速,利用组织培养,不仅可以生产大量的优良无性系,并可获得人类需要的多种代谢物质;细胞融合可打破种属间的界限,克服远缘杂交不亲和性障碍,在植物新品种的培育和种性的改良中有着巨大的潜力;还可获得单倍体、三倍体及其它多倍体、非整倍体;组织培养的植物细胞也成为在细胞水平上分析研究的理想材料[1]。
因此,植物组织培养广泛应用于植物科学的各个分支,如植物学、植物生理学、遗传学、育种学、栽培学、胚胎学、解剖学、病理学等,并广泛应用在农业、林业、医药业等多种行业,产生了巨大的经济效益和社会效益,被认为是一项很有潜力的高新技术。
1组织培养的基本原理1.1植物组织培养的概念植物组织培养技术是指在无菌条件下,将离体的植物器官(如根尖、茎尖、叶、花、未成熟的果实、种子等)、组织(如形成层、花药组织、胚乳、皮层等)、细胞(如体细胞、生殖细胞等)、胚胎(如成熟和未成熟的胚)、原生质体培养在人工配制的培养基上,给予适宜的培养条件,诱发产生愈伤组织或潜伏芽等,或长成完整的植株的技术[2]。
1.2植物组织培养的依据植物组织培养的依据是植物细胞“全能性”及植物的“再生作用”。
1902年,德国著名植物学家GHaberlanclt根据细胞学理论[3],大胆地提出了高等植物的器官和组织可以不断分割,直到单个细胞,即植物体细胞在适当的条件下具有不断分裂和繁殖,发育成完整植株的潜力的观点。
1943年,美国人White在烟草愈伤组织培养中, 偶然发现形成一个芽, 证实了GHaberlanclt的论点[4]。
在许多科学家的努力下,植物组织培养技术得到了迅速发展,其理论和方法趋于完善和成熟,并广泛应用产生了巨大的经济效益和社会效益。
1.3培养基的选择组织培养的基础培养基有MT、MS、SH、White等[5]。
由于不同植物所需要的生长条件有所不同,会对培养基做一些不同的处理,一般采用较多的是MS。
组织培养采用固体培养基的较多,但只有在植物周围的营养物和激素被吸收,如果其他残留的培养基也能被利用,对工厂化生产的成本减少方面有很大的帮助。
董雁等[6]利用回收转换后废弃的继代培养基,加入原继代培养基30 %浓度母液的培养基,培养效果与原继代培养基的基本相同,说明继代培养基再利用是可行的,这为规模化组培育苗开辟了新的途径。
杜勤[7]等在无外源激素条件下,研究液体和固体培养基对黄瓜子叶培养器官分化的影响,结果用液体培养基直接诱导花芽率更高,分化高峰期出现的时间也更早,说明液体培养基对外植体的生长更有利,只是固体培养基更易操作而被较广泛应用。
2植物组织培养过程中存在的问题2.1 污染问题组织培养过程中的污染包括内因污染和外因污染。
内因污染指由于外植体的表面或者内部带菌而引起的污染;外因污染则是主要由环境污染和操作不当引起,是指在接种或培养过程中病菌入侵,例如培养基、接种工具和接种室消毒不严格以及操作不规范等[8]。
针对植物组织培养中污染产生的原因,应从以下2个方而着手来控制污染。
一是控制外植体自身带菌,外植体的表而带菌可以经过一系列的杀菌处理来减少;而外植体的内部带菌是不容易清除的,但也可以通过对外植体的预培养来加以控制;一是降低环境污染和操作污染,这类污染可通过规范操作程序加以控制[9]。
2.2褐化问题2.2.1.发生形式细胞受胁迫条件或其他不利条件影响而死亡或细胞发生自然死亡;材料伤口分泌的酚类物质,在多酚氧化酶作用下氧化为醌类物质形成的。
2.2.2影响因素外植体、培养基、pH值、培养条件、其他。
2.2.3解决途径2.2.3.1选取适宜的外植体一般木本植物的酚类化合物较草本高,组培时木本植物更易褐化;外植体的老化程度越高,其木质素的含量也越高,也越易褐化,成龄材料一般比幼龄材料褐化严重[10],切口越大,酚类物质的被氧化面积也越大,褐化程度就会越严重;由于植物体内酚类化合物含量和多酚氧化酶的活性在不同的生长季节不同,一般在生长季节含较多的酚类化合物,在取材部位上存在幼嫩茎尖较其他部位褐化程度严重。
2.2.3.2选取适宜的培养基(1)利用抗氧化剂、吸附剂。
抗氧化剂能够阻止多酚氧化物对酚类物质的氧化作用,减少褐变。
目前常用的抗氧化剂有硫代硫酸钠(Na2S2O3)、植酸(PA)、抗坏血酸(Vc)、过氧化氢、半胱氨酸等,吸收剂有活性炭(AC)和PVP(聚已烯吡喀烷酮)[11]。
抗氧化剂要注意分次使用,应注意有些抗氧化剂会对培养物产生毒害作用,要避免长期在含这些抗氧化剂的培养基中培养,如果先期褐变得到了控制,就应该从培养基中除去抗氧化剂。
杨薇红等在亚洲百合接种前用50 mg/L Vc浸泡外植体2 h及在之后的继代培养中加入150 mg/L PVP以抑制组培苗褐变现象的发生[12]。
张红对库拉索芦荟组培中的褐变现象,培养基中加入活性炭500.0 mg/L,环境温度控制在25 ℃有利于减轻褐变[13]。
(2)使用金属螯合剂(EDTA)。
由于多酚氧化酶是一种含铜的蛋白质,其氧化活性依赖于铜的氧化还原作用,而金属螯合剂可以把铜离子从酶中螯合出来,形成稳定的螯合物,使多酚氧化酶失去活性。
(3)琼脂量的减少、较低的pH值利于减少褐变。
(4)培养基中适宜的细胞分裂素浓度可以减轻或抑制褐变。
这在很多植物的组培研究中都得到证实,张红在库拉索芦荟组培中的褐变现象及防止试验中也表明,适宜的6-BA浓度(2.0 mg/L)对库拉索芦荟的褐变现象有较好的抑制作用[14]。
2.2.3.3选取适宜的培养条件试验证明适度的低温、初培暗光或弱光培养可抑制酚类的氧化。
陈红等在试验中,低温预处理对刺梨花药愈伤组织诱导有显著的影响,以低温处理3 d,花药愈伤组织诱导率最高,褐化率最低[15]。
赵伶俐等以蝴蝶兰R4品种叶片为外植体,研究不同时间的黑暗预处理对褐化率、多酚氧化酶(PPO)活性和总酚含量的影响。
结果表明,黑暗预处理能减轻褐化[16] 。
2.2.3.4其他方法热击处理,采用45 ℃以上的短时间高温处理能够使多酚氧化酶失去活性[17],从而达到抗褐变的目的,另外适度缩短继代周期,可以从一定程度上使褐变减轻。
2.3玻璃化现象2.3.1作用机理内源激素失调,能量代谢受阻,蛋白质的正常合成受抑,使分化难以顺利启动,细胞发育异常而致。
2.3.2发生因素外植体材料差异、环境湿度、碳源、无机盐、外源激素、温度、光照、培养基pH值及其添加物等。
2.3.3克服方法2.3.3.1适宜的外植体刘非燕等在试验中发现,重瓣石竹顶芽产生的试管苗玻璃化百分率最低,基部茎段次之,中部茎段最高[18]。
分析这种差异性主要是由顶芽到茎基在内源激素含量和比例上的差异而致。
2.3.3.2培养基的硬度调节培养基的pH值,提高琼脂浓度,玻璃化的比例明显下降。
2.3.3.3培养基成分提高培养基的碳氮比,降低NH+4 浓度或及时转移培养基,在其中加入适量的根本苷、活性炭或聚乙烯醇和青霉素G钾等添加物。
2.3.3.4合适的培养环境适当提高光照强度,保持适宜温度25 ℃(19.5~30 ℃)利于控制玻璃化[19],降低湿度(瓶内的空气湿度和培养基的含水量),改善氧气供应状况利于减少玻璃化苗的出现[18]。
2.3.3.5 适当降低细胞分裂素浓度和细胞分裂素与生长素比例许多报道指出,培养基中外源细胞分裂素供应过多容易导致组培苗玻璃化。
如在沾化冬枣的快繁中,培养基中6-BA 的浓度为3~5 mg/L 时,能显著促进外植体发生褐化;在重瓣丝石竹的组培中发现,培养基中高浓度的细胞分裂素,尤其在6-BA为5.0 mg/L时,是影响玻璃苗发生的主要原因[20]。
2.3.3.6热击处理高于40 ℃的温度对外植体热击处理可消除玻璃化。
2.4黄化现象2.4.1原因培养基中Fe的含量不足;各矿质营养不均衡;培养环境通气不良,瓶内乙烯含量升高;激素配比不当;糖用量不足或长时间不转移导致糖耗尽;pH值变化过大;培养温度不适;光照不足等都会造成黄化现象的出现[21]。
2.4.2解决方法(1)配制母液和培养基的制作过程中,要检查仪器设备是否准确,还要认真细致地核对每项称量的每一个环节。
(2)配制培养基时切记不要忘记加糖。
(3)及时转接培养物。
(4)使用透气的封口膜以改善瓶内通气状况。
(5)适当调节pH值、激素配比和无机盐浓度。
(6)控制培养室内的温度;适当增加光照。
(7)在培养基中添加抗生素类物质如青霉素、链霉素、头孢霉素等,有时也会出现幼苗黄化现象,应适当减少用量或停止使用。
3 植物组织培养的应用植物组织培养技术不仅是植物体细胞遗传学的基础,而且对理论研究和植物基因工程以及农作物品种改良等都具有重大意义。
3.1在植物育种上的应用3.1.1进行单倍体育种取未成熟的花药或花粉粒培养,很容易获得单倍的胚状体,然后用秋水仙碱等加倍剂处理胚状体,使染色体加倍,形成正常的二倍体。
与一般二倍体不同的是,这样获得的二倍体基因型是纯合的。
在自然界,自花授粉植物是纯系,而异花授粉植物基因型是杂合的。
要获得异花授粉植物的纯系,至少需要自交10代以上。
对于自粉授粉植物,通过杂交方式导入新的基因后,利用花药或花粉单倍体培养,然后加倍,获得纯系,将大大缩短育种年限[22]。
同样,对于异花授粉植物,利用花药和花粉培养可缩短杂交后代的纯合时间,加快杂交育种进度[23]。
然而,花药和花粉单倍体培养主要在自花授粉植物中获得成功,对于异花授粉植物还比较困难。
花药和花粉单倍体培养的技术完善和突破,将会推动杂交育种的发展。
3.1.2克服远缘杂交不亲和性carlsno等在1972年获得第一株烟草体细胞杂种植株以来,细胞融合技术在不断改善和发展,获得体细胞杂种植株的植物种类在不断增加[24]。
细胞融合可打破种属间的界限,克服远缘杂交不亲和性障碍,在植物新品种的培育和种性的改良中有着巨大的潜力。
通过原生质体融合,不仅可克服远缘杂交的不亲和性,而且能创造新品种和从中选择到优良品种;还可转移植物杂交育种上有重要价值的细胞质雄性不育基因,迅速选育出期望的雄性不育系[25]。
在经济林木和果树上,柑桔原生质体融合是最早而且是成功事例最多的种类。
3.1.3获得抗病品种无论是愈伤组织培养还是细胞培养,培养细胞均处在不断分生状态,容易受培养条件和外界因素(如射线、化学物质等)的影响而产生诱变[26]。
从中可以筛选出对人们有用的突变体,从而育成新品种。
例如植物抗病虫性、抗寒、耐盐、抗除草剂毒性、生理生化变异株等的诱发,为进一步筛选和选育提供了丰富的变异材料[27]。
