燃料电池练习题(带答案)
新能源练习题与答案

新能源练习题与答案1、先进驾驶辅助系统按照环境感知系统的不同可以分为自主式和网联式两种,目前自主式和网联式的发展现在()。
A、自主式为主,网联式为辅B、自主式为辅,网联式为主C、自主式和网联式融合完好D、以上均不对答案:A2、有直流环节的逆变器属于()。
A、电压源逆变器B、电流源逆变器C、直接逆变器D、间接逆变器答案:D3、研究表明人体感知电流大约为( )。
A、 1mAB、 2mAC、 5mAD、 10mA答案:A4、某电池充满电后消耗容量60Ah,已知其额定容量为80Ah,则此刻该电池的SOC 是( )。
A、 25%B、 40%C、 75%D、 60%答案:A5、汽车轻量化材料中镁合金在汽车上使用最早的部件是( )。
A、发动机悬架B、轮辋C、离合器壳体D、离合器踏板答案:B6、当变压器一次侧电压一定时,若二次侧电流增大,则一次侧电流将()。
A、增大B、减小C、略有减小D、不变答案:A7、下列描述中属于车用碳纤维特点的是( )。
A、密度小B、抗热冲击和热摩擦性能优异C、耐腐蚀性好D、已上的都对答案:D8、某种氢氧燃料电池的电解液为KOH 溶液,下列有关该电池的叙述不正确的是( )。
A、用该电池电解CuCl2 溶液,产生2. 24L Cl2标准状况时,有0. 1mol电子转移B、工作一段时间后,电解液中KOH 的物质的量不变C、该燃料电池的总反应方程式为:2H2+O2=2H2OD、正极反应式为:O2+2H2O+4e-=4OH-答案:A9、高精地图的构建与高精定位的实现,是车辆重要的环境信息来源,能够帮助汽车驾驶系统感知到更大范围的交通态势,保证自动驾驶安全,同时帮助汽车进行自主路径规划及决策支持,具备多维度、更新及时、结果精确到厘米级的优点,最高可达( )。
A、 1cmB、 10cmC、 20cmD、 50cm答案:A10、笼形异步电动机降压启动能减少启动电流, 但由于电机的转矩与电压的平方成( ),因此降压启动时转矩减少较多。
根据原燃料电池电极方程式书写练习题。

根据原燃料电池电极方程式书写练习题。
根据原燃料电池电极方程式书写练题
1. 写出原燃料电池阳极反应的化学方程式。
答案:2H2 + 4OH- → 4H2O + 4e-
2. 写出原燃料电池阴极反应的化学方程式。
答案:O2 + 2H2O + 4e- → 4OH-
3. 结合阳极和阴极反应的化学方程式,写出原燃料电池完整的电池方程式。
答案:2H2 + O2 → 2H2O
4. 原燃料电池中产生的电子是从哪个电极流向哪个电极?
答案:电子从阳极流向阴极。
5. 原燃料电池的电解质是什么?
答案:原燃料电池的电解质通常为固体氧化物电解质,例如氧化锆(ZrO2)和氧化铈(CeO2)等。
6. 原燃料电池的工作温度通常是多少?
答案:原燃料电池的工作温度通常在800℃至1000℃之间。
7. 原燃料电池的优点是什么?
答案:原燃料电池具有高效能、环保、低噪音、无污染排放以及不受季节和地域限制等优点。
8. 原燃料电池的应用领域有哪些?
答案:原燃料电池在电力、交通、军事、航空航天和移动设备等领域有广泛应用。
9. 原燃料电池的一个例子是什么?
答案:固体氧化物燃料电池(Solid Oxide Fuel Cell,SOFC)
是原燃料电池的一个例子。
10. 请简要说明原燃料电池的工作原理。
答案:原燃料电池的工作原理是利用电极反应将燃料和氧气直
接转化为电能,无需通过燃烧的方式,从而实现高效能的能量转换。
希望以上内容对您有所帮助。
如有需要,欢迎继续提问。
新能源模拟练习题(附参考答案)

新能源模拟练习题(附参考答案)一、单选题(共80题,每题1分,共80分)1、通常由永磁转子电机本体、转子位置传感器和电子换向电路三部分组成的( ),用电子电路取代电刷和机械换向器。
A、开关磁阻电机B、永磁同步电机C、异步电机D、无刷直流电机正确答案:D2、 ( )是表示汽车电气系统、分系统、装置、部件中各项目的基本组成和相互关系的一种简图。
A、线束图B、原理框图C、原理图D、接线图正确答案:B3、有“220V、100W”“220V、25W”白炽灯两盏,串联后接入220V 交流电源,其亮度情况是()。
A、两只灯泡一样亮B、100W 灯泡最亮C、无法判断D、25W 灯泡最亮正确答案:D4、先进驾驶辅助系统(Advanced Driver Assistance Systems,ADAS)是利用( )技术采集汽车、驾驶员和周围环境的动态数据并进行分析处理,通过提醒驾驶员或执行器介入汽车操纵以实现驾驶安全性和舒适性的一系列技术的总称。
A、环境感知B、触觉感知C、嗅觉感知D、听觉感知正确答案:A5、测量直流电压时,如果不知道被测电压范围,则将数字万用表功能/量程开关置于DC档( )。
A、最大量程,并逐渐降低B、最小量程,并逐渐升高C、任何位置,并随意改变D、1000V 量程即可正确答案:A6、智能网联汽车需要通过()准确感知自身在全局环境中的相对位置以及所要行驶的速度、方向、路径等信息。
A、导航技术B、定位技术C、无线技术D、卫星技术正确答案:B7、自动驾驶汽车属于智能汽车,是其中L 3—L 5 级别的智能汽车,该级别的智能汽车是能够执行完整( )(DDT)的自动驾驶系统(ADS)功能车。
A、动态驾驶任务B、静态驾驶任务C、复杂驾驶任务D、简单驾驶任务正确答案:A8、在汽车重量为1/3 时,车身材料的选择对汽车的轻量化至关重要。
汽车选材一般应遵循基本原则有( )。
A、满足汽车零件使用性能的要求,如安全性,舒适操控性等B、具有良好的工艺性能,如形性,焊接性C、具有良好的经济性,如成本低、可回收性D、以上都对正确答案:D9、 ( )是根据不同材料体系、工艺的电池其静止开路电压与SOC 的对应关系来计。
燃料电池电极反应式的书写巩固练习

《燃料电池电极反应式的书写》巩固练习1、电解质为酸性电解质溶液例1、科学家预言,燃料电池将是21世纪获得电力的重要途径,美国已计划将甲醇燃料用于军事目的。
一种甲醇燃料电池是采用铂或碳化钨作电极催化剂,在稀硫酸电解液中直接加入纯化后的甲醇,同时向一个电极通入空气。
试回答下列问题:⑴这种电池放电时发生的化学反应方程式是。
⑵此电池的正极发生的电极反应是;负极发生的电极反应是。
⑶电解液中的H+离子向极移动;向外电路释放电子的电极是。
⑷比起直接燃烧燃料产生电力,使用燃料电池有许多优点,其中主要有两点:首先是燃料电池的能量转化率高,其次是。
【参考答案】⑴2CH3OH+3O2=2CO2+4H2O⑵正极3O2+12H++12e-=6H2O;负极2CH3OH+2H2O-12e-=2CO2↑+12H+⑶正;负⑷对空气的污染较小【答案解析】因燃料电池电化学反应的最终产物与燃料燃烧的产物相同,又且其电解质溶液为稀硫酸,所以该电池反应方程式是2CH3OH+3O2=2CO2+4H2O。
按上述燃料电池正极反应式的书写方法1知,在稀硫酸中,其正极反应式为:3O2+12H++12e-=6H2O,然后在电子守恒的基础上利用总反应式减去正极反应式即得负极反应式为:2CH3OH+2H2O-12e-=2CO2↑+12H+。
由原电池原理知负极失电子后经导线转移到正极,所以正极上富集电子,根据电性关系知阳离子向正极移动,阴离子向负极移动。
故H+离子向正极移动,向外电路释放电子的电极是负极。
2、电解质为碱性电解质溶液例2、甲烷燃料电池的电解质溶液为KOH溶液,下列关于甲烷燃料电池的说法不正确的是()A、负极反应式为CH4+10OH--8e-=CO32-+7H2OB、正极反应式为O2+2H2O +4e-=4OH-C、随着不断放电,电解质溶液碱性不变D、甲烷燃料电池的能量利用率比甲烷燃烧的能量利用率大【参考答案】C【答案解析】因甲烷燃料电池的电解质为KOH溶液,生成的CO2还要与KOH 反应生成K2CO3,故该电池发生的反应方程式是CH4+2OH-+2O2=CO32-+3H2O。
2021届高三化学一轮复习每天练习题20分钟——基于有机物、微生物、熔融盐等的燃料电池(有答案和详细

2021 届高三化学一轮复习每天练习 20 分钟——基于有机物、微生物、熔融盐等的燃料电池(有答案和详细解析)1.甲醇 (CH 3OH)是一种有毒物质,检测甲醇含量的测试仪工作原理示意图如下。
下列说法 正确的是( )A .该装置将电能转化为化学能B . a 电极发生的电极反应为 CH 3OH - 6e-+ H 2O===CO 2+ 6H +C .当电路中有1 mol 电子转移时,有1 mol H+移向 a 电极区D .将酸性电解质溶液改为碱性电解质溶液,该测试仪不可能产生电流2. (2020 昌拟·南模 )一种微生物燃料电池如图所示,下列关于该电池的说法正确的是A . a 电极发生还原反应B . H+由右室通过质子交换膜进入左室C . b 电极反应式为 2NO-3+10e-+ 12H + ===N 2↑+6H 2OD .电池工作时,电流由a 电极沿导线流向b 电极3. NO 2、 O 2和熔融 NaNO 3可制作燃料电池,其原理如图。
该电池在使用过程中石墨Ⅰ电极 上生成氧化物Y 。
下列说法正确的是()( )A .若将该电池中的熔融NaNO 3换成NaOH 溶液,则不可能产生电流B .电子从石墨Ⅱ电极流向石墨Ⅰ电极C.石墨Ⅰ电极的电极反应式为NO2+NO-3 -e-===N2O5D.NO 2只有还原性没有氧化性4. (2019 大连调·研)微生物燃料电池是指在微生物的作用下将化学能转化为电能的装置。
某微生物燃料电池的工作原理如图所示,下列说法正确的是( )A .电子从 b 流出,经外电路流向aB.H S-在硫氧化菌作用下转化为SO42-的反应是H S -+4H2O-8e-===SO42-+9H+C.如果将反应物直接燃烧,能量的利用率不会变化D .若该电池电路中有0.4 mol 电子发生转移,则有0.5 mol H +通过质子交换膜5. (2019 ·河北邢台质检)宇宙飞船配备的高效MCPC 型燃料电池可同时供应电和水蒸气,所用燃料为氢气,电解质为熔融的碳酸钾,已知该电池的总反应为2H2+O2===2H2O,负极反应为H 2+CO32--2e-===CO2+H2O,则下列推断中,正确的是( )A .电池工作时,CO 32-向负极移动B .电池放电时,外电路电子由通氧气的正极流向通氢气的负极C.正极的电极反应:4OH --4e-=== O2↑+2H2OD .通氧气的电极为正极,发生氧化反应二、选择题:每小题有一个或两个选项符合题意。
燃料 电池
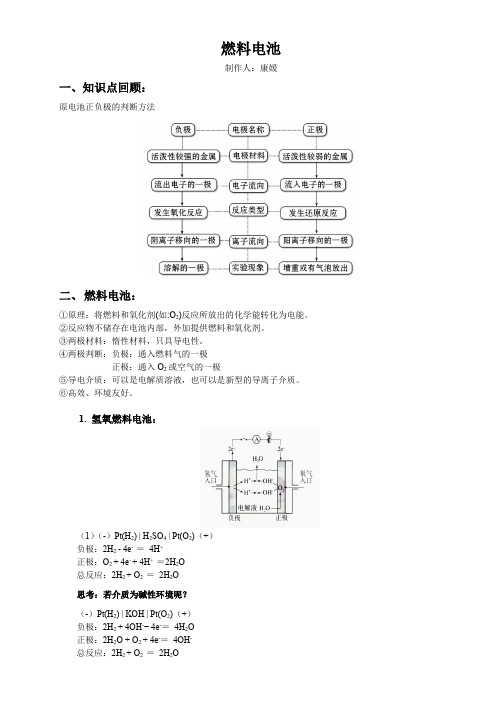
燃料电池制作人:康媛一、知识点回顾:原电池正负极的判断方法二、燃料电池:①原理:将燃料和氧化剂(如:O2)反应所放出的化学能转化为电能。
②反应物不储存在电池内部,外加提供燃料和氧化剂。
③两极材料:惰性材料,只具导电性。
④两极判断:负极:通入燃料气的一极正极:通入O2或空气的一极⑤导电介质:可以是电解质溶液,也可以是新型的导离子介质。
⑥高效、环境友好。
1. 氢氧燃料电池:(1)(-)Pt(H2) | H2SO4 | Pt(O2)(+)负极:2H2 - 4e- =4H+正极:O2 + 4e- + 4H+ =2H2O总反应:2H2 + O2 =2H2O思考:若介质为碱性环境呢?(-)Pt(H2) | KOH | Pt(O2)(+)负极:2H2 + 4OH-− 4e-=4H2O正极:2H2O + O2 + 4e-=4OH-总反应:2H2 + O2 =2H2O总结:燃料电池电极反应式的写法:总式→正极→负极 正极写法:碱性/中性: O 2 + 4e - + 2H 2O = 4OH - 酸性: O 2 + 4e - + 4H + = 2H 2O例1.(1)氢氧燃料电池以KOH 溶液作电解质溶液时,工作一段时间后,电解质溶液的浓度将___减小_____,溶液的pH________减小___________。
(填“减小”、“增大”或“不变”)(2)氢氧燃料电池以H 2SO 4溶液作电解质溶液时,工作一段时间后,电解质溶液的浓度将____减小____,溶液的pH____ _增大___。
(填“减小”、“增大”或“不变”)2. 甲烷燃料电池(一池多变):讨论:以甲烷燃料电池为例来分析不同的环境下电极反应式的书写。
(1)酸性介质(如H 2SO 4)负极:CH 4-8e -+2H 2O===CO 2+8H +正极:2O 2+8e -+8H +===4H 2O总反应式:CH 4+2O 2===CO 2+2H 2O(2)碱性介质(如KOH)负极:CH 4-8e -+10OH -===CO 2-3+7H 2O正极:2O 2+8e -+4H 2O===8OH -总反应式:CH 4+2O 2+2OH -===CO 2-3+3H 2O(3)固体电解质(高温下能传导O 2-)负极:CH 4-8e -+4O 2-===CO 2+2H 2O正极:2O 2+8e -===4O 2-总反应式:CH 4+2O 2===CO 2+2H 2O(4)熔融碳酸盐(如熔融K 2CO 3)环境下负极:CH 4-8e -+4CO 2-3===5CO 2+2H 2O正极:2O 2+8e -+4CO 2===4CO 2-3总反应式: CH 4+2O 2===CO 2+2H 2O特备注意:要注意溶液的酸碱性,适当的在电极方程式两边添加H +、OH -、H 2O ,以遵循电荷守恒和质量守恒。
物理化学—电化学练习题及参考答案(1)-推荐下载
电化学A一、选择题1. 某燃料电池的反应为:H 2(g)+O 2(g)─→H 2O(g)12在 400 K 时的 ∆r H m 和 ∆r S m 分别为 -251.6 kJ ·mol -1和 –50 J ·K -1·mol -1,则该电池的电动势为:()(A) 1.2 V (B) 2.4 V(C) 1.4 V (D) 2.8 V2. 已知下列两个电极反应的标准电极电位为:Cu 2++ 2e -─→ Cu(s)φ= 0.337 V1$Cu ++ e -─→ Cu(s) φ= 0.521 V2$由此可算得 Cu 2++ e -─→ Cu +的 φ 值为: ()(A) 0.184 V (B) 0.352 V(C) -0.184 V (D) 0.153 V 3. 有下面一组电池:(1) H 2(p )│HCl(a =1)‖NaOH(a =1)│O 2(p )(2) H 2(p )│NaOH(a =1)│O 2(p )(3) H 2(p )│HCl(a =1)│O 2(p )(4) H 2(p )│KOH(a =1)│O 2(p )(5) H 2(p )│H 2SO 4(a =1)│O 2(p )电动势值:()(A) 除 1 外都相同(B) 只有 2,4 相同(C) 只有3,5 相同(D) 都不同4. 对应电池Ag(s)|AgCl(s)|KCl(aq)|Hg2Cl2(s)|Hg(l)的化学反应是:()(A) 2Ag(s)+Hg22+(aq) = 2Hg(l) +2Ag+(B) 2Hg+2Ag+ = 2Ag +Hg22+(C) 2AgCl+2Hg = 2Ag +Hg2Cl2(D) 2Ag+Hg2Cl2 = 2AgCl +2Hg5. 电动势测定应用中,下列电池不能用于测定H2O(l)的离子积的是:()(A) Pt,H2(p )|KOH(aq)||H+(aq)|H2(p ),Pt(B) Pt,H2(p )|KOH(aq)||参比电极(C) Pt,H2(p )|KOH(aq)|HgO(s)|Hg(l)(D) Pt,H2(p )|HCl(aq)|Cl2(p ),Pt6. 在电极与溶液的界面处形成双电层,其中扩散层厚度与溶液中离子浓度大小的关系是()(A) 两者无关(B) 两者成正比关系(C) 两者无确定关系(D) 两者成反比关系7. 某电池反应为Zn(s)+Mg2+(a=0.1)=Zn2+(a=1)+Mg(s) 用实验测得该电池的电动势E=0.2312 V, 则电池的E 为:( )(A) 0.2903 V(B) -0.2312 V(C) 0.0231 V(D) -0.202 V 8.电极 Tl 3+,Tl +/Pt 的电势为φ=1.250 V,电极 Tl +/Tl 的电势1$φ=-0.336 V ,则电极 Tl 3+/Tl 的电势 φ为: ()2$3$(A) 0.305 V (B) 0.721 V(C) 0.914 V (D) 1.568 V 9. 298 K 时,在下列电池的右边溶液中加入 0.01 mol ·kg -1的 Na 2S溶液, 则电池的电动势将: ()Pt │H 2(p )│H +(a =1)‖CuSO 4(0.01 mol ·kg -1)│Cu(s)(A) 升高(B) 下降(C) 不变 (D) 无法判断 10.298 K 时,反应为 Zn(s)+Fe 2+(aq)=Zn 2+(aq)+Fe(s) 的电池的E 为 0.323 V,则其平衡常数 K 为: ()(A) 2.89×105 (B) 8.46×1010(C) 5.53×104 (D) 2.35×102 二、填空题11.将反应H 2(g)+I 2(s)→2HI(aq)设计成电池的表示式为:__________________________________。
氢能与燃料电池技术在电力生产中的应用考核试卷
五、主观题(本题共4小题,每题10分,共40分)
1.请简述氢能作为一种能源的特点及其在电力生产中的应用前景。
2.分析燃料电池的工作原理,并阐述质子交换膜燃料电池在氢能利用中的优势。
3.描述氢能储存与运输的主要方法,以及这些方法在实际应用中面临的技术挑战。
C.火力发电厂
D.个人电子设备
17.氢能燃料电池的运行温度分类包括以下哪些?()
A.低温燃料电池
B.中温燃料电池
C.高温燃料电池
D.超高温燃料电池
18.以下哪些措施可以提高氢能燃料电池的效率?()
A.优化催化剂
B.提高氢气纯度
C.控制运行温度
D.减少电池内阻
19.以下哪些材料可以用作燃料电池的电解质?()
A.液态氢
B.压缩氢气
C.金属氢化物
D.氨硼烷
5.质子交换膜燃料电池的电解质是()。
A.碱性
B.酸性
C.质子交换膜
D.盐性
6.燃料电池的阳极反应通常是()。A.氢气Leabharlann 化成氢离子B.氧气还原成水
C.氢离子与电子结合生成氢气
D.氧气氧化成臭氧
7.下列哪种物质的加入可以提高燃料电池的导电性?()
A.碘
B.氯化钠
C.碳酸氢钠
D.硫酸
8.氢能发电系统中,氢气的存储压力一般为()。
A. 5MPa
B. 10MPa
C. 20MPa
D. 30MPa
9.关于氢能燃料电池的效率,以下描述正确的是()。
A.理论效率可达100%
B.实际效率可达80%
C.实际效率可达60%
D.实际效率可达30%
燃料电池技术题集
燃料电池技术题集一、选择题1.氢气在燃料电池负极发生的电化学反应是?A. H₂+ 2e⁻→2H⁺B. O₂+ 4e⁻+ 4H⁺→2H₂OC. H₂O + 2e⁻→H₂+ 2OH⁻D. C + 4e⁻→C⁴⁻答案:A2.在质子交换膜燃料电池(PEMFC)中,氧气在正极的反应是?A. O₂+ 4H⁺+ 4e⁻→2H₂OB. H₂O + 2e⁻→H₂+ 2OH⁻C. 2H⁺+ 2e⁻→H₂D. CO₂+ 4e⁻→C + 2O²⁻答案:A3.固体氧化物燃料电池(SOFC)中,氢气在阳极的反应通常涉及哪种离子?A. 氢离子(H⁺)B. 氧离子(O²⁻)C. 氢氧根离子(OH⁻)D. 碳酸根离子(CO₃²⁻)答案:B4.哪种类型的燃料电池在反应过程中不直接产生二氧化碳(考虑主要反应物)?A. 碱性燃料电池(AFC)B. 直接甲醇燃料电池(DMFC)C. 磷酸燃料电池(PAFC)D. 熔融碳酸盐燃料电池(MCFC)答案:A(注:AFC通常使用氢气和氧气作为反应物,不直接产生CO₂)5.在直接甲醇燃料电池(DMFC)中,甲醇在阳极的氧化反应会产生什么?A. CO₂、H⁺和电子B. H₂O、O₂和电子C. CO、H₂和电子D. CH₄、H⁺和电子答案:A6.熔融碳酸盐燃料电池(MCFC)中,电解质的主要成分是什么?A. 磷酸B. 氢氧化钾C. 熔融的碳酸盐(如碳酸锂和碳酸钾)D. 质子交换膜答案:C7.在碱性燃料电池(AFC)中,为什么电解质需要保持碱性环境?A. 为了促进氢气的氧化反应B. 为了防止电极材料的腐蚀C. 为了提高氧气的还原速率D. 以上都是答案:C(虽然A和B也是正确的考虑因素,但最直接的原因是C)8.哪种燃料电池类型在低温下操作,并且通常用于便携式设备?A. 质子交换膜燃料电池(PEMFC)B. 固体氧化物燃料电池(SOFC)C. 熔融碳酸盐燃料电池(MCFC)D. 磷酸燃料电池(PAFC)答案:A9.燃料电池中,电子从负极流向正极的过程中,通过什么方式完成电路的闭合?A. 通过电解质溶液B. 通过外部电路C. 通过空气D. 不需要闭合,因为燃料电池是开路系统答案:B10.在直接硼氢化钠燃料电池中,硼氢化钠(NaBH₄)通常作为哪种电极的反应物?A. 正极B. 负极C. 同时作为正极和负极的反应物D. 不作为任何电极的直接反应物答案:B11.燃料电池的效率主要受哪些因素影响?A. 电解质的导电性B. 电极材料的催化活性C. 反应气体的压力和温度D. 以上都是答案:D12.燃料电池中,如何防止燃料和氧化剂在电极上直接混合并发生燃烧反应?A. 通过电解质的选择性透过性B. 降低反应温度C. 增加电极间的距离D. 使用催化剂降低反应活性答案:A13.哪种燃料电池类型在高温下操作,并可能用于固定式发电站?A. 质子交换膜燃料电池(PEMFC)B. 固体氧化物燃料电池(SOFC)C. 碱性燃料电池(AFC)D. 直接甲醇燃料电池(DMFC)答案:B14.燃料电池中,当氢气在负极被氧化时,主要产生的离子是什么?A. 氢离子(H⁺)B. 氢氧根离子(OH⁻)C. 氢原子(H)D. 电子(e⁻)答案:A(但在某些特定类型的燃料电池中,如碱性燃料电池,氢离子会与电解质中的氢氧根离子结合生成水)15.在直接甲醇燃料电池(DMFC)中,甲醇主要在哪个电极上发生反应?A. 正极B. 负极C. 同时在正极和负极D. 既不在正极也不在负极答案:B16.燃料电池的“开路电压”主要取决于什么因素?A. 电解质的浓度B. 电极材料的种类C. 燃料和氧化剂的性质及反应的热力学条件D. 电流密度答案:C17.哪种类型的燃料电池通常不使用贵金属催化剂?A. 质子交换膜燃料电池(PEMFC)B. 碱性燃料电池(AFC)C. 微生物燃料电池(MFC)D. 固体氧化物燃料电池(SOFC)答案:C(微生物燃料电池通常利用微生物作为催化剂,不依赖贵金属)18.燃料电池的“燃料效率”指的是什么?A. 燃料完全燃烧产生的热量转化为电能的效率B. 燃料中化学能转化为电能的效率C. 燃料电池的输出功率与输入燃料量的比值D. 燃料电池的寿命与燃料消耗量的比值答案:B19.燃料电池中,如何减少电极上的极化现象以提高电池性能?A. 增加电极材料的厚度B. 降低电解质的电阻C. 优化电极材料的催化性能D. 提高反应气体的压力答案:C(虽然B和D也有助于提高性能,但最直接有效的方法是C)20.在燃料电池的商业化应用中,需要解决的主要技术挑战有哪些?(多选题)A. 提高能量密度和功率密度B. 降低生产成本C. 延长电池寿命D. 改进燃料储存和供应技术E. 提高燃料利用率答案:A, B, C, D, E(这些都是燃料电池商业化过程中需要考虑的关键因素)21. 质子交换膜燃料电池的工作温度一般在:A. 50 - 80℃B. 80 - 100℃C. 100 - 120℃D. 120 - 150℃答案:A22. 在质子交换膜燃料电池中,提高电池性能的关键因素不包括:A. 增加质子交换膜的厚度B. 优化电极结构C. 提高催化剂活性D. 改善气体扩散答案:A23. 质子交换膜燃料电池中的催化剂通常是:A. 铂B. 钯C. 镍D. 铜答案:A24. 以下哪种气体不是质子交换膜燃料电池的常见燃料?A. 氢气B. 甲烷C. 甲醇D. 一氧化碳答案:D25. 质子交换膜燃料电池的优点不包括:A. 启动速度快B. 能量转化效率高C. 对燃料纯度要求低D. 工作噪音低答案:C26. 质子交换膜燃料电池中,质子交换膜的主要作用是:A. 传导电子B. 传导氧气C. 分离燃料和氧化剂D. 传导质子并阻隔电子答案:D27. 下列哪种因素会导致质子交换膜燃料电池的性能下降?A. 降低工作温度B. 增加燃料流量C. 膜的干燥D. 提高氧气压力答案:C28. 质子交换膜燃料电池的输出电压主要取决于:A. 电池的面积B. 燃料的浓度C. 电极反应的过电位D. 电池的工作温度答案:C29. 以下哪种方法不能提高质子交换膜燃料电池的寿命?A. 优化电池结构B. 频繁启停电池C. 采用抗腐蚀材料D. 改进操作条件答案:B30. 质子交换膜燃料电池的电流密度通常用以下哪个单位表示?A. A/m²B. V/m²C. W/m²D. J/m²答案:A31. 质子交换膜燃料电池中,氧气在哪个电极发生还原反应?A. 阳极B. 阴极C. 双极板D. 质子交换膜答案:B32. 以下哪种因素对质子交换膜燃料电池的功率密度影响最大?A. 质子交换膜的电阻B. 电极的孔隙率C. 燃料的储存量D. 电池的重量答案:A33. 质子交换膜燃料电池在运行过程中,产生的水主要来自:A. 燃料的氧化B. 氧气的还原C. 空气中的水分D. 电池内部的化学反应答案:D34. 为提高质子交换膜燃料电池的性能,通常采用的措施不包括:A. 增加膜的厚度以提高质子传导性B. 减小电极的极化电阻C. 优化气体扩散层的结构D. 提高催化剂的利用率答案:A35. 质子交换膜燃料电池的效率主要受以下哪种损失的影响?A. 欧姆损失B. 活化损失C. 浓差损失D. 以上都是答案:D36. 以下哪种材料不是质子交换膜燃料电池常用的气体扩散层材料?A. 碳纤维纸B. 金属泡沫C. 陶瓷D. 石墨毡答案:C37. 质子交换膜燃料电池中的水管理的主要目的是:A. 保持膜的湿润B. 排出多余的水C. 控制水的生成速率D. 以上都是答案:D38. 以下哪种技术可以用于检测质子交换膜燃料电池的故障?A. 电化学阻抗谱B. 红外光谱C. 质谱D. 紫外光谱答案:A39. 质子交换膜燃料电池的冷启动性能主要取决于:A. 电池的热容量B. 膜的含水量C. 催化剂的活性D. 以上都是答案:D40. 以下哪种情况会导致质子交换膜燃料电池的成本增加?A. 减少铂催化剂的用量B. 简化电池结构C. 提高生产规模D. 使用昂贵的质子交换膜材料答案:D41. 固态氧化物燃料电池(SOFC)的工作温度通常在:A. 500 - 700℃B. 700 - 1000℃C. 1000 - 1200℃D. 1200 - 1500℃答案:B42. 以下哪种材料常用于固态氧化物燃料电池的电解质?A. 氧化锆B. 氧化铝C. 氧化镁D. 氧化钛答案:A43. 固态氧化物燃料电池的阳极材料通常是:A. 镍基合金B. 铂基合金C. 钛基合金D. 铜基合金答案:A44. 在固态氧化物燃料电池中,阴极发生的反应是:A. 燃料的氧化B. 氧气的还原C. 电子的释放D. 质子的传导答案:B45. 以下哪种因素对固态氧化物燃料电池的性能影响较大?A. 电解质的厚度B. 阳极的孔隙率C. 阴极的电导率D. 以上都是答案:D46. 固态氧化物燃料电池的优点之一是:A. 对燃料纯度要求高B. 启动速度快C. 能量转化效率高D. 成本低答案:C47. 以下哪种气体不是固态氧化物燃料电池常用的燃料?A. 氢气B. 甲烷C. 一氧化碳D. 氮气答案:D48. 固态氧化物燃料电池中的连接体材料需要具备:A. 良好的导电性B. 良好的耐腐蚀性C. 高强度D. 以上都是答案:D49. 以下哪种方法可以提高固态氧化物燃料电池的功率密度?A. 增加电解质的电阻B. 降低工作温度C. 优化电极结构D. 减少燃料供应答案:C50. 固态氧化物燃料电池的电解质在高温下的离子传导主要依靠:A. 质子B. 电子C. 氧离子D. 钠离子答案:C51. 以下哪种技术可以用于改善固态氧化物燃料电池的密封性能?A. 激光焊接B. 胶粘C. 机械压紧D. 以上都是答案:D52. 固态氧化物燃料电池的热管理主要是为了:A. 防止电池过热B. 提高电池效率C. 延长电池寿命D. 以上都是答案:D53. 以下哪种材料常用于固态氧化物燃料电池的阴极?A. 镧锶锰氧化物B. 镍铁氧化物C. 钴铝氧化物D. 铜锌氧化物答案:A54. 固态氧化物燃料电池的燃料利用率主要取决于:A. 燃料的流量B. 电池的工作温度C. 电极的反应速率D. 以上都是答案:D55. 以下哪种因素会导致固态氧化物燃料电池的性能衰减?A. 电解质的相变B. 阴极的氧化C. 阳极的积碳D. 以上都是答案:D56. 为提高固态氧化物燃料电池的稳定性,通常采取的措施不包括:A. 优化电池结构B. 降低工作压力C. 采用新型材料D. 增加运行时间答案:D57. 固态氧化物燃料电池的输出电压与以下哪个因素无关?A. 电池的面积B. 燃料的种类C. 环境温度D. 电池的重量答案:D58. 以下哪种测试方法常用于评估固态氧化物燃料电池的电化学性能?A. 循环伏安法B. 恒流放电法C. 交流阻抗法D. 以上都是答案:D59. 固态氧化物燃料电池在大规模应用中面临的挑战不包括:A. 高温密封问题B. 成本较高C. 启动时间短D. 系统复杂性答案:C60. 以下哪种燃料重整方式适用于固态氧化物燃料电池?A. 蒸汽重整B. 部分氧化重整C. 自热重整D. 以上都是答案:D二、简答题1. 燃料电池电极的主要功能是什么?答案:燃料电池电极的主要功能是作为电化学反应的场所,促进燃料(如氢气)和氧化剂(如氧气)之间的电荷转移,从而生成电能和水。
高二化学燃烧热能源试题答案及解析
高二化学燃烧热能源试题答案及解析1. 科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇: ( CO 2 + 3H 2 = CH 3OH + H 2O ),并开发出直接以甲醇为燃料的燃料电池。
已知 H 2(g)、 CO(g) 和 CH 3OH(l) 的燃烧热△H 分别为-285.8 kJ·mol -1、-283.0 kJ·mol -1和-726.5kJ·mol -1。
请回答下列问题:(1)用太阳能分解10mol 水消耗的能量是_____________kJ(2)在容积为2L 的密闭容器中,由CO 2和H 2合成甲醇,在其他条件不变的情况下,考察温度对反应的影响,实验结果如图所示(注:T 1、T 2均大于300℃);下列说法正确的是________(填序号)①温度为T 1时,从反应开始到平衡,生成甲醇的 平均速率为v(CH 3OH)=mol·L -1·min -1②该反应在T 1时的平衡常数比T 2时的小③该反应为放热反应④处于A 点的反应体系从T 1变到T 2,达到平衡时增大(3)在T 1温度时,将1molCO 2和3molH 2充入一密闭恒容容器中,充分反应达到平衡后,若CO 2转化率为a,则容器内的压强与起始压强之比为 ( 用 a 表示 )(4)已知甲醇燃烧的化学方程式为2CH 3OH +3O 2 =2CO 2 +4H 2O ,在直接以甲醇为燃料电池中,电解质溶液为酸性,负极的反应式为 ,正极的反应式为 【答案】(1) 2858 ;(2) ③④ ; (3) 1- (或(2- a )/ 2 );(4)CH 3OH + H 2O- 6e -= CO 2 + 6H + ;O 2 + 4H + + 4e -= 2H 2O 【解析】(1)由于H 2(g)的燃烧热△H 分别为-285.8 kJ·mol -1,所以产生1mol 的水时放出热量是285.8 kJ ,因此若用太阳能分解10mol 水消耗的能量是285.8 kJ×10=2858KJ ;(2) ①速率是单位时间内的浓度改变数值,定义应用不对,错误;②由于在温度为T 1时甲醇的平衡物质的量浓度大于T 2时,说明该反应在T 1时的平衡常数比T 2时的大,错误;③H 2(g)、 CO(g) 和 CH 3OH(l) 的燃烧热的热化学方程式是H 2(g)+1/2O 2(g)= H 2O(l) ΔH=-285.8 kJ/mol; CO(g)+ 1/2O 2(g)=CO 2(g)ΔH=-283.0 kJ/mol; CH 3OH(l) + 3/2O 2(g)= CO 2(g)+ 2H 2O(l) ΔH=-726.5 kJ/mol;将氢气燃烧热的方程式扩大3倍与甲醇的燃烧热方程式相减,整理可得CO 2(g)+ 3H 2(g)= CH 3OH (g)+ H 2O(g)ΔH=-130.9KJ/mol ,所以该反应为放热反应,正确;④由于该反应是反应反应,所以升高温度,平衡逆向移动,甲醇的含量降低,因此温度T 2>T 1,处于A 点的反应体系从T 1变到T 2,达到平衡时增大,正确;(3)在恒容密闭容器内发生的反应,气体的物质的量的比等于容器内气体的压强之比,在反应开始时,容器内气体的物质的量是4mol,由于CO 2转化率为a,则达到平衡时各种气体的物质的量分别是H 2:(3-3a )mol; CO 2; (1-a )mol; CH 3OH: amol; H 2O :amol;平衡时气体的物质的量是(4-4a )mol ;故此时的压强与开始的压强之比是:(4-4a )÷4=1-;(4)已知甲醇燃烧的化学方程式为2CH 3OH +3O 2 =2CO 2 +4H 2O ,在直接以甲醇为燃料电池中,电解质溶液为酸性,负极甲醇的反应式为CH 3OH + H 2O- 6e -= CO 2 + 6H +;正极的反应式为O 2 + 4H + + 4e -= 2H 2O 。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
燃料电池练习题(带答案)
1.以甲烷燃料电池为例来分析不同环境下电极反应式的书写。
(1)酸性介质(如 H2SO4)
负极:____________________________________________________________________ ;
正极:____________________________________________________________________ ;
总反应式:__________________________________________________________________ 。
(2)碱性介质(如 KOH)
负极:________________________________________________________________________ ;
正极:________________________________________________________________________ 总反应式:____________________________________________________________________ (3)固体电解质(高温下能传导 O2-)
负极:______________________________________________________________________ ;
正极:______________________________________________________________________ ;
总反应式:____________________________________________________________________ 。
⑷熔融碳酸盐(如熔融K2CO3)环境下
负极:________________________________________________________________________ 正极:________________________________________________________________________ 总反应式:____________________________________________________________________
2. ________________________________________________________ 肼-双氧水燃料电池由于其较高的能量密度而广受关注,其工作原理如图所示。
请写出电池正极的电极反应式:,电池工作过程中,
A 极区溶液的 pH _________ (填“增大”“减小”或“不变”)。
3 •按要求写出电极反应式或总反应方程式。
肼(N 2H 4)-空气燃料电池是一种碱性电池,该电池放电时,负极的电极反应式为
4• (2015高考江苏卷)一种熔融碳酸盐燃料电池原理示意图如下。
下列有关该电池的说
法正确的是( )
电战人 ◎凡一
\一
催 ift L 整
CJL+HiO
B. 电极 A 上H 2参与的电极反应为 H 2 + 2OH - -2e -___2H 2O
C. 电池工作时,CO 3-向电极B 移动
D. 电极B 上发生的电极反应为 O 2+ 2CO 2 + 4e -___2CO 2-
燃料电池练习题答案
1. 答案:(1)CH 4- 8e -
+ 2H 2O___CO 2 + 8H + 202 + 8e -
+ 8H + ___4H 2O
CH 4 + 2O 2___CO 2 + 2H 2O
(2)CH 4-8e - + 10OH -___CO 2- + 7H 2。
2O 2 + 8e - + 4H 2O___8OH -
CO ;-
111
A .反应 CH 4+ H 2O 催化== -3H 2+ CO ,每消耗1 mol CH 4转移12 mol 电子
CH 4+2O 2+2OH -===CO 23-+3H2O
(3)CH 4-8e-+4O 2-===CO 2+2H 2O
2O2+8e-===4O2- CH 4+2O2===CO 2+2H2O
(4)CH 4- 8e-+4CO 23-===5CO 2+ 2H2O
2O 2 + 8e -+ 4CO 2 ===4CO 32-
CH 4+2O 2===CO 2+2H2O
2. 燃料N2H4在负极放电,则 H2O2在正极(B极)上发生还原反应: H2O2+ 2e -===2OH 一。
电极A 为负极,N2H4发生氧化反应:N2H4— 4e- + 4OH - ===N2 T+4H2O , A极区c(OH -)减小, pH 减小。
3. 解析:(1)肼-空气燃料电池是一种碱性电池,O2在正极反应,故负极是肼发生反应:
N2H4 —4e —+ 4OH — ===N2 T+4H2O。
4. 解析:选D。
A选项,甲烷中的 C为一4价,一氧化碳中的 C为+ 2价,每个碳原子
失去 6 个电子,因此每消耗 1 mol 甲烷失去 6 mol 电子,所以错误; B 选项,熔融盐中没有氢氧根离子,因此氢氧根离子不能参与电极反应,电极反应式应为H2+CO+2CO23—— 4e—
===3CO 2 + H2O,所以错误;C选项,碳酸根离子应向负极移动,即向电极A移动,所以错误; D 选项,电极 B 上氧气得电子与二氧化碳反应生成碳酸根离子,所以正确。
THANKS !!!
致力为企业和个人提供合同协议,策划案计划书,
学习课件等等
打造全网一站式需求
欢迎您的下载,资料仅供参考。
