双抗体夹心法
双抗体夹心实验报告(3篇)

第1篇一、实验目的1. 掌握双抗体夹心法的基本原理和操作步骤。
2. 学习利用ELISA技术检测乙型肝炎病毒表面抗原(HBsAg)。
3. 分析实验结果,验证实验方法的有效性和准确性。
二、实验原理双抗体夹心法是一种常用的酶联免疫吸附试验(ELISA)方法,用于检测抗原。
其基本原理是将抗原与抗体结合,形成抗原-抗体复合物,再加入酶标记的抗体,通过显色反应判断抗原含量。
具体步骤如下:1. 将已知抗体包被于固相载体上,形成固相抗体。
2. 加入待测标本,若标本中含有目标抗原,则与固相抗体结合,形成抗原-抗体复合物。
3. 洗涤去除未结合的标本。
4. 加入酶标记的抗体,该抗体能与抗原-抗体复合物中的抗原结合。
5. 再次洗涤去除未结合的酶标记抗体。
6. 加入底物,底物在酶的催化下发生颜色变化,颜色深浅与抗原含量成正比。
三、实验材料1. 乙型肝炎病毒表面抗原(HBsAg)标准品2. 乙型肝炎病毒表面抗原(HBsAg)单克隆抗体3. 酶标记的二抗(辣根过氧化物酶标记的羊抗人IgG抗体)4. 酶联免疫吸附试验(ELISA)试剂盒5. 微孔板6. 仪器:酶标仪、离心机、移液器等四、实验步骤1. 包被抗体:将乙型肝炎病毒表面抗原(HBsAg)单克隆抗体稀释后,加入微孔板中,每孔100μl,37℃孵育过夜。
2. 洗涤:弃去孔内液体,用洗涤液洗板3次,甩干。
3. 封闭:加入封闭液,每孔200μl,37℃孵育1小时。
4. 洗涤:弃去孔内液体,用洗涤液洗板3次,甩干。
5. 加样:将待测标本、阳性对照、阴性对照和空白对照分别加入对应的孔中,每孔100μl,37℃孵育1小时。
6. 洗涤:弃去孔内液体,用洗涤液洗板3次,甩干。
7. 加酶标记二抗:将酶标记的二抗稀释后,加入各孔中,每孔100μl,37℃孵育1小时。
8. 洗涤:弃去孔内液体,用洗涤液洗板3次,甩干。
9. 加底物:将底物A液和B液按比例混合,加入各孔中,每孔100μl,37℃孵育15分钟。
双抗体夹心法原理

双抗体夹心法原理双抗体夹心法,也称为双特异性抗体结合(bispecific antibody sandwich method),是一种生物医学研究和临床应用中常用的技术手段。
它利用双特异性抗体能够同时结合两个不同抗原的特性,实现对细胞表面的目标分子的高效识别和定位。
本文将介绍双抗体夹心法的原理及其应用。
一、双抗体夹心法的原理概述双抗体夹心法原理基于单克隆抗体的特异性识别和结合,利用两个不同的单克隆抗体分别与两个不同的抗原结合,形成一个夹心结构,从而实现对目标分子的高效定位。
双抗体夹心法相较于传统的单克隆抗体法具有更强的特异性和高效性。
二、双抗体夹心法的工作原理双抗体夹心法的工作原理可以概括为以下几个步骤:1.制备双特异性抗体:首先,需要根据目标分子的特性和结构,设计并合成具有双特异性的抗体(例如,IgG1/2抗体)。
这种抗体一般由两个单克隆抗体的结合部分构成,通过基因工程技术将两个单克隆抗体的DNA片段融合,形成一个新的融合抗体。
2.融合抗体的表达和纯化:将融合抗体的DNA片段导入到特定的表达宿主细胞中,通过培养和表达,使融合抗体得以表达出来。
随后,通过一系列的纯化步骤,如离心、层析、过滤等,得到纯化的融合抗体。
3.双抗体的结合与识别:将纯化的融合抗体与目标分子进行混合,并保持一定的时间,使融合抗体与目标分子发生特异性结合。
由于融合抗体具有两个抗原结合部分,可同时与两个不同的目标分子结合,从而形成一个夹心结构。
4.检测体系的建立:为了定量检测目标分子的存在量,需要建立相应的检测体系。
一般常见的检测体系有酶联免疫吸附测定法(ELISA)、放射性测定法(RIA)等。
通过这些检测方法,可以快速、准确地测定融合抗体与目标分子的结合情况。
三、双抗体夹心法的应用双抗体夹心法由于其高效性和特异性,在生物医学研究和临床应用中得到广泛的应用。
以下是一些常见的应用领域:1.肿瘤治疗:利用双抗体夹心法的特点,可以设计并合成具有双靶向功能的抗体药物,如具有同时识别肿瘤细胞和免疫细胞的抗体。
双抗体夹心法名词解释(一)

双抗体夹心法名词解释(一)双抗体夹心法名词解释1. 双抗体夹心法(Double Antibody Sandwich Method)双抗体夹心法是一种常用的免疫学技术,用于检测特定蛋白质的存在和定量。
它利用两种抗体来固定待测物质,并借助酶标记物质的信号输出,实现对待测物质的检测。
2. 抗体(Antibody)抗体是一种由机体产生的免疫蛋白质,能够识别并结合特定的抗原分子。
在双抗体夹心法中,需要使用两种抗体,即固定抗体和检测抗体。
•固定抗体:固定抗体是特异性结合待测物质的抗体,通常进行固定和包被的处理,用于捕获和固定待测物质。
•检测抗体:检测抗体是与待测物质不同的抗体,常常标记有特定的酶,用于检测待测物质的存在,并通过酶的催化作用产生信号。
3. 酶标记(Enzyme Labeling)酶标记是将酶与抗体进行结合,用于产生信号输出。
在双抗体夹心法中,常用的酶标记物包括辣根过氧化物酶(HRP)和碱性磷酸酶(AP)等。
•辣根过氧化物酶(HRP):HRP是常用的酶标记物之一,它能够催化底物的氧化反应,产生可测定的信号,如发色反应。
•碱性磷酸酶(AP):AP是另一种常用的酶标记物,它能够催化底物的磷酸化反应,产生可测定的信号,如荧光或发色反应。
4. 信号输出(Signal Output)信号输出是指通过酶标记物催化作用产生的可测定的信号。
在双抗体夹心法中,可以通过测定底物的颜色、荧光强度或发光强度等来获得待测物质的定量信息。
例如,双抗体夹心法可以用于检测血液中的癌症标志物。
固定抗体首先被固定在试验板上,然后样品中的待测物质与固定抗体结合。
接着,添加检测抗体标记的酶,使其结合到待测物质上,形成一个含有待测物质的夹心结构。
最后,加入底物,酶催化底物发生化学反应,产生颜色或荧光信号。
根据信号的强度,可以定量分析待测物质的含量。
通过以上解释,我们了解了双抗体夹心法的基本原理和常用术语,以及其在分析检测中的应用。
这种免疫学技术在生命科学研究和临床诊断中具有广泛的应用价值。
双抗体夹心法原理

双抗体夹心法原理双抗体夹心法(Dual-Antibody Sandwich Assay)是一种常用于蛋白质检测的实验方法。
该方法通过同时使用两种特异性抗体,实现对目标蛋白的夹心检测,具有较高的灵敏度和特异性。
本文将介绍双抗体夹心法的原理及其应用。
一、原理双抗体夹心法原理基于酶联免疫吸附试验(ELISA)的基本原理发展而来。
其主要步骤包括涂覆、夹心、检测和信号检测等。
首先,实验者将一种特异性抗体沉积于固定载体(如微孔板)表面,形成抗原夹心层。
然后,待测物中的目标蛋白与夹心层中的特异性抗体结合。
接下来,实验者使用另一种与目标蛋白不同抗原冠名的特异性抗体,即“第二抗体”,来与目标蛋白结合。
第二抗体通常与酶标记有关,如辣根过氧化物酶(HRP)。
最后,通过添加特定底物,比如TMB(3,3', 5,5'-四甲基联苯胺)或BMP(2,2'-联氨苯胺),来观察信号的产生。
由于目标蛋白与第一、第二抗体同时结合,因此形成了一个夹心型结构。
这种双抗体夹心的结构能够在分析前富集目标蛋白,并增强信号的产生。
通过比较待测样品与已知浓度的标准曲线,可以确定待测物样品中目标蛋白的含量。
二、应用双抗体夹心法在生物医学及生命科学研究中得到了广泛的应用。
其主要应用领域包括药物研发、临床诊断和生物工程等。
在药物研发中,双抗体夹心法可用于药物候选分子的筛选和鉴定。
通过测定目标蛋白的含量,可以评估药物分子对目标蛋白的亲和力和选择性。
在临床诊断中,双抗体夹心法可用于检测体液中的生物标志物。
生物标志物是与疾病状态相关联的分子,如肿瘤标志物。
双抗体夹心法具有高灵敏度和特异性,可以准确、快速地检测这些生物标志物,为临床诊断提供重要依据。
另外,双抗体夹心法在生物工程领域也得到了广泛应用。
它可用于检测和定量表达蛋白。
通过测定特定蛋白的含量,可以评估蛋白表达系统的效率和纯度。
总结起来,双抗体夹心法是一种灵敏、特异、快速的蛋白质检测方法。
ELISA测定的常用模式一--测定的常用模式一--双抗体夹心法
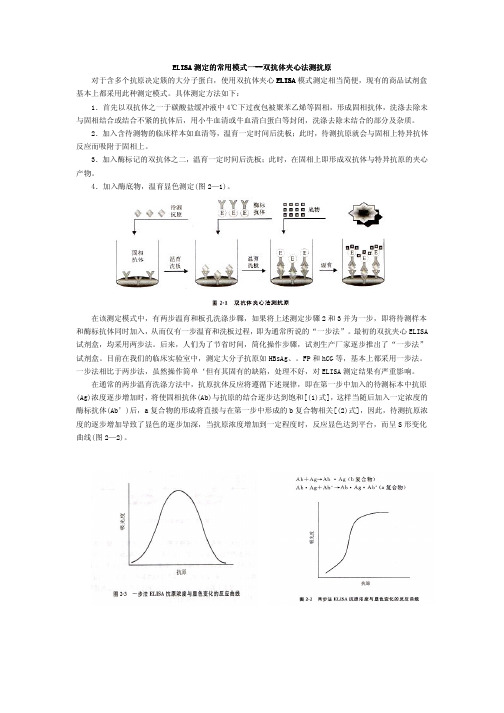
ELISA 测定的常用模式一测定的常用模式一------双抗体夹心法测抗原双抗体夹心法测抗原双抗体夹心法测抗原 对于含多个抗原决定簇的大分子蛋白,使用双抗体夹心ELISA 模式测定相当简便,现有的商品试剂盒基本上都采用此种测定模式。
具体测定方法如下:1.首先以双抗体之一于碳酸盐缓冲液中4℃下过夜包被聚苯乙烯等固相,形成固相抗体,洗涤去除未与固相结合或结合不紧的抗体后,用小牛血清或牛血清白蛋白等封闭,洗涤去除未结合的部分及杂质。
2.加入含待测物的临床样本如血清等,温育一定时间后洗板;此时,待测抗原就会与固相上特异抗体反应而吸附于固相上。
3.加入酶标记的双抗体之二,温育一定时间后洗板;此时,在固相上即形成双抗体与特异抗原的夹心产物。
4.加入酶底物,温育显色测定(图2—1)。
在该测定模式中,有两步温育和板孔洗涤步骤,如果将上述测定步骤2和3并为一步,即将待测样本和酶标抗体同时加入,从而仅有一步温育和洗板过程,即为通常所说的“一步法”。
最初的双抗夹心ELISA 试剂盒,均采用两步法。
后来,人们为了节省时间,简化操作步骤,试剂生产厂家逐步推出了“一步法”试剂盒。
目前在我们的临床实验室中,测定大分子抗原如HBsAg、。
FP 和hCG 等,基本上都采用一步法。
一步法相比于两步法,虽然操作简单‘但有其固有的缺陷,处理不好,对ELISA 测定结果有严重影响。
在通常的两步温育洗涤方法中,抗原抗体反应将遵循下述规律,即在第一步中加入的待测标本中抗原(Ag)浓度逐步增加时,将使固相抗体(Ab)与抗原的结合逐步达到饱和[(1)式],这样当随后加入一定浓度的酶标抗体(Ab’)后,a 复合物的形成将直接与在第一步中形成的b 复合物相关[(2)式],因此,待测抗原浓度的逐步增加导致了显色的逐步加深,当抗原浓度增加到一定程度时,反应显色达到平台,而呈S 形变化曲线(图2—2)。
而一步法双抗夹心ELISA 的反应曲线则为钟形曲线(图2—3)。
elisa双抗体夹心法临床应用

elisa双抗体夹心法临床应用ELISA(酶联免疫吸附试验)是一种广泛应用于生物医学领域的实验技术,可以用于检测特定抗体或抗原的存在。
在ELISA实验中,常用的检测方法之一就是双抗体夹心法。
本文将介绍ELISA双抗体夹心法在临床应用中的重要性和优势。
一、ELISA双抗体夹心法原理ELISA双抗体夹心法是一种通过两种抗体反应来检测目标分子的方法。
首先,在试验板上吸附抗原,然后加入第一种对抗原特异的抗体,使其与抗原结合。
接着,加入第二种与第一种抗体不同的抗体,这第二种抗体常被标记有酶等物质,以便后续检测。
通过测量酶的底物反应程度,可以确定目标分子的存在量。
二、ELISA双抗体夹心法在临床诊断中的应用1. 疾病诊断:ELISA双抗体夹心法可以用于检测患者体液中特定抗原或抗体的存在,帮助医生进行疾病的早期诊断。
例如,在HIV感染的诊断中,ELISA双抗体夹心法有着很高的敏感性和特异性,可以快速准确地检测出HIV抗体的存在。
2. 肿瘤标记物检测:ELISA双抗体夹心法也常用于检测患者体液中的肿瘤标记物,帮助筛查和监测肿瘤患者的疾病进展。
通过检测血清中特定肿瘤标记物的水平,医生可以及早发现肿瘤的复发或转移。
3. 药物检测:在药物治疗过程中,ELISA双抗体夹心法可以帮助医生监测患者体内药物浓度的变化,确定药物的治疗效果,以及调整治疗方案。
三、ELISA双抗体夹心法的优势1. 敏感性高:ELISA双抗体夹心法可以检测非常低浓度的抗原或抗体,具有较高的敏感性。
2. 特异性好:通过选择特异性较好的抗体,可以确保ELISA双抗体夹心法对目标分子的检测具有较高的特异性。
3. 操作简便:ELISA双抗体夹心法操作简单,不需要复杂的仪器设备,适合临床快速检测的需求。
总结:ELISA双抗体夹心法作为一种重要的生物医学检测技术,在临床应用中发挥着重要作用。
其高敏感性、良好特异性和操作简便性,使其成为临床诊断和治疗中不可或缺的工具,有助于提高疾病的早期诊断率和治疗效果,促进患者的健康管理。
elisa双抗体夹心法原理
elisa双抗体夹心法原理Elisa双抗体夹心法原理引言:Elisa(酶联免疫吸附试验)是一种常用的实验技术,用于检测和定量分析生物样本中的特定分子。
其中,双抗体夹心法是Elisa的一种常见应用,它通过特定抗体的结合来检测目标分子的存在。
本文将详细介绍Elisa双抗体夹心法的原理和应用。
一、Elisa双抗体夹心法的原理Elisa双抗体夹心法是一种间接的免疫测定方法,它利用两种不同的抗体来夹持目标分子,从而实现对目标分子的检测和定量分析。
1. 抗原涂覆:首先,在试验板上涂覆含有目标分子的抗原。
这个抗原可以是蛋白质、多肽、病毒、细菌等。
涂覆后,将试验板放置在适当的条件下,使抗原与试验板表面结合。
2. 阻断:为了避免非特异性结合,需要在试验板上进行阻断步骤。
通常使用一种无关的蛋白质(如牛血清蛋白)来阻断未被抗原结合的表面。
3. 第一次抗体结合:将含有特异性抗体的溶液加入试验板中,使其与目标分子结合。
这种特异性抗体通常是由动物免疫产生的,可以识别并结合目标分子。
4. 第一次洗涤:为了去除未结合的第一次抗体,需要进行洗涤步骤。
洗涤可以去除非特异性结合物,提高检测的特异性。
5. 第二次抗体结合:将与酶结合的第二次抗体加入试验板中,使其与第一次抗体结合。
这种第二次抗体通常是与酶(如辣根过氧化物酶)结合的抗体,可以通过酶的催化作用来放大信号。
6. 第二次洗涤:为了去除未结合的第二次抗体,需要进行洗涤步骤。
洗涤可以去除非特异性结合物,提高检测的特异性。
7. 底物添加:将含有底物的溶液加入试验板中,底物与酶的催化作用产生可测量的信号。
常用的底物有TMB(3,3',5,5'-四甲基联苯胺)等。
8. 反应停止:通过加入反应停止剂,停止底物的反应,并产生一个可测量的信号。
反应停止剂通常是酸性溶液,可以改变底物的颜色。
9. 信号检测:使用光谱仪或酶标仪等设备,测量底物反应产生的信号强度。
信号的强度与目标分子的浓度成正比,可以通过标准曲线来定量分析目标分子的浓度。
免疫层析双抗体夹心法原理
免疫层析双抗体夹心法原理免疫层析双抗体夹心法(sandwich ELISA)是一种常用的免疫测定方法,可以用来检测血清、尿液、细胞上清等样品中特定蛋白质的含量。
该方法利用酶标记的第一抗体与待测蛋白质结合,并用另一种与该蛋白质不同的第二抗体来结合被测蛋白质上获得的第一抗体,从而实现间接检测。
1.准备试剂:准备酶标记的第一抗体、被试蛋白质样品、第二抗体和底物等试剂。
2.将样品加入试剂:将待测样品加入微孔板中,与抗原结合。
如果需要,可以对样品进行前处理,如离心、稀释等。
3.洗涤:洗去未结合的样品成分。
这一步的目的是去除非特异结合物,以减少干扰。
4.加入酶标记的第一抗体:将酶标记的第一抗体加入微孔板中,与待测样品中的蛋白质结合。
5.洗涤:洗去未结合的酶标记的第一抗体。
6.加入第二抗体:将与酶标记的第一抗体所属物种不同的第二抗体加入微孔板中,与酶标记的第一抗体结合。
由于第二抗体与酶标记的第一抗体不同源,所以能够结合在被测蛋白质上的酶标记的第一抗体将同时与第二抗体结合。
7.洗涤:洗去未结合的第二抗体。
8.加入底物:加入酶底物,如TMB,使酶反应发生。
酶反应会产生一种可测量的产物,如染色产物。
9.反应停止:加入反应停止液停止酶反应,阻止产物的进一步形成。
10.测量:使用光谱仪或酶标仪测量样品中产物的光吸收值或荧光强度,从而得到待测蛋白质在样品中的含量。
通常,光吸收或荧光强度与蛋白质的浓度成正比。
免疫层析双抗体夹心法优点是具有较高的灵敏度和特异性。
它的原理基于两个特异性抗体固定在固相上,夹持着待测蛋白质。
通过使用两种特异性抗体,可以避免其他非特异性结合物的干扰,从而提高检测的特异性。
酶标记的抗体和酶底物使得检测结果可以通过光学或颜色变化进行定量分析,该方法因此非常适用于高通量检测。
然而,免疫层析双抗体夹心法也存在一些限制。
首先,该方法需要使用专门的抗体对待测蛋白质进行识别,因此需要事先开发特定的抗体。
其次,实验过程中存在多步酶反应,可能引入误差。
双抗体夹心法原理
双抗体夹心法原理随着生物技术的不断发展,研究人员不断努力寻找更有效的药物疗法来治疗各种疾病。
双抗体夹心法(或称抗体夹心法)作为一种新兴的治疗策略,正在受到越来越多的关注。
本文将介绍双抗体夹心法的原理和应用。
1. 基本概念双抗体夹心法是一种利用两种不同抗体与同一抗原结合的策略。
通常情况下,这两种抗体分别被称为抗原抗体和效应抗体。
抗原抗体与目标抗原结合,然后效应抗体与抗原抗体结合,形成一个“夹心”结构,从而实现对目标抗原的高度特异性识别和调控。
2. 原理解析双抗体夹心法的原理基于两种抗体结合抗原的能力和效应抗体的调控作用。
首先,抗原抗体具有高度特异性,可以选择性地识别和结合目标抗原。
其次,效应抗体具有特定的功能,例如抑制、促进或激活细胞免疫应答等。
当抗原抗体与目标抗原结合时,效应抗体可以通过结合抗原抗体来调控目标抗原的生物活性。
这可以通过以下几种方式实现:2.1. 抗体依赖性细胞毒性(ADCC)效应抗体可以结合至抗原抗体的Fc区域,激活免疫细胞,如自然杀伤细胞(NK细胞)以及单核细胞等,通过ADCC机制杀伤抗原阳性细胞。
这种机制在治疗癌症等疾病中已经被广泛应用。
2.2. 免疫调节效应抗体可以通过影响信号通路、改变细胞素产生及调节免疫细胞的功能,来调控免疫应答。
这种机制在治疗自身免疫性疾病、感染性疾病等方面具有良好的应用前景。
2.3. 抗体依赖性细胞捕获(ADCP)效应抗体不仅可以激活免疫细胞来杀伤抗原阳性细胞,同时还可以通过ADC机制让免疫细胞吞噬抗原阳性细胞。
这种机制在治疗炎症性疾病、感染性疾病等方面显示出潜力。
3. 应用前景双抗体夹心法作为一种新型的治疗策略,具有广泛的应用前景。
它可以用于治疗多种疾病,如肿瘤、自身免疫性疾病、炎症性疾病等。
临床试验已经显示,双抗体夹心法在治疗某些肿瘤中取得了显著的疗效。
此外,由于效应抗体具有多样化的功能,双抗体夹心法还具有潜力用于精准医学和个体化治疗。
尽管双抗体夹心法在治疗领域中有着广阔的应用前景,但仍然面临一些挑战。
双抗体夹心法原理
双抗体夹心法原理双抗体夹心法(Bispecific T-cell Engagers, BiTEs)是一种新型的抗体工程技术,通过同时结合两个不同的抗原靶标,激活并增强人体免疫系统对肿瘤细胞的攻击能力。
该技术的原理基于特异性结合抗原的单克隆抗体,并通过连接肿瘤细胞和T细胞,促进肿瘤细胞的杀伤作用。
1. 双抗体夹心法的结构双抗体夹心法的结构可以分为四个部分:单链Fv抗体、连接剂、单链Fv抗体、连接剂。
其中,单链Fv抗体是双抗体夹心法的关键组成部分,它可以同时结合两种不同的抗原靶标,例如肿瘤细胞上的特定抗原和T细胞上的CD3ε。
连接剂则起到连接作用,将两个单链Fv抗体相互连接在一起,形成抗体结构。
2. 双抗体夹心法的原理双抗体夹心法的原理是通过两个单链Fv抗体同时结合肿瘤细胞和T细胞,将它们紧密地连接在一起。
当双抗体夹心法与肿瘤细胞结合时,它可以释放活化信号,激活附近的T细胞。
同时,双抗体夹心法也能够增强T细胞对肿瘤细胞的杀伤能力,并促使T细胞产生细胞毒性溶解素和细胞因子等效应分子,进一步增强其杀伤作用。
3. 双抗体夹心法的应用双抗体夹心法作为一种新型的免疫治疗技术,已经在临床试验中显示出良好的疗效,并在一些特定类型的恶性肿瘤治疗中取得了显著的进展。
例如,针对B细胞淋巴瘤的双抗体夹心法已经获得了FDA的批准,并成功实现了临床应用。
此外,双抗体夹心法还可以用于其他类型的恶性肿瘤治疗,如乳腺癌、肺癌等。
4. 双抗体夹心法的优势和挑战双抗体夹心法相比传统的单克隆抗体治疗具有一些明显的优势。
首先,双抗体夹心法可以同时结合两种不同的抗原靶标,通过激活T细胞的杀伤作用,增强肿瘤细胞的杀伤效果,并减少肿瘤细胞对治疗的耐药性。
其次,双抗体夹心法可以有效地激活免疫系统,提高肿瘤治疗的整体效果。
然而,双抗体夹心法在应用过程中也存在一些挑战,如制备成本高、体内稳定性等问题,需要进一步研究和改进。
总结:双抗体夹心法是一种基于抗体工程技术的新型免疫治疗方法,通过同时结合两个不同的抗原靶标,激活并增强人体免疫系统对肿瘤细胞的攻击能力。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
⑴将已知抗原包被固相载体,形成固相抗原.洗涤除去未结合的抗原及杂质.⑵封闭:用高浓度无关蛋白封闭,阻止待检血清中非特异IgG吸附固相.
⑶加待检血清,孵育,使固相抗原和待检抗体充分结合,洗涤除去未结合的非特异抗体 及其他血清成分.
⑷加酶标抗体或酶标SPA,孵育,形成固相抗原彳寺检抗体-酶标抗抗体(或酶标SPA复 合物.
⑷加底物显色.固相上的酶催化底物产生有色产物,通过比色,测标本中抗原的量.现多采用针对单一抗原决定簇特异性的单克隆抗体做固相化和酶标抗体,则受检样
品和酶标抗体可一次性加入,简化流程,缩短反应时间.若标本中待测抗原浓度过高,抗 原可分别与酶标抗体和固相抗体结合而不形成上述夹心复合物(类似于免疫沉淀反
应中抗原过剩时的后带现象),使最终结果低于实际含量(钩状效应),甚至出现假阴性 现象.因此对此类标本应适当稀释后再测定.另外,当血清中存在类风湿因子(RF)时,类
是双抗原夹心法.
操作步骤:
⑴将特异性抗体包被固相载体McAb.孵育一定时间,使形成固相抗体,洗涤除去未结 合的抗体和杂质.
⑵加待检标本,孵育,使标本中的抗原与固相载体上的抗体充分反应,形成固相抗原抗
体复合物.洗涤除去其他未结合物质.
⑶加酶标抗体,孵育,使形成固相抗体-待测抗原-酶标抗体夹心复合物.洗涤除去未结 合酶标抗体.
1.双抗体夹心法 双抗体夹心法,属于非竞争结合测定.它是检测抗原最常用的ELISA,适用于检测分子 中具有至少两个抗原决定簇的多价抗原,而不能用于小分子半抗原的检测.其基本工作原理是:利用连接于固相载体上的抗体和酶标抗体分别与样品中被检测 抗原分子上两个抗原决定簇结合,形成固相抗体-抗原-酶标抗体免疫复合物.由于反 应系统中固相抗体和酶标抗体的量相对于待测抗原是过量的,因此复合物的形成量
合的酶标抗原多,显色深,测定管则依被检抗原和酶标抗原竞争结合固相抗体程度不 同而显色深浅有异:被检抗原多,酶标抗原与固相抗体结合少,底物显色反应弱,色浅;反之呈色深.即结合于固相的酶标抗原量与样品中被检抗原浓度负相关.计算测定管
与对照管颜色深度(OD值)之差,即可确定被检抗原量.
4.捕获法
捕获法(亦称反向间接法)ELISA,主要用于血清中某种抗体亚型成分(如IgM)的测定.以目前最常用的IgM测定为例,因血清中针对某种抗原的特异性IgM和IgG同时存 在,则后者可干扰IgM的测定.因此捕获法的工作原理设计为:先将针对IgM的第二抗 体(如羊抗人IgM口链抗体)连接于固相载体,用以结合("捕获")样品中所有lgM(特异或 非特异),洗涤出去IgG等无关物质,然后加入特异抗原与待检IgM结合;再加入抗原特 异的酶标抗体,最后形成固相二抗-IgM-抗原-酶标抗体复合物,加酶底物作用显色后,即可对样品中待检IgM是否存在及其含量进行测定.
固相载体上复合物中被测定的酶标抗原(抗体)的量(酶活性)与样品或标准品中非标
记抗原(抗体)的浓度成反比.
操作步骤
⑴将已知抗体包被载体,形成固相抗体.洗涤除去未结合物.
⑵加入待检标本和酶标抗原,孵育,使两者与固相抗体竞争结合.洗涤除去未结合到固 相上的游离酶标抗原及其他未结合物.
⑶加底物显色.颜色深浅与待测抗原量成反比.同理,也可用固相抗原和酶标抗体作试剂,使固相抗原和标本中的待检抗原竞争结合
(enzyme linked immunofluorecenee assay,ELFIA),斑点-ELISA(dot-ELISA)和酶联免疫 电转移印迹法(enzyme linked immunoelectrotransfer blot,EITB)以及酶联免疫化学发 光测定(enzyme linked immunochemiluminescenee assay,ELICLA)等.新方法不仅进一 步提高了测定灵敏,特异性,而且使ELISA技术在提高自动化程度的同时,也便于单份 样本测定和简化设备条件,尤其试用于急诊,社区诊所及家庭化验.
5.其他ELSA
ELSA法由于测定灵敏,特异,操作简便,易于自动化,且无放射性污染等诸多优点,使其 不仅成为目前应用最广而且发展最快的一种免疫测定技术.而且在方法学上的改进 和衍化,使其不断有各具特点的新测定法问世,如应用生物素-亲和素放大系统
(biotin-axidin system,BAS)的ELISA;利用酶催化底物发荧光的酶联免疫荧光测定
酶标抗体.待检抗原竞争抑制酶标抗体和固相抗原结合,即待检抗原越多,显色越浅.
以抗原测定为例,先将特异性抗体连接于固相载体,分别设置对照管和样品测定管;对 照管中仅加酶标抗原,加样后,无非标记抗原竞争,酶标抗原即与固相抗体充分结合;而 测定管抗原与后者的结合受到抑制而减少.加酶底物显色后,对照管因固相抗体上结
风湿因子(RF)可充当抗原 而形成固相抗体-类风湿因子-酶标抗体夹心复合物,从而出 现假阳性结果.
2.间接法 此法是测定抗体最常用的方法,属非竞争结合试验.其原理是将抗原连接到固相载体 上,样品中待测抗体与之结合成固相抗原-受检抗体复合物,再用酶标二抗(针对受检
抗体的抗体,如羊抗人IgG抗体)与固相免疫复合物中的抗体结合,形成固相抗原-受检 抗体-酶标二抗复合物,测定加底物后的显色程度,确定待测抗体含量.
⑸加底物显色.
间接法由于采用的酶标二抗是针对一类免疫球蛋白分子(如抗人IgG),因此该法只需 要换固相抗原,即可用一种酶标二抗检测各种与抗原相应的抗体,具有更广泛的通用 性.
3.竞争法
竞争法ELISA可用于抗原和半抗原的定量测定,也可对抗体进行检测.其方法和特点 是:①酶标记抗原(抗体)与样品或标准体中的非标记抗原或抗体具有相同的与固相抗 体(抗原)结合的能力;②反应体系中,固相抗体(抗原)和酶标抗原(抗体)是固定限量,且 前者的结合位点少于酶标记与非标记抗原(抗体)的分子量和;③免疫反应后,结合于
与待测抗原的含量成正比(在方Байду номын сангаас可检测范围内).测定复合物中的酶作用于加入的底 物后生成的有色物质量(OD值),即可确定待测抗原含量.若固相载体上的抗体和酶 标抗体分别与样品中被检测抗原分子上两个不同的抗原决定簇结合,则属于双位点 夹心法.若采用固相载体上的抗原和酶标抗原分别与样品中被检测抗体分子结合,则
