【开题报告】液质联用测定银杏提取物中银杏酸的方法研究
注射用银杏叶提取物及其制剂中总银杏酸含量的测定

注射用银杏叶提取物及其制剂中总银杏酸含量的测定引言银杏是一种珍贵的中草药,其叶子被广泛应用于医药制剂中。
银杏叶提取物中的总银杏酸是其主要活性成分之一,具有改善微循环、抗氧化、抗炎等多种作用。
监测和测定注射用银杏叶提取物及其制剂中总银杏酸含量是非常重要的。
材料与方法1. 实验仪器与试剂(1) 仪器: 离心机、紫外可见分光光度计、磁力搅拌器、研钵、磁力搅拌器、0.22μm微孔膜过滤器。
(2) 试剂: 甲醇、乙醇 (分析纯)、总银杏酸标准品。
2. 样品的制备粉碎银杏叶干燥物,取适量粉碎物加入甲醇与乙醇混合溶液浸泡,振荡60分钟后过滤,取滤液加入甲醇与乙醇混合液中,浸泡24小时后过滤,浓缩收集溶剂,干燥得到提取物。
3. 总银杏酸的测定(1) 样品溶液的制备: 取适量提取物加入甲醇与乙醇的混合溶液中,振荡溶解,通过0.22μm微孔膜过滤器过滤。
(2) 样品溶液的检测: 取适量样品溶液,用紫外可见分光光度计进行检测,以总银杏酸标准品为对照组。
数据处理通过测定样品中总银杏酸的浓度,得出样品中总银杏酸的含量,并与标准品进行对照,计算出样品中总银杏酸的含量。
讨论注射用银杏叶提取物及其制剂中总银杏酸含量的测定是十分重要的。
总银杏酸的含量不仅决定了银杏叶提取物的质量,也与其药效密切相关。
对总银杏酸含量进行精准的测定是保证药品质量和有效性的重要保障。
结论制作注射用银杏叶提取物及其制剂中总银杏酸含量的测定是十分关键的,通过合理选择仪器、试剂和标准操作流程,可以准确测定样品中总银杏酸的含量,并且得出科学准确的数据,为保障药品的质量和有效性提供了重要的支持。
这一研究也为银杏叶提取物及其制剂在临床上的应用提供了科学的参考依据。
银杏酸检测

迪信泰检测平台
银杏酸检测
银杏酸(Ginkgolic acid)是6-烷基或6-烯基水杨酸的衍生物,是一种混合物,包括有白果酸、氢化白果酸、氢化白果亚酸等。
银杏酸有抗菌作用,主要体现在体外能抑制结核杆菌的生长。
迪信泰检测平台采用高效液相色谱(HPLC)和液质联用(LC-MS)技术,可高效、精准的检测银杏酸的含量变化。
此外,迪信泰检测平台还提供其他多种中药成分检测服务,方法成熟,可高效处理大批量样本。
HPLC和LC-MS测定银杏酸样本要求:
1. 请确保样本量大于0.2g或者0.2mL。
周期:2~3周。
项目结束后迪信泰检测平台将会提供详细中英文双语技术报告,报告包括:
1. 实验步骤(中英文)。
2. 相关质谱参数(中英文)。
3. 质谱图片。
4. 原始数据。
5. 银杏酸含量信息。
迪信泰检测平台可根据需求定制其他物质测定方案,具体可免费咨询技术支持。
银杏叶提取物中的银杏酸

银杏叶提取物中的银杏酸更新时间:2010-8-4 8:56:52银杏是一种具有很高药用价值的植物, 其叶、果实、种子均有较高的药用价值, 其药理作用不断被认识, 临床应用范围逐步扩大。
银杏叶提取物中的黄酮苷与银杏内酯分别具有抗氧化、抗血小板聚集及改善记忆、提高机体免疫功能等药理作用, 银杏叶提取物制剂目前在临床上用于治疗胸痹、中风, 实际上其功能远不止这些, 已有确切的报道指出其对周围神经病变、老年痴呆症等有良好的功效。
该类银杏叶提取物制剂的应用范围日渐扩大, 产品也涉及药品、保健品和化妆品等领域。
银杏叶有重要的药用价值, 它含有多种药用成分, 如: 银杏黄酮类、萜类内酯类、生物碱、亚油酸、酚类、奎宁酸、抗坏血酸、白果酸、白果酮等, 这些物质对于由动脉硬化、血脂过高引起的各种疾病有很好的疗效, 现有上市的银杏叶提取物叶片, 多以单味银杏叶提取物为原料制成。
相关研究发现, 银杏叶中除含有功效成分银杏黄酮苷与银杏内酯外, 还含有一类引起不良反应的烷基酚酸类物质, 约占银杏叶干重的l%~2%, 主要由银杏酸、白果酚和白果二酚组成[1], 其中与不良反应有关的主要是银杏酸。
目前已知的银杏叶提取物制剂中银杏酸主要有白果酸( Ginkgolic acid, a) 、氢化白果酸( Hydroginkgolic acid, b) 、氢化白果亚酸( Hydroginkgolinicacid, c) 和白果新酸( Ginkgoneolic acid, d) , 各化合物结构与生漆中的致敏物质漆酚类似, 而此结构正是致敏的根源, 其中烃基上的双链越多越易致敏。
国外研究报道, 银杏叶提取物中的银杏酸具有潜在的致敏和致突变作用、和强烈的细胞毒性[5], 可引起严重的过敏反应、基因突变、神经损伤, 导致恶心和胃灼热、过敏性休克、过敏性紫癜、剥脱性皮炎、消化道黏膜过敏、痉挛和神经麻痹等不良反应。
在德国银杏叶提取物制剂EGb761的一项回顾性研究中报道, 8505例用药患者中共有9例出现胃肠道不良反应。
注射用银杏叶提取物及其制剂中总银杏酸含量的测定
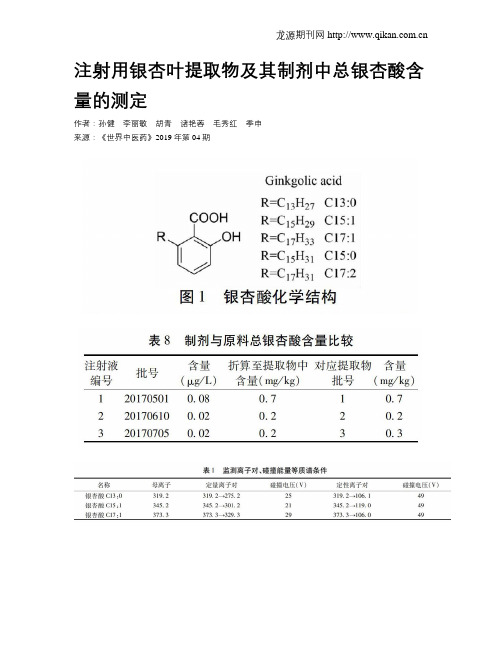
注射用银杏叶提取物及其制剂中总银杏酸含量的测定作者:孙健李丽敏胡青诸艳蓉毛秀红季申来源:《世界中医药》2019年第04期摘要;目的:建立超高效液相色谱串联三重四极杆质谱测定注射用银杏叶提取物及其制剂中总银杏酸的方法。
方法:采用HLB固相萃取净化制剂,Waters Cortecs T3色谱柱(50mm×2.1 mm,2.7 μm),以甲醇-1%冰醋酸溶液(90∶10)为流动相,在电喷雾离子化负离子模式下,以多反应监测方式(MRM)检测。
结果:银杏酸C13:0、C15:1、C17:1在0~50 ng/mL范围内成良好线性关系,相关系数均大于0.999;平均加样回收率为97.3%~115.2%,相对标准偏差(RSD)为0.3%~3.4%;检出限分别为0.03、0.06、0.04 mg/kg。
结论:本方法可应用于实际样品的测定。
关键词;银杏叶提取物;注射剂;银杏酸C13:0;银杏酸C15:1;银杏酸C17:1;超高效液相色谱-三重四极杆质谱;多重反应监测;固相萃取Determination of Ginkgolic Acids in the Ginkgo Biloba Extract for Injection and its Preparation Sun Jian,Li Limin,Hu Qing,Zhu Yanrong,Mao Xiuhong,Ji Shen(Shanghai Institute for Food and Drug Control,Shanghai 201203,China)Abstract;Objective:To develop an analytical method for determination of ginkgolic acids in the ginkgo biloba extract for injection and its preparation by ultra-high performance liquid chromatography-triple quadrupole mass spectrometry.Methods:The preparations were purified by HLB SPE.A chromatographic column,Waters Cortecs T3(50 mm×2.1 mm,2.7 μm),was used with methanol-1% acetic acid(90∶10)as the mobile phase.The ginkgo acids were detected by electrospray ionization mass spectrometry in negative mode with multiple reaction monitoring (MRM)mode.Results:Ginkgo Acid C13:0,C15:1 and C17:1 possessed good linear correlation in the mass concentration range from 0 to 50 ng/mL,with the correlation coefficients more than 0.999.The mean recoveries were in the range of 97.3%-115.2%,and the RSDs were 0.3%-3.4%.The limits of quantification were 0.03,0.06,0.04 mg/kg,respectively.Conclusion:The method could be applied to the analysis of ginkgolic acids in actual samples.Key Words;Ginkgo biloba extract; Injection; Ginkgolic acid C13:0; Ginkgolic acid C15:1; Ginkgolic acid C17:1; Ultra high performance liquid chromatography-tandem mass spectrometry; Multiple reaction monitor; Solid-phase extraction中圖分类号:R284.1文献标识码:Adoi:10.3969/j.issn.1673-7202.2019.04.006银杏叶提取物为银杏科植物银杏的干燥叶经加工制成的提取物,其主要功效为活血化瘀通络。
几种银杏类制剂中银杏酸的高效液相色谱法测定

几种银杏类制剂中银杏酸的高效液相色谱法测定作者:李兰崇尹志芳杨宇强汤梓雄王玲来源:《中国实用医药》2015年第01期【摘要】采用正己烷提取,薄层色谱纯化,高效液相色谱法(HPLC)检测并考察几种银杏类制剂总银杏酸的含量。
色谱条件为Hypersil ODS C-18(150 mm×4.6 mm, 5 µm);流动相组成为甲醇-3% HAc溶液(92:8, V/V),紫外检测波长306 nm,流速1.0 ml/ min,柱温40℃,进样量:20 µl,外标法计算含量。
结果表明:总银杏酸线性回归方程为:Y=4998X-100492, r2=0.9986,线性关系良好。
标准品和样品的相对标准偏差RSD均为0.38%,表明仪器精密度良好。
7种银杏产品中,采摘的新鲜银杏叶中总银杏酸的含量接近于1%,其余6种市场上的银杏制剂总银杏酸含量均较大程度超过10 ppm。
其中,这一研究结果为正确使用银杏叶产品提供了参考。
【关键词】银杏类制剂;银杏酸;高效液相色谱法近年来,各种银杏类制剂如银杏茶、银杏片、银杏胶囊、银杏注射液因含有较高的总黄酮醇苷、萜类内酯等,具有降血糖,软化血管等功效,逐渐广泛使用于治疗心脑血管类疾病。
但同时还含有一类有毒成分银杏酸,具有致敏性[1, 2]、细胞毒性[3, 4]和免疫毒性[5]等作用,其食用安全性已引起人们的高度重视。
按照《中国药典2010版》对银杏叶药材的质量标准规定,有效成分总黄酮不得少于0.4%、银杏总内酯不得少于0.25%。
对其毒性成分总银杏酸的含量不得超过百万分之十。
从药品安全性角度考虑,德国Schwabe公司1991年专利中提出银杏酸类化合物含量要求低于10 mg/kg,德国卫生部1997年提出银杏酸含量应低于5 mg/kg[6]。
基于此,本实验从市面上购买了几种不同的银杏产品,采用正己烷提取,薄层色谱纯化, HPLC法检测考察其中银杏酸的含量。
银杏酸及银杏酚的提取分离工艺探讨

银杏酸及银杏酚的提取分离工艺探讨韩相永马西欣银杏外种皮含有醇、酚、酸等多种化学物质,不但有恶臭昧.而且对较多人的皮肤会发生强烈的刺激作用,引起瘙痒,出现皮炎水疱,严重者出现痉挛和皮肤灼伤.这说明银杏外种皮中含有较多的活性成分。
有研究者曾用银杏外种皮作过杀虫剂及有关农药的研究探讨。
多年来,银杏外种皮一直作为废物被丢弃,这既浪费了资源又污染了环境,为更好地综合开发利用银杏资源。
我们采用甲酵提取、乙醚萃取法,从银杏外种皮中提取出了银杏酸、银杏酚,为银杏外种皮的进一步开发利用奠定了基础。
1 提取工艺银杏外种皮用70%甲醇浸提,浓缩液用乙醚萃取,醚层再加5%Na2CO3萃取.所得碱性水层酸化得组分c.醚层再加5% NaOH萃取,所得碱性水层酸化后乙醚萃取,柱层析得组分A为银杏酸.醚层经层析得组分B为银杏酚。
2 操作步骤2.1 提取分离取干燥的外种皮3kg粉碎,加70%甲酵7000ml室温浸泡48h,然后抽滤,待滤液减压回收至50ml。
将浓缩液用乙醚600 ml分三次萃取,得深褐色的醚层。
醚层用5%Na2CO3溶液萃取,得红棕色的醚层和桶红色Na2CO3液层.碱液层经酸化抽滤干燥后得酸性成分C为2.2g。
为黄色固态物质。
红棕色的醚层再用5%NaOH溶液萃取。
NaOH层酸化后再用乙醚萃取,回收乙醚得红褐色的组分A 50ml。
NaOH萃取后的醚层回收后得黄色组分B 25ml。
2.2 各组分的层折分离2.2.1 组分A的分离先用薄层层析摸索分离条件。
薄层层析条件为吸附剂硅胶GF254(110℃活化1h).展开剂为石油醚-乙酸乙酯(85:15),显色用紫外光照射(波长254nm),斑点呈棕色。
然后用柱层析分离。
分离条件:吸附剂为硅胶240g(100一200目,活性三级),洗脱液为石油醚-乙酸乙酯(85:15),组分共8ml。
用薄层层析监控柱层析,收集洗脱液第一个300ml。
回收洗脱液得黄色固态物质2g。
在分离组分A时.也可用制备薄板进行切割分离,薄层层析为一个斑点。
注射用银杏叶提取物及其制剂中总银杏酸含量的测定

注射用银杏叶提取物及其制剂中总银杏酸含量的测定【摘要】本研究旨在开发一种测定注射用银杏叶提取物及其制剂中总银杏酸含量的方法。
样品经过制备后,通过色谱条件进行分析,采用定量方法测定银杏酸含量,并进行方法验证。
结果分析表明,该方法准确可靠,适用于银杏酸的测定。
结论指出,本研究为注射用银杏叶提取物及其制剂的质量控制提供了重要参考,具有一定的应用前景。
【关键词】注射用银杏叶提取物、总银杏酸含量、测定、样品制备、色谱条件、定量方法、方法验证、结果分析、总结、展望1. 引言1.1 研究背景目前,国内外对于银杏叶提取物中总银杏酸含量的测定方法主要有高效液相色谱法、气相色谱法、紫外分光光度法和色谱质谱联用法等。
这些方法在测定精度、灵敏度和准确性上各有优劣,但都需要进行方法的验证和结果的分析,以确保测定结果的可靠性和准确性。
本研究旨在建立一种简便、准确的方法,用于测定注射用银杏叶提取物及其制剂中总银杏酸的含量,并进行方法验证和结果分析,为其临床应用提供科学依据。
1.2 研究目的本研究旨在建立一种精确、快速、稳定的测定注射用银杏叶提取物及其制剂中总银杏酸含量的方法。
当前市面上对注射用银杏叶提取物及其制剂中总银杏酸含量的测定方法存在一定的局限性和不足,在一定程度上影响了产品质量的监控和控制。
本研究的目的是对现有的测定方法进行改进和优化,使其具有更高的灵敏度、准确度和稳定性,从而为相关企业提供更准确、可靠的产品质量控制手段。
通过该研究,也将为相关行业的技术研发和质量监管提供参考和借鉴,推动该领域的发展和进步。
2. 正文2.1 样品制备样品制备是该研究的关键步骤之一,其质量直接影响到后续的分析结果。
需要选择高质量的注射用银杏叶提取物作为样品。
样品的选择应该考虑到其来源、保存条件以及处理方式等因素,以确保样品的稳定性和纯度。
在实际操作中,可以选择市售的银杏叶提取物作为样品,也可以自行提取银杏叶提取物。
在样品制备过程中,需要注意保持样品的稳定性和一致性。
银杏叶提取开题报告

银杏叶提取开题报告1. 研究背景和目的银杏叶是银杏树的叶片,含有丰富的活性成分,具有多种保健功效。
银杏叶提取物已被广泛应用于药物、食品和化妆品等领域。
然而,目前对于银杏叶提取物的研究大多局限于传统的溶剂提取法,存在提取效率低、工艺复杂、成本高等问题。
因此,本研究旨在探索高效、简单、经济的银杏叶提取方法,以进一步优化银杏叶提取工艺,提高提取效率和降低成本。
2. 研究内容和方法本研究将采用超声波辅助提取技术对银杏叶中的活性成分进行提取。
具体研究内容和方法如下:2.1 银杏叶样品准备从成熟的银杏树上采集新鲜、健康、无病虫害的银杏叶作为研究样品。
将采集的银杏叶进行洗净、晾干,并粉碎成足够细的颗粒以便于提取。
2.2 超声波辅助提取将银杏叶颗粒放入装有提取溶剂的超声波提取仪中,设置适当的超声波功率和提取时间。
超声波的作用下,溶剂中的超声波波动将加速提取物的释放,从而提高提取效率。
2.3 提取液处理将超声波提取得到的提取液过滤,去除固体颗粒。
然后,使用旋转蒸发仪对提取液进行浓缩,以得到浓缩银杏叶提取物。
2.4 活性成分分析使用色谱-质谱联用系统(LC-MS)对银杏叶提取物中的活性成分进行分析和鉴定。
借助高效液相色谱技术,可以快速、精确地测定银杏叶提取物中各种活性成分的含量和组成。
3. 预期结果和意义3.1 预期结果通过超声波辅助提取技术,预期可以获得高纯度、高效率的银杏叶提取物。
同时,通过活性成分分析,预期可以确定银杏叶提取物中的主要活性成分及其含量。
3.2 意义本研究的结果可以为银杏叶的生产和应用提供科学依据和技术支持。
高效的银杏叶提取方法可以降低生产成本,提高产品质量。
同时,对银杏叶中活性成分的分析和鉴定有助于深入了解其保健功效,为进一步开发和利用银杏叶提取物提供参考。
4. 工作计划本研究计划按照以下时间表进行:•第一周:收集相关文献,详细了解超声波辅助提取技术及其在植物提取领域的应用。
•第二周:制备银杏叶样品,包括采集、洗净、晾干和粉碎。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
开题报告化学液质联用测定银杏提取物中银杏酸的方法研究一、选题的背景与意义在生活水品不断提高的今天,健康与美丽成为人们不断追求的目标。
作为天然活性成分的代名词——银杏便备受热捧。
无论是时尚美丽的美容界,还是天然健康的保健品行业,又或者是不断探索的医药品领域,都随处可见银杏的芳名。
尤其医疗领域中,银杏是一种药用历史悠久的植物,以银杏黄酮和银杏内酯为主要成分的银杏叶制剂是目前国际上流行的治疗心脑血管疾病的天然有效药物,许多国家都致力于银杏叶制剂的开发。
银杏叶提取物(EGB)的化学成分不仅包括银杏黄酮/内酯等主要有效成分,还有银杏酸这一有害成分。
银杏酸是国内外一致公认的潜在过敏物质,是自然界中最强烈的接触性过敏原中的成分之一,可引起严重的过敏反应,还会引起基因突变、神经损伤等。
德国卫生部规定银杏提取物(EGb)制剂中银杏酸的含量必须小于5 ug/g。
市面上竟然有人在EGB中利用芦丁等掺杂使假,但现行质量标准又无法控制,这个问题如果不解决,终究会影响银杏叶制剂的功效,损害并断送我国的银杏叶产业。
所以,真正全面控制EGB的质量迫在眉睫[1]。
我国是银杏种植大国,也是银杏叶提取物生产和出口大国,因此,建立准确的银杏酸检测方法就显得尤为重要。
二、研究的文献回顾:目前就银杏酸的检测没有规定的国家标准,但是相关文献报道不少。
其中关于由于实验者不同,实验方法也竞相各异,归纳起来大致有以下几大类不同的方法。
2.1 高效液相法王志强黄胜海张琰曾报道过利用Agilent1100 高效液相色谱仪对SC-CO2萃取和甲醇回流萃取银杏果外种皮中的银杏酸进行含量测定[2]。
沈刚,姚渭溪报道过一种用改性的超临界二氧化碳萃取和离线的反相高效液相色谱分析银杏叶提取物中银杏酸含量的方法。
以硅胶为载体,在30MPa、55℃条件下,8%甲醇作改性剂时的超临界二氧化碳萃取,最小检测限为0.42 mg/L[4]。
仰榴青,吴向阳,陈钧还报道过反相高效液相色谱法测定银杏外种皮中银杏酸含量的方法,该方法以Inertsil ODS-2色谱柱,流动相为甲醇:3%HAc溶液(92:8,V,V),流速1.0 mL/min,检测限5.2 ng。
但银杏外种皮提取物经硅胶柱层析预处理[5]。
孔玉霞,李晨恺,王盼盼,宋金玉报道了银杏酸含量的反相高效液相色谱测定方法。
银杏酸在酸性盐溶液中,仅用正己烷萃取后的样品即可供HPLC分析,避免了多次浓缩过程。
研究表明,此定量分析方法可用于银杏制剂中银杏酸含量的定量检测,最小检出量为0.41mg/L[8]。
2.2 紫外光度法吴向阳,仰榴青,陈钧在《不同生长季节银杏叶中有毒成分银杏酸含量的测定》中报道过银杏叶经正己烷处理后用紫外分光光度法测定银杏叶中有毒成分银杏酸含量的方法。
该方法最低可测至5.72×10-6,可用于银杏叶和银杏茶中有毒成分银杏酸的定量分析[3]。
2.3 液质联用法何静仁,谢笔钧用LC/ESI一MS对银杏叶提取物中银杏酸进行鉴定,并用反相银化HPLC研究4种银杏酸的分离和含量测定。
在银杏叶的乙醇浸提液中加酸性盐溶液和少量吸附剂后,用正己烷提取,浓缩后的残留物进行HPM 分析。
流动相为甲醇:5% 乙酸(90:10),其中银离子浓度为0.03 mol/l 。
HPLC和二极管阵列检测联用对银杏酸色谱峰进行光谱分析和纯度鉴定[9]。
陈学国,孔亮等报道过全二维液相色谱串联质谱分离分析模式,将质脂体色谱柱和ODS反相色谱柱作为二维分析色谱柱,二者通过一个连有两个0.5 mL定量环的八通阀耦联。
质脂体色谱柱上的馏分在反相色谱柱上分离后,直接进入紫外一检测器,然后经分流器分流后进入大气压电离质谱方法来分析银杏叶提取物成分。
不过该方法只给出了定性分析,并未给出定量分析结果[6]。
吴向阳,仰榴青,陈钧等报道了银杏叶提取物及其制剂经石油醚提取,提取液浓缩后用石油醚定容,HPLC直接测定,并用LC/MS对其中的银杏酸进行了定性鉴定。
结果大致给出总银杏酸含量并未给出单一银杏酸含量[7] [10]。
Karine Ndjoko, Jean-Luc Wolfender等曾用LC - ESI- MS检测过银杏叶中银杏酸的含量,该方法需要经过氯仿等有机溶剂萃取,还要过硅胶柱等繁琐的前处理[15]。
综上所诉,目前检测银杏酸的方法主要以HPLC法为主,高效液相法的技术较成熟,但大多测定结果均未能达到5ppm以下的标准。
紫外分光光度法用于定量分析误差较大,准确度不高。
液质联用技术处于起步阶段有待进一步确定及提高,从而满足相关国际限量标准。
三、研究的技术路线与预期目标:拟采取的技术路线预期达到目标建立较为简洁步骤方法,选择一种能较好提取该类化合物的溶剂,进行充分快速的净化、浓缩操作,并确保方法的回收率;色谱分离条件要满足化合物的残留分析,能对银杏提取物中银杏酸残留量情况进行检测。
检测方法能满足兽药残留以及分析化学行业的分析要求,最低检测限达到国内外相关技术标准,符合出入境检验检疫药物残留控制限量要求。
四、研究的总体安排与进度:2010年10月15日:完成选题工作2010年10月16日——2010年12月10日:外文翻译,文献综述和开题报告2010年12月11日——2011年1月20日:实验验证及方法初步探索2011年2月20日——2011年4月3日:实验条件优化与数据整理2011年4月4日——2011年5月3日:毕业论文撰写2011年5月4日——2011年5月20日:毕业答辩五、主要参考文献:[1]. 祝匡善,刘明.警惕:银杏叶制剂中的银杏酸含量[N].医药经济报, 2007, (2007-01-19).[2]. 王志强,黄胜海,张琰.不同工艺提取银杏外种皮中银杏酸及含量的测定[J].现代农业科技,2009(24): 326-328.[3]. 吴向阳,仰榴青,陈钧. 不同生长季节银杏叶中有毒成分银杏酸含量的测定[J].分析检测,2002,23(12):94-97.[4]. 沈刚,姚渭溪. 超临界流体萃取和高效液相色谱法测定银杏酸[J].分析化学研究简报,2000,28(8):985-988.[5]. 仰榴青,吴向阳,陈钧.高效液相色谱法测定银杏外种皮中银杏酸的含量[J].分析化学研究样品提取、净化、浓缩 液液提取净化浓缩条件的建立、优化色谱柱分离条件 HPLC-PDA 色谱条件建立、优化LC-MS/MS 测定数据处理、结果技术报告 数据分析、建立详尽方法报告,2002,30(8):901-905.[6].陈学国,孔亮,盛亮洪,厉欣,邹汉法.全二维液相色谱串联质谱用于银杏叶提取物成分分析的研究[J].色谱,2005,23(1):46-51.[7].吴向阳,仰榴青,陈钧.高效液相色谱法测定银杏叶提取物及其制剂中银杏酸的含量[J].药学学报,2003,38(11):846-849.[8].孔玉霞,李晨恺,王盼盼,宋金玉.银杏酸的定量分析方法研究[J].辽宁大学学报,2010,37(1):57-60.[9].何静仁,谢笔钧.银杏酸的反相银化高效液相色谱法分离和测定[J].药学学报,2001,36(8):609-612.[10].聂黎行,鲁静.银杏叶提取物中总银杏酸的HPLC法限量检测[J].药物分析杂志,2005,25(8):909-911.[11].仰榴青,吴向阳,杨克迪,尹秀莲,陈钧.银杏酸分析方法研究进展[J].药物分析杂质,2003,23(3):241-244.[12].蒋永红,王佩维,李五洲,曹礼群.银杏叶提取物中银杏酸的分离与分析[J].日用化学工业,2002,32(3):66-68.[13].王颖,盛龙生,楼凤昌,张正行,安登魁.银杏总酸中有关成分的LC/DAD/API/MS分析[J].中国药科大学学报,2001,32(5):371-374.[14].魏秀莉,唐翠,印春华.银杏叶提取物中银杏酸的HPLC测定[J].中国医药工业杂质,2003,34(6):295-296.[15].K arine Ndjoko, Jean-Luc Wolfender, Kurt Hostettmann. Determination of trace amounts ofginkgolic acids in Ginkgo biloba L. leaf extracts and phytopharmaceuticals by liquid chromatography–electrospray mass spectrometry [J].Journal of Chromatography B,2000, 744: 249-255.[16].N. Fuzzati, R. Pace, F. Villa. A simple HPLC-UV method for the assay of ginkgolic acids inGinkgo biloba extracts [J]. Fitoterapia, 2003, 74: 247–256.[17].D irk Lichtblau, John M. Berger and Koji Nakanishi. Efficient Extraction of Ginkgolides andBilobalide from Ginkgo biloba Leaves [J].Nat.Prod,2002, 65: 1501-1504.[18].H ongjun Xia, Xiao dan Wang,, Li Li, ShengjiaWang, Changchuan Guo, Yao Liu, Lushan Yu,Huidi Jiang, Su Zeng. Development of high performance liquid chromatography/electrospray ionization mass spectrometry for assay of ginkgolic acid (15:1) in rat plasma and its application to pharmacokinetics study [J]. Journal of Chromatography B, 2010, 878: 2701-2706.[19].王军,钱虹.银杏酸分析方法的研究世界农药,2008,31(1):52-54.[20].E ckhard Leistner and Christel Drewke.Ginkgo biloba and Ginkgotoxin [J].Journal of NaturalProducts,2010, 73(1):86-92.[21].H isashi Kuribara, SusanT.Weintraub,Tatsumi Yoshihama , and Yuji Maruyama. AnAnxiolytic-Like Effect of Ginkgo biloba Extract and Its Constituent, Ginkgolide-A, in Mice[J].Journal of Natural Products, 2003,66(10):1333-1337.[22].张小利,欧阳臻,杨克迪,陈钧.银杏酸的分离制备及HPLC分析[J].中药材,2003,26(8):557-559.[23].赵月珍,陈正收,徐瑾,周应军.银杏酸的分离与银杏叶制剂中银杏酸的含量测定[J].中医药导报,2006,12(7):86-88.[24].张洪国,李晖.色谱技术在银杏酸分析中的研究应用[J].现代仪器,2003,3:11-13.。
