氢氧化钠检验标准程序
最简检验氢氧化钠变质的方法

最简检验氢氧化钠变质的方法
化学实验室已经对氢氧化钠的变质进行了广泛的研究,为检验氢氧化钠变质提供了一种可靠的方法。
在本篇文章中,我们将探讨最简检验氢氧化钠变质的方法。
首先,我们需要了解氢氧化钠的性质和特点。
氢氧化钠是一种强碱性物质,通常以固体形态出现。
当氢氧化钠与水反应时,会产生强烈的热量。
氢氧化钠在空气中极易吸收水分,因此应储存在干燥、通风的地方。
为了检验氢氧化钠是否变质,我们需要使用一种称为酚酞的指示剂。
酚酞是一种紫红色的指示剂,用于检测氢氧化钠是否是饱和溶液。
下面是我们的实验步骤:
材料:
-新鲜的氢氧化钠
-酚酞指示剂
-蒸馏水
步骤:
1.取一小部分氢氧化钠,将其放入试管中。
2.加入约10ml的蒸馏水,使其溶解。
3.加入几滴酚酞指示剂。
新鲜的酚酞会呈现出紫红色,表示氢氧化钠是饱和溶液。
4.如果溶液呈现出棕色、黄色或其他颜色,那么氢氧化钠就变质了。
其他提示:
1.在储存氢氧化钠时,应将其存放在干燥、通风的地方,并在密封的容器中存放。
2.请勿将氢氧化钠与酸性物质混合,以免引起反应并产生有害气体。
3.氢氧化钠是一种高度腐蚀性物质。
在处理它时,应戴上手套和防护眼镜,并小心处理。
结论:
酚酞指示剂是识别氢氧化钠是否变质的简单、快速的方法。
如果溶液呈现出正确的紫红色,那么氢氧化钠就是新鲜的。
但如果溶液呈现出其他颜色,那么氢氧化钠就变质了,需要予以处理或更换。
氢氧化钠检测方法

氢氧化钠检测方法本页仅作为文档封面,使用时可以删除This document is for reference only-rar21year.March氢氧化钠检测方法一、实验室测定方法名称:氢氧化钠—氢氧化钠的测定——中和滴定法。
应用范围:该方法采用滴定法测定氢氧化钠的含量。
该方法适用于氢氧化钠。
实验原理:利用酸碱指示剂在溶液pH值不同时显现不同颜色的特性,用酸调整试样溶液的pH至特定值时,通过消耗酸的量计算出试样中氢氧化钠的量与变质的量。
试剂:1. 水(新沸放冷);2. 硫酸滴定液(L);3. 酚酞指示液;4.甲基橙指示液:取甲基橙,加水100mL使溶解,即得。
仪器设备:酸式滴定管、分析天平、容量瓶、锥形瓶、铁架台、移液管。
操作步骤:供试品加新沸过的冷水适量使溶解后,放冷,用水稀释至刻度,摇匀,精密量取25mL,加酚酞指示液3滴,用硫酸滴定液(L)滴定至红色消失,记录消耗硫酸滴定液(L)的容积(mL),加甲基橙指示液2滴,继续加硫酸滴定液(L)至显持续的橙红色,根据前后两次消耗硫酸滴定液(L)的容积(mL),算出供试量中的碱含量(作为NaOH计算)并根据加甲基橙指示液后消耗硫酸滴定液(L)的容积(mL),算出供试量中NaCO的含量。
[14]注:“精密称取”系指称取重量应准确至所称取重量的千分之一,“精密量取”系指量取体积的准确度应符合国家标准中对该体积移液管的精度要求。
变质检验NaOH变质后会生成NaCO化学方程式:2NaOH + CO=NaCO+ HO1.样品中滴加过量稀盐酸若有气泡产生,则氢氧化钠变质。
原理:2HCl + NaCO=2NaCl + CO↑+ HO(空气中含有少量的CO,而敞口放置的NaOH溶液能够与CO 反应,生成NaCO和HO从而变质;HCl中的H+能够与NaCO中的CO32-离子反应生成CO气体和HO,通过气泡产生这个现象来检验变质)注:HCl会优先与NaOH反应生成NaCl和HO。
氢氧化钠(45%)质量检验操作规程2009.5.6[1]
![氢氧化钠(45%)质量检验操作规程2009.5.6[1]](https://img.taocdn.com/s3/m/97bf2dea6f1aff00bed51edb.png)
东北制药总厂标准操作规程1.目的:建立一个关于进厂原料氢氧化钠(粒碱)质量检验操作规程。
2.方法来源:GB209-2006、中国药典2005年版二部。
3.适用范围:本规程适应于进厂原料粒碱的检验。
4.责任人:本岗位操作者和复核者对实施本规程负责。
5.规程内容:5.1外观:按《外观检测操作规程911》检测,应符合规定。
5.2鉴别:本品的水溶液显钠盐的鉴别反应。
具体操作详见《一般鉴别检测操作规程946》。
5.3氢氧化钠和碳酸钠含量的测定5.3.1 氢氧化钠含量的测定原理试样溶液中先加入氯化钡,将碳酸钠转化为碳酸钡沉淀,然后以酚酞为指示剂,用盐酸标准滴定溶液滴定至终点。
反应如下:Na2CO3+BaCl2→BaCO3↓+2NaClNaOH+HCl→NaCl+H2O5.3.2 碳酸钠含量的测定原理试样溶液以溴甲酚绿-甲基红混合指示剂为指示剂,用盐酸标准滴定溶液滴定至终点,测得氢氧化钠和碳酸钠总和,再减去氢氧化钠含量,则可测得碳酸钠含量。
5.3.3试剂和材料5.3.3.1盐酸标准滴定溶液:c(HCl)=1.000mol/L,同中国药典2005年版二部。
5.3.3.2氯化钡溶液:100g/L。
溶解10g氯化钡于100ml水中。
使用前,以酚酞为指示剂,用氢氧化钠标准溶液调至微红色。
规程编号:64-QOP-736-00 页码:2/65.3.3.3酚酞指示剂:10g/L。
溶解1g酚酞于100ml95%乙醇中。
5.3.3.4溴甲酚绿-甲基红混合指示剂:将三份0.1g/L溴甲酚绿的乙醇溶液和一份0.2g/L甲基红的乙醇溶液混合。
5.3.4 仪器、设备一般实验室仪器和磁力搅拌器。
5.3.5分析步骤5.3.5.1 试样溶液的制备用已知质量干燥、洁净的称量瓶,迅速从样品瓶中移取液体氢氧化钠50g ±1g(精确至0.01g)。
将已称取的样品置于已盛有约300mL水的1000mL 容量瓶中,冲洗称量瓶,将洗液加入容量瓶中。
氢氧化钠的检验方法

氢氧化钠的检验方法
氢氧化钠的检验方法有以下几种:
1. 酸碱中性试纸检验:将酸碱中性试纸贴近氢氧化钠溶液,如果试纸变蓝,则表示氢氧化钠为碱性物质。
2. 酸碱滴定法:用稀盐酸与氢氧化钠反应,直到溶液中所有的碱都中和掉,通过滴定酸的体积来计算氢氧化钠的浓度。
3. 加入苯酚酞指示剂滴定法:首先加入几滴苯酚酞指示剂,然后加入稀盐酸滴定,溶液由无色变为粉红色时停止滴定,以计算氢氧化钠的浓度。
4. 火焰颜色法:将氢氧化钠溶液挥发至干燥,然后在火焰中加热,观察火焰颜色,氢氧化钠会使火焰变为明亮的黄色。
5. 重量法:将一定质量的氢氧化钠固体溶解于水中,然后用加热的方法将水蒸发,最后测量残留物的重量来计算氢氧化钠的含量。
氢氧化钠有效成分含量的检测

氢氧化钠有效成分含量的检测一、试剂1、酚酞指示剂:用电子天平称取0.5g 酚酞,转移到烧杯中,用玻璃棒搅拌溶于50ml95%乙醇中,用蒸馏水稀释至100ml ,转移到试剂瓶中,贴上标签,标明药剂种类和日期。
2、盐酸标准溶液C HCl =0.0250mol/L :用移液管准确移取2.25ml 浓盐酸(ρ=1.19g/ml ),并用蒸馏水稀释至1000ml 容量瓶中,按照下述方法标定:用移液管准确移取25.00ml 碳酸钠标准溶液于250ml 锥形瓶中,加入25-50ml 的蒸馏水稀释,加入3滴甲基橙指示剂,用盐酸标准溶液滴定至由橙黄色刚刚变成橙红色,记录盐酸标准液的用量。
C HCl ⨯V HCl =2C Na2CO3⨯V Na2CO3 C Na2CO3 =m/106/V二、试样制备1、取样:必须是从刚拆开的药剂袋中取样,取好样后,立即从所取样品中用分析天平称取(精确到0.001g )2g 样品,记为m ;置于烧杯中溶解,然后全部转移入1000mL 容量瓶中,用水稀释至刻度,摇匀。
三、实验步骤取5-10ml 配置好的试样(V 0)于三角锥形瓶内,滴加酚酞指示剂,用盐酸标准溶液进行滴定至刚刚变为无色,记录盐酸用量为V 1;再加甲基橙指示剂继续滴定至溶液由黄色变为橙红色为止,记录盐酸用量为V 2。
四、计算%100108.40)(c 021l ⨯⨯⨯-⨯=m V V V X HC 氢氧化钠有效含量%1001m 106c 02l ⨯⨯⨯⨯=V V X HC 碳酸钠的含量 c HCl --HCl 标定后的摩尔浓度,mol/L ;V 1、V 2、V 0--单位均为:L ;m--单位为:g ; 1--单位为:L ;备注:氢氧化钠的有效成分含量为≥98%,碳酸钠的含量≤1%。
氢氧化钠的检验方法

氢氧化钠的检验方法氢氧化钠(NaOH)是一种常见的无机化合物,也是一种强碱。
检验氢氧化钠的方法主要包括外观观察、化学反应和仪器分析等多种方法。
下面,将详细介绍几种常用的氢氧化钠检验方法。
1. 外观观察法:外观观察法是最简单直观的方法。
氢氧化钠为固体晶体,一般为白色粉末状。
我们可以通过裸眼观察样品的颜色、形状和纯度等特征来初步判断其是否为氢氧化钠。
2. 气味检测法:氢氧化钠具有特殊的氨味,可以通过闻气味来判断样品是否为氢氧化钠。
但是需要注意的是,由于氢氧化钠在空气中易吸湿,会形成碱性氢氧化钠,故应避免直接闻氢氧化钠样品。
3. 中和反应法:氢氧化钠是一种强碱,可以与酸反应生成盐和水。
通过对待检样品进行酸碱中和反应,可以进一步确认是否为氢氧化钠。
具体方法是将待检样品溶解在水中,然后滴加酸(如盐酸),如出现中和反应产生气体、变色或加热等现象,则可以初步确认为氢氧化钠。
4. 溶解性检测法:氢氧化钠可溶于水,生成氢氧化钠溶液。
溶解性检测法可以通过观察待检样品在水中的溶解情况来判断是否为氢氧化钠。
将待检样品分别与不同溶剂(如水、醇等)接触,观察其溶解情况,如果溶解度较高、水溶液呈碱性,则可以初步判定为氢氧化钠。
5. 电导率测定法:电导率测定法是一种仪器分析方法,通过测定待检样品的电导率来判断是否为氢氧化钠。
氢氧化钠是一种良好的电解质,具有较高的电导率。
可使用电导仪或电导率计对待检样品进行测定,如果测得的电导率较高,则可以确认为氢氧化钠。
需要注意的是,以上方法只是检验氢氧化钠的常用方法,并不能完全保证结果的准确性。
对于一些特殊情况,还可借助其他现代分析技术,如红外光谱、质谱等对样品进行分析,以确保检验结果的准确性。
氢氧化钠标准溶液标定

氢氧化钠标准溶液标定氢氧化钠(NaOH)是一种常用的化学试剂,通常用于酸碱中和实验以及其他化学实验中。
在实验室中,我们经常需要使用氢氧化钠标准溶液,因此对氢氧化钠标准溶液进行准确的标定就显得尤为重要。
本文将介绍氢氧化钠标准溶液标定的方法和步骤。
首先,准备工作。
在进行标定之前,需要准备好所需的试剂和仪器设备。
首先准备一定浓度的氢氧化钠溶液,通常使用0.1mol/L的氢氧化钠溶液进行标定。
另外,还需要准备一定浓度的盐酸溶液作为反应溶液,通常使用0.1mol/L的盐酸溶液。
此外,还需要天平、移液器、烧杯、磁力搅拌器等实验仪器设备。
其次,进行标定实验。
首先,使用天平称取一定质量的氢氧化钠固体,溶解于适量的去离子水中,配制成一定体积的氢氧化钠溶液。
然后,使用移液器分取一定体积的氢氧化钠溶液,滴加到盛有盐酸溶液的烧杯中。
在滴加的过程中,使用磁力搅拌器搅拌溶液,直至溶液呈现中性。
此时,记录下滴加的氢氧化钠溶液体积V1。
接下来,使用0.1mol/L的盐酸溶液进行标定。
使用天平称取一定质量的氢氧化钠固体,溶解于适量的去离子水中,配制成一定体积的氢氧化钠溶液。
然后,使用移液器分取一定体积的氢氧化钠溶液,滴加到盛有盐酸溶液的烧杯中。
在滴加的过程中,使用磁力搅拌器搅拌溶液,直至溶液呈现中性。
此时,记录下滴加的氢氧化钠溶液体积V2。
最后,计算标定结果。
根据滴加的氢氧化钠溶液体积V1和V2,可以计算出氢氧化钠标准溶液的浓度。
标定的计算公式为,C(NaOH)×V(NaOH)=C(HCl)×V(HCl),通过这个公式可以计算出氢氧化钠标准溶液的浓度。
在进行氢氧化钠标准溶液标定的过程中,需要注意以下几点,首先,实验操作要准确,避免误差的发生;其次,实验仪器设备要保持干净和精准;最后,实验过程要注意安全,避免发生意外。
总之,氢氧化钠标准溶液标定是化学实验中常见的操作,通过本文介绍的方法和步骤,希望能够帮助大家正确、准确地进行氢氧化钠标准溶液的标定工作。
氢氧化钠质量标准及检验操作规程
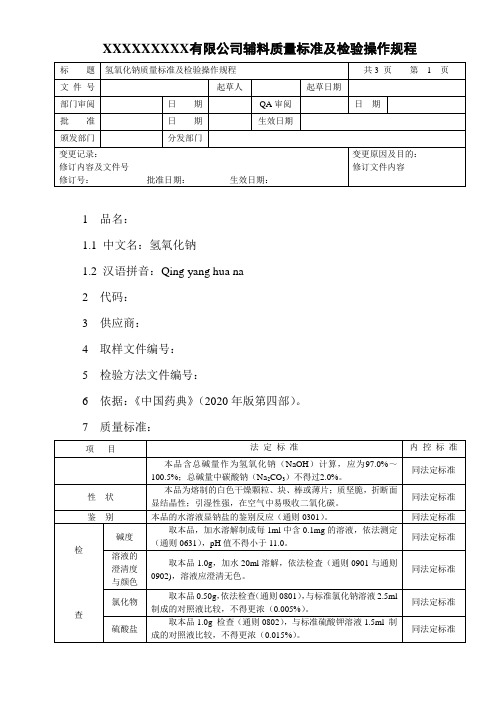
XXXXXXXXX有限公司辅料质量标准及检验操作规程1 品名:1.1 中文名:氢氧化钠1.2 汉语拼音:Qing yang hua na2 代码:3 供应商:4 取样文件编号:5 检验方法文件编号:6 依据:《中国药典》(2020年版第四部)。
7 质量标准:7 检验操作规程:7.1 性状:取本品适量,自然光下目测色泽,嗅闻气味。
7.2 鉴别:本品的水溶液显钠盐的鉴别反应(附录21)。
7.3检查:7.3.1碱度:取本品,加水溶解制成每1ml中含0.1mg的溶液,依法测定(附录11),pH值不得小于11.0。
7.3.2溶液的澄清度与颜色:取本品1.0g,加水20ml溶解,溶液应澄清无色。
7.3.3氯化物:取本品0.50g,依法检查(附录26),与标准氯化钠溶液5.0ml 制成的对照液比较,不得更浓(0.005%)。
7.3.4硫酸盐:取本品1.0g 检查(附录40),与标准硫酸钾溶液2.0制成的对照液比较,不得更浓(0.015%)。
7.3.5钾盐:取本品0.25g,加水5ml溶解后,加醋酸使成酸性,置冰浴中冷却,再加亚硝酸钴钠试液数滴,不得产生浑浊。
7.3.6铝盐与铁盐:取本品5.0g,加稀盐酸50ml溶解后,煮沸,放冷,加氨试液使成碱性,滤过,滤渣用水洗净,并炽灼至恒重,遗留残渣不得过5mg。
7.3.7重金属:取本品1.0g,加水5ml与稀盐酸11ml溶解后,煮沸,放冷,加酚酞指示液1滴与氨试液适量至溶液显淡红色,加醋酸盐缓冲液(PH3.5)2ml 与水适量使成25ml,依法检查(附录13第一法),含重金属不得过百万分之二十。
7.4 含量测定:取本品1.5g,精密称定,加新沸过的冷水40ml溶解,放冷至室温,加酚酞指示液3滴,用硫酸滴定液(0.5m ol/L)滴定至红色消失,记录消耗硫酸滴定液的体积,再加甲基橙指示液2滴,继续滴加硫酸滴定液至显持续的橙红色。
根据消耗硫酸滴定液的体积,算出供试量中的总碱量(作为NaOH 计算),并根据加甲基橙指示液后消耗硫酸滴定液的体,算出供试量中Na2CO3的含量。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
氢氧化钠检验标准程序
1.目的:建立氢氧化钠检验标准程序,以指导氢氧化钠的检验。
2.范围:适用于氢氧化钠检验的操作。
3.职责:质量部检验人员对本规程的实施负责。
4.程序:
取样:按《有洁净度要求的物料取样标准程序》(SOP-)取样,取样量应为全检量的3倍(36g)。
检验
4.2.1性状
4.2.1.1外观、质地、引湿性:取供试品置于白纸上,观察、检测。
合格标准:供试品为熔制的白色干燥颗粒、块、棒或薄片;质坚脆,折断面显结晶性;引湿性强,在空气中易吸收二氧化碳。
4.2.1.2溶解性:
4.2.1.仪器与用具:恒温水浴锅、托盘扭力天平
4.2.1.操作:
(1)水中溶解性:取供试品1g,加入不到1ml的水,置恒温水浴锅(25±2℃)中,每隔5分钟强力振摇30秒钟,观察30分钟内的溶解情况。
合格标准:应看不见溶质颗粒,即完全溶解(极易溶解)。
(2)乙醇中的溶解性:取供试品1g,加入1~不到10ml的乙醇中,置恒温水浴锅(25±2℃)中,每隔5分钟强烈振摇30秒钟,观察30分钟内的溶解情况。
合格标准:应看不见溶质颗粒,即完全溶解(易溶)。
4.2.2鉴别
4.2.2.1钠盐的鉴别反应
4.2.2.2试剂、试液:盐酸、醋酸氧铀锌试液
4.2.2.3用具:铂丝、酒精灯
4.2.2.4操作:
(1)取铂丝插入盐酸中润湿,蘸取供试品,在火焰中燃烧,观察。
合格标准:火焰应即显鲜黄色。
(2)称取供试品少量,滴加盐酸使成中性溶液,加醋酸氧铀锌试液几滴,观察。
4.2.2.5合格标准:应即生成黄色沉淀。
4.2.3氯化物检查
4.2.3.1操作:取供试品0.50g,按《氯化物检查标准程序》(SOP-)检查,与标准氯化钠溶液(10μg/ml)制成的对照液比较。
4.2.3.2合格标准:与标准氯化钠溶液制成的对照液比较,应不得更浓(%)。
4.2.4硫酸盐检查
4.2.4.1操作:取供试品1.0g,按《硫酸盐检查标准程序》(SOP-)检查,与标准硫酸钾溶液制成的对照液比较。
4.2.4.2合格标准:不得更浓(%)。
4.2.5钾盐检查
4.2.
5.1 仪器与用具:托盘扭力天平(分度值:10mg)
4.2.
5.2试剂与试液:醋酸(AR)、亚硝酸钴钠试液
4.2.
5.3操作:取供试品0.25g,加水5ml溶解后,加醋酸使成酸性,置冰浴中冷却,再加亚硝酸钴钠试液数滴,观察。
4.2.
5.4合格标准:不得发生浑浊。
4.2.6铝盐与铁盐检查
4.2.6.1试剂与试液:稀盐酸、氨试液
4.2.6.2仪器与用具:托盘扭力天平、分析天平(感量)、布氏漏斗、坩锅、箱式电阻炉、干燥器、通风橱
4.2.6.3操作:取供试品
5.0g,加稀盐酸50ml溶解后,煮沸,放冷,加氨试液使成碱性,滤过,滤渣用水洗净后,置炽灼至恒重的坩埚内,置箱式电阻炉中,炽灼至恒重,称量遗留的残渣。
4.2.6.4合格标准:遗留残渣应不得过5mg。
4.2.7重金属检查
4.2.7.1操作:取供试品1.0g,加水5ml与稀盐酸11ml溶解后,煮沸,放冷,加酚酞指示液1滴与氨指示液适量至溶液显淡红色,加醋酸盐缓冲溶液()2ml 与水适量使成25ml,按《重金属检查标准程序》(SOP-)检查。
4.2.7.2合格标准:含重金属不得过百万分之三十。
4.2.8含量测定
4.2.8.1试剂与试液:酚酞指示液、甲基橙指示液、硫酸滴定液(L)
4.2.8.2仪器与用具:分析天平(分度值:)、量瓶(250ml)、移液管(25ml)、碘量瓶(250ml)、酸式滴定管(50ml)
4.2.8.3操作:取供试品约2g,精密称定(M),置250ml量瓶中,加新沸过的冷水适量使溶解,放冷,用水稀释至刻度,摇匀,精密量取25ml,加酚酞指示液3滴,用硫酸滴定液(L)滴定至红色消失,记录消耗硫酸滴定液(L)的容积V
1(ml),加甲基橙指示液2滴,继续滴加硫酸滴定液(L)至显持续的橙红色,根据前后两次消耗硫酸滴定液(L)的容积(ml),算出供试量中的总碱量(作为
NaOH计算),并根据加甲基橙指示液后消耗硫酸滴定液(L)的容积(ml)V
2
,算
出供试品中Na
2CO
3
的含量。
每1ml硫酸滴相当于的NaOH或的Na
2
CO
3。
4.2.8.4计
算:根据硫酸滴定液(L)的F值计算,
V
2
××F×250
总碱量%= ×100% M×25×1000
(V
2- V
1
)××F×250
总碱量中碳酸钠含量%= ×100%
M×25×1000
4.2.8.5合格标准:供试品含总碱量作为氢氧化钠(NaOH)计算,应为%~%;
总碱量中碳酸钠(Na
2CO
3
)不得过%。
5.检验结束后,及时填写检验记录及检验台帐。
6.本文件编制依据为《氢氧化钠的质量标准》(SOP-)及《中华人民共和国药典》(2010年版二部)p904“氢氧化钠”。
附:
试液配制方法:
1.醋酸氧铀锌试液:称取醋酸氧铀10g,加冰醋酸5ml与水50ml,微热使溶解;另取醋酸锌30g,加冰醋酸3ml与水30ml,微热使溶解,将两液混合,放冷,滤过,即得。
2.亚硝酸钴钠试液:称取本品10g,加水溶解,使成50ml,滤过,即得。
3.稀盐酸:取盐酸234ml,加水使成1000ml,摇匀。
4.氨试液:取浓氨液400ml,加水使成1000ml,摇匀。
5.酚酞指示液:取本品1g,加乙醇100ml,使溶解,混匀,即得。
6.甲基橙指示液:取本品0.1g,加水100ml,使溶解,混匀,即得。
7.硫酸滴定液(L):按《滴定液配制与标定标准程序》(SOP-)操作。
