差热分析技术资料讲解
差热分析分析

差热分析分析差热分析是一种热分析技术,用于测定样品在温度变化过程中吸收或放出的热量。
差热分析主要应用于材料科学、化学、生物医学等领域,常用于确定材料的热稳定性、相变、降解等特性,以及化学反应、生物活性等反应过程的动力学参数。
本文将对差热分析技术的基本原理、数据分析、应用前景等进行详细介绍。
一、基本原理差热分析主要基于热量守恒原理,通过对比样品和参比样品在温度变化过程中的热量差异,得出样品在该温度范围内所吸收或放出的热量。
差热分析一般使用差动热量计,其基本结构由两个热电偶构成,一个接触样品,另一个接触参比样品。
当样品和参比样品接受相同的温度变化时,两侧热电偶所产生的电动势不同,这种电势差称为差动信号,与样品的热量吸收或释放有关。
差热分析实验中,通常以恒定的升温速率对样品和参比样品加热,同时测量两侧热电偶的电动势和温度。
通过对比两侧热电偶的信号,得出样品与参比样品的热量差异,进而确定样品的物理化学性质。
在差热分析过程中,常用的参比样品有空气、金属等。
二、数据分析差热分析实验中,得到的差动信号曲线通常呈现出峰形或谷形。
当样品发生物理化学变化时,其热量吸放会导致差动信号出现峰谷现象,峰表示样品吸收热量,谷表示释放热量。
通过对峰谷的面积、高度、位置等参数的分析,可以确定样品的热力学特性、相变、反应动力学参数等。
常用的数据分析方法包括:1. 峰温和半高宽分析:通过对峰温和半高宽的测量,可以确定样品的相变温度、热稳定性等。
2. 反应级数分析:差热分析可用于研究化学反应中的反应级数、反应机理等。
通过对峰形状的分析,可以确定反应级数以及反应动力学参数。
3. 动力学分析:差热分析可以用于测定反应的激活能、反应速率常数等动力学参数。
三、应用前景总之,随着科学技术的不断进步,差热分析技术将在材料科学、化学、生物医学等多个领域得到广泛应用,为相关研究提供有力的支持。
差热分析(DTA)
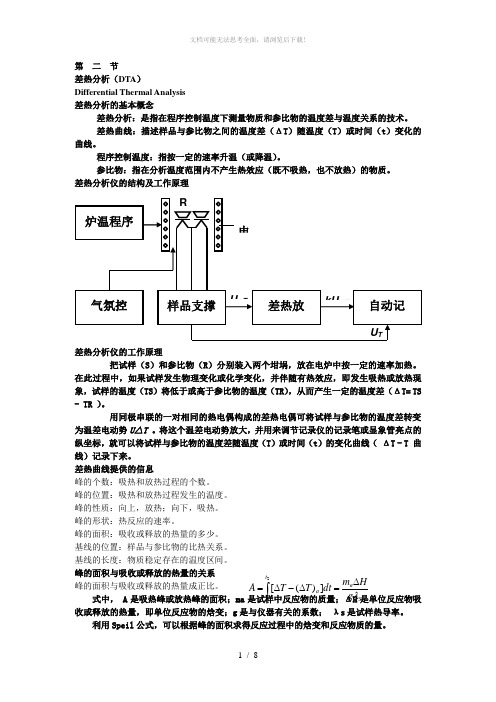
第 二 节差热分析(DTA )Differential Thermal Analysis 差热分析的基本概念差热分析:是指在程序控制温度下测量物质和参比物的温度差与温度关系的技术。
差热曲线:描述样品与参比物之间的温度差(ΔT )随温度(T )或时间(t )变化的曲线。
程序控制温度:指按一定的速率升温(或降温)。
参比物:指在分析温度范围内不产生热效应(既不吸热,也不放热)的物质。
差热分析仪的结构及工作原理差热分析仪的工作原理把试样(S )和参比物(R )分别装入两个坩埚,放在电炉中按一定的速率加热。
在此过程中,如果试样发生物理变化或化学变化,并伴随有热效应,即发生吸热或放热现象,试样的温度(TS )将低于或高于参比物的温度(TR ),从而产生一定的温度差(ΔT= TS - TR )。
用同极串联的一对相同的热电偶构成的差热电偶可将试样与参比物的温度差转变为温差电动势U △T 。
将这个温差电动势放大,并用来调节记录仪的记录笔或显象管亮点的纵坐标,就可以将试样与参比物的温度差随温度(T )或时间(t )的变化曲线( ΔT - T 曲线)记录下来。
差热曲线提供的信息峰的个数:吸热和放热过程的个数。
峰的位置:吸热和放热过程发生的温度。
峰的性质:向上,放热;向下,吸热。
峰的形状:热反应的速率。
峰的面积:吸收或释放的热量的多少。
基线的位置:样品与参比物的比热关系。
基线的长度:物质稳定存在的温度区间。
峰的面积与吸收或释放的热量的关系 峰的面积与吸收或释放的热量成正比。
式中, A 是吸热峰或放热峰的面积;ma 是试样中反应物的质量;ΔH 是单位反应物吸收或释放的热量,即单位反应物的焓变;g 是与仪器有关的系数; λs 是试样热导率。
利用Speil 公式,可以根据峰的面积求得反应过程中的焓变和反应物质的量。
S a t t a g H m dt T T A λ∆=∆-∆=⎰21])([ΔH= gλs A/ ma ma= A gλs / ΔH基线的位置与样品和参比物的比热关系CR—参比物的比热CS—试样的比热V —升温速率k —比例常数加热过程中会产生吸热或放热效应的各种物理化学过程脱水作用—吸热•自由水:存在于物质颗粒表面或微型裂隙中的水,110℃以下脱出。
差热分析法(DTA)简介 (Differential Thermal Analysis)

差热分析法(DTA)简介(Differential Thermal Analysis)1.DTA的基本原理差热分析是在程序控制温度下,测量物质与参比物之间的温度差与温度关系的一种技术。
差热分析曲线是描述样品与参比物之间的温差(ΔT)随温度或时间的变化关系。
在DAT试验中,样品温度的变化是由于相转变或反应的吸热或放热效应引起的。
如:相转变,熔化,结晶结构的转变,沸腾,升华,蒸发,脱氢反应,断裂或分解反应,氧化或还原反应,晶格结构的破坏和其它化学反应。
一般说来,相转变、脱氢还原和一些分解反应产生吸热效应;而结晶、氧化和一些分解反应产生放热效应。
差热分析的原理如图Ⅱ-3-1所示。
将试样和参比物分别放入坩埚,置于炉中以一定速率进行程序升温,以表示各自的温度,设试样和参比物(包括容器、温差电偶等)的热容量Cs、Cr不随温度而变。
则它们的升温曲线如图Ⅱ-3-2所示。
若以对t作图,所得DTA曲线如图Ⅱ-3-3所示,在0-a区间,ΔT大体上是一致的,形成DTA曲线的基线。
随着温度的增加,试样产生了热效应(例如相转变),则与参比物间的温差变大,在DTA曲线中表现为峰。
显然,温差越大,峰也越大,试样发生变化的次数多,峰的数目也多,所以各种吸热和放热峰的个数、形状和位置与相应的温度可用来定性地鉴定所研究的物质,而峰面积与热量的变化有关。
图Ⅱ-3-1差热分析的原理图 II-3-1 差热分析的原理图图II-3-2试样和参比物的升温曲线1.参比物;2.试样;3.炉体;4.热电偶(包括吸热转变)图Ⅱ-3-3 DTA吸热转变曲线TA曲线所包围的面积S可用下式表示式中m是反应物的质量,ΔH是反应热,g是仪器的几何形态常数,C是样品的热传导率ΔT是温差,t1是DTA曲线的积分限。
这是一种最简单的表达式,它是通过运用比例或近似常数g和C来说明样品反应热与峰面积的关系。
这里忽略了微分项和样品的温度梯度,并假设峰面积与样品的比热无关,所以它是一个近似关系式。
差热分析原理

差热分析原理
差热分析(DSC)是一种常用的热分析技术,它通过测量样品与
参比物在加热或冷却过程中的热量差异来研究样品的物理和化学性质。
差热分析原理主要基于样品在加热或冷却过程中吸收或释放的
热量与温度的关系,通过对这些热量变化的测量和分析,可以得到
样品的热力学性质、相变温度、热稳定性等信息。
在差热分析中,样品和参比物分别放置在两个独立的量热杯中,然后同时加热或冷却,测量两者之间的温度差异。
当样品发生物理
或化学变化时,会吸收或释放热量,导致样品和参比物之间的温度
差异,通过测量这种温度差异,可以确定样品的热量变化情况。
差热分析原理的关键在于对热量变化的准确测量和分析。
通常
采用热电偶或热电堆等热量传感器来测量样品和参比物之间的温度
差异,然后通过数据处理和分析,得到样品的热量变化曲线和相应
的热力学参数。
差热分析原理的应用非常广泛,可以用于研究材料的相变性质、热稳定性、反应动力学等方面。
例如,通过差热分析可以确定材料
的玻璃化转变温度、熔融温度、晶化温度等重要参数,也可以用于
研究材料的热分解、氧化、聚合等反应过程。
除此之外,差热分析还可以用于药物的热稳定性评价、聚合物材料的热性能研究、金属材料的热处理行为分析等领域。
在材料科学、化学工程、药物研发等领域,差热分析都发挥着重要的作用。
总之,差热分析原理是一种重要的热分析技术,通过测量样品与参比物在加热或冷却过程中的热量差异,可以得到样品的热力学性质、相变温度、热稳定性等信息,具有广泛的应用前景和重要的研究意义。
差热分析的原理及应用

差热分析的原理及应用1. 原理介绍差热分析(Differential Scanning Calorimetry,简称DSC)是一种热分析技术,用于研究样品的热性质和相变行为。
该技术可以通过测量样品和参比物在恒定的升温或降温速率下的热容差,来研究样品的热性质和相变行为。
差热分析是一种非常常见的技术,在材料科学、化学、医药、食品等领域都有广泛的应用。
差热分析的基本原理是测量样品和参比物在相同的升温或降温速率下的温度响应差异。
当样品经历热性质改变或相变时,它的热容发生变化,从而导致在差热图中观察到峰或谷。
通过分析差热曲线的形状、峰的位置、峰的形状等,可以获得样品的相关热性质参数,例如熔化温度、结晶温度、热容变化等。
2. 应用领域差热分析在许多领域中都有广泛的应用,下面列举了一些典型的应用领域:2.1 材料科学差热分析可以用于研究材料的热性质和相变行为。
通过差热分析,可以确定材料的熔化温度、结晶温度、玻璃化转变温度等重要的热性质参数。
这对于材料的工艺设计、性能改进等具有重要意义。
2.2 化学反应研究差热分析可以用于研究化学反应的热效应和动力学。
通过测量反应过程中的热效应变化,可以推断反应的放热或吸热性质,进而了解反应的性质和动力学参数。
这对于化学反应的优化、机理研究等具有重要意义。
2.3 药物研发差热分析可以用于药物的热性质研究和稳定性评估。
药物的热性质对于其制剂工艺和贮存条件具有重要的影响。
通过差热分析,可以确定药物的熔化温度、热容变化等参数,为药物的制剂工艺和贮存条件的设计提供依据。
2.4 食品分析差热分析可以用于研究食品的热性质和稳定性。
食品的热性质对于其贮存、加工和烹饪过程具有重要的影响。
通过差热分析,可以确定食品的热性质参数,为食品的贮存、加工和烹饪过程的改进提供依据。
此外,差热分析还可以用于食品的质量检测和真伪鉴别。
3. 优势和局限性如同其他科学技术一样,差热分析有其优势和局限性。
3.1 优势•高灵敏度:差热分析具有很高的灵敏度,能够检测到很小的热效应变化。
《化学中常用的实验方法》差热分析法

《化学中常用的实验方法》差热分析法化学中常用的实验方法——差热分析法在化学领域,实验方法的多样性为我们深入理解物质的性质和变化提供了有力的工具。
其中,差热分析法作为一种重要的热分析技术,具有独特的应用价值和研究意义。
差热分析法(Differential Thermal Analysis,简称 DTA)是一种通过测量物质在加热或冷却过程中与参比物之间的温度差来研究物质的物理化学变化的方法。
这种方法基于物质在发生物理或化学变化时会吸收或放出热量,从而导致与参比物之间产生温度差异。
为了更好地理解差热分析法,让我们先来了解一下它的工作原理。
在差热分析实验中,通常将待测样品和一种在实验条件下不发生任何物理化学变化的参比物(如氧化铝)同时置于加热炉中,并以相同的速率进行加热或冷却。
在这个过程中,通过热电偶等温度传感器分别测量样品和参比物的温度,并将两者的温度差随时间或温度的变化记录下来,形成差热曲线(DTA 曲线)。
差热曲线包含了丰富的信息。
曲线的峰形、峰位和峰面积都与样品所发生的物理化学变化密切相关。
例如,吸热峰通常表示样品发生了熔化、蒸发、分解等吸热过程;而放热峰则可能意味着样品发生了氧化、结晶、凝固等放热过程。
峰位对应的温度可以提供有关反应发生的温度范围的信息,而峰面积则与反应的热效应大小成正比。
那么,差热分析法在化学研究中有哪些具体的应用呢?首先,它在材料科学领域发挥着重要作用。
对于新型材料的研发和性能评估,差热分析可以帮助我们了解材料的热稳定性、相变温度、玻璃化转变温度等关键参数。
通过对这些参数的分析,我们能够优化材料的制备工艺,提高材料的性能和质量。
在化学合成方面,差热分析可以用于监测化学反应的进程。
通过观察差热曲线的变化,我们能够确定反应的起始温度、结束温度以及反应的热效应,从而为优化反应条件、提高反应产率提供依据。
在药物研究中,差热分析也有着广泛的应用。
它可以用于药物的纯度检测、晶型分析以及药物与辅料之间的相容性研究。
差热分析法(DTA)简介 (Differential Thermal Analysis)

差热分析法(DTA)简介(Differential Thermal Analysis)1.DTA的基本原理差热分析是在程序控制温度下,测量物质与参比物之间的温度差与温度关系的一种技术。
差热分析曲线是描述样品与参比物之间的温差(ΔT)随温度或时间的变化关系。
在DAT试验中,样品温度的变化是由于相转变或反应的吸热或放热效应引起的。
如:相转变,熔化,结晶结构的转变,沸腾,升华,蒸发,脱氢反应,断裂或分解反应,氧化或还原反应,晶格结构的破坏和其它化学反应。
一般说来,相转变、脱氢还原和一些分解反应产生吸热效应;而结晶、氧化和一些分解反应产生放热效应。
差热分析的原理如图Ⅱ-3-1所示。
将试样和参比物分别放入坩埚,置于炉中以一定速率进行程序升温,以表示各自的温度,设试样和参比物(包括容器、温差电偶等)的热容量Cs、Cr不随温度而变。
则它们的升温曲线如图Ⅱ-3-2所示。
若以对t作图,所得DTA曲线如图Ⅱ-3-3所示,在0-a区间,ΔT大体上是一致的,形成DTA曲线的基线。
随着温度的增加,试样产生了热效应(例如相转变),则与参比物间的温差变大,在DTA曲线中表现为峰。
显然,温差越大,峰也越大,试样发生变化的次数多,峰的数目也多,所以各种吸热和放热峰的个数、形状和位置与相应的温度可用来定性地鉴定所研究的物质,而峰面积与热量的变化有关。
图Ⅱ-3-1差热分析的原理图 II-3-1 差热分析的原理图图II-3-2试样和参比物的升温曲线1.参比物;2.试样;3.炉体;4.热电偶(包括吸热转变)图Ⅱ-3-3 DTA吸热转变曲线TA曲线所包围的面积S可用下式表示式中m是反应物的质量,ΔH是反应热,g是仪器的几何形态常数,C是样品的热传导率ΔT是温差,t1是DTA曲线的积分限。
这是一种最简单的表达式,它是通过运用比例或近似常数g和C来说明样品反应热与峰面积的关系。
这里忽略了微分项和样品的温度梯度,并假设峰面积与样品的比热无关,所以它是一个近似关系式。
差热分析法

差热分析法差热分析法(Differential Thermal Analysis,DTA)是一种常用的热分析技术,它通过比较样品与参比物的温度差异来研究样品的热性质。
DTA技术在化学、材料科学、地质学等多个领域具有广泛的应用。
DTA的工作原理基于样品和参比物在受热过程中吸收或释放热量的差异。
在实验中,样品和参比物被放置在两个相邻的炉区,受同等程度的升温条件控制。
当样品发生物理或化学变化时,其吸热或放热会导致样品与参比物温度的差异。
这些温度差异会通过一个差温探测器进行检测和记录。
DTA实验中,样品和参比物通常以粉末或粒状形式存在。
粉末样品可在合适的容器中进行测试,而固体样品则需先研磨成粉末以方便测试。
样品和参比物应具有相似的物理和化学性质,以确保实验的准确性和可靠性。
在DTA实验中,通常以升温速率为X轴,差温信号(样品与参比物温度差异)为Y轴来绘制曲线图。
曲线上出现的峰或谷表示样品发生了热事件,如相变、化学反应、放热或吸热过程等。
通过对峰的位置、峰的形状和峰的峰值进行分析,可以获得有关样品的热性质和热行为的信息。
DTA技术广泛应用于材料研究、催化剂研究、岩石和土壤分析、陶瓷研究等领域。
它可以用于研究材料的熔化过程、晶体相变、氧化、还原、析出和溶解等反应。
同时,DTA还可以用来测定热容、热导率、热膨胀系数等热性质参数。
通过结合其他热分析技术,如差热/差热衍生物分析(DTA/DSC)和差热差热衍生物重量分析(DTA/TGA),可以对样品进行更全面和深入的分析。
总之,差热分析法是一种用于研究样品热性质和热行为的重要工具。
它通过比较样品与参比物的温度差异,可以揭示样品发生的热事件和热特性,为材料研究和过程分析提供了有力的支持。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
简称 TG DTG EGD EGA ETA TPA TVA
DTA
DSC
TG-GC
TG-IR
TG-XRD-IR
DTA-MS
2
TM
1.1 热重分析(TG)
Thermogravimetry
基本原理
热重分析法(thermogravimetry, TG)是在程序 控制温度下,测量物质的质量随温度变化的规 律,一定温度下,物质失去重量表明样品中某 些组分的分解或挥发。
天平可以检测时的温度。Tf
为终止温度,即累计质量变 化达到最大值时的温度。
图2 固体热分解反应的热重曲线
2020/6/18
6
热重曲线上质量基本不变的部分称为基线或平台,如图2中 ab、cd部分。
若试样初始质量为W0,失重后试样质量为W1,则失重百分 数为(W0-W1)/W0×100%。
许多物质在加热过程中会在某温度发生分解、脱水、氧化、 还原和升华等物理化学变化而出现质量变化,发生质量变 化的温度及质量变化百分数随着物质的结构及组成而异, 因而可以利用物质的热重曲线来研究物质的热变化过程, 如试样的组成、热稳定性、热分解温度、热分解产物和热 分解动力学等。
C2 O a 4 C 4 ℃ 0~ 0 5 ℃ 0 0Ca 3 C CO O
在600℃和800℃之间失重并出现第四个平台,其失 重量占试样总质量的30%,正好相当于每 m解o应lC按aC下2O述4分反解应出进1行molCO2,因此这一步的热分
2020/6/18 C2 O a 4 6 C ℃ 0 ~ 0 8 ℃ 0 0 C a C 2 O O 10
2020/6/18
4
仪器结构
热重分析仪的基本结构由精密天平、加热炉 及温控单元组成。
图1 热重分析仪结构
2020/6/18
1、温控单元 2、精密天平 3、加热炉
5
固体热分解反应 A(固)→B(固)+C(气)
典型热重曲线如图2所示。
曲线的纵坐标为质量,横坐
标为温度。图中Ti为起始温
度,即累计质量变化达到热
➢ 总之,试样用量与粒度对热重曲线有着类似的影响,实 验时应选择适当。一般粉末试样应过200-300目筛,用 量在1g左右为宜。
2020/6/18
12
➢ 气氛的影响 静态气氛下,对可逆的分解反应, 升温时分解速率增大,样品周围的气体浓度增 大。随着气体浓度的增大,分解向相反方向进 行,正反应的分解速率降低,将严重影响实验 结果。实际中通常采用动态气氛。
2020/6/18
7
例如含有一个结晶水的草酸钙 (CaC2O4·H2O)的热重曲线如图3所示:
图3 CaC2O4·H2O的热重曲线
2020/6/18
8
C 2 O 4 · a H 2 O C 1 ℃ 0 ~ 2 0 ℃ 0C 02 O 4 a H 2 O C CaC2O4·H2O在100℃以前没有失重现象,其热重曲 线呈水平状,为TG曲线的第一个平台。在100℃
和200℃之间失重并开始出现第二个平台。这一
步的失重量占试样总质量的12.3%,正好相当于
每molCaC2O4·H2O失掉1molH2O,因此这一步 的热分解应按以下反应进行
2020/6/18
9
在400℃和500℃之间失重并开始呈现第三个平台, 其失重量占试样总质量的18.5%,相当于每 molCaC2O4分解出1molCO,因此这一步的热分解应 按下述反应进行:
➢ 气体流量的影响 有些样品在加热升温时,分 解或升华产生的挥发物可能会产生冷凝现象, 而使实验结果产生偏差,为此样品量要少,气 流量要合适。
2020/6/18
13
1.2 差示热分析法(DTA)
( Differential Thermal Analysis)
❖ 定义:在程序控制温度下,测量物质和参比 物之间的温度差与温度关系的一种技术。
❖ 当试样发生任何物理(如相转变、熔化、结 晶、升华等)或化学变化时,所释放或吸收 的热量使试样温度高于或低于参比物的温度, 从而相应地在DTA曲线上得到放热或吸收 峰。
2020/6/18
14
✓ 差热曲线是由差热分析得到的记录曲线。纵坐标是 试样与参比物的温度差ΔT,向上表示放热反应,向 下表示吸热反应,横坐标为T(或t)。
2020/6/18
15
1.2.1 DTA曲线术语
2020/6/18
典型的DTA曲线
差热分析技术
表1 热分析技术的分类
被测物质的性质 质量
温度 热焓 联用
2020/6/18
名称 热重法 微析 热挥发物分析 加热(冷却)曲线测定
差示热分析 差示扫描量热测定 热重-气相色谱 热重-红外 热重-X线衍射-红外 差热-质谱 差热-电镜
2020/6/18
11
➢ 试样的用量的影响 因为试样的吸热或放热反应会引起 试样温度发生偏差,试样用量越大,偏差越大。试样用 量大,逸出气体的扩散受到阻碍,热传递也受到影响, 使热分解过程中TG曲线上的平台不明显。因此,在热 重分析中,试样用量应在仪器灵敏度范围内尽量小。
➢ 试样的粒度的影响 粒度不同会使气体产物的扩散过程 有较大变化,这种变化会导致反应速率和TG曲线形状 的改变,如粒度小,反应速率加快,TG曲线上反应区 间变窄。粒度太大总是得不到好的TG曲线的。
热重分析通常有静态法和动态法两种类型
2020/6/18
3
➢ 静态法又称等温热重法,是在恒温下测定物 质质量变化与温度的关系,通常把试样在各 给定温度加热至恒重。该法比较准确,常用 来研究固相物质热分解的反应速度和测定反 应速度常数。
➢ 动态法又称非等温热重法,是在程序升温下 测定物质质量变化与温度的关系,采用连续 升温连续称重的方式。该法简便,易于与其 他热分析法组合在一起,实际中采用较多。
热重分析影响因素
➢ 坩埚的影响 坩埚和试样间必须无任何化 学反应,坩埚一般由铂、铝、石英或刚玉(陶瓷) 制成。
➢ 升温速率的影响 升温速率一般是5℃/min、 10 ℃/min、20 ℃/min。升温速率过快,热滞后 现象严重,热失重曲线的起始温度和终止温度偏 高,TG曲线上的拐点不明显;升温慢时曲线表现 为转折,有利于中间体的鉴定与解析,但测定时 间长,曲线变得平坦。
