水溶液中的三大平衡练习题
水溶液中的三大平衡练习题

水溶液中的“三大平衡”(1)题型:选择题6分,电离度(2016),沉淀溶解平衡、溶度积常数(2015、2013)、K sp 计算(2014)、离子积常数(2012) 选择题:每小题只有一项符合题意。
1.醋酸是电解质,下列事实能说明醋酸是弱电解质的组合是①醋酸与水能以任意比互溶 ②醋酸溶液能导电 ③醋酸溶液中存在醋酸分子 ④0.1 mol ·L -1醋酸的pH 比0.1 mol ·L -1盐酸的pH 大 ⑤醋酸能和碳酸钙反应放出CO 2 ⑥大小相同的锌粒与相同物质的量浓度的盐酸和醋酸反应,醋酸产生H 2速率慢 A .②⑥B .③④⑤C .③④⑥D .①②2.下列叙述正确的是A .盐酸中滴加氨水至中性,溶液中溶质为氯化铵B .NaHSO 4溶液、KF 溶液、KAl(SO 4)2溶液、NaI 溶液中,前三个都对水的电离平衡产生影响,且都促进水的电离C .向NaAlO 2溶液中滴加NaHCO 3溶液,有沉淀和气体生成D .25℃时,用醋酸溶液滴定等浓度NaOH 溶液至pH = 7,V (醋酸) > V (NaOH)3.将浓度为0.1 mol ·L -1HF 溶液加水不断稀释,下列各量始终保持增大的是A .c (H +)B .K a (HF)C .c (F -)c (H +)D .c (H +)c (HF)4.对滴有酚酞试液的下列溶液,操作后颜色变深的是 A .明矾溶液加热B .CH 3COONa 溶液加热C .氨水中加入少量NH 4Cl 固体D .小苏打溶液中加入少量NaCl 固体5.下列溶液中粒子的物质的量浓度关系正确的是A .0.1 mol ·L -1NaHCO 3溶液与0.1 mol ·L -1NaOH 溶液等体积混合,所得溶液中:c (Na +) > c (CO 2-3) > c (HCO -3) > c (OH -)B .20 mL 0.1 mol ·L -1CH 3COONa 溶液与10 mL 0.1 mol ·L -1HCl 溶液混合后溶液呈酸性,所得溶液中:c (CH 3COO -) > c (Cl -) > c (CH 3COOH) > c (H +)C .室温下,pH = 2的盐酸与pH = 12的氨水等体积混合,所得溶液中:c (Cl -) + c (H +) > c (NH +4) + c (OH -)D .0.1 mol ·L -1CH 3COOH 溶液与0.1 mol ·L -1NaOH 溶液等体积混合,所得溶液中:c (OH -) > c (H +) + c (CH 3COOH)6.常温下,0.2 mol ·L -1的一元弱酸HA 与等浓度的NaOH 溶液等体积混合后,所得溶液中部分微粒组成及浓度如图所示,下列说法正确的是A .HA 为强酸B .该混合液pH = 7C .图中X 表示HA ,Y 表示OH -,Z 表示H+D .该混合溶液中:c (A -) + c (Y) = c (Na +)7.室温下,甲、乙两烧杯均盛有5 mL pH = 3的某一元酸溶液,向乙烧杯中加水稀释至pH = 4。
(完整版)水溶液中的离子平衡典型练习题及答案

水溶液中的离子平衡1.常温下将稀NaOH溶液和稀CH3COOH溶液混合,溶液中不可能出现的结果是().A.pH>7,且c(OH-)>c(Na+)>c(H+)>c(CH3COO-)B.pH>7,且c(Na+)+c(H+)=c(CH3COO-)+c(OH-)C.pH<7,且c(CH3COO-)>c(H+)>c(Na+)>c(OH-)D.pH=7,且c(CH3COO-)>c(Na+)>c(H+)=c(OH-)2. 在25℃,将a mol/L的氨水与b…的盐酸等体积混合,反应后显中性…用含a和b的代数式表示该混合溶液中一水合氨的电离平衡常数是?3.水的电离平衡曲线如图所示,下列说法中,正确的是()A、图中A、B、D三点处Kw的大小关系:B>A>DB、25℃时,向pH=1的稀硫酸中逐滴加入pH=8的稀氨水,溶液中c(NH4+)/c(NH3?H2O)的值逐渐减小C、在25℃时,保持温度不变,在水中加人适量NH4Cl固体,体系可从A点变化到C点D、A点所对应的溶液中,可同时大量存在Na+、Fe3+、Cl-、S042-4. 设水的电离平衡线如图所示:(1)若以A点表示25℃时水在电离平衡时的离子浓度,当温度上升到100℃时,水的电离平衡状态到B点,则此时水的离子积从_____增加到____,造成水的离子积增大的原因是____.(2)将pH=8的Ba(OH) 2 溶液与pH=5的稀盐酸混合,并保持100℃的恒温,欲混合溶液pH=7,则Ba(OH) 2 溶液与盐酸的体积比为____.(3)100℃时,已知某强酸溶液的pH酸与某强碱溶液的pH碱存在如下关系:pH酸+ pH碱=13,若要使该强酸与该强碱混合后溶液呈中性,则该强酸溶液的体积与强碱溶液的体积之比为__5. 已知NaHSO4在水中的电离方程式为:NaHSO4═Na++H++SO42-.某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2.下列对该溶液的叙述中,不正确的是()A.该温度高于25℃B.由水电离出来的H+的浓度是1.0×10-10mol/LC.加入NaHSO4晶体抑制了水的电离D.该温度下加入等体积pH=12的NaOH溶液可使该溶液恰好呈中性6.为更好地表示溶液的酸碱性,科学家提出了酸度(AG)的概念,AG=已知某无色溶液的AG=12,则在此溶液中能大量共存的离子组是( )A.Na+、AlO2-、K+、NO3-B.MnO4-、K+、SO42-、Na+C.NH4+、NO3-、Al3+、Cl-D.Mg2+、SO42-、HCO3-、Na+7.下列事实能说明醋酸是弱电解质的是( )①醋酸与水能以任意比互溶②醋酸溶液能导电③醋酸溶液中存在醋酸分子④1mol/L醋酸的pH比0.1mol/L盐酸pH大⑤醋酸能和碳酸钙反应放出CO2⑥0.1mol/L醋酸钠溶液pH=8.9⑦大小相同的锌粒与相同物质的量浓度的盐酸和醋酸反应,醋酸产生H2速率慢A.②⑥⑦B.③④⑥⑦C.③④⑤⑥D.①②③8.关于小苏打水溶液的表述正确的是()A.c (Na+)=c (HCO3-)+c (CO32-)+2c (H2CO3)B.c (Na+)+c (H+)=c (HCO3-)+c (CO32-)+c (OH-)C.HCO3-的电离程度大于HCO3-的水解程度D.存在的电离有:NaHCO3=Na++HCO3-,HCO3-⇌H++CO32-,H2O⇌H++OH-9.下列有关电解质溶液中微粒的物质的量浓度关系正确的是()A.在0.1mol•L-1NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)B.在0.1mol•L-1Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3)C.向0.2 mol•L-1NaHCO3溶液中加入等体积0.1mol•L-1NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+)D.常温下,CH3COONa和CH3COOH混合溶液[pH=7,c(Na+)=0.1mol•L-1]:c(Na+)=c(CH3COO-)>c(CH3COOH)>c(H+)=c(OH-)10. (1)在25°C时,已知0.1mol/LHCN溶液的PH=4,0.1mol/LNaCN溶液的pH=12.现将0.2mol/L 的HCN溶液和0.1mol/L的NaOH溶液等体积混合后,溶液中各种离子的浓度有大到小的关系为______.(2)常温下,将0.01molNH4Cl和0.002molNaOH溶于水,配制成0.5L混合溶液.试回答(填写数据):①溶液中c(NH4+)+c(NH3•H2O)一定等于______②溶液中n(OH-)+n(Cl-)-n(NH+4)=______.11某二元弱酸的酸式盐,NaHA溶液,若PH<7,则溶液中各离子的浓度关系不正确的是A C(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)B c(Na+)+ c(H+)= c(HA-)+2 c(A2-)+ c(OH-)C c(H+)+ c(HA-)= c(OH-)+ c(H2A)D c(Na+)= c(HA-)+ c(H2A)+ c(A2-).答案1.在电解质溶液中存在三个守恒:①电荷守恒:c(Na+)+c(H+)=c(OH-)+c(CH3COO-),②物料守恒,③质子守恒,故B正确;D项pH=7,c(H+)=c(OH-),则有c(Na+)=c(CH3COO-),故D项错;A项NaOH是强电解质NaOH====Na++OH-,当两溶液混合OH-参加反应被消耗,而Na+不参加反应,故c(Na+)>c(OH-),同理c (CH3COO-)>c(H+),故A项错;C项pH<7,醋酸过量,结论正确。
水溶液中的离子平衡测试题及答案

第三章 水溶液中的离子平衡 测试题一、选择题1.将纯水加热至较高温度,下列叙述正确的是( )A.水的离子积变大、pH变小、呈酸性 B.水的离了积不变、pH不变、呈中性C.水的离子积变小、pH变大、呈碱性 D.水的离子积变大、pH变小、呈中性2.下列有关“电离平衡”的叙述中正确的是( )A.电解质在溶液里达到电离平衡时,分子的浓度和离子的浓度相等B.电离平衡时,由于分子和离子的浓度不断发生变化,所以说电离平衡是动态平衡C.电离平衡是相对的、暂时的,外界条件改变时,平衡就会发生移动D.电解质达到电离平衡后,各种离子的浓度相等3.下列关系一定正确的是( )A.当溶液中c(H+)>10-7 molL-1时,其pH<7,溶液呈现酸性B.当溶液中c(H+)>10-7 molL-1时,其pH>7,溶液呈现碱性C.当溶液中c(H+)=c(OH-)>10-7 molL-1时,其pH<7,溶液呈现中性D.当溶液中c(H+)=c(OH-)>10-7 molL-1时,其pH<7,溶液呈现酸性4.从植物花朵中提取到一种色素,它实际上是一种有机弱酸,可用HR表示,HR在盐酸溶液中呈现红色,HR在NaOH溶液中呈现蓝色,将HR 加入浓硝酸中呈现红色,微热后溶液的红色褪去,根据以上现象,可推测( )A.HR应为红色 B.HR应为蓝色 C.R-应为无色 D.R- 应为红色5.在稀氨水溶液中存在如下平衡体系:NH3·H2ONH4++OH-,当增大溶液的pH时,c(NH4+)会( )A.可能增大也可能减小 B.增大 C.减小 D.无变化6.将pH=1的盐酸平均分为2份,1份加适量水,另一份加入与该盐酸物质的量浓度相同的适量NaOH溶液后,pH都升高1,则加入的水与NaOH 溶液的体积比为( )A.9 B.10 C.11 D.12 7.有一种含氨和氯化铵物质的量相等的混合溶液,其pH为9.3,下列说法中错误的是( )A.氨水的电离作用大于氯化铵的水解作用 B.氯化铵的水解作用大于氨水的电离作用C.氨水的存在抑制了氯化铵的水解 D.氯化铵的存在抑制了氨水的电离8.将0.lmol∙L-1醋酸溶液加水稀释,下列说法正确的是( )A.溶液中c(H+)和c(OH-)都减小 B.溶液中c(H+)增大C.醋酸电离平衡向左移动 D.溶液的pH增大9.室温下,某溶液中由水电离出的c(OH-)=10-5mol·L-1,则其溶质可能是( )A.CH3COOH B.H2SO4 C.NaOH D.Na2CO310.pH=3的醋酸溶液加水冲稀到原溶液体积的3倍,则稀释后的pH为( )A.3.2 B.3.5 C.3.7 D.411.已知,往0.1mol∙L-1的氨水中滴入酚酞试液时,溶液将呈现粉红色。
高考常考选择题训练——水溶液中的离子平衡

选择题12水溶液中的离子平衡角度一溶液中的三大平衡及影响因素1.三大平衡影响因素电离平衡CH3COOH CH3COO -+H+水解平衡CH3COO-+H2O CH3COOH+OH-沉淀溶解平衡AgCl(s)Ag+(aq)+Cl-(aq)(或物质)2.影响水电离程度大小的常考因素3.溶液中离子浓度大小比较(1)紧扣两个微弱电离是微弱的,大多数盐的水解也是微弱的。
(2)牢记三大守恒①电荷守恒:电解质溶液中阴离子所带电荷总数等于阳离子所带电荷总数,根据电荷守恒可准确、快速地解决电解质溶液中许多复杂的离子浓度问题。
如(NH4)2CO3与NH4HCO3的混合溶液中一定有:c(NH+4)+c(H+)=2c(CO2-3)+c(HCO-3)+c(OH-)。
②物料守恒:物质发生变化前后,有关元素的存在形式不同,但元素的种类和原子数目在变化前后保持不变,根据物料守恒可准确、快速地解决电解质溶液中复杂离子、分子的物质的量浓度或物质的量的关系。
如:0.1mol·L-1NaHCO3溶液中一定有c(Na+)=c(HCO-3)+c(CO2-3)+c(H2CO3)=0.1mol·L-1。
0.1mol·L-1CH3COOH溶液与0.1mol·L-1CH3COONa溶液等体积混合一定有:c(CH3COOH)+c(CH3COO-)=2c(Na+)=0.1mol·L-1。
③质子守恒:在电离或水解过程中,会发生质子(H+)转移,但质子转移过程中其数量保持不变。
将混合溶液中的电荷守恒式和物料守恒式相联立,通过代数运算消去其中未参与平衡移动的离子,即可推出溶液中的质子守恒式。
(3)解题思维流程1.正误判断,正确的打“√”,错误的打“×”(1)LiH 2PO 4溶液中含P 元素的粒子有H 2PO -4、HPO 2-4和PO 3-4( )(2018·天津,6B 改编) (2)常温下,pH =2的H 3PO 4溶液,加水稀释使电离度增大,溶液pH 减小( )(2019·全国卷Ⅲ,11C)(3)常温下,pH =2的H 3PO 4溶液,加入NaH 2PO 4固体,溶液酸性增强( )(2019·全国卷Ⅲ,11D)(4)碳酸钠可用于去除餐具的油污( )(2018·全国卷Ⅱ,7A)(5)100mL1mol·L -1FeCl 3溶液中所含Fe 3+的数目为0.1N A ( )(2018·全国卷Ⅱ,11B)(6)常温下,pH =2的H 3PO 4溶液,c (H +)=c (H 2PO -4)+2c (HPO 2-4)+3c (PO 3-4)+c (OH -)( )(2019·全国卷Ⅲ,11B)答案 (1)× (2)× (3)× (4)√ (5)× (6)√2.(2016·全国卷Ⅲ,13)下列有关电解质溶液的说法正确的是( ) A.向0.1mol·L -1CH 3COOH 溶液中加入少量水,溶液中c (H +)c (CH 3COOH )减小B.将CH 3COONa 溶液从20℃升温至30℃,溶液中c (CH 3COO -)c (CH 3COOH )·c (OH -)增大C.向盐酸中加入氨水至中性,溶液中c (NH +4)c (Cl -)>1D.向AgCl 、AgBr 的饱和溶液中加入少量AgNO 3,溶液中c (Cl -)c (Br -)不变答案 D解析 A 项,c (H +)c (CH 3COOH )=K a c (CH 3COO -),加水稀释,c (CH 3COO ―)减小,K a 不变,所以比值增大,错误;B 项,c (CH 3COO -)c (CH 3COOH )·c (OH -)=1K h(K h 为水解常数),温度升高,K h 增大,比值减小,错误;C 项,向盐酸中加入氨水至中性,根据电荷守恒:c (NH +4)+c (H +)=c (Cl ―)+c (OH -),此时c (H +)=c (OH ―),故c (NH +4)=c (Cl ―),所以c (NH +4)c (Cl -)=1,错误;D 项,在饱和溶液中c (Cl -)c (Br -)=K sp (AgCl )K sp (AgBr ),温度不变K sp 不变,则溶液中c (Cl -)c (Br -)不变,正确。
溶液中的三大平衡-高考化学专题复习与测试

D.当
lg
V V0
=
2
时,若两溶液同时升高温度,则
cc((MR++))增大
解析:由图象分析浓度为 0.10 mol·L-1 的 MOH 溶液, 在稀释前 pH 为 13,说明 MOH 完全电离,则 MOH 为 强碱,而 ROH 的 pH<13,说明 ROH 没有完全电离,ROH 为弱碱。A 项,MOH 的碱性强于 ROH 的碱性,正确。 B 项,曲线的横坐标 lgVV0越大,表示加水稀释体积越大, 由曲线可以看出 b 点的稀释程度大于 a 点,弱碱 ROH 存 在电离平衡:ROH R++OH-,溶液越稀,
B 项,向溶液中加入 0.05 mol CaO,则 CaO+
H2O===Ca(OH)2 , 则
c(OH - ) 增 大 , 且
Ca2
+
+
CO
2- 3
===CaCO3↓,使 CO23-+H2O HCO- 3 +OH-平衡左移,
c(HCO- 3 )减小,故cc((HOCHO-3-))增大,正确;C 项,加入
答案:D
题组二 考查盐类水解及其应用
3.室温下,将 0.05 mol Na2CO3 固体溶于水配成 100 mL 溶液,向溶液中加入下列物质。有关结论正确的是
() 选项 加入的物质
结论
50 mL
反应结束后,c(Na+)=
A 1 mol·L-1H2SO4 c(SO24-)
B
0.05 mol CaO 溶液中cc((HOCHO-3-))增大
专题九 电解质溶液
考点二 溶液中的三大平衡
1.(2018·北京卷)测定 0.1 mol·L-1Na2SO3 溶液先升温 再降温过程中的 pH,数据如下。
时刻 ① ② ③ ④ 温度/℃ 25 30 40 25
高三化学二轮复习 溶液中的“三大平衡”(学案及训练)
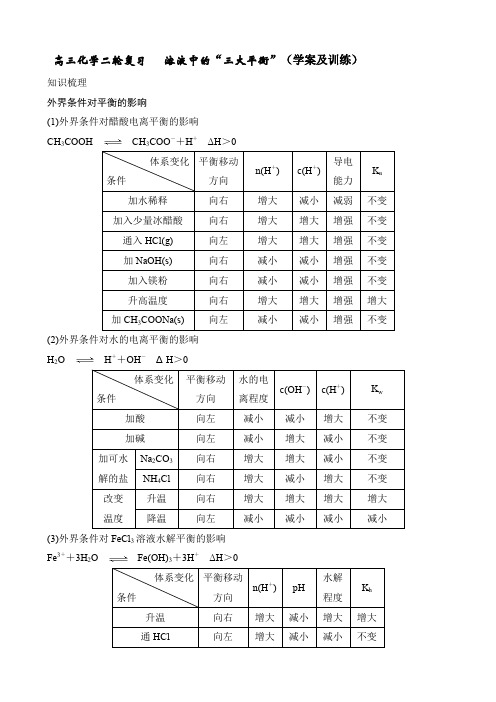
高三化学二轮复习 溶液中的“三大平衡”(学案及训练)知识梳理外界条件对平衡的影响(1)外界条件对醋酸电离平衡的影响 CH 3COOHCH 3COO -+H + ΔH >0(2)外界条件对水的电离平衡的影响 H 2OH ++OH - ΔH >0(3)外界条件对FeCl 3溶液水解平衡的影响 Fe 3++3H 2OFe(OH)3+3H + ΔH >0(4)外界条件对AgCl 溶解平衡的影响 AgCl(s)Ag +(aq)+Cl -(aq) ΔH >0注意对溶液中同时存在的其他平衡的影响。
强化训练1.(2019·课标全国Ⅲ,11)设N A 为阿伏加德罗常数值。
关于常温下pH =2的H 3PO 4溶液,下列说法正确的是( )A.每升溶液中的H +数目为0.02N AB.c (H +)=c (H 2PO -4)+2c (HPO 2-4)+3c (PO 3-4)+c (OH -)C.加水稀释使电离度增大,溶液pH 减小D.加入NaH 2PO 4固体,溶液酸性增强 答案 B2.下列有关电解质溶液的说法正确的是( )A.向0.1 mol·L -1CH 3COOH 溶液中加入少量水,溶液中c (H +)c (CH 3COOH )减小B.将CH 3COONa 溶液从20 ℃升温至30 ℃,溶液中c (CH 3COO -)c (CH 3COOH )·c (OH -)增大C.向盐酸中加入氨水至中性,溶液中c (NH +4)c (Cl -)>1D.向AgCl 、AgBr 的饱和溶液中加入少量AgNO 3,溶液中c (Cl -)c (Br -)不变答案 D3.(2019·北京理综,12)实验测得0.5 mol·L-1CH3COONa溶液、0.5 mol·L-1 CuSO4溶液以及H2O的pH随温度变化的曲线如图所示。
下列说法正确的是()A.随温度升高,纯水中c(H+)>c(OH-)B.随温度升高,CH3COONa溶液的c(OH-)减小C.随温度升高,CuSO4溶液的pH变化是K w改变与水解平衡移动共同作用的结果D.随温度升高,CH3COONa溶液和CuSO4溶液的pH均降低,是因为CH3COO-、Cu2+水解平衡移动方向不同答案 C4测定0.1 mol·L-1 Na2SO3溶液先升温再降温过程中的pH,数据如下。
水溶液中三大守恒

二、两种电解质溶液混合后离子浓度大小的比较
1、 两种物质混合不反应:
【例】:用物质的量都是 0.1 mol 的 CH3COOH和 CH3COONa配制成 1L 混合溶液,已知其中
C(CH3COO- ) > C(Na+) ,对该混合溶液的下列判断正确的是 ( )
A.C(H+) > C(OH-)
B.C(CH
C.c(NH 4+)= c(Cl -)> c(H +)= c(OH -) D.c(Cl -)=c(NH 4+)> c(H +)>c(OH -)
分析: 由于氯化铵溶液中存在下列电离过程: NH 4Cl=NH 4++Cl -, H2O
H++OH- 和水解过
程: NH 4++H2O
H++NH 3 ·H2O,由于
解析 :上述溶液混合后,溶质为 HCN 和 NaCN ,由于该题已说明溶液显碱性,所以不能
再按照 HCN 的电离处理,而应按 NaCN 水解为主。所以 c(Na+)>c(CN - ),选 B D
变式: pH 等于 7 型
【例 5】 . (2002 年全国高考理综 ) 常温下,将甲酸和氢氧化钠溶液混合,所得溶液
0.1mol/LKHC 2O4 溶液
中,下列关系正确的是( CD)
A. c(K+)+ c(H+)= c(HC2O4- )+ c(OH-)+
c
(C2
O 24
)
B
. c(HC2O4-)+ c (C2O42-)=0.1mol/L
C.
c
(C2
O 24
)
高考化学《水溶液中的四大平衡》专题训练

高考化学《水溶液中的四大平衡》专题训练知识网络:水溶液中的三大守恒规律:物料守恒、电荷守恒、质子守恒(H+的得失守恒)。
例1.(沉淀的溶解平衡)1.常温下,现将足量的AgCl固体分别放入下列液体中,AgCl的溶解度由大到小排序正确的是( B)①20mL 0.1mol/L(NH4)2CO3溶液②40mL 0.03mol/L HCl溶液③50mL 0.05mol/L AgNO3溶液④30mL 0.02mol/L CaCl2溶液⑤10mL蒸馏水⑥30mL 0.02mol/L NH4NO3溶液A.②>③>④>⑥>⑤>①B.①>⑥>⑤>②>④>③C.①>②>③>④>⑤>⑥D.③>②>④>⑥>①>⑤解:AgCl在溶液中存在溶解平衡AgCl(aq)Ag+(aq)+Cl-(aq),由于c(Ag+)或c(Cl-)对溶解平衡有抑制作用,则溶液中c(Ag+)或c(Cl-)越大,则AgCl的溶解度越小;①和⑥中铵根离子水解生成NH3•H2O,Ag+与NH3•H2O结合,使溶解平衡正移,AgCl的溶解度增大,由于(NH4)2CO3中NH4+水解程度大,则NH3•H2O的浓度大,使溶解平衡正移的程度大,则①>⑥;当溶液中存在c(Ag+)或c(Cl-)对溶解平衡有抑制作用,②c(Cl-)=0.03mol/L,③c(Ag+)=0.05mol/L,④c(Cl-)=0.04mol/L,⑤c(Ag+)或c(Cl-)为0,则AgCl的溶解度由大到小排列顺序是:⑤>②>④>③,综上可知AgCl的溶解度由大到小排列顺序是:①>⑥>⑤>②>④>③;故合理选项是B。
例2.(水、弱酸、弱碱的电离平衡)2.1.在pH均为9的NaOH和CH3COONa两种溶液中,假设由水电离产生的OH- 离子浓度分别为c1 mol/L与c2 mol/L,则(B )A.c1>c2B.c1=10-4c2C.c2=10-4c1D.c1=c22.2.四种弱酸的电离常数列于下表:①向H 3BO 3溶液中滴加等浓度的Na 2CO 3溶液不发生反应②向KClO 溶液中通入少量CO 2,产物为HClO 和KHCO 3③向KClO 溶液中通入过量SO 2,产物为HClO 和KHSO 3④等体积等浓度的Na 2CO 3和Na 2SO 3溶液相比,后者阴离子的数目更多A.1个B.2个C.3个D.4个解:①H 3BO 3的电离平衡常数,比碳酸的第二步电离平常大,说明H 3BO 3的酸性比HCO 3-的酸性强,向H 3BO 3溶液中加入Na 2CO 3会发生反应,生成HCO 3-,符合题意;②HClO 的电离平衡常数比碳酸的K 1小,但是比K 2大,向KClO 通入CO 2,能生产HClO 和HCO 3-,不符合题意;③ClO-具有强氧化性,SO 2具有还原性,会发生氧化还原反应,生成Cl -和SO 42-,符合题意;④Na 2CO 3溶液中,根据电荷守恒,c(Na +)+c(H +)=2c(CO 32-)+c(HCO 3-)+c(OH -),同样的在Na 2SO 3溶液中,也有c(Na +)+c(H +)=2c(SO 32-)+c(HSO 3-)+c(OH -),不能直接比阴离子浓度,但是可以通过阳离子浓度来比较,c(Na +)相同,c(H +)越大,阳离子浓度,则阴离子浓度越大。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
水溶液中的“三大平衡” (1)题型:选择题 6分,电离度(2016),沉淀溶解平衡、溶度积常数( 2015、2013 )、K sp 计算(2014)、离子积常数(2012) 选择题:每小题只有一项符合题意。
1 •醋酸是电解质,下列事实能说明醋酸是弱电解质的组合是 ①醋酸与水能以任意比互溶 ②醋酸溶液能导电③醋酸溶液中存在醋酸分子④0.1—1一 1mol L 醋酸的pH 比0.1 mol L 盐酸的pH 大⑤醋酸能和碳酸钙反应放出 CO ⑥大小相同的锌粒与相同物质的量浓度的盐酸和醋酸反应,醋酸产生 耳速率慢A.②⑥B.③④⑤C.③④⑥D.①②2. 下列叙述正确的是A. 盐酸中滴加氨水至中性,溶液中溶质为氯化铵B. NaHSO 溶液、KF 溶液、KAI(SO “2溶液、Nal 溶液中,前三个都对水的电离平衡产生 影响,且都促进水的电离C. 向NaAIQ 溶液中滴加NaHCO 溶液,有沉淀和气体生成D.25 C 时,用醋酸溶液滴定等浓度 NaOH 溶液至pH = 7 ,V (醋酸)> V3. 将浓度为0.1 mol L 「1HF 溶液加水不断稀释,下列各量始终保持增大的是+C (F 一)A. C (H )B. K a (HF)C. c (H +)D. 4. 对滴有酚酞试液的下列溶液,操作后颜色变深的是A.明矶溶液加热 B. CHCOON 溶液加热 C.氨水中加入少量 NHCI 固体D.小苏打溶液中加入少量5. 下列溶液中粒子的物质的量浓度关系正确的是A. 0.1 mol L 一1NaHCO 溶液与0.1 mol L 一1NaOH 溶液等体积混合,所得溶液中: c (Na +) >c (CO 3 ) > c (HCO ) > c (OH )B. 20 mL 0.1 mol L —1 CH 3COON 溶液与 10 mL 0.1 mol L —1HCI 溶液混合后溶液呈酸性, 所得溶液中:c (CHCOO) > c (CI 一)> c (CH 3COOH) > c (H +)C. 室温下,pH = 2的盐酸与pH = 12的氨水等体积混合,所得溶液中:— + + —c (CI ) + c (H +) > c (NH 4)+ c (OH )D. 0.1 mol L 一1CH 3COOH 溶液与0.1 mol •一1NaOH 溶液等体积混合,所得溶液中: C (OH 「)>c (H +) + c (CH 3COOH)6. 常温下,0.2 mol L —1的一元弱酸HA 与等浓度的NaOH 溶液等体积混合后,所得溶液中部分微粒组成及浓度如图所示,下列说法正确的是 A. HA 为强酸B.该混合液pH = 7C. 图中X 表示HA Y 表示 OH , Z 表示HD. 该混合溶液中:c (A —) + c (Y) = c (Na +)7.室温下,甲、乙两烧杯均盛有 5mL pH = 3的某一元酸溶液,向乙烧杯中加水稀释至 pH = 4。
关于甲、乙烧杯中溶 液的描述正确的是c (H +) C (HF)NaCI 固体①溶液的体积10V甲< V乙②水电离出的 OH浓度:10c(OH「)甲< c(OH「)乙③若分别用等浓度的 NaOH溶液完全中和,所得溶液的pH:甲w乙④若分别与5 mL pH = 11的NaOH溶液反应,所得溶液的 pH:甲w乙A. ①②B.②③C.①④D.②④& 室温下,用 0.100 mol L 「1 NaOH 溶液分别滴定 20.00 mL 0.100 mol 1的盐酸和醋酸,滴定曲线如图所示,下列说法正确的是 A. n 表示的是滴定醋酸的曲线B. pH = 7时,滴定醋酸消耗 V (NaOH)/小于20 mLC. V (NaOH) = 20 mL 时,c (CI 「)= c (CHCOO)D. V (NaOH) = 10 mL 时,醋酸溶液中:c (Na +) > c (CH s COO) > c (H +) > c (OH )9. 25C 时,用浓度为 0.1000 mol 「1的NaOH 溶液滴定20.00 mL 浓度均为 0.1000 mol L 的三种酸 HX HY HZ 滴定曲线如图所示。
下列说法正确的是A. 在相同温度下,同浓度的三种酸溶液的导电能力顺序:B. 根据滴定曲线,可得 K a (HY) ~10 _5C. 将上述HX HY 溶液等体积混合后,用 NaOH 溶液滴定 至HX恰好完全反应时:c (X _) > c (Y _) > c (OH 「)> c (H +)D. HY 与HZ 混合,达到平衡时:_ 1 _ 110. 常温下,用 0.1000 mol L NaOH 溶液滴定 20.00 mL 0.1000 mol L CHCOOH 溶液所得滴定曲线如右图。
下列说法正确的是 A. 点①所示溶液中:c (CH s CO(_) + c (OH _) = c (CHCOOH) + c (H +)B. 点②所示溶液中:c (Na +) = c (CfCOOH)+ c (CH s CO(_)C. 点③所示溶液中:c (Na +) > c (OH ) > c (CH s COO) > c (H +)D. 滴定过程中可能出现:c (CH s COOH) > c (CHCOO) > c (H +) > c (Na +) > c (OH )_ 12一 3— 111.已知 K sp (Ag 2CrO 4) = 9.0 X 10 ,将等体积的 4 X 10 mol L 的AgNO 溶液和 4 X 10_3mol L _1的K 2CrO 4溶液混合,下列说法正确的是A. 恰好形成 Ag 2CrCu 饱和溶液B.能析出Ag^CrO 沉淀C.不能析出Ag 2CrO 4沉淀D.无法确定能否析出 Ag 2CrO 4沉淀c (H +)=K a (HY) c (HY)—c(Y _)—+ c (Z _) + c (OH 「)HZ < HY < HX12. 某温度下,Fe(OH)3(s)、C U(OH)2(S)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示。
据图分析,下列判断错误的是A. K sp[Fe(OH) 3] < K sp[Cu(OH) 2]B. 加适量NHCI固体可使溶液由a点变到b点C. c、d两点代表的溶液中c(H +)与c(OH )乘积相等D. Fe(OH)3(s)、C U(OH)2(S)分别在b、c两点代表的溶液中达到饱和_ _ io _ 13 一 1213.已知 K sp (AgCI) = 1.56 X 10 , K sp (AgBr) = 7.7 X 10 ,K sp (Ag 2CrO 4)= 9.0 X 10。
_ _2_ 一1某溶液中含有 Cl 、Br 和CrQ 浓度均为0.010 mol L ,向该溶液中逐滴加入 0.010mol L _1的AgNO 溶液时,三种阴离子产生沉淀的先后顺序为2_2_A. Cl 、Br 、CrQB. CrO 4、Br 、Cl2 __2 _C. Br 、Cl 、CrC 4D. Br 、CrO 4、Cl14.已知常温下:K Sp [Mg(OH )2] = 1.2 X 10_ 11, K Sp (AgCl) = 1.8X 10_10, K sp (Ag 2S) = 6.3 x_ EQ_ Q10_ , K sp (CH 3COOAg) = 2.3 X 10 _。
下列叙述正确的是A. 浓度均为0.02 mol L _ 1的AgNO 和CHCOON 溶液混合一定产生 CHCOOA 沉淀B. 将 0.001 mol L 的 AgNO 溶液加入到 0.001 mol L 的 KCl 和 0.001 mol L 的 K 2S溶液中,先产生AgCl 沉淀C. 要使Mg +浓度为0.12 mol L _1的溶液产生 Mg(OH>的沉淀,溶液的pH >9 D. 向饱和AgCl 的水溶液加入NaCl 溶液,K sp (AgCl)变大C. pH = 11的NaOH 溶液与pH = 3的醋酸溶液等体积混合,滴入石蕊溶液呈红色D.向0.1 mol •一1的氨水中加入少量硫酸铵固体,则溶液中 /(NHHHo)增大17. 下列说法正确的是A.中和相同体积、相同c (H +)的①硫酸、②盐酸和③醋酸所需相同浓度的NaOH 溶液的体积关系:V 1 > V 2 = V 3B. 将0.1 mol L _1CH 3COOH 溶液加水稀释,在此过程中,醋酸的电离程度、溶液的 pH 都逐渐增15.—定温度下,三种碳酸盐MCQM : MgS.2 一已知 pM = _ lg c (M) , p c (CQ ) = _ lg ① MgCQ CaCO MnCO 的 K p 依次增大 ② a 点可表示MnCO 勺饱和溶液,2 +2_且 c (Mn ) = c (CQ )③ b 点可表示CaCO 的饱和溶液, 且 c (Ca +) < c (CO 3 )④ c 点可表示MgCO 勺饱和溶液,2 +2 _且 c (Mg ) < c (CO 3 ) A. ①② B .②③ C.①③D.②④16. 下列叙述正确的是C 『、MrT)的沉淀溶解平衡曲线如下图所示。
c (C&_)。
下列说法正确的是pM 1210 8 6 4 2 024 6 8 10 12p(COS }2一+pH = 7 时,c (SO 4 ) > c (NH 4)C 1 和 C 2, pH 分别为 a 和 a + 1,贝U C 1 = 10 C 2大C. 稀氨水中部分离子的浓度大小关系:c(NH^) > C(OH「)> c(H+) > c(NH3 H2O)D. 已知氢气的标准燃烧热为—285.8 kJ mol _1,相应的热化学方程式为:2H2(g) + O2(g) = 2fO(l) △H = — 285.8 kJ mol18. 取pH均等于2的盐酸和醋酸各100 mL分别稀释2倍后,再分别加入 0.03 g锌粉,在相同条件下充分反应,有关叙述正确的是①醋酸与锌反应放出氢气多②盐酸和醋酸分别与锌反应放出的氢气一样多③醋酸与锌反应速率大④盐酸和醋酸分别与锌反应的速率一样大A. ①③B.①④C.②③D.②④19. 25C时,水的电离达到平衡:H2O H++ 0H「△H> 0,下列叙述正确的是A. 向水中加入稀氨水,平衡逆向移动,c(OH「)降低B. 向水中加入少量固体硫酸氢钠,C(H +)增大,K w不变C. 向水中加入少量固体醋酸钠平衡逆向移动,C(H+)降低D. 将水加热,K w增大,pH不变20. 已知温度T时水的离子积常数为K w,该温度下,将浓度为a mol L-1的一元酸HA与b mol L的一元碱BOH等体积混合,可判定该溶液呈中性的依据是A. a = bB. 混合溶液的pH = 7C. 混合溶液中,c(H +) = K w mol 1D. 混合溶液中,C(H+) + C(B+) = C(OH「)+ C(A「)21. 下列关于电解质溶液的正确判断是A. 25C时NH4CI溶液的K w大于100C时NHCI溶液的KB. 在pH = 0的溶液中,NaS Ba2*、AIQ、NO可以大量共存C. 由0.1 mol L1一元碱BOH溶液的pH = 10,可推知BOH溶液存在BOH= B++ OH「D. 由0.1 mol L1一元酸 HA溶液的pH = 3,可推知 NaA溶液存在A + H2O HA + OH「22. 下列叙述正确的是A. 某醋酸溶液的pH = a,将此溶液稀释1倍后,溶液的pH = b,则a > bB. 在滴有酚酞溶液的氨水里,加入NH4CI至溶液恰好无色,则此时溶液的pH < 7C. 1.0 X10 mol L 盐酸的 pH = 3.0 , 1.0 X10 mol L 盐酸的 pH = 8.0D. 若1 mL pH = 1的盐酸与100 mL NaOH溶液混合后,溶液的 pH = 7,贝U NaOH溶液的 pH = 1123. 已知AgI为黄色沉淀,AgCl为白色沉淀,25 C时,AgI饱和溶液中C(Ag+)为1.22 X10 _8 molL_1, AgCl 饱和溶液中C(Ag +)为 1.30 X10 一5 mol L_1。
