物理化学第10章(下)1
合集下载
傅献彩《物理化学》第五版课件及习题答案_10电解与极化作用
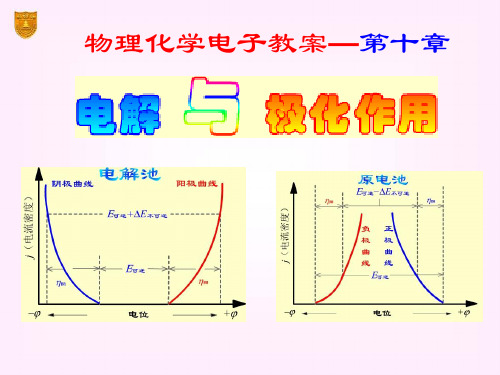
用搅拌和升温的方法可以减少浓差极化 也可以利用滴汞电极上的浓差极化进行极谱分析。
§10.2 极化作用
例如电解一定浓度的硝酸银溶液 阴极反应
Ag + (mAg+ ) e Ag(s)
可逆
电解时
RT 1 Ag |Ag ln F aAg+
阴
可逆 > 不可逆 阳极上有类似的情况,但 可逆 < 不可逆
动势达极大值 Eb,max。
电 流 I
3
再增加电压,使I 迅速增 加。将直线外延至I = 0 处, 得E(分解)值,这是使电解
2 1
池不断工作所必需外加的 最小电压,称为分解电压。
E分解
电压E
测定分解电压时的电流-电压曲线
实际分解电压
要使电解池顺利地进行连续反应,除了克服作
为原电池时的可逆电动势外,还要克服由于极化在
生消耗氧的还原反应:
O2 (g)+4H+ 4e 2H2O
(O2 |H2O,H+ )
RT 1 ln 4 4F aO2 aH +
1.229 V
设 aO2 1, aH+ 107 , 则 (O2 |H2O,H+ ) 0.816V
这时与 E(Fe2+ |Fe) (-0.617V)阳极组成原电池的电动 势为 1.433 V 显然耗氧腐蚀比析氢腐蚀严重得多。
所以铁很快腐蚀形成铁锈。
CO2 SO2
Fe2+
H 2或 H 2O
O2
O2
H
Cu
+
H2 O
Fe
2e-
H2 O
H+
Cu
电化学腐蚀示意图
§10.2 极化作用
例如电解一定浓度的硝酸银溶液 阴极反应
Ag + (mAg+ ) e Ag(s)
可逆
电解时
RT 1 Ag |Ag ln F aAg+
阴
可逆 > 不可逆 阳极上有类似的情况,但 可逆 < 不可逆
动势达极大值 Eb,max。
电 流 I
3
再增加电压,使I 迅速增 加。将直线外延至I = 0 处, 得E(分解)值,这是使电解
2 1
池不断工作所必需外加的 最小电压,称为分解电压。
E分解
电压E
测定分解电压时的电流-电压曲线
实际分解电压
要使电解池顺利地进行连续反应,除了克服作
为原电池时的可逆电动势外,还要克服由于极化在
生消耗氧的还原反应:
O2 (g)+4H+ 4e 2H2O
(O2 |H2O,H+ )
RT 1 ln 4 4F aO2 aH +
1.229 V
设 aO2 1, aH+ 107 , 则 (O2 |H2O,H+ ) 0.816V
这时与 E(Fe2+ |Fe) (-0.617V)阳极组成原电池的电动 势为 1.433 V 显然耗氧腐蚀比析氢腐蚀严重得多。
所以铁很快腐蚀形成铁锈。
CO2 SO2
Fe2+
H 2或 H 2O
O2
O2
H
Cu
+
H2 O
Fe
2e-
H2 O
H+
Cu
电化学腐蚀示意图
第10章_界面现象-wfz-1

25
弯曲液面附加压力Δp 与液面曲率半径之间关系的推导: 水平分力相互平衡, 垂直分力指向液体内部 其单位周长的垂直分力为cos 球缺底面圆周长为2r1 ,得垂直分力在圆周上的合力为: F=2r1 cos 因cos = r1/ r ,球缺底面面积为 r12 , 故弯曲液面对于单位水平面上的附加压力 p 整理后得:
表10.1.1 某些液态物质的表面张力
物 质 t / °C
/ mN m-1
18.4 21.8 22.3 26.43 72.75 113.8 137.8 250 582 700 878.5 1300 1800
正己烷 正辛醇 乙醇 乙醚 H2O NaCl LiCl Na2SiO3(水玻璃) FeO Al2O3 Ag Cu Pt
\ dn = - 4p r 2 (dr ) r / M
/mNm-1
1670 1140 685 527 12010 1000 905 4500 1030
Cu Ag Sn 苯 冰 氧化镁 氧化铝 云母 石英(1010晶面)
17
(2) 与接触相的性质有关。
两种互不混溶的液体形成液-液界面时,界面层分子所处力场取 决于两种液体。所以不同液-液对界面张力不同。
18
(3) 温度的影响
T↑ 气相中分子密度↑ 液相中分子距离↑
↓ (有例外)
(表10.1.4) 不同温度下液体的表面张力 0 液体 水 乙醇 甲醇 CCl4 丙酮 甲苯 苯 75.64 24.05 24.5 26.2 30.74 31.6 72.75 22.27 22.6 26.8 23.7 28.43 28.9 69.58 20.60 20.9 24.3 21.2 26.13 26.3 66.18 19.01 21.9 18.6 23.81 23.7 62.61 16.2 21.53 21.3 58.85 15.7 19.39 20 40 60 80 100
弯曲液面附加压力Δp 与液面曲率半径之间关系的推导: 水平分力相互平衡, 垂直分力指向液体内部 其单位周长的垂直分力为cos 球缺底面圆周长为2r1 ,得垂直分力在圆周上的合力为: F=2r1 cos 因cos = r1/ r ,球缺底面面积为 r12 , 故弯曲液面对于单位水平面上的附加压力 p 整理后得:
表10.1.1 某些液态物质的表面张力
物 质 t / °C
/ mN m-1
18.4 21.8 22.3 26.43 72.75 113.8 137.8 250 582 700 878.5 1300 1800
正己烷 正辛醇 乙醇 乙醚 H2O NaCl LiCl Na2SiO3(水玻璃) FeO Al2O3 Ag Cu Pt
\ dn = - 4p r 2 (dr ) r / M
/mNm-1
1670 1140 685 527 12010 1000 905 4500 1030
Cu Ag Sn 苯 冰 氧化镁 氧化铝 云母 石英(1010晶面)
17
(2) 与接触相的性质有关。
两种互不混溶的液体形成液-液界面时,界面层分子所处力场取 决于两种液体。所以不同液-液对界面张力不同。
18
(3) 温度的影响
T↑ 气相中分子密度↑ 液相中分子距离↑
↓ (有例外)
(表10.1.4) 不同温度下液体的表面张力 0 液体 水 乙醇 甲醇 CCl4 丙酮 甲苯 苯 75.64 24.05 24.5 26.2 30.74 31.6 72.75 22.27 22.6 26.8 23.7 28.43 28.9 69.58 20.60 20.9 24.3 21.2 26.13 26.3 66.18 19.01 21.9 18.6 23.81 23.7 62.61 16.2 21.53 21.3 58.85 15.7 19.39 20 40 60 80 100
大学物理化学--第10章

上一内容 下一内容 回主目录
返回
2020/8/23
分散系统分类
根据分散相颗粒大小,分散系统可分为三类:
真溶液: d 1nm 胶体系统: 1nm d 1000nm 粗分散系统: d 1000nm
根据分散相和分散介质聚集状态不同,分散系统 可分为气溶胶、液溶胶、固溶胶等。
上一内容 下一内容 回主目录
如图所示,在CDFE 的桶内盛溶胶,在某一 截面AB两侧溶胶浓度不 同,C1>C2;可以观察到 胶粒从C1区向C2区迁移 的现象。
上一内容 下一内容 回主目录
返回
2020/8/23
3. 沉降与沉降平衡
分散相粒子受力情况分析:
一方面是重力场的作用,它力图把粒子拉向容器 的底部,使之发生沉降。
另一方面当沉降作用使底部粒子数密度高于上部 时,由数密度差引起的扩散作用使粒子均匀分布。
第十章 胶体化学(Colloid Chemistry)
上一内容 下一内容 回主目录
返回
2020/8/23
分散系统(dispersion system)
一种或几种物质分散在另一种物质中就构成 分散系统;被分散的物质称为分散相,另一种物质 称为分散介质。
分散相总是不连续的,又称为不连续相或内相; 分散介质一般都是连续的,又称为连续相或外相。
返回
2020/8/23
胶体系统 (1nm < d<1000nm)
(1)溶胶:分散相不溶于分散介质,有很大相 界面,是热力学不稳定系统。(憎液溶胶)
胶
(2)高分子溶液: 高分子以分子形式溶于介质,
体
分散相与分散介质间无相界面,是热力学稳定
系
系统。(亲液溶胶)
统
物理化学第五版课后习题答案

3.931
7.528
10.102
V∕(dm3·kg-1)
10.2
14.7
17.3
23.7
28.4
41.9
50.1
试求方程式V=kpn中的k及n的数值。
解:
lgp
-0.1412
0.1163
0.2363
0.4621
0.5945
0.8767
1.0044
lgV
1.0086
1.1673
1.2380
1.3747
(4)最本质区别是分子之间的作用力不同。物理吸附是固体表面分子与气体分子间的作用力为范德华力,而化学吸附是固体表面分子与气体分子的作用力为化学键。
(5)由于物理吸附过程是自发进行的,所以ΔG<0,而ΔS<0,由ΔG=ΔH-TΔS,得
ΔH<0,即反应为放热反应。
10-2在293.15K及101.325kPa下,把半径为1×10-3m的汞滴分散成半径为1×10-9m的汞滴,试求此过程系统表面吉布斯函数变(ΔG)为多少?已知293.15K时汞的表面张力为0.4865N·m-1。
解:由朗缪尔吸附等温式 得:
b= = =0.01208 =5.9524
p= = =82.78kPa
10-11在291.15K的恒温条件下,用骨炭从醋酸的水溶液中吸附醋酸,在不同的平衡浓度下,每千克骨炭吸附醋酸的物质的量如下:
解:由热力学分析得知:插入容器的毛细管中液柱的静压力ρwgh与(Δp+ρogh)成平衡,即: ρwgh=Δp+ρoghh=
由于 Δp= r′= Δp=
h= =
10-8在351.45K时,用焦炭吸附NH3气测得如下数据,设V~p关系符合V=kpn方程。
p∕kPa
7.528
10.102
V∕(dm3·kg-1)
10.2
14.7
17.3
23.7
28.4
41.9
50.1
试求方程式V=kpn中的k及n的数值。
解:
lgp
-0.1412
0.1163
0.2363
0.4621
0.5945
0.8767
1.0044
lgV
1.0086
1.1673
1.2380
1.3747
(4)最本质区别是分子之间的作用力不同。物理吸附是固体表面分子与气体分子间的作用力为范德华力,而化学吸附是固体表面分子与气体分子的作用力为化学键。
(5)由于物理吸附过程是自发进行的,所以ΔG<0,而ΔS<0,由ΔG=ΔH-TΔS,得
ΔH<0,即反应为放热反应。
10-2在293.15K及101.325kPa下,把半径为1×10-3m的汞滴分散成半径为1×10-9m的汞滴,试求此过程系统表面吉布斯函数变(ΔG)为多少?已知293.15K时汞的表面张力为0.4865N·m-1。
解:由朗缪尔吸附等温式 得:
b= = =0.01208 =5.9524
p= = =82.78kPa
10-11在291.15K的恒温条件下,用骨炭从醋酸的水溶液中吸附醋酸,在不同的平衡浓度下,每千克骨炭吸附醋酸的物质的量如下:
解:由热力学分析得知:插入容器的毛细管中液柱的静压力ρwgh与(Δp+ρogh)成平衡,即: ρwgh=Δp+ρoghh=
由于 Δp= r′= Δp=
h= =
10-8在351.45K时,用焦炭吸附NH3气测得如下数据,设V~p关系符合V=kpn方程。
p∕kPa
天津大学物理化学第十章 界面现象

4. 亚稳态及新相生成
系统分散度增大、粒径减小引起液滴和固
体颗粒的饱和蒸气压大于普通液体、固体的情
况,只有在粒径很小时才需要考虑。 在蒸气冷凝、液体凝固和沸腾、溶液结晶 等过程中,新相从无到有,最初尺寸极其微小, 比表面积和表面吉布斯函数都很大,新相的产
生非常困难,会出现一些特殊的状态——亚稳
态(介安态)。
dG dA 8πr dr
pr 4πr 2 (dr ) pr dG (dn) RT ln RT ln p M p
dG dA 8πr dr
pr 2 M RT ln p r
开尔文公式
由Kelvin公式可知: 凸液面 r 越小pr 越大 p 2 M 对于凹液面: RT ln pr r 比较饱和蒸气压: p凸> p平> p凹
吸附等温线:
Va
Ⅰ
Va
Ⅱ
0
Va
Ⅲ
p/p*
Ⅳ
1
0 Va
p/p*
Ⅴ
1
Va
0p/p*ຫໍສະໝຸດ 10p/p*
1
0
p/p*
1
p: 达平衡时的吸附压力; p*: 该温度下吸附气体的饱和蒸气压。
2. 吸附经验式——弗罗因德利希公式
Freundlich用指数方程描述 型吸附等温线
V a kpn
n、k 是两个经验参数,均是 T 的函数。 k: 单位压力时的吸附量。一般T ,k; n :介于0~1之间,反映 p 对V a 影响的强弱。 直线式: lgV
§10.4 液 - 固界面
固体表面力场不对称,存在润湿和吸附 1. 接触角与杨氏方程
平衡时
cos
s ls lg
物理化学第十章 胶体化学

3. 沉降与沉降平衡
多相分散系统中的粒子,因受重力作用而下 沉的过程,称为沉降。沉降与扩散为一对矛盾 的两个方面
沉降 扩散 分散相分布
真溶液
粗分散系统 胶体系统 平衡
均相
沉于底部 形成浓度梯度
贝林(Perrin)导出沉降平衡时粒子浓度随高度的分布:
o c2 Mg ln 1 ( h2 h1 ) c1 RT
胶核 可滑动面
胶粒
{[AgI]m nI-(n-x)K+}x- xK+ 胶团结构
K+
K+
I-
K+
(AgI)m
I-
I-
K+
特点:
1) 胶核:首先吸附过量的成核离子,然后吸附反离子; 2) 胶团整体为电中性
I-
§10.5
溶胶的稳定与聚沉
Derjaguin&Landau(1941)
1. 溶胶的经典稳定理论DLVO理论
溶胶粒子间的作用力:
Verwey &Overbeek(1948) van der Waals 吸引力:EA -1/x2
势 能 ER
双电层引起的静电斥力:ER ae-x 总作用势能:E = ER + EA
E
EA 曲线的形状由粒子本
性决定,不受电解质影响;
Emax
0 x 第二最小值 EA 第一最小值
势 能 ER 电解质浓度: c1 < c2 < c3 ,
0EAc3源自c2c1E电解质浓度,ER,E,
溶胶稳定性。在 c3 以后, 引力势能占绝对优势,分散 相粒子一旦相碰,即可聚合。
41
电解质对溶胶的聚沉规律:
(i)反离子的价数起主要作用
第10章深层搅拌法
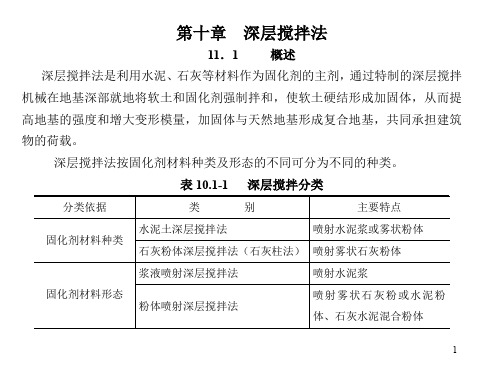
水泥土搅拌法分为深层搅拌法 (以下简称 湿法)和粉体喷搅法 (以下简称干法)。
1、适用条件:水泥土搅拌法适用于处理正 常固结的淤泥与淤泥质土、粉土、饱和黄土、 素填土、粘性土以及无流动地下水的饱和松散 砂土等地基。当地基土的天然含水量小于 30% (黄土含水量小于 25%)、大于 70%或地下水 的 pH值小于 4时不宜采用干法。冬期施工时, 应注意负温对处理效果的影响。
4
3、规定
• (1)确定处理方案前应搜集拟处理区域内详尽的 岩土工程资料。尤其是填土层的厚度和组成;软 土层的分布范围、分层情况;地下水位及 pH值; 土的含水量、塑性指数和有机质含量等。
• (2)设计前应进行拟处理土的室内配比试验。针 对现场拟处理的最弱层软土的性质,选择合适的 固化剂、外掺剂及其掺量,为设计提供各种龄期、 各种配比的强度参数。对竖向承载的水泥土强度 宜取 90d龄期试块的立方体抗压强度平均值;对承 受水平荷载的水泥土强度宜取 28d龄期试块的立方 体抗压强度平均值。
表 10.1-1 深层搅拌分类
分类依据
类
别
主要特点
水泥土深层搅拌法
喷射水泥浆或雾状粉体
固化剂材料种类
石灰粉体深层搅拌法(石灰柱法) 喷射雾状石灰粉体
浆液喷射深层搅拌法
喷射水泥浆
固化剂材料形态 粉体喷射深层搅拌法
喷射雾状石灰粉或水泥粉 体、石灰水泥混合粉体
1
深层搅拌法适用于加固软弱地基,它所形成的固结体可提高软
10
2、硬凝反应
随着水泥水化反应的进行,溶液中析出大量的钙离子Ca2+, 当Ca 2+的数量超过离子交换的需要量后,在碱性环境中,组成 粘土矿物的二氧化硅与三氧化铝的一部分或大部分与Ca 2+产生 化学反应,并逐渐生成不溶于水的稳定的铝酸钙、硅酸钙及钙 黄长石的结晶水化物。这些化合物在水中和空气中逐渐硬化, 提高了水泥强度,且其结构比较致密,水分不易侵入,从而使 水泥土具有足够的水稳定性。
1、适用条件:水泥土搅拌法适用于处理正 常固结的淤泥与淤泥质土、粉土、饱和黄土、 素填土、粘性土以及无流动地下水的饱和松散 砂土等地基。当地基土的天然含水量小于 30% (黄土含水量小于 25%)、大于 70%或地下水 的 pH值小于 4时不宜采用干法。冬期施工时, 应注意负温对处理效果的影响。
4
3、规定
• (1)确定处理方案前应搜集拟处理区域内详尽的 岩土工程资料。尤其是填土层的厚度和组成;软 土层的分布范围、分层情况;地下水位及 pH值; 土的含水量、塑性指数和有机质含量等。
• (2)设计前应进行拟处理土的室内配比试验。针 对现场拟处理的最弱层软土的性质,选择合适的 固化剂、外掺剂及其掺量,为设计提供各种龄期、 各种配比的强度参数。对竖向承载的水泥土强度 宜取 90d龄期试块的立方体抗压强度平均值;对承 受水平荷载的水泥土强度宜取 28d龄期试块的立方 体抗压强度平均值。
表 10.1-1 深层搅拌分类
分类依据
类
别
主要特点
水泥土深层搅拌法
喷射水泥浆或雾状粉体
固化剂材料种类
石灰粉体深层搅拌法(石灰柱法) 喷射雾状石灰粉体
浆液喷射深层搅拌法
喷射水泥浆
固化剂材料形态 粉体喷射深层搅拌法
喷射雾状石灰粉或水泥粉 体、石灰水泥混合粉体
1
深层搅拌法适用于加固软弱地基,它所形成的固结体可提高软
10
2、硬凝反应
随着水泥水化反应的进行,溶液中析出大量的钙离子Ca2+, 当Ca 2+的数量超过离子交换的需要量后,在碱性环境中,组成 粘土矿物的二氧化硅与三氧化铝的一部分或大部分与Ca 2+产生 化学反应,并逐渐生成不溶于水的稳定的铝酸钙、硅酸钙及钙 黄长石的结晶水化物。这些化合物在水中和空气中逐渐硬化, 提高了水泥强度,且其结构比较致密,水分不易侵入,从而使 水泥土具有足够的水稳定性。
物理化学知识点chap 10

Pa
2.356
103
kPa
【10.5】水蒸气迅速冷却至298.15K时可达到过饱和状态。已
知该温度下水的表面张力为71.97×10-3 N·m -1 ,密度为997
kg·m-3。 当过饱和水蒸气压力为平液面水的饱和蒸气压的4
倍时,计算: (1)开始形成水滴的半径;(2)每个水滴中
所含水分子的个数。
m
= 7.569 ? 10- 10m
(2)每个水滴的体积
( ) V 水滴=
4 3
pr
3
=
4 创3.14 3
7.569 ? 10- 10 3 m 3
1.815 ? 10- 27m 3
每个水分子的体积
V 水分子=
M rL
=
骣 琪 琪 琪 桫997
创
0.018 6.022
m 3 = 3.00 ? 10- 29m 3 1023
分析: 利用拉普拉斯方程
p 2
r
解: (1)和(2)两种情况下均只存在一个气-液界面, 其附加压力相同。根据拉普拉斯方程
p
2
r
2 58.91103 0.1106
Pa
1.178
103
kPa
(3)空气中存在的气泡,有两个气-液界面,其附加压力 为
p
4
r
4
58.91103 0.1106
•
pg
••
•
气
•
p
• •
pl
(a)
pg
• 气 p • •
液•
pl (b)
附加压力方向示意图
•
•
气•
•
•
• •
p=• 0
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Δp = p内-p外
16
球形液滴(凸液面),附加压力为: p p内 p外 pl pg
液体中的气泡(凹液面),附加压力: p p内 p外 pg pl
p总是一个正值,方向指向凹面曲率半径中心。
需要说明的一点是,如果在液体表面上任意划一条分 界线把液面分成a、b两部分,则 a 部分表面层中的分子对 b 部分的吸引力,一定等于 b 部分对 a 部分的吸引力,这 两部分的吸引力大小相等、方向相反。这种表面层中任意 两部分间的相互吸引力,造成了液体表面收缩的趋势。由 于表面张力的存在,液体表面总是趋于尽可能缩小,微小 液滴往往呈圆球形,正是因为相同体积下球形面积最小。
Wr dGT,p dAs
G
即:
As
T,p,N
:恒温恒压下,增加单位表面时系统所增加的
Gibbs函数。 单位:J·m-2。
三者物理意义不同,但量值和量纲等同, 单位均可化为: N·m-1
12
2. 热力学公式 对一般多组分体系: G f (T , p, nB , nC ) 当系统作表面功时,G 还是面积A的函数,若系
(Fe , s ) >(NaCl , s ) > (H2O , l ) >(C6H14 , l )
(2) 与接触相的性质有关。
(3) 温度的影响:温度升高,界面张力下降。
极限情况:T→Tc时, →0。
气相中分子密度↑ T ↑ 液相中分子距离↑
↓ (有例外)
0 1 T/Tc n 其中:0与n为经验常数。
统内只有一个相界面,且两相T、p相同 ,
G f (T, p, As, nB, nC )
dG S dT V d p
B( )d nB( ) dAs
G
U B H
A
As
T,p,nB( )
As
S,V,nB( )
As
S,p,nB( )
As
T,V,nB( )
恒T、p、 、恒组分 下积分,有:Gs As
把物质分散成细小微粒的程度,称为分散度。
通常采用质量比表面积或体积比表面积来表示分散度的
大小。
def am
As m
aV
def
As V
As、V、m-分别为物质的总表面积、体积和质量。
应用:人的大脑比猿脑总表面积大10倍(爱因斯坦);植 物的叶绿素;催化剂的活性:表面积有关;隐形飞机的 表面涂层:纳米级超细颗粒的活性氧化锌;纳米材料; 薄膜制备:
(2)表面功
当用外力F 使皂 膜面积增大dA时, 需克服表面张力作可 逆表面功。
W Fdx 2ldx dA
即:
Wr dAs
:使系统增加单位表面所需的可逆功 ,称为表面功
。单位:J·m-2。(IUPAC以此来定义表面张力)
11
(3)表面吉布斯函数: 恒温、恒压下的可逆非体积功等于系统的吉布斯函数变
pg pl
一般情况下,液体表面是水平的,水 平液面下液体所受压力即为外界压力。
弯曲液面的附加压 力
图中为球形液滴的某一球缺,凸液面
上方为气相,压力pg ;下方为液相,压力 pl ,底面与球形液滴相交处为一圆周。圆周
外液体对球缺表面张力 作用在圆周线上,
垂直于圆周线,而且与液滴表面相切。圆 周线上表面张力合力对凸液面下液体造成 额外压力。将凹液面一侧压力以p内表示, 凸液面一侧压力用p外表示,附加压力
相
面
相
B 相
特征:几个分子厚 、结构与性质与两 侧体相均不同
思考
直径为 1cm的
直 径 10nm 的 球
球型小水滴
分成 1018个 形小液滴
表面积: 3.1416cm2
表 面 积 相 总表面积 314.16m2 差 106倍
界面效应不容忽视!
一些多孔物质如:硅胶、活性炭等,也具有很大的比表面积。
概念
14
(4)压力的影响。
a.表面分子受力不对称的程度 ↓
P↑
b.气体分子可被表面吸附,改变, ↓
↓
c.气体分子溶于液相
一般:p↑10atm, ↓1mN/m,例:
1atm 10atm
H2O = 72.8 mN/m H2O = 71.8 mN/m
15
§10.2 弯曲液面的附加压力及其后果
1. 弯曲液面的附加压力——Laplace方程
曙
碧
光
海
晚
蓝
霞
天
雨
露
滴
珠
在界面现象这一章中,将应用物理化学的基本原理,对 界面的特殊性质及现象进行讨论和分析。
7
§10.1 界面张力 1. 液体的表面张力,表面功及表面吉布斯函数
的由来:
表面分子受力不对称
所以液体表面有自动收缩的倾向,扩展表面要 作功。
8
(1) 液体的表面张力 实验:
l
若使膜维持不变,需在金属丝上加一力F,其大小
全微分得: dGTs ,p dAs Asd
可知自发降低表面自由焓有两种途径
——降低表面积 降低表面张力
dT ,pGs < 0
13
3. 表面张力及其影响因素:
(1)与物质的本性有关——分子间相互作用力越大, 越大。例:气-液界面: (金属键) > (离子键) > (极 性键) > (非极性键)
与金属丝长度 l 成正比,比例系数 。因膜有两个表面,
故有:
F 2l
即: F / 2l
:引起表力的方向
L
L
对于平液面,表面张力的方向总是与外力 相反,与液面平行且垂直作用于分界线上。
对于弯曲液面,表面张力的方 向与曲面相切,与分界边缘垂直 。
小颗粒的分散系统往往具有很大的比表面积, 因此由界面特殊性引起的系统特殊性十分突出。
人们把粒径在1~1000nm的粒子组成的分散 系统称为胶体(见第十二章),由于其具有极高的 分散度和很大的比表面积,会产生特有的界面现 象,所以经常把胶体与界面现象一起来研究,称 为胶体表面化学。
6
我们身边的胶体界面现象
第十章 界面现象
1
自然界中物质的存在状态:
气—液界面
气
液—液界面
液
固—液界面
固
固—气界面
固—固界面
界面现象
界面:所有两相的接触面 若其中一相为气体,这种界面通常称为表面。
2
强调:界面不是接触两相间的几何平面!界面 有一定的厚度,所以又称界面为界面相。
界面的结构和性质与相邻两侧的体相都不相同。
A
界
17
弯曲液面附加压力Δp 与液面曲率半径之间关系的推导:
水平分力相互平衡, 垂直分力指向液体内部,
其单位周长的垂直分力为cos
球缺底面圆周长为2r1 ,得垂直分力在圆周上的合
16
球形液滴(凸液面),附加压力为: p p内 p外 pl pg
液体中的气泡(凹液面),附加压力: p p内 p外 pg pl
p总是一个正值,方向指向凹面曲率半径中心。
需要说明的一点是,如果在液体表面上任意划一条分 界线把液面分成a、b两部分,则 a 部分表面层中的分子对 b 部分的吸引力,一定等于 b 部分对 a 部分的吸引力,这 两部分的吸引力大小相等、方向相反。这种表面层中任意 两部分间的相互吸引力,造成了液体表面收缩的趋势。由 于表面张力的存在,液体表面总是趋于尽可能缩小,微小 液滴往往呈圆球形,正是因为相同体积下球形面积最小。
Wr dGT,p dAs
G
即:
As
T,p,N
:恒温恒压下,增加单位表面时系统所增加的
Gibbs函数。 单位:J·m-2。
三者物理意义不同,但量值和量纲等同, 单位均可化为: N·m-1
12
2. 热力学公式 对一般多组分体系: G f (T , p, nB , nC ) 当系统作表面功时,G 还是面积A的函数,若系
(Fe , s ) >(NaCl , s ) > (H2O , l ) >(C6H14 , l )
(2) 与接触相的性质有关。
(3) 温度的影响:温度升高,界面张力下降。
极限情况:T→Tc时, →0。
气相中分子密度↑ T ↑ 液相中分子距离↑
↓ (有例外)
0 1 T/Tc n 其中:0与n为经验常数。
统内只有一个相界面,且两相T、p相同 ,
G f (T, p, As, nB, nC )
dG S dT V d p
B( )d nB( ) dAs
G
U B H
A
As
T,p,nB( )
As
S,V,nB( )
As
S,p,nB( )
As
T,V,nB( )
恒T、p、 、恒组分 下积分,有:Gs As
把物质分散成细小微粒的程度,称为分散度。
通常采用质量比表面积或体积比表面积来表示分散度的
大小。
def am
As m
aV
def
As V
As、V、m-分别为物质的总表面积、体积和质量。
应用:人的大脑比猿脑总表面积大10倍(爱因斯坦);植 物的叶绿素;催化剂的活性:表面积有关;隐形飞机的 表面涂层:纳米级超细颗粒的活性氧化锌;纳米材料; 薄膜制备:
(2)表面功
当用外力F 使皂 膜面积增大dA时, 需克服表面张力作可 逆表面功。
W Fdx 2ldx dA
即:
Wr dAs
:使系统增加单位表面所需的可逆功 ,称为表面功
。单位:J·m-2。(IUPAC以此来定义表面张力)
11
(3)表面吉布斯函数: 恒温、恒压下的可逆非体积功等于系统的吉布斯函数变
pg pl
一般情况下,液体表面是水平的,水 平液面下液体所受压力即为外界压力。
弯曲液面的附加压 力
图中为球形液滴的某一球缺,凸液面
上方为气相,压力pg ;下方为液相,压力 pl ,底面与球形液滴相交处为一圆周。圆周
外液体对球缺表面张力 作用在圆周线上,
垂直于圆周线,而且与液滴表面相切。圆 周线上表面张力合力对凸液面下液体造成 额外压力。将凹液面一侧压力以p内表示, 凸液面一侧压力用p外表示,附加压力
相
面
相
B 相
特征:几个分子厚 、结构与性质与两 侧体相均不同
思考
直径为 1cm的
直 径 10nm 的 球
球型小水滴
分成 1018个 形小液滴
表面积: 3.1416cm2
表 面 积 相 总表面积 314.16m2 差 106倍
界面效应不容忽视!
一些多孔物质如:硅胶、活性炭等,也具有很大的比表面积。
概念
14
(4)压力的影响。
a.表面分子受力不对称的程度 ↓
P↑
b.气体分子可被表面吸附,改变, ↓
↓
c.气体分子溶于液相
一般:p↑10atm, ↓1mN/m,例:
1atm 10atm
H2O = 72.8 mN/m H2O = 71.8 mN/m
15
§10.2 弯曲液面的附加压力及其后果
1. 弯曲液面的附加压力——Laplace方程
曙
碧
光
海
晚
蓝
霞
天
雨
露
滴
珠
在界面现象这一章中,将应用物理化学的基本原理,对 界面的特殊性质及现象进行讨论和分析。
7
§10.1 界面张力 1. 液体的表面张力,表面功及表面吉布斯函数
的由来:
表面分子受力不对称
所以液体表面有自动收缩的倾向,扩展表面要 作功。
8
(1) 液体的表面张力 实验:
l
若使膜维持不变,需在金属丝上加一力F,其大小
全微分得: dGTs ,p dAs Asd
可知自发降低表面自由焓有两种途径
——降低表面积 降低表面张力
dT ,pGs < 0
13
3. 表面张力及其影响因素:
(1)与物质的本性有关——分子间相互作用力越大, 越大。例:气-液界面: (金属键) > (离子键) > (极 性键) > (非极性键)
与金属丝长度 l 成正比,比例系数 。因膜有两个表面,
故有:
F 2l
即: F / 2l
:引起表力的方向
L
L
对于平液面,表面张力的方向总是与外力 相反,与液面平行且垂直作用于分界线上。
对于弯曲液面,表面张力的方 向与曲面相切,与分界边缘垂直 。
小颗粒的分散系统往往具有很大的比表面积, 因此由界面特殊性引起的系统特殊性十分突出。
人们把粒径在1~1000nm的粒子组成的分散 系统称为胶体(见第十二章),由于其具有极高的 分散度和很大的比表面积,会产生特有的界面现 象,所以经常把胶体与界面现象一起来研究,称 为胶体表面化学。
6
我们身边的胶体界面现象
第十章 界面现象
1
自然界中物质的存在状态:
气—液界面
气
液—液界面
液
固—液界面
固
固—气界面
固—固界面
界面现象
界面:所有两相的接触面 若其中一相为气体,这种界面通常称为表面。
2
强调:界面不是接触两相间的几何平面!界面 有一定的厚度,所以又称界面为界面相。
界面的结构和性质与相邻两侧的体相都不相同。
A
界
17
弯曲液面附加压力Δp 与液面曲率半径之间关系的推导:
水平分力相互平衡, 垂直分力指向液体内部,
其单位周长的垂直分力为cos
球缺底面圆周长为2r1 ,得垂直分力在圆周上的合
